Постгеморрагическая анемия развивается вследствие
Различают острую и хроническую
постгеморрагическую анемии.
Острая постгеморрагическая анемия
Возникает в результате острой массивной
потери крови в объеме от 5 мл/кг массы
тела и выше (травма, хирургическое
вмешательство, желудочные, маточные,
кишечные кровотечения, разрыв фаллопиевых
труб, нарушение гемостаза и др.). Сразу
после потери крови вследствие уменьшения
ее массы появляется общеанемические
признаки — тахикардия, одышка, бледность
кожных покровов и слизистых оболочек,
падение АД. Содержание эритроцитов и
гемоглобина снижается равномерно
(нормоцитемическая гиповолемия),
развивается нормохромная анемия.
Изменения периферической крови носят
стадийный характер. На 2–3-е сутки после
кровотечения в кровь поступает тканевая
жидкость, масса ее восстанавливается
(гидремическая фаза), а количество
эритроцитов и гемоглобина снижается,
падает гематокрит, но в связи с выходом
эритроцитов из депо цветовой показатель
сохраняется в норме (нормохромная
анемия), развивается лейкопения (утрата
лейкоцитов во время кровотечения,
гемодиллюция), тромбоцитопения (утрата
тромбоцитов при потере крови, потребление
при образовании тромба). Наблюдается
умеренный анизоцитоз и пойкилоцитоз
эритроцитов. Возникшая гипоксия ведет
к повышению уровня эритропоэтина и на
4–5-е сутки после кровотечения активируется
функция костного мозга (костномозговая
фаза компенсации) появляются регенеративные
формы эритроцитов — полихроматофилы,
единичные нормобласты (полихроматофильные,
оксифильные), ретикулоцитоз. Анемия
приобретает гипохромный характер, т.
к. ускоренная регенерация опережает
созревание эритроцитов из-за возникшего
дефицита железа. Развивается нейтрофильный
лейкоцитоз со сдвигом влево по
регенеративному типу.
Данные нарушения обусловлены уменьшением
объема циркулирующей крови и гипоксией.
В ответ на кровопотерю включаются
механизмы компенсации, направленные
на восстановление утерянного объема
крови и на борьбу с анемическим состоянием
(гипоксией).
Хроническая постгеморрагическая анемия
Развивается в результате длительно
повторяющихся небольших кровотечений.
Является вариантом железодефицитных
анемий, патогенез и проявления обусловлены
нарастающим дефицитом железа.
Железодефицитная анемия
Железо — один из важнейших микроэлементов,
входящих в состав организма человека.
Взрослому человеку требуется 15–18 мг/сут
железа, из которых всасывается 2–2,5 мг.
При этом биодоступность содержащегося
в пище гемового железа существенно
выше, чем негемового. Основные депо
железа: печень (гепатоциты и макрофаги),
костный мозг, селезёнка, мышцы. Если
метаболизм железа нормален, 30–40 %
нормобластов костного мозга содержат
гранулы ферритина (сидеробласты).
Отсутствие сидеробластов характерно
для железодефицита. Избыток гранул в
сидеробласте служит признаком переполнения
организма железом (гемосидероз) или
неспособности утилизировать его
(сидеробластная анемия). На рис. 2
представлена схема метаболизма железа.
Дефицит железа в организме существует
в двух формах, представляющих собой две
последовательные стадии одного процесса:
латентный (тканевый) дефицит железа
(ЛДЖ) и собственно железодефицитная
анемия (ЖДА).
ЖДА составляет около 80–90 % всех случаев
анемий и является одной из самых
распространенных ее форм. Женщины
страдают данным заболеванием чаще, чем
мужчины, поскольку запасы железа у
последних значительно превышают (на
100–200 %) таковые у женщин. Явный и скрытый
дефицит железа отмечается почти у 60 %
женщин земного шара. Железодефицитные
анемии встречаются во всех возрастных
группах. Различают «истинные» ЖДА —
при абсолютном дефиците железа и «ложные»
— при нарушении включения железа в
гемм, в отсутствие первичного истинного
железодефицита.
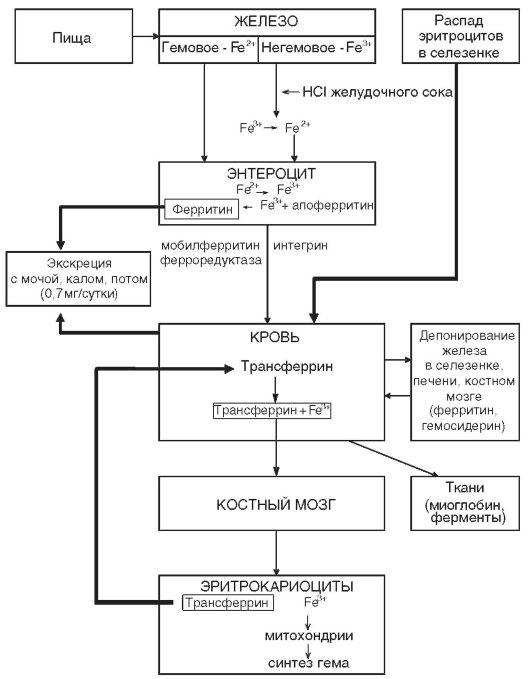
Рисунок 2 – Схема метаболизма
железа в организме
Этиология
По патогенетическому принципу с учетом
основных этиологических причин
железодефицитные анемии делят на пять
основных подгрупп (Л.И. Идельсон): 1)
связанные с повышенной потерей железа;
2) связанные с недостаточным исходным
уровнем железа; 3) связанные с повышенным
расходованием железа; 4) связанные с
нарушением всасывания железа и
недостаточным поступлением его с пищей
(алиментарные); 5) связанные с нарушением
транспорта железа.
Таблица 3.Причины и механизмы
развития железодефицитных состояний
Группы | Характеристика | Патогенез |
Особенные периоды | Дети недоношенные Дети первых лет | Недостаточный |
Интенсивный рост Беременность Лактация | Повышенное | |
Патологические | Хроническая При При Из Из При Припатологии | Повышенная потеря |
Патологические | Патология ЖКТ: Резекция желудка Гипосекреция Хронический Дисбактериозы; Глистные инвазии | Нарушение |
Наследственная Приобретённая | Нарушение | |
Алкоголизм | Комбинация Недостаточное | |
Нарушение | Нерациональное Голодание; Вегетарианская Искусственное | Недостаточное |
Избыточные | Повышенное |
Нередко действуют комбинации указанных
факторов, вызывающих отрицательный
баланс железа. Примером ЖДА, развивающейся
вследствие комплексного влияния
нескольких факторов, является хлороз
(от греч. «хлорос» — бледно-зеленый, или
«бледная немочь»). Название связано со
специфическим цветом лица таких больных.
При ЖДА уменьшается содержание железа
в плазме крови, костном мозге и в тканевых
депо.
Патогенез.
Основным звеном патогенеза заболевания
является снижение содержания железа в
депо, сыворотке крови и костном мозгу.
В результате нарушается синтез
гемоглобина, возникают гипохромная
анемия и трофические расстройства в
тканях, признаками которых являются:
сухость и вялость кожи, ломкость ногтей,
выпадение волос, атрофия слизистой
оболочки языка, повышенное разрушение
зубов, дисфагия, извращение вкуса,
мышечная слабость и др.. В патогенезе
клинических проявлений болезни имеет
значение: нарушение активности
железосодержащих ферментов в тканях
организма (цитохром С, цитохромоксидаза,
сукцинатдегидрогеназа, пероксидаза,
митохондриальная моноаминооксидаза,
α-глицерофосфатоксидаза) и недостаточное
снабжение тканей кислородом. Признаки
гипоксии тканей появляются лишь при
значительной выраженности малокровия,
когда наступает истощение компенсаторных
механизмов, обеспечивающих на ранних
этапах развития дефицита железа
нормализацию отдачи кислорода из
гемоглобина тканям.
Клиническая картинаскладывается
из двух основных синдромов: общеанемического
и сидеропенического.
Общеанемический синдром проявляется
симптомами, характерными для всех видов
анемии: бледность, общая слабость,
быстрая утомляемость, обмороки, одышка,
тахикардия, систолический шум.Сидеропенический синдром характеризуется
рядом трофических нарушений. Отмечаются:
сухость и трещины кожи, преждевременные
морщины, ломкость ногтей, койлонихия
(катлонихия) — ложкообразные ногти,
ангулярный стоматит, атрофия слизистых
оболочек рта, пищевода, желудка,
дыхательных путей. Нарушается иммунитет,
что приводит к хронизации инфекций,
частым ОРЗ; развивается мышечная
слабость, слабость физиологических
сфинктеров. Может возникнуть извращение
вкуса (поедание несъедобных продуктов
— мела, бумаги и др.), пристрастие к
необычным запахам (ацетон, бензин,
краска). Нарушается память, концентрация
внимания. При дефиците железа резко
усиливается абсорбция свинца, и у детей
на этом фоне развивается необратимая
задержка интеллектуального развития.
Нарушение проницаемости мелких сосудов
ведет к отекам лица. Иногда возникает
«сидеропенический субфебрилитет».
Картина крови.Основным признаком
железодефицитной анемии является
гипохромия со снижением цветового
показателя ниже 0,8 и, соответственно,
уменьшением содержания гемоглобина
ниже 110 г/л. Количество эритроцитов, как
правило, остается на исходном уровне,
но в ряде случаев может оказаться
сниженным до 2,0-1,5×1012/л вследствие
нарушения процессов пролиферации клеток
эритроидного ряда в костном мозгу и
усиления неэффективного эритропоэза
(в норме разрушение эритронормобластов
в костном мозгу не превышает 10-15%).
Ретикулоциты в норме или незначительно
увеличены, при прогрессировании ЖДА их
количество снижается. Важным морфологическим
признаком железодефицитных анемий
является анизоцитоз эритроцитов с
преобладанием микроцитов.
Нередко развивается нейтропения (в
результате уменьшения содержания
железосодержащих ферментов в лейкоцитах).
СОЭ в норме или незначительно увеличена.
Уровень тромбоцитов может быть
незначительно повышен (на фоне
кровотечений).
Исследование костного мозга.В КМ
определяется нормобластическая
гиперплазия с нарушением гемоглобинизации
(преобладание базофильных и
полихроматофильных нормобластов при
снижении оксифильных), снижение индекса
созревания нормобластов, снижение
количества сидеробластов вплоть до
полного их отсутствия. Миелоидный и
мегакариоцитарный ростки не изменены.
Биохимический анализ крови – основной
диагностический критерий при ЖДА,
включающий набор тестов, при помощи
которых подтверждается факт дефицита
железа в организме:
снижение уровня сывороточного железа,
снижение уровня сывороточного ферритина,
снижение степени насыщения трансферрина
железом,увеличение содержания трансферрина в
сыворотке,повышение общей и латентной
железосвязывающей способности сыворотки,увеличение содержания растворимых
рецепторов к трансферритину в сыворотке,повышение свободного протопорфирина
IX в эритроцитах.
Количество железа в сыворотке крови
при выраженной ЖДА падает до 5,4–1,8
мкмоль/л при норме 12,5–30,4 мкмоль/л
(мужчины; у женщин этот показатель на
10–15% ниже. Под общей железосвязывающей
способностью сыворотки понимается
количество железа, которое может
связаться с трансферрином (в норме
54,0–72,0 мкмоль/л). В норме одна треть
трансферрина насыщена железом, а две
трети — свободны. Об уровне депонированного
железа можно судить по содержанию железа
в суточной моче после однократного
введения больному 500 мг десферала
(продукт метаболизма актиномицетов,
избирательно выводящий ион железа из
организма). В норме этот показатель
соответствует 0,6–1,3 мг железа, а при
железодефицитной анемии снижается до
0,2 мг в сутки и менее.
Сывороточный ферритин— очень точный
индикатор резервных запасов железа. Он
содержит примерно 15-20% общего запаса
железа в организме взрослого человека.
Определяется почти во всех тканях,
особенно высока его концентрация и
синтетическая способность в печени,
селезенке и костном мозге. Белок в
свободном от железа виде называется
апоферритином. Ферритин состоит из
белковой оболочки, которая окружает
ядро трехвалентного железа в виде
комплексов окиси и фосфата железа.
Каждая молекула апоферритина может
сорбировать до 5000 атомов железа, однако
большинство молекул ферритина содержат
от 1000 до 3000 атомов железа.
Анемии, ассоциированные с заболеваниями
внутренних органов, включают анемии
при эндокринных заболеваниях, заболеваниях
печени и почек.
К числу анемий при эндокринных
заболеванияхотносятся анемии при
заболеваниях щитовидной и паращитовидных
желез, надпочечников, половых желез,
гипопитуитаризме и др., в основе патогенеза
которых лежит депрессия эритропоэза
при дефиците или, напротив, гиперсекреции
ряда гормонов. В частности, такие гормоны,
как тироксин, кортизол, тестостерон в
очень высоких концентрациях вызывают
угнетение пролиферативной активности
эритроидных прекурсоров. В случае
сгущения крови в результате дегидратации
(при надпочечниковой недостаточности,
гипотиреозе) диагностика анемии может
быть затруднена.
К анемиям при заболеваниях печени
относятся анемии, возникающие при
диффузных поражениях органа (циррозе,
хроническом гепатите, гемохроматозе и
др.).
Патогенез анемии при заболеваниях
печени отличается многообразием
патогенетических факторов, что
определяется особенностями патогенеза
основного заболевания. Выделяют следующие
механизмы развития анемии:
угнетение процессов кроветворения в
костном мозгу вследствие прямого
токсического влияния на клетки-предшественницы
гемопоэза алкоголя (при алкогольном
поражении печени) и эндогенных токсинов
(при нарушениях обезвреживающей и
клиренсной функции печени), при нарушениях
метаболизма железа и депонирования
витамина В12и фолиевой кислоты
в пораженной печени;укорочение продолжительности жизни
эритроцитов в результате прямого
повреждающего действия токсических
продуктов экзогенного (алкоголь) и
эндогенного (при эндотоксемии)
происхождения, гиперспленизма, при
нарушениях внутриклеточного метаболизма
эритроцитов (например, в связи с дефицитом
в клетках НАДФ+) и их способности
к деформации (вследствие патологии
клеточной мембраны при изменениях
фракционного состава фосфолипидов,
снижении содержания сиаловых кислот);кровотечения из расширенных вен
желудочно-кишечного тракта (при циррозе
печени), носовые, геморроидальные и
иной локализации (при формирующейся
недостаточности синтеза факторов
свертывания крови вследствие нарушений
белкового обмена).
В подавляющем большинстве случаев при
заболеваниях печени регистрируется
нормохромная нормоцитарная анемия, при
присоединяющемся дефиците железа —
микроцитарная нормоили гипохромная,
при недостаточности витамина В12и фолиевой кислоты, метастазах рака
желудка в печень — макроцитарная анемия
нормо- или гиперхромного типа.
Анемии при заболеваниях почекмогут
выявляться у больных острым
гломерулонефритом, интерстициальным
нефритом, хронической почечной
недостаточностью. Патогенез анемии при
заболеваниях почек определяется
снижением продукции эритропоэтина
клетками юкстагломерулярного аппарата,
депрессией кроветворения в костном
мозгу (в результате нарушения
пролиферативной активности эритроидных
клеток, торможения процессов синтеза
гема) и сокращением срока жизни эритроцитов
(до 40-50 дней) при действии токсических
продуктов азотистого обмена.
Контрольные вопросы по теме:
Охарактеризуйте типовые формы изменений
общего объема циркулирующей крови.Какова этиология олигоцитемических и
полицитемических гиповолемий?Какова этиология олигоцитемических и
полицитемических гиперволемий?Укажите общие механизмы формирования
компенсаторно-приспособительных
механизмов при кровопотере.Каков механизм формирования экстренных
защитно-приспособительных реакций
организма при кровопотерях?Каков механизм формирования долговременных
защитно-приспособительных реакций
организма при кровопотерях?Дайте определение понятию анемия,
каковы принципы классификации?Назовите основные фонды железа в
организме?Перечислите лабораторные показатели,
характеризующие состояние красной
крови при острой кровопотере?Перечислите лабораторные показатели,
характеризующие состояние красной
крови при хронической кровопотере?Какие Вы знаете анемии, ассоциированные
с заболеваниями внутренних органов,
какие особенности для них характерны?
Темы реферативных сообщений:
Этиологи и патогенез ювенильного
хлороза (у девочек в пубертатный период)
при ЖДА
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Постгеморрагическая анемия – комплекс клинических и гематологических изменений, возникающий вследствие острой или хронической кровопотери. Постгеморрагическая анемия характеризуется бледностью, одышкой, потемнением в глазах, головокружением, гипотермией, артериальной гипотонией; в тяжелых случаях — заторможенностью, нитевидным пульсом, шоком, потерей сознания. Постгеморрагическую анемию диагностируют по данным клинической картины и общего анализа крови; для установления источника кровотечения проводятся инструментальные исследования. При развитии данного состояния необходимо устранение источника кровопотери, проведение трансфузионной и симптоматической терапии.
Общие сведения
Постгеморрагическая анемия – гипогемоглобинемия, развивающаяся вследствие геморрагического синдрома и сопровождающаяся ощутимым снижением объема циркулирующей крови (ОЦК). Постгеморрагическая анемия протекает с эритропенией, но часто без уменьшения концентрации гемоглобина (Hb). В норме уровень общего Hb и объем циркулирующих эритроцитов крови составляет соответственно: у мужчин – не ниже 130 г/л и 29-30 мл/кг веса, у женщин – не ниже 120 г/л и 22-23 мл/кг. Постгеморрагическая анемия может осложнять течение самых различных патологический состояний в хирургии, гематологии, гинекологии, гастроэнтерологии, кардиологии и др. Постгеморрагическая анемия может носить острый или хронический характер. Хроническая форма является вариантом железодефицитной анемии, так как механизм развития и симптомы патологии обусловлены усиливающимся дефицитом железа.
Постгеморрагическая анемия
Причины постгеморрагической анемии
Непосредственной причиной постгеморрагической анемии выступает острая или хроническая потеря крови, возникшая вследствие наружного или внутреннего кровотечения. Острая постгеморрагическая анемия возникает при быстрых, массивных кровопотерях, вызванных обычно механическим повреждением стенок крупных кровеносных сосудов или полостей сердца при различных травмах и хирургических операциях, разрывом стенок сердечных камер в зоне инфаркта, разрывом аневризмы аорты и ветвей легочной артерии, разрывом селезенки, разрывом фаллопиевой трубы при внематочной беременности.
Острая постгеморрагическая анемия характерна для обильных маточных кровотечений (менорагий, метрорагий), может сопровождать течение язвы желудка и 12-перстной кишки. У новорожденных постгеморрагическая анемия может быть вызвана плацентарным кровотечением, родовой травмой.
Хроническая постгеморрагическая анемия обусловлена продолжительными, часто возникающими потерями небольших объемов крови при желудочно-кишечных, геморроидальных, почечных, носовых кровотечениях, нарушениях механизмов свертывания крови (ДВС-синдроме, гемофилии). Опухолевые процессы (рак желудка, рак толстой кишки), протекающие с разрушением тканей и органов, проводят к развитию внутреннего кровотечения и постгеморрагической анемии. Гипогемоглобинемия может быть связана с повышением проницаемости стенок капилляров при лейкозах, лучевой болезни, инфекционно-септических процессах, недостаточности витамина C.
Патогенез постгеморрагической анемии
Основными факторами развития постгеморрагической анемии выступают явления сосудистой недостаточности, гиповолемия с уменьшением общего объема плазмы и циркулирующих форменных элементов, в частности, эритроцитов, осуществляющих транспорт кислорода. Этот процесс сопровождается снижением артериального давления, кровенаполнения внутренних органов и тканей, гипоксемией, гипоксией и ишемией, развитием шока.
Степень выраженности защитно-приспособительных реакций организма определяется объемом, скоростью и источником кровотечения. В раннюю рефлекторно-сосудистую фазу компенсации кровопотери (первые сутки) благодаря возбуждению симпатико-адреналовой системы наблюдается вазоконстрикция и усиление сопротивления периферических сосудов, стабилизация гемодинамики за счет централизации кровообращения с первоочередным кровоснабжением головного мозга и сердца, уменьшение возврата крови к сердцу и сердечного выброса. Концентрация эритроцитов, Hb и гематокрит пока близки к норме («скрытая» анемия).
Вторая гидремическая фаза компенсации (2-3 сутки) сопровождается аутогемодилюцией — поступлением в кровеносное русло тканевой жидкости и восполнением объема плазмы. Усиление секреции катехоламинов и альдостерона надпочечниками, вазопрессина – гипоталамусом способствует стабильности уровня электролитов в плазме крови. Происходит прогрессирующее снижение показателей эритроцитов и Hb (общего и в единице объема), гематокрита; значение цветового показателя в норме (постгеморрагическая нормохромная анемия).
В третью, костномозговую фазу компенсации (4-5 сутки) из-за недостатка железа анемия становится гипохромной, усиливается образование эритропоэтина почками с активацией ретикулоэндотелиальной системы, эритропоэза костного мозга, очагов экстрамедуллярного кроветворения. В красном костном мозге наблюдается гиперплазия эритроидного ростка и увеличение общего числа нормоцитов, в периферической крови — значительное повышение количества молодых форм эритроцитов (ретикулоцитов) и лейкоцитов. Уровни Hb, эритроцитов и гематокрит понижены. Нормализация уровня эритроцитов и Hb при отсутствии дальнейшей кровопотери происходит через 2-3 недели. При массивной или длительной кровопотере постгеморрагическая анемия приобретает гипорегенеративный характер, при истощении адаптационных систем организма развивается шок.
Симптомы постгеморрагической анемии
Клинические признаки постгеморрагической анемии однотипны вне зависимости от причины кровопотери, определяются ее объемом и длительностью.
В первые сутки после острой кровопотери у пациентов отмечается резкая слабость, бледный оттенок кожи и слизистых, одышка, потемнение и мелькание мушек в глазах, головокружение, шум в ушах, пересыхание во рту, снижение температуры тела (особенно, конечностей), холодный пот. Пульс становится частым и слабым, появляется артериальная гипотония. Следствием геморрагического синдрома является малокровие внутренних органов, жировая дистрофия миокарда, печени, ЦНС и других органов. Дети, особенно новорожденные и 1-го года жизни, кровопотерю переносят намного тяжелее, чем взрослые пациенты.
Постгеморрагическая анемия при массивной и быстрой кровопотере сопровождается геморрагическим коллапсом, резким падением артериального давления, нитевидным аритмичным пульсом, адинамией и заторможенностью, учащенным поверхностным дыханием с возможным развитием рвоты, судорог, потерей сознания. Если давление падает до критического уровня, вызывая острое нарушение кровоснабжения и гипоксию органов и систем, смерть наступает от паралича дыхательного центра и остановки сердца.
Медленно развивающаяся постгеморрагическая анемия характеризуется менее выраженными проявлениями, так как успевает частично компенсироваться за счет адаптационных механизмов.
Диагностика постгеморрагической анемии
Диагностика постгеморрагической анемии проводится по данным клинической картины, лабораторных и инструментальных исследований (общего и биохимического анализов крови и мочи, ЭКГ, УЗ-диагностики, пункции костного мозга, трепанобиопсии). При осмотре пациента с острой постгеморрагической анемией обращает внимание гипотония, частое дыхание, слабый аритмичный пульс, тахикардия, приглушенность сердечных тонов, небольшой систолический шум на верхушке сердца.
В крови — абсолютное снижение эритроцитарной массы; при продолжающейся кровопотере наблюдается прогрессирующее равномерное падение содержания Hb и эритроцитов. При умеренной кровопотере гематологические признаки постгеморрагической анемии обнаруживается только на 2-4 сутки. Обязателен контроль диуреза, уровня тромбоцитов, электролитов и азотистых продуктов в крови, АД и ОЦК.
При острой постгеморрагической анемии нет необходимости в исследовании костного мозга, его проводят при трудно диагностируемых кровопотерях. В образцах костномозговой пункции признаками анемии являются повышение активности красного костного мозга, в препаратах трепанобиопсии – замещение жировой ткани костного мозга красным кроветворным мозгом.
При диагностике внутренних кровотечений показателен синдром острого малокровия и лабораторные данные. В селезенке, печени, лимфоузлах выявляются очаги экстрамедуллярного кроветворения, указывающие на повышенную нагрузку на гемопоэтическую систему; в крови — транзиторное понижение уровня железа, небольшое увеличение АлТ.
Для выявления и устранения источника кровопотери больные нуждаются в консультациях гематолога, хирурга, гинеколога, гастроэнтеролога и других специалистов; проведении УЗИ органов брюшной полости и малого таза, ФГДС и пр. ЭКГ при постгеморрагической анемии может демонстрировать снижение амплитуды Т-зубца в стандартном и грудном отведении.
Лечение и прогноз постгеморрагической анемии
Первостепенным в лечении постгеморрагической анемии является установление источника кровотечения и его немедленная ликвидация за счет перевязки и ушивания сосудов, резекции и ушивания поврежденных органов и тканей, повышения свертываемости крови и т. д.
Для восстановления ОЦК и снижения степени гемодинамических нарушений по наблюдением трансфузиолога проводится неотложное переливание консервированной крови, кровезаменителей, плазмы и плазмозаменителей. При незначительном, но продолжительном кровотечении трансфузия цельной крови или плазмы показана в небольших гемостатических дозах. При значительной потере ОЦК трансфузии должны выполняться в дозах, превышающих кровопотерю на 20-30%. Тяжелая постгеморрагическая анемия лечится переливаниями больших доз крови («трансплантация крови»). В период коллапса гемотрансфузии дополняют гипертоническими кровозамещающими растворами.
После восстановления ОЦК проводится коррекция качественного состава крови – восполнение ее компонентов: эритроцитов, лейкоцитов, тромбоцитов. При большой одномоментной кровопотере и остановившемся кровотечении необходимы массивные дозы эритроцитарной массы (> 500 мл). Об эффективности гемотрансфузий судят по повышению АД, гематологическим сдвигам.
Также необходимо введение белковых и электролитных растворов (альбумина, физ. раствора, глюкозы), восстанавливающих водно-солевой баланс. В лечении постгеморрагической анемии используются препараты железа, витамины группы B. Назначается симптоматическая терапия, направленная на нормализацию функциональных нарушений со стороны сердечно-сосудистой и дыхательной систем, печени, почек и др.
Прогноз постгеморрагической анемии зависит от длительности и объема кровотечения. Резкая потеря 1/4 ОЦК приводит к острой анемии и состоянию гиповолемического шока, а потеря 1/2 ОЦК является несовместимой с жизнью. Постгеморрагическая анемия при медленной потере даже значительных объемов крови не столь опасна, поскольку может компенсироваться.