Анемия аддисона бирмера патологическая анатомия
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 января 2019;
проверки требуют 5 правок.
Перницио́зная анеми́я (от лат. perniciosus — гибельный, опасный) или B12-дефицитная анемия или мегалобластная анемия или болезнь Аддисона — Бирмера или (устаревшее название) злока́чественное малокро́вие — заболевание, обусловленное нарушением кроветворения из-за недостатка в организме витамина B12. Особенно чувствительны к дефициту этого витамина костный мозг и ткани нервной системы.
Основные сведения[править | править код]
Это синдром, связанный с недостатком B12 и фолиевой кислоты в организме. Характеризуется наличием в костном мозге большого количества крупных незрелых предшественников эритроцитов (мегалобластов).
Витамин B12всасывается в основном в нижней части подвздошной кишки. Анемия может быть вызвана недостаточным потреблением витамина B12 в пищу, недостаточной выработкой внутреннего фактора Касла в париетальных клетках желудка, патологическими процессами в подвздошной кишке с нарушением всасывания или конкуренцией за витамин B12 со стороны ленточных червей или бактерий.
При дефиците витамина B12 на фоне анемической клинической картины (или без неё) могут возникнуть и неврологические расстройства из-за связанного с дефицитом витамина B12 нарушения синтеза жирных кислот. Может наблюдаться демиелинизация и необратимая гибель нервных клеток. Симптомами такой патологии являются онемение или покалывание конечностей и атаксия.
Проявления[править | править код]
- Ярко-красный, а затем «лакированный» язык.
- Желудочная ахилия.
- Малокровие с наличием патологических эритроцитов.
- Поражение нервной системы.
- Желтоватый цвет кожи.
- Образование в костном мозге аномальных крупных клеток вместо эритроцитов (переход на мегалобластический тип кроветворения).
Причины[править | править код]
- Недостаток витамина B12 в питании или нарушение его всасывания
- Расстройство кишечника
- Долгое использование медицинских препаратов, приводящих к уменьшению кислотности в желудке
- Гастрэктомия
- Аутоиммунное поражение внутреннего фактора Касла или париетальных клеток.
- Заражение ленточными червями (лентец широкий)
- Токсическое воздействие на стенку желудка
- Рак желудка
- Наследственный дефект, передается аутосомно-рецессивно
Осложнения[править | править код]
В отсутствие лечения развиваются анемия и дегенерация нервов, так как костный мозг и ткани нервной системы особенно чувствительны к дефициту витамина B12.
Историческая справка[править | править код]
В 1855 году английский врач Томас Аддисон, а затем в 1872 году более подробно немецкий врач Антон Бирмер описали болезнь, которую назвали злокачественной (пернициозной) анемией. Вскоре французский врач Арман Труссо предложил называть эти болезни аддисоновой анемией и болезнью Аддисона.
В 1926 году Дж. Уипл, Дж. Майнот и У. Мерфи сообщили, что пернициозная анемия лечится введением в рацион питания сырой печени и что в основе заболевания лежит врожденная неспособность желудка секретировать вещество, необходимое для всасывания витамина B12 в кишечнике. За это открытие они в 1934 году получили Нобелевскую премию.
См. также[править | править код]
- Внутренний фактор
- https://en.wikipedia.org/wiki/Vitamin_B12_deficiency
Примечания[править | править код]
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
Ссылки[править | править код]
- Анемия
- Наше здоровье
- Da-med.ru ::: B12-дефицитная анемия (Пернициозная анемия)
Основными
причинами развития данной анемии
являются:
Дефицит
поступления данных витаминов:
дефицит
витамина В12
может развиться у приверженцев
вегетарианской диеты, дефицит фолиевой
кислоты – при отсутствии в питании
свежих фруктов и овощей. Поступление
данных витаминов уменьшено у больных,
страдающих алкоголизмом, у пожилых
людей.
Дефицит
гастромукопротеина (внутреннего фактора
Касла)
при поражениях желудка (рак, полипоз,
резекция желудка). У 50% больных данной
анемией дефицит гастромукопротеина
обусловлен наличием антител к добавочным
клеткам желез фундального отдела
желудка, в которых он синтезируется
(аутоиммунный гастрит-гастрит типа А).
При недостатке гастромукопротеина
витамин В-12, поступающий с пищей,
разрушается кишечной флорой и не
усваивается организмом – возникает
В-12-авитаминоз.
Нарушение
всасывания:
энтерит, после резекции подвздошной
кишки.Разрушение
витамина В-12 при некоторых видах
глистной инвазии (широкий лентец).Нарушение
утилизации: при
тяжелых заболеваниях печени (цирроз,
гепатит, рак), в результате воздействия
цитотоксических веществ, алкоголя.
Повышение
потребности
физиологическое:
(беременность, лактация, быстрый рост
у детей).патологическое:
тяжелые воспалительные заболевания,
миелопролиферативные заболевания,
диализ.
Биологическое
действие витамина В-12 проявляется в
активации двух коферментов: фолиевой
кислоты и дезоксиаденозилкобаламина.
Фолиевая кислота,
как и витамин В-12, относится к витаминам
группы В, содержится в листьях различных
растений, свежих овощах, бобовых, печени,
почках животных. В организме человека
она депонирует главным образом в печени,
где находится в неактивном состоянии.
Витамин В-12 способствует образованию
производных фолиевой кислоты – фолатов,
которые и являются фактором, непосредственно
необходимым для костномозгового
кроветворения. При дефиците витамина
В-12 и фолатов нарушается синтез ДНК, что
приводит к нарушению деления клеток,
увеличению их размеров и качественной
неполноценности. Наиболее значительно
страдают клетки эритробластического
ростка: вместо эритробластов в костном
мозге обнаруживаются крупные клетки
эмбрионального кроветворения –
мегалобласты. Кроме размера, они
отличаются от эритробластов рядом
особенностей строения ядра и протоплазмы,
более ранним и интенсивным насыщением
гемоглобином в процессе их дифференцировки,
замедленностью митотического деления,
а главное неспособностью созревания
до нормального эритроцита. Большинство
мегалобластов разрушается в костном
мозге еще в стадии ядросодержащей
клетки. Очень незначительное количество
мегалобластов проходит дифференцировку
до безъядерной клетки (мегалоцит) и
поступает в кровяное русло. Мегалоциты
– более крупные и более насыщенные
гемоглобином клетки, чем эритроциты,
отличаются от них морфологической и
функциональной неполноценностью.
Мегалоциты не обладают такой высокой
способностью к переносу кислорода, как
эритроциты, быстро разрушаются клетками
ретикулоэндотелиальной системы.
Наибольшее их количество разрушается
в печени и селезенке, что приводит к
увеличению данных органов и появлению
болевого синдрома.
При недостатке
витамина В-12 нарушается активация
второго кофермента – дезоксиаденозилкобаламина,
в результате чего происходит своеобразное
нарушение жирового обмена с накоплением
метилмалоновой кислоты, токсичной для
нервной системы. Под действием
метилмалоновой кислоты блокируется
проведение импульсов по боковым и задним
столбам спинного мозга, вследствие чего
возникает фуникулярный миелоз,
расстройство функции тазовых органов.
При
проведении опроса
больного, выявляются
наиболее характерные жалобы, которые
обусловлены:
Поражением
желудочно-кишечного тракта:
боли, жжение в
языке из-за атрофии его слизистой
(географический язык, хантеровский
глоссит);снижение аппетита,
отвращение к пище (к мясу!), тяжесть в
эпигастрии (из-за атрофического
гастрита);обильные поносы
с интенсивно окрашенным калом (интенсивное
окрашивание обусловлено наличием
большого количества стеркобилина –
основного пигмента кала; из-за распада
мегалоцитов, мегалобластов повышается
уровень непрямого билирубина крови,
который в печени переходит в прямой и
в большем количестве выводится с калом
в виде стеркобилина).
Поражением нервной
системы: ранней жалобой является
появление онемения в дистальных отделах
конечностей, чувство ползанья «мурашек»
по коже. Позже появляется неуверенная
походка, нарушается функция тазовых
органов. Причиной перечисленных жалоб
является дегенерация и склероз задних
и боковых столбов спинного мозга
(фуникулярный миелоз). Клиническая
картина этого синдрома складывается
из сочетаний спастического спинального
паралича (спастический парапарез с
патологическими рефлексами Бабинского,
Россолимо, Бехтерева) и табетических
симптомов, симулирующих спинную сухотку
(«псевдотабес»): парастезии (ощущение
ползания мурашек, онемение дистальных
отделов конечностей), гипотония и
понижение рефлексов вплоть до арефлексии,
нарушение болевой, тактильной,
температурной и вибрационной
чувствительности.Жалобы, обусловленные
проявлением циркуляторно-гипоксического
синдрома: головокружение, головная
боль, шум в ушах, мушки перед глазами,
одышка и сердцебиение, сонливость в
течение дня и ночная бессонница.
При
сборе анамнеза,
обращает внимание выявление
вышеперечисленных причин развития
данной анемии.
Объективное
обследование больного
При
осмотре больного
можно выявить бледность кожных покровов
с желтоватым оттенком (из-за повышенного
содержания непрямого билирубина,
образующегося в результате разрушения
мегалоцитов, мегалобластов), выраженность
бледности коррелирует с количеством
гемоглобина. По той же причине выявляется
субиктеричность (легкая желтушность)
склер. Больные чаще повышенного питания,
имеют одутловатое лицо (патологическая
маска – «лицо восковой куклы»). Замечено,
что больные В12-дефицитной
анемией часто имеют голубые глаза и
преждевременную седину. На языке можно
выявить ярко-красные участки воспаления,
весьма чувствительные к приему пищи и
лекарств. Могут выявляться: «ошпаренный»
язык, изъязвление по краям и на кончике
языка, изъязвление на слизистой оболочке
полости рта (афты), трещины. Позже
воспаление стихает. Сосочки языка
атрофируются и появляется типичный для
данной анемии лакированный язык. Нередко
из-за усиленного распада мегалоцитов
и мегалобластов выявляется субфебрильная
температура. При поколачивании по
плоским и трубчатым костям выявляется
болезненность.
При
проведении обследования сердечно-сосудистой
системы границы
сердца могут быть смещены влево, часто
выявляется тахикардия, во всех точках
аускультации может выслушиваться
функциональный систолический шум. В
тяжелых случаях выслушивается «шум
волчка» над яремными венами. Пульс
мягкий, учащенный. Артериальное давление
снижено.
При
проведении обследования органов
пищеварения обращают
внимание изменения слизистой оболочки
в ротовой полости (см. общий осмотр). При
пальпации живота может выявляться
болезненность в эпигастральной области,
обусловленная атрофическим гастритом.
Печень чаще увеличена, мягкая
безболезненная. Селезенка плотная,
иногда увеличена.
Со
стороны нервной системы
ранним признаком
фуникулярного миелоза является потеря
вибрационной чувствительности, которая
проверяется путем прикладывания
звучащего камертона к костям дистальных
отделов конечностей. Характерно также
снижение рефлексов, нарушение походки.
Иногда нарушена функция тазовых органов
(мочевого пузыря и прямой кишки).
Изменения в
анализах крови
В
начале заболевания в периферической
крови обнаруживаются макроциты, так
как сохраняется макронормобластический
эритропоэз. Макроциты являются как бы
переходными клетками между нормо- и
мегалобластами. В дальнейшем развивается
мегалобластический (эмбриональный) тип
кроветворения, и в периферической крови
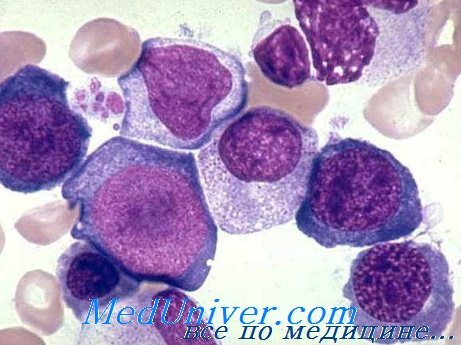
появляются мегалоциты и мегалобласты.
Мегалоциты и мегалобласты представляют
собой крупные клетки вытянутой формы.
Их объем почти в 2 раза больше объема
нормоцита, а содержание гемоглобина
значительно выше нормы. Мегалобласты
не способны превращаться в нормальные
эритроциты. Незначительная часть
мегалобластов (содержащих ядро) вызревает
до безъядерных мегалоцитов и поступает
в периферическую кровь. В процессе
вызревания мегалобласты теряют ядро,
остатки которого можно обнаружить в
виде телец Жолли (круглые, вишнево-красные
образования диаметром около 1 m
в цитоплазме эритроцита) и колец Кебо
(колечко или восьмерка красного цвета
в цитоплазме эритроцита). (Рисунок 7.3)
В результате
нарушенного костномозгового кроветворения
развивается анемия. При очень тяжелом
течении гемоглобин может снизиться до
20 г/л, а количество эритроцитов может
уменьшиться в 20-30 раз по сравнению с
нормой. Как бы сильно не снижался
гемоглобин, количество эритроцитов
снижается еще больше, вследствие чего
ЦП всегда превышает норму и в тяжелых
случаях достигает 1,4-1,8. В крови также
можно обнаружить эритроциты различной
формы (пойкилоциты).
Для В-12
–фолиево-дефицитной анемии характерен
повышенный распад эритроцитов, поэтому
в крови выявляются осколки эритроцитов
(шизоциты). До начала лечения витаминами
количество ретикулоцитов понижено
(угнетен нормальный эритропоэз), а после
лечения наблюдается ретикулоцитарный
криз (количество ретикулоцитов превышает
10 %о). Ретикулоцитарный криз свидетельствует
о восстановлении нормального,
нормобластического эритропоэза и
предвещает близкое наступление ремиссии.
В результате
задержки созревания гранулоцитов
наблюдается лейкопения, нейтропения с
полисегментацией нейтрофилов, эозинопения.
Выявляется относительный лимфоцитоз.
Количество тромбоцитов может быть
несколько снижено.
В костномозговом
пунктатевыявляется обилие мегалобластов.
Чем тяжелее анемия, тем больше среди
них юных форм: промегалобластов,
базофильных и полихроматофильных
мегалобластов.
При
проведении дополнительных исследований
выявляется уменьшение
общего количества желудочного сока,
ахлоргидрия, чаще имеющая гистаминустойчивый
характер. Содержание пепсина в желудочном
соке мало или он не определяется совсем
(имеется ахилия). Обычно ахлоргидрия
выявляется за много лет до первых
симптомов анемии. В случае анемии,
связанной с развитием аутоиммунного
гастрита, при гастроскопии выявляется
гастрит типа А
с наличием блестящих, зеркальных участков
атрофии по типу бляшек («персамутровые
пятна»).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Болезнь Бирмера (Аддисона-Бирмера, злокачественная анемия) — история изучения, причиныБолезнь Бирмера (Аддиссона-Бирмера) или «злокачественная анемия» наиболее частая и лучше изученная форма дефицита витамина В12. Бирмеру мы обязаны анатомоклиническим описанием «злокачественной анемии» (1868—1872), хотя большинство рассмотренных им случаев видимо в действительности, составляли виды анемии за счет недостатка фолиевой кислоты (Castle, 1970). Описание мегалобласта Эрлихом в 1908 г. заложило основу морфологического диагноза, увенчавшегося в дальнейшем практикой костномозговых пункций. На основе современных знаний болезнь Бирмера можно определить как болезненное состояние, характеризующееся изменениями мегалобластического вида клеток периферической крови и костного мозга и дегенеративными поражениями слизистых оболочек пищеварительного тракта и нервной системы в связи с недостаточным поглощением витамина В12 по причине отсутствия внутреннего фактора, что, видимо создается каким-то аутоиммунным механизмом на наследственном фоне. Частота заболевания значительно колеблется в зависимости от географической области при этом болезнь чаще в странах, населенных «северными расами» (Голландия, Скандинавский полуостров, Англия, США, Канада), чем на востоке и юге Европы и совсем редко встречается на Дальнем Востоке и среди негроз (Gummert). Более высокий показатель частоты у женского пола (5:2) не подтвержден всеми авторами. По возрастным группам наиболее высокий показатель приходится на группу 45—55 лет, однако процент заболевших растет неуклонно в последующих группах. Экономические и трудовые (профессиональные) условия не оказывают существенного влияния на показатель частоты этого заболевания «эндогенного детерминизма» (в отличие от мегалобластической анемии за счет недостатка фолиевой кислоты).
В болезни Бирмера роль строения и наследственности была выявлена при описании первых случаев (Аддисон). В дальнейшем высказывалось предположение о взаимосвязи с определенными соматическими, нервными или эндокринными строениями, была отмечена частота отдельных соматических черт (широкое лицо, отдаленные глаза, белесный цвет волос, раннее появление седины и пр.), которые, в, настоящее время, не считаются показательными. По материалам Вернера (цит. Бегеманном), проводившего исследования в ряде семей страдающих, у 9% обследованных были отмечены иные явные случаи заболевания, а в 15% — частичные проявления [скрытые или исходные признаки болезни]. Среди близких родственников больного наиболее часто наблюдались заниженность или отсутствие кислотности (19%), желудочно-кишечные расстройства (33%), холе-цистопатия (15%) (реже — 8%—изменения языка), парестезия (25%) (в некоторых семьях наблюдалось развитие заболевания в сопровождении невропатии); из числа гематологических сдвигов отмечены мокроцитоз, овалицотоз, гиперсегментирование (примерно в 23% случаев). Болезнь Бирмера описана и у одножелточных близнецов (Arbo и Mohr). По одному из предложенных генетических объяснений болезнь передается посредством гена, вовлеченного в процесс образования внутреннего фактора, при этом дефицит передается доминантным способом, но с небольшой проницаемостью; гомозитотное состояние видимо обусловливает ювенильную форму заболевания (при врожденном отсутствии внутреннего фактора), в то время как для проявления болезни в гетерозиготных условиях (обычной у взрослых) предполагается необходимым образование, во времени, атрофических поражений слизистой оболочки желудка (под воздействием каких-то эпигенетических факторов). Вероятность наличия полигенетического механизма подсказывается относительно большой частотой случаев «конституционной гипохромной анемии» (с заниженным выделением желудочного сока, воспалением слизистой оболочки языка и пр.) среди родственников больного. Второй основной вопрос патогенеза болезни Бирмера связан с нали чием аутоиммунных антител у большинства больных. В сыворотке примерно 40% страдающих имеются антитела против ВФ, в то время как у примерно 90% — антитела против пристеночных клеток. Последние (примерно в размере 30% случаев) выявляются и при других заболеваниях аутоиммунного патогенеза, таких как тиреоз Хашимото, тиреотоксикоз, генуинная недостаточность надпочечной железы (Ирвине и сотр.). С другой стороны у 40—50% страдающих отмечается наличие противощитовидных антител. Однако антитела против пристеночных клеток встречаются и при простом атрофическом гастрите (60%) или даже у лиц, страдающих невыявимыми заболеваниями (5—8%), особенно у женщин старше 60 лет (Ирвине и сотр.). Поставлен вопрос о том, не составляет ли развитие этих аутоантител вторичное явление изменению антител клеточных структур. Антитела против внутреннего фактора находятся в разной пропорции в слюне и желудочном соке страдающих бирмеровской болезнью; их роль в сокращении поглощения витамина В1а доказана. Что касается роли антител против пристеночных клеток в патогенезе поражения слизистой оболочки желудка вопрос остается еще невыясненным (участвуют иммунологические механизмы гуморального и клеточного видов в обстановке разных эндо- и экзогенных факторов). С диагностической точки зрения в случае мегалобластической анемии присутствие антител против пристеночных клеток указывает, с большой вероятностью, на наличие болезни Бирмера, в то время как выявление антител против внутреннего фактора свидетельствует о развитии этого заболевания почти с достоверностью (Williams). Другим аргументом в пользу аутоиммунного патогенеза болезни Бирмера служит способность глюкокортикостероидов обусловливать (временно) регрессию поражений слизистой желудка и понижение коэффициента антител против внутреннего фактора (Robro и сотр.). На сонове этих аргументов, выступающих, с одной стороны, за наследственный характер болезни, а с другой, за аутоиммунный фактор патогенеза в настоящее время многие авторы склонны рассматривать болезнь Бирмера как результат генетического недостатка, вызывающего иммунологическое нарушение, которое заключается в низкой иммуной переносимости в отношении клеток желудочного эпителия (и других клеток одинакового эмбриологического происхождения), в связи с чем проявляются аутоантитела (под воздействием добавочных факторов). — Также рекомендуем «Клиника болезни Аддисона-Бирмера (злокачественной анемии) — признаки» Оглавление темы «Анемии»:
|