Желтуха при в 12 анемия
Когда происходит усиленное разрушение красных кровяных телец, развивается гемолитическая желтуха, так как в процессе гемолиза высвобождается билирубин, что должен связываться печенью и выводиться с организма, но из-за большого его количества печень не успевает справляться с задачей. Об этом сигнализирует желтый окрас кожных покровов и белков глаз. Этот вид желтухи является опасным, особенно для младенцев, и требует незамедлительного лечения.
 Свободный билирубин, циркулирующий в крови из-за патологии печени, несёт значительную опасность для здоровья человека.
Свободный билирубин, циркулирующий в крови из-за патологии печени, несёт значительную опасность для здоровья человека.
Общие сведения
Чаще всего желтый цвет кожи обусловлен проблемами с печенью или желчными путями, когда органы не способны связать высвободившийся билирубин и вывести его с организма естественными путями. Но бывает, что эти органы работают полноценно, но билирубин все равно накапливается. Такое возможно при гемолитической желтухе. Патология характеризуется чрезмерным кроверазрушением, когда эритроциты распадаются, и гемоглобин преобразовывается в билирубин, который не успевает перерабатываться ответственными за это органами, и билирубин попадает обратно в кровь.
Гемолитическая желтуха развивается при гемолитической анемии, крупозной пневмонии, малярии и других заболеваниях, что способны спровоцировать усиленный распад эритроцитов.
 Гемолитическая желтуха опасна тем, что может осложниться до степени разрушения клеток крови.
Гемолитическая желтуха опасна тем, что может осложниться до степени разрушения клеток крови.
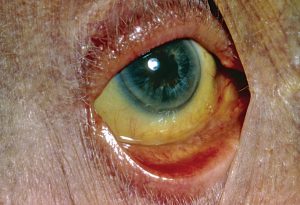
Кожа при гемолитической желтухе становится лимонно-желтой, отмечается сильная бледность больных, при этом зуд отсутствует (он характерен при других формах желтухи). Анализы крови не показывают чрезмерно увеличенный уровень билирубина. Увеличение печени не характерно для гемолитической желтухи, но при пальпации прощупывается небольшая отечность селезенки.
Надпочечная желтуха бывает двух типов:
- врожденная;
- приобретенная.
Вернуться к оглавлению
Врожденная (гемолитическая анемия)
Врожденная желтуха – заболевание, которому характерны проблемы с жизнедеятельностью эритроцитов, когда разрушается большое количество красных кровяных телец, а формируется небольшое. Врожденная желтуха является распространенным заболеванием, она встречается у каждого 100 жителя Земли. Гемолитическая болезнь составляет 1/10 часть среди всех видов анемии. В нормальных условиях эритроциты живут примерно 4 месяца, при этом заболевании – 3 недели максимум. При этом, красные кровяные тельца погибают в сосудах, в печени, селезенке и костном мозгу.
Вернуться к оглавлению
Приобретенная
При приобретенной гемолитической желтухе окончательный механизм патологии устроен так, что гибель эритроцита локализуется в селезенке. У малышей надпеченочная желтуха чаще обусловлена адаптацией к новой среде, у взрослого – может быть признаком опасного заболевания крови или других проблем со здоровьем.
Вернуться к оглавлению
Причины и патогенез
Спровоцировать гемолитическую желтуху могут приобретенные или наследственные патологии, что приводят к большой концентрации такого токсического вещества, как билирубин. Механизм развития патологии заключается в том, что эритроциты разрушаются быстро, и печень не успевает их связать и вывести. Таким образом, билирубин всасывается обратно в кровь, что приводит к его накоплению в костном мозгу. Кроме того, они скапливаются под кожей, что обусловливает ее пожелтение. Причины гемолитической желтухи:
 Гемолитическая форма желтухи может развиться на фоне травм внутренних органов, болезней кровеносной системы, токсических отравлений.
Гемолитическая форма желтухи может развиться на фоне травм внутренних органов, болезней кровеносной системы, токсических отравлений.
- травмы внутренностей или гематомы;
- гипербилирубинемия;
- септический эндокардит;
- инфаркт легких;
- крупозная или В12-дефицитная анемия;
- новообразования злокачественного характера;
- проблемы с печенью;
- интоксикация организма из-за мышьяка, фосфора т. д.;
- болезнь Аддисона-Бримера;
- талассемия (генетическая болезнь, когда эритроциты быстро погибают);
- отравление фармацевтическими препаратами;
- сфероцитоз (наследственно передаваемая болезнь, при которой срок жизни красных кровяных телец значительно уменьшается);
- гемоглобинопатия;
- малярия (инфекция, что переносится через кровь);
- гемолитическая и серповидно-клеточная анемии (врожденная ломкость красных кровяных телец из-за особенностей формы).
Вернуться к оглавлению
Симптомы гемолитической желтухи
Признаки желтухи безоговорочно укажут на ее патогенез, что значительно упрощает диагностику. Симптомы:
 Болезнь печени провоцирует пожелтение кожи и белков глаз, отемняет мочу, провоцирует чесания и боль за грудиной.
Болезнь печени провоцирует пожелтение кожи и белков глаз, отемняет мочу, провоцирует чесания и боль за грудиной.
- желтый цвет кожных покровов, слизистых оболочек и склер глаз;
- кожа становится бледной, румянец отсутствует, так как развивается анемия;
- моча темнеет;
- нет зуда кожных покровов;
- болезненные ощущения в области расположения селезенки (слева под ребрами);
- нет болевых ощущений в районе печени;
- кал становится более темным;
- при пальпации не ощущается увеличение печени, но селезенка отекшая и немного больше нормы.
Вернуться к оглавлению
Диагностика и анализы
Первые признаки заболевания чаще всего остаются без внимания, больной идет к специалисту при явном пожелтении кожи или болях в районе селезенки. Сначала специалист проводит сбор анамнеза, проводит визуальный осмотр и пальпацию брюшной полости. При этом возможно прощупывание увеличенных размеров селезенки при нормальных размерах печени.
Далее пациент должен сдать анализ мочи, что покажет изменение ее состава. При лабораторном исследовании мочи будет отмечен повышенный уробилин при нормальных показателях билирубина. Это свидетельствует именно от гемолитическом типе.
Биохимический анализ проводится забором крови из вены утром на голодный желудок. Формула крови изменена, а значит, больному назначают печеночные пробы, что покажут опасные отклонения в работе печени.
Если есть вероятность инфекционных поражений печени, необходимо лабораторное исследование крови на гепатит.
Кроме того, пациенту необходимо провести инструментальные диагностические процедуры, что помогут выявить причину гемолитической желтухи:
- ультразвуковая диагностика;
- КТ;
- МРТ;
- ретроградная холангиопанкреатография (эндоскопическое исследование мочевыводящих каналов);
- биопсия (если есть подозрение на наличие злокачественного образования или цирроза).
Вернуться к оглавлению
Лечение
Прежде чем назначить лечение, врач должен поставить окончательный диагноз, так как желтуха часто является симптомом, а не самостоятельной болезнью. В первую очередь пациенту нужно придерживаться рекомендованной диеты. Терапия надпеченочной желтухи обычно комплексная и требует приема фармацевтических препаратов, изменения образа жизни на более щадящий.
Основой медикаментозной терапии является восстановление кроветворной функции организма и выведение билирубина естественным путем. Иногда больному показано хирургическое вмешательство.
Вернуться к оглавлению
Диета
Пациенту с желтухой необходимо строго придерживаться рекомендаций врача по питанию, что поможет разгрузить печень. Запрещается есть соленую, острую, копченую, жареную и жирную еду. Все виды алкогольных напитков под запретом.
Лучше всего, если основу рациона составят гречка или овсянка, термически обработанные овощи, нежирные сорта мяса или рыбы, вчерашний хлеб. Можно, чтоб в рационе присутствовали макароны из твердых сортов пшеницы, нежирная молочка.
Необходимо наладить режим питания. Есть нужно 5-6 раз в сутки небольшими порциями. Еду нужно хорошо пережевывать.
Вернуться к оглавлению
У новорожденных
Надпеченочная желтуха нередко встречается у новорожденных. Ее можно разделить на 2 типа: конъюгационную (патологическую) и физиологическую. Последняя обычно сама проходит за 1-1,5 недели, если же кожные покровы не возвращают здоровый цвет или появляются другая симптоматика, это может свидетельствовать о наличии патологии, тогда следует немедленно обратиться к врачу.
Симптомы желтухи появляются у малыша на 2 сутки жизни.
Вернуться к оглавлению
Причины и симптомы
Физиологическая желтуха неопасна, она возникает как реакция организма на резкий распад фетального гемоглобина при неполноценной работе ферментов печени, что не справляется со своей задачей. Патогенез желтухи у малышей такой же, как у взрослых. Патологическую гемолитическую желтуху могут спровоцировать такие факторы:
- проблемы со щитовидкой;
- разный резус-конфликт мамы и ребенка;
- врожденные патологии;
- инфекционные болезни печени, что передались от матери;
- незрелость клеток печени у недоношенного младенца;
- осложнение диабета в беременность.
 Гемолитическая желтуха у деток появляется часто из-за противоположности резуса крови с мамой.
Гемолитическая желтуха у деток появляется часто из-за противоположности резуса крови с мамой.
Чаще всего желтуха у новорожденного проявляется из-за резус-конфликта, так как клетки материнского организма всю беременность атакуют клетки плода, как патологические. Возможно развитие ядерной желтухи на фоне такой несовместимости.
Желтуха обычно дает о себе знать еще в роддоме, что увеличивает шансы на благоприятный прогноз и отсутствие осложнений. Симптоматика такая же, как у взрослых:
- желтушность кожи и склер глаз;
- вялость;
- бледность и т. д.
Существует несколько форм гемолитических желтух:
- анемическая;
- отечная;
- желтушная.
Анемическая форма является легко переносимым видом, так как она является следствием короткого периода неблагоприятного воздействия антител матери на плод. При этом отмечается анемия, бледная кожа, увеличенные печень и селезенка
Отечная форма возникает при более длительном воздействии материнских антител на малыша. Считается, что это опасная форма гемолитической желтухи, что часто приводит к смерти новорожденных. При этом присутствует такая симптоматика:
- селезенка, печень, сердце, эндокринные железы значительно увеличены;
- сильная анемия;
- проблемы с работой сердца;
- нарушение работоспособности печени;
- отечность;
- скопление свободных жидкостей в полостях живота и плевры.
Желтушная возникает, когда антитела начинают атаковать клетки уже сформировавшегося организма. При этом новорожденный абсолютно здоров. Спустя некоторое время кожа начинает желтеть, печень, селезенка, лимфоузлы увеличиваются. Скапливается билирубин, что неблагоприятно влияет на работу печени, сердца, нервной системы. При этом ребенок вялый и не хочет есть. Новорожденный может часто срыгивать или рвать. Иногда возникают судороги и проблемы с дыханием.
Вернуться к оглавлению
Лечение
Терапия надпеченочной желтухи у малышей должна быть незамедлительной. Основа терапевтических процедур – нормализация работы печени и селезенки в процессе связывания и нейтрализации билирубина.
Для нормализации состояния ребенка необходимо применение комплексного лечения. Используются фармацевтические средства, фототерапия и т. д. Возможно, понадобится переливание крови.
Заниматься самолечением маленького ребенка категорически запрещено. При первых признаках гемолитической желтухи следует обратиться к педиатру-неонатологу. Улучшение появляется практически сразу после начала терапии.
Вернуться к оглавлению
Медикаментозная терапия
 Лечение гемолитической желтушхи у маленьких деток подразумевает витаминные инъекции.
Лечение гемолитической желтушхи у маленьких деток подразумевает витаминные инъекции.
Пациенту с надпеченочной желтухой показано введение инфузионного белкового препарата, использование глюкозы, витаминов Е, С, В. Гемолитический тип желтухи вызывает дефицит витамина В9, поэтому иногда необходимо вводить фолиевую кислоту. Возможно использование глюкокортикостероидов.
Вернуться к оглавлению
Светотерапия
Это один из наиболее широко используемых методов терапии желтухи у младенцев, так как флуоресцентное освещение специальной лампы способно преобразовать билирубин в безопасное вещество, что выводится с организма путем физиологических испражнений.
Терапия проводится только стационарно. При этом не должно быть никаких факторов, что препятствуют безопасности процедуры для младенца. Суть метода заключается в том, что малыша помещают в специальный бокс или просто под лампу. В процессе лечения приветствуется частое грудное вскармливание, так как билирубин выводится с остатками переработанной еды. Сколько времени длиться светотерапия? Малыша помещают под лампу на 24 часа с перерывами для кормления.
Вернуться к оглавлению
Переливание крови
Если уровень билирубина значительно превышает норму, он не уменьшается и становится опасным для здоровья и жизни ребенка, ему показано переливание крови. Механизм: через пупочную вену малышу вводят и выводят кровь донора, что способствует очищению организма от опасного вещества.
Это крайняя мера, что сопровождается некими возможными последствиями, поэтому процедура проводится, если обычная терапия неэффективна.
Вернуться к оглавлению
Профилактика
Профилактические меры помогут предотвратить желтуху и ее опасные последствия. Считается, что раннее прикладывание к груди младенца благоприятно влияет на уровень билирубина. Молозиво, что выделяется в первые сутки после родов, обладает слабящим действием, поэтому меконий (первый кал темного цвета) выходит быстрее, а вместе в ним билирубин.
 Для предотвращения гемолитической желтухи принято делать укол на иммуноглобулин беременной.
Для предотвращения гемолитической желтухи принято делать укол на иммуноглобулин беременной.
При искусственном вскармливании кал дольше задерживается в организме, что может привести к тому, что опасное вещество попадает обратно в кровоток, что приводит к желтухе.
Профилактической мерой считается введение инъекций иммуноглобулина беременной женщине при наличии резус-конфликта. Это сглаживает борьбу антител с плодом, что уменьшает риск возникновения проблемы. Кроме того, инъекция иммуноглобулина делается в первые 2 суток после родового процесса.
Важно придерживаться здорового образа жизни, отказаться от вредных привычек и сбалансировано питаться в период беременности.
Вернуться к оглавлению
Прогноз
Прогноз для взрослых пациентов обычно благоприятный, желтуха не сопровождается осложнениями. Но в случае развития симптоматики из-за гемоглобинопатии или гипербилирубинемии, существует риск множества опасных осложнений.
Надпеченочная форма желтухи у младенцев имеет не такой хороший прогноз. Тяжелая форма желтушного вида патологии может привести к летальному исходу. Возможно развитие ядерной желтухи, что чревато поражениями центральной нервной системы. При легкой и средней формах желтухи у маленьких детей прогнозы благоприятные, она проходит бесследно.
Кандидат медицинских
наук, доцент В.А. Ткачев
В12-ДЕФИЦИТНАЯ
АНЕМИЯ
В12-дефицитная
анемия –
это тяжелая прогрессирующая анемия,
возникающая при нарушении усвоения
витамина В12,
поступающего с пищей, вследствие
пониженной (или при отсутствии) секреции
внутреннего желудочного фактора.
Номенклатура
названия этого заболевания разная, и
оно нередко обозначается в литературе
как пернициозная анемия (perniciosa
– гибельная), злокачественная болезнь
Аддисона–Бирмера (по фамилии авторов),
а также мегалобластная анемия (по типу
кроветворения).
Болеют лица старше
40 лет. Женщины подвержены этому заболеванию
в два раза чаще, чем мужчины и, прежде
всего, в возрасте старше 50–60 лет. Известны
случаи В12-дефицитной
анемии у детей, вскармливаемых козьим
молоком или сухими молочными смесями.
Заболеваемость составляет от 20 до 60
случаев на 10 000 населения.
Историческая
справка.
Первое описание этого заболевания
сделал Кумбс в 1822 г. и назвал его тяжелым
первичным малокровием. В 1855 г. врач
Аддисон описал это страдание под
названием «идиопатическая анемия». В
1872 г. Бирмер опубликовал результаты
наблюдения за группой больных, страдавших
прогрессирующей пернициозной анемией.
Однако возможность излечения этого
заболевания появилась только в 1926 г.,
когда Майнот и Мерфи обнаружили выраженный
лечебный эффект от назначения сырой
печени.
Через три года
американский физиолог Кастл показал,
что сырое мясо, печень, дрожжи, обработанные
желудочным соком здорового человека,
обладают свойством вызывать ремиссию
у больного пернициозной анемией.
Исследования Кастла легли в основу
концепции, согласно которой в результате
взаимодействия двух факторов – внешнего,
содержащегося в сыром мясе, сырой печени,
дрожжах, и внутреннего, вырабатываемого
слизистой оболочкой желудка, создается
антианемическое соединение, которое
обеспечивает физиологическое вызревание
костномозговых клеток.
Природа внешнего
фактора была установлена – им является
цианкобаламин
(витамин В12).
Витамин В12
по потребности организма используется
не только для гемопоэза в костном мозге,
но и для нормального функционирования
нервной ткани и органов пищеварения.
Комплексное
соединение, состоящее из пептидов
(появляющихся в процессе превращения
пепсиногена в пепсин) и мукоидов
(выделяемых добавочными клетками
слизистой оболочки желудка) было названо
гастромукопротеидом
или внутренним фактором Кастла.
Роль внутреннего фактора (гастромукопротеида)
заключается в образовании с витамином
В12
комплекса, обеспечивающего транспорт
цианкобаламина по кишечнику и
препятствующего его распаду и инактивации.
Резорбция (всасывание) витамина В12
происходит в подвздошной кишке. Дальнейшее
поступление его в портальный кровоток
осуществляется при помощи белковых
переносчиков: транскобаламина-1
(-глобулина)
и транскобаламина-2 (-глобулина),
которые образуют белково-В12-витаминный
комплекс, способный депонироваться в
печени.
Этиология.
Ведущим фактором в этиологии заболевания
является эндогеннная
недостаточность витамина В12,
возникающая вследствие нарушения его
всасывания из-за прекращения секреции
внутреннего фактора (гастромукопротеида).
Нарушение всасывания
В12
может возникнуть в результате поражения
желудочно-кишечного тракта воспалительным
или злокачественным процессом, после
субтотального
или тотального удаления желудка,
после обширной
резекции части тонкого кишечника.
В редких случаях пернициозная анемия
развивается при нормальной секреции
внутреннего желудочного фактора и
обусловлена врожденным
отсутствием транскобаламина-2,
с которым витамин В12
связывается и доставляется в печень,
либо в результате отсутствия
в кишечнике белкового акцептора
(воспринимающего) витамина В12,
необходимого для поступления цианкобаламина
из кишечника в кровеносное русло. В
отдельных случаях имеет место генетический
фактор развития
В12-дефицитной
анемии вследствие врожденного нарушения
выработки желудочного фактора или
наличия антител против париетальных
клеток.
К возникновению
В12-дефицитной
анемии могут привести и следующие
факторы:
нарушение всасывания
В12
в тонком кишечнике в результате
хронического
энтерита или глютеновой энтеропатии;конкурентное
поглощение витамина В12
в тонком кишечнике широким
лентецом
или микроорганизмами;полное исключение
пищи животного происхождения;длительное снижение
внешнесекреторной активности
поджелудочной железы,
следствием чего является нарушение
расщепления протеина R,
без которого витамин В12
не может связаться с мукополисахаридом;длительное
назначение некоторых
лекарственных препаратов:
метотрексат, сульфасалазин, триамтерен,
6-меркаптопурин, азатиоприн, ацикловир,
фторурацил, цитозар, фенобарбитал и
др.
Патогенез.
Нарушение
кроветворения при В12-дефицитной
анемии характеризуется мегалобластическим
типом для
всех трех ростков крови: эритроидного,
гранулоцитарного и мегакариоцитарного.
Отмечается неэффективность красного
кроветворения: нарушение дифференцировки
эритроидных клеток и появление аномальных
клеток типа промегалобластов, мегалобластов
(большого размера клеток с базофильной
цитоплазмой и ядром, содержащим ядрышки).
В результате
дефектного метаболизма фолиевой кислоты
(из-за дефицита В12),
которая участвует в образовании ДНК,
нарушается клеточное деление. Следствием
этого является выраженная интрамедуллярная
гибель эритроидных элементов и снижение
количества эритроцитов на периферии.
Из-за несостоятельности
клеточных элементов крови усилен
гемолиз,
который проявляется гипербилирубинемией,
уробилинурией, увеличением стеркобилина
в кале.
Патологоанатомические
изменения
характеризуются общим малокровием,
желтушностью кожи и слизистых, жировой
дистрофией миокарда, печени, почек.
Костный мозг сочный, малинового цвета
из-за гиперплазии.
Со стороны органов
пищеварения выявляются атрофические
изменения сосочков языка (их сглаженность),
воспалительные его изменения (глоссит),
афтозные высыпания, трещины (Гунтеровский
глоссит), а также атрофия слизистой
оболочки щек, неба, глотки, пищевода.
Наибольшая атрофия регистрируется в
желудке, которая характеризуется
истончением его стенок, формированием
полипов. Слизистая оболочка кишечника
также атрофирована. Селезенка, как
правило, нормальных размеров или
увеличена.
Гепатомегалия
невыраженная. Выявляется гемосидероз
в печени, селезенке, почках (ржавый
оттенок на разрезе) в результате гемолиза
эритроцитов.
В нервных волокнах
языка (нервных сплетениях Мейснера и
Ауэрбаха), а также в задних столбах
спинного мозга (очаговое набухание с
распадом миелиновых нервных волокон)
отмечаются дистрофические изменения.
Клинические
проявления
В12-дефицитной
анемии чаще развиваются постепенно:
нарастает слабость, недомогание,
головокружение, диспепсические
расстройства, шум в ушах, склонность к
ожирению. Редко заболевание начинается
остро, с подъема температуры тела до
38
С, выраженной слабости.
Анемический
синдром
характеризуется вялостью, бледностью
кожных покровов с лимонно-желтым
оттенком, иногда (у 12% больных)
субиктеричностью склер. В периферической
крови регистрируется анемия, чаще (58%)
тяжелая, с увеличением цветного показателя
до 1,4, снижением ретикулоцитов до 0,5 –
1,0% (у трети больных – ретикулоцитоз),
пойкилоцитозом и наличием телец Жолли
и колец Кэбота в эритроцитах. Часто
выявляется лейкопения, лимфоцитоз, но
тромбоцитопения.
В костном мозге
определяются признаки мегалобластического
типа кроветворения.
Синдром желудочной
диспепсии
(37,% наблюдений) проявляется отрыжкой,
тошнотой, потерей вкусовых ощущений,
снижением аппетита вплоть до отвращения
к пище, тяжестью в эпигастрии, иногда
дисфагией, чувством жжения языка,
слизистой оболочки рта. На ЭГДС выявляются
атрофические изменения в слизистой
оболочки пищевода и желудка.
Синдром кишечной
диспепсии характеризуется
неустойчивым стулом, похуданием.
Глоссит
проявляется наличием «ошпаренного»
(красного) или «лакированного» с трещинами
языка. Боли в языке отмечаются у 30%
больных с В12-дефицитной
анемией.
Синдром желтухи
бывает у 50% больных и проявляется
субиктеричностью склер и гипербилирубинемией.
Синдром
фуникулярного миелоза (сенсорная
атаксия – нарушение координации
движений) отмечается у больных с
В12-дефицитной
анемией в 11% случаев и развивается в
результате нарушения проприорецептивной
чувствительности из-за атрофических
процессов в задних рогах спинного мозга.
Могут быть и другие симптомы поражения
нервной системы: парестезии, расстройства
функции тазовых органов, снижение
рефлексов.
Синдром межреберной
невралгии
встречается существенно чаще (до 30%
случаев), чем признаки фуникулярного
миелоза, проявляется невралгическими
болями по ходу межреберий и также
обусловлен функциональной недостаточностью
нервной ткани проводников.
У части больных
отмечается поражение черепномозговых
нервов (зрительного, слухового,
обонятельного), наличие симптомов
спинального паралича (спастический
парапарез с повышенными рефлексами и
клонусами) Может обнаруживаться
центральная скотома (дефект поля зрения)
с потерей зрения.
Изменения со
стороны центральной
нервной системы
могут проявляться синдромом
психомоторного возбуждения
(маниакальное состояние с эйфорией или
синдромом депрессии
с нарушением памяти и критики —
мегалобластное слабоумие).
Кардиальный
синдром (в
15–20% наблюдений) характеризуется
одышкой, сердцебиением, болями в области
сердца, миокардиодистрофией. При
аускультации сердца выслушивается
функциональный анемический шум. На ЭКГ
определяется снижение ST,
расширение желудочкового комплекса.
Отечный синдром
встречается при В12-дефицитной
анемии в 80% случаев и проявляется
периферическими отеками, могущими
достигать степени анасарки, как результат
недостаточности кровообращения.
Увеличение печени
(синдром
гепатомегалии)
встречается у 22% больных, увеличение
селезенки (синдром
спленомегалии)
в 10% случаях.
При нелеченной
В12-дефицитной
анемии может развиться синдром
пернициозной комы,
проявляющийся ишемией головного мозга,
потерей сознания, арефлексией, падением
температуры тела, снижением АД, рвотой,
непроизвольным мочеиспусканием.
С целью диагностики
заболеванияпроводится
тщательное гематологическое исследование,
включающее изучение картины
периферической крови,
стернального
пунктата и
сывороточных факторов, участвующих в
гемопоэзе. Точный
диагноз очень важен, т.к. эти больные в
ряде случаев нуждаются в пожизненном
лечении.
Гиперсегментация
нейтрофилов
(более пяти ядерных долей) периферической
крови является первой гематологической
патологией при мегалобластном статусе.
У здорового человека могут циркулировать
в крови до 2% гиперсегментированных
нейтрофилов. У больных мегалобластной
анемией количество гиперсегментированных
нейтрофилов превышает 5%.
Для костномозгового
кроветворения характерен мегалобластический
тип, для
которого типично раздражение красного
ростка и появление мегалобластов.
Костный мозг гиперклеточный за счет
увеличения количества ядросодержащих
клеток красного ряда. В результате
нарушения клеточного деления эритроидные
клетки становятся очень крупными
(мегалобласты).
Они характеризуются большой величиной,
нежной структурой и необычным расположением
хроматина в ядре, асинхронной
дифференцировкой ядра и цитоплазмы.
В сыворотке крови
у больных с В12-дефицитной
анемией повышена
концентрация билирубина, железа,
ферритина
(железосодержащий белок печени).
Активность
сывороточной лактатдегидрогеназы (ЛДГ)
значительно повышена
и увеличивается по мере прогрессирования
заболевания. Уровень сывороточного
цианкобаламина
обычно низкий, но может быть нормальным.
Дифференциальная
диагностика
проводится с
фолиево-дефицитной анемией.
Дефицит фолиевой кислоты наблюдается
обычно в более молодом возрасте, не
сопровождается атрофическими изменениями
слизистой оболочки желудка и неврологической
симптоматикой.
Для исключения
фолиево-дефицитной анемии проводится
тест Шиллинга: вводят витамин В12
парентерально, который определяется в
моче в минимальных количествах при
В12-дефицитной
анемии и в больших количествах — при
фолиево-дефицитной. Важно учитывать,
что назначение больным с В12-дефицитной
анемией фолиевой кислоты быстро
способствует развитию фуникулярного
миелоза.
Следует помнить,
что симптоматическую мегалобластную
анемию вызывают опухоли
желудка, тонкой и слепой кишки, а также
глистная инвазия
(глистная В12-дефицитная
анемия), что необходимо исключить при
верификации диагноза.
Дифференцировать
следует и с эритромиелозами
(начальные формы проявления лейкоза),
которые сопровождаются анемией,
протекающей с повышенным содержанием
в крови витамина В12
и резистентной к лечению цианкобаламином.
При проведении
дифференциальной диагностики
В12-дефицитной
анемии необходимо установить ее причины.
ЛечениеВ12-дефицитной
анемии включает парентеральное
введение витамина В12
или гидрооксикобаламина (метаболит
цианкобаламина) в дозах, обеспечивающих
удовлетворение дневной потребности и
удвоение запасов депо. Витамин В12
вводят по 1000 мкг внутримышечно ежедневно
в течение двух недель, затем один раз в
неделю до нормализации уровня гемоглобина,
после чего переходят на введение 1 раз
в месяц в течение всей жизни.
Оксикобаламин
по фармакологическим свойствам близок
к цианкобаламину, но сравнительно с
последним быстрее превращается в
организме в активную коферментную форму
и дольше сохраняется в крови. Вводится
оксикобаламин в дозе 500–1000 мкг через
день или ежедневно. При наличии
неврологической симптоматики необходимо
введение препарата в дозе 1000 мкг каждые
две недели в течение шести месяцев.
При фуникулярном
миелозе назначаются массивные дозы
цианкобаламина по 1000 мкг ежедневно в
течение 7–10 дней, далее два раза в неделю
до исчезновения неврологических
признаков.
Начало терапии
кобаламином быстро улучшает самочувствие
больных. Костномозговой эритропоэз
превращается из мегалобластного в
нормобластный уже через 12 часов после
введения витамина В12.
Поэтому назначение витамина В12
при
коматозном состоянии относится к
неотложным мероприятиям. Ретикулоцитоз
появляется на 3–5 день, пик его
(ретикулоцитарный криз) наиболее выражен
на 4–10 день. Концентрация гемоглобина
нормализуется через 1–2 месяца.
Гиперсегментация нейтрофилов сохраняется
до 10–14 дней.
Трансфузии
эритроцитарной массы
показаны для срочной ликвидации симптомов
гипоксии.
После терапии
кобаламином может развиться тяжелая
гипокалиемия.
Поэтому в процессе лечения витамином
В12
необходимо тщательно контролировать
содержание калия в крови и при необходимости
проводить заместительную терапию.
Лечение кобаламином
следует назначать всем больным после
тотальной
гастрэктомии.
Для предупреждения обострения витамин
В12
вводится один раз в две недели по 100 –
200 мкг.
Диспансеризация.
Больные В12-дефицитной
анемией подлежат диспансерному
наблюдению, в ходе которого проводится
мониторинг состояния периферической
крови 1-2 раза в год, а также лечение
заболеваний и состояний, приведших к
развитию данного вида анемии.
Существуют разные
схемы поддерживающей терапии кобаламинами.
При назначении цианкобаламина
рекомендуются пожизненно ежегодные
профилактические трехнедельные курсы
по 400-500 мкг через день либо ежемесячное
введение 500-1000 мкг препарата.
Гидроксикобаламин
рекомендуется
ежегодными профилактическими курсами
по одной инъекции в неделю (1 мг) в течение
2-х месяцев.