В 12 дефицитная анемия этиология патогенез клиника лечение
Перницио́зная
анеми́я (от лат. perniciosus — гибельный,
опасный) или B12-дефицитная анемия или
мегалобластная анемия или болезнь
Аддисона-Бирмера или (устаревшее
название) злока́чественное малокро́вие
— заболевание, обусловленное нарушением
кроветворения из-за недостатка в
организме витамина B12.
Этология
1. Нарушение
всасывания.
— Неадекватная
выработка внутренного фактора при В 12
-дифицитной анемии,после гастрэктомии,врождённом
отсутсвии или дефекте внутреннего
фактора. Основной причиной дефицита
витамина В 12 (у 90% больных) является
арофический гастрит,приводящий к
нарушению выработки обкладочными
клетками внутреннего фактора Кастла.
Реже заболевание развивается после
гастрэктомии или резекции желудка .Эти
операции приводят к развитию анемического
синдрома более чем у 50% пациентов.
— Заболевания
подвздошной кишки(спру, энтерит,резекция
подвздошной кишки, дивертикулез и др.),
являющейся основным местом всасывания
витамина В 12.
2. Синдром мальабсорбции.
3. Конкурентное
поглощение витамина В 12 при инвазии
широким лентецом(дифиллоботриоз),
дисбактериозе (при синдроме «слепой
петли»,стриктурах тонкой
кишки,дивертикулите).
4. Приём ряда
медикаментов(колхицин,аминосалициловая
кислота).
5. Неадекватное
поступление с пищей.
6. Нарушение синтеза
и структуры транскобаламинов(чаще
транскобаламина 2)
Роль цианкобаламина
и фолиевой кислоты в развитии мегалобластной
анемии связана с их участием в широком
спектре обменных процессов и обменных
реакций в организме. Фолиевая кислота
в форме 5,10 — метилентетрагидрофолата
участвует в метилировании дезоксиуридина,
необходимого для синтеза тимидина, при
этом образуется 5-метилтетрагидрофолат.
Цианокобаламин
является кофактором метилтрасферазной
каталитической реакции, осуществляющей
ресинтез метионина и одновременно
регенерацию 5-метилтетрагидрофолата в
тетрагидрофолат и 5,10 метилентетрагидрофолат.
При недостаточности
фолатов и (или) цианкобаламина нарушается
процесс включения уридина в ДНК
развивающихся гемопоэтичеких клеток
и образования тимидина, что обуславливает
фрагментацию ДНК (блокирование ее
синтеза и нарушение клеточного деления).
При этом возникает мегалобластоз,
происходит накопление больших форм
лейкоцитов и тромбоцитов, их раннее
внутрикостномозговое разрушение и
укорочение жизни циркулирующих клеток
крови. В результате гемопоэз оказывается
неэффективным, развивается анемия,
сочетающаяся с тромбоцитопенией и
лейкопенией.
Кроме того,
цианкобаламин является коферментом в
реакции превращения метилмалонил-КоА
в сукцинил-КоА. Эта реакция необходима
для метаболизма миелина в нервной
системе, в связи с чем при дефиците
цианкобаламина наряду с мегалобластной
анемией отмечается поражение нервной
системы, в то время как при недостаточности
фолатов наблюдается только развитие
мегалобластной анемии.
Цианкобаламин
содержится в пищевых продуктах животного
происхождения — печени, почках, яйцах,
молоке. Запасы его в организме взрослого
человека (главным образом в печени)
велики — около 5 мг, и если учесть, что
суточная потеря витамина составляет 5
мкг, то полное истощение запасов при
отсутствии поступления (нарушение
всасывания, при вегетарианской диете)
наступает только через 1000 дней.
Цианкобаламин в желудке связывается
(на фоне кислой реакции среды) с внутренним
фактором — гликопротеином, продуцируемым
париетальными клетками желудка, или
другими связывающими белками — R-факторами,
присуствующими в слюне и желудочном
соке. Эти комплексы предохраняют
цианкобаламин от разрушения при
транспорте по ЖКТ. В тонкой кишке при
щелочном значении рН под влиянием
протеиназ панкреатического сока
цианкобаламин отщепляется от R-протеинов
и соединяется с внутренним фактором. В
пдовздошной кишке комплекс внутреннего
фактора с цианкобаламином связывается
со специфическими рецепторами на
поверхности эпителиальных клеток,
освобождение цианкобаламина из клеток
кишечного эпителия и транспорт к тканям
происходит с помощью особых белков
плазмы крови — транскобаламинов 1,2,3,
причем транспорт цианкобаламина к
гемопоэтическим клеткам осуществляется
преимущественно транскобаламином 2.
В костном мозге
обнаруживают в большем или меньшем
количестве мегалобласты диаметром
более (15 мкм), а также мегалокариоциты.
Мегалобласты характеризуются
десинхронизацией созревания ядра и
цитоплазмы. Быстрое образование
гемоглобина (уже в мегалобластах)
сочетается с замедленной дифференциацией
ядра. Указанные изменения в клетках
эритрона сочетаются с нарушением
дифференцировки и других клеток
миелоидного ряда: мегакариобласты,
миелоциты, метамиелоциты, палочко- и
сегментоядерные лейкоциты также
увеличены в размерах, ядра их имеют
более нежную, чем в норме, структуру
хроматина. В периферической крови
значительно снижено число эритроцитов,
иногда до 0,7 — 0,8 x 1012 /л. Они большого
размера — до 10 — 12 мкм, часто овальной
формы, без центрального просветления.
Как правило, встречаются мегалобласты.
Во многих эритроцитах обнаруживаются
остатки ядерного вещества (тельца Жолли)
и нуклеолеммы (кольца Кебота). Характерны
анизоцитоз (преобладают макро- и
мегалоциты), пойкилоцитоз, полихроматофилия,
базофильная пунктация цитоплазмы
эритроцитов. Эритроциты избыточно
насыщены гемоглобином. Цветовой
показатель обычно более 1,1 — 1,3. Однако
общее содержание гемоглобина в крови
существенно снижено в связи со значительным
уменьшением числа эритроцитов. Количество
ретикулоцитов обычно понижено, реже —
нормальное. Как правило, наблюдаются
лейкопения (за счет нейтрофилов),
сочетающаяся с наличием полисегментированных
гигантских нейтрофилов, а также
тромбоцитопения. В связи с повышенным
гемолизом эритроцитов (в основном в
костном мозге) развивается билирубинемия.
В12 — дефицитная анемия обычно сопровождается
и другими признаками авитаминоза:
изменениями в желудочно-кишечном тракте
связи с нарушением деления (при этом
выявляются признаки атипичного митоза)
и созревания клеток (наличие мегалоцитов),
особенно в слизистой оболочке. Наблюдается
глоссит, формирование «полированного»
языка (в связи с атрофией его сосочков);
стоматит; гастроэнтероколит, что
усугубляет течение анемии в связи с
нарушением всасывания витамина В12;
неврологический синдром, развивающимся
вследствие изменений в нейронах. Эти
отклонения в основном являются следствием
нарушения обмена высших жирных кислот.
Последнее связано с тем, что другая
метаболически активная форма витамина
В12 — 5 — дезоксиаденозилкобаламин (помимо
метилкобаламина) регулирует синтез
жирных кислот, катализируя образование
янтарной кислоты из метилмалоновой.
Дефицит 5 — дезоксиаденозилкобаламина
обусловливает нарушение образования
миелина, оказывает прямое повреждающее
действие на нейроны головного и спинного
мозга (особенно задних и боковых его
столбов), что проявляется психическими
расстройствами (бред, галлюцинации),
признаками фуникулярного миелоза
(шаткая походка, парестезии, болевые
ощущения, онемение конечностей и др.)
Комплекс лечебных
мероприятии при В12 — дефицитной анемии
следует проводить с учетом этиологии,
выраженности анемии и наличия
неврологических нарушений. При лечении
следует ориентироваться на следующие
положения:
непременным условием
лечения В12 — дефицитной анемии при
глистной инвазии является дегельминтизация
(для изгнания широкого лентеца назначают
фенасал по определенной схеме или
экстракт мужского папоротника).при органических
заболеваниях кишечника и поносах
следует применять ферментные препараты
(панзинорм, фестал, панкреатин), а также
закрепляющие средства (карбонат кальция
в сочетании с дерматолом).нормализация
кишечной флоры достигается приемом
ферментных препаратов (панзинорм,
фестал, панкреатин), а также подбором
диеты, способствующей ликвидации
синдромов гнилостной или бродильной
диспепсии.сбалансированное
питание с достаточным содержанием
витаминов, белка, безусловным запрещением
алкоголя — непременное условие лечения
В12 и фолиеводефицитной анемии.патогенетическая
терапия осуществляется с помощью
парентерального введения витамина В12
(цианкобаламин), а также нормализации
измененных показателей центральной
гемодинамики и нейтрализации антител
к гастромукопротеину («внутреннему
фактору») или комплексу гастромукопротеин
+ витамин В12 (кортикостероидная терапия).
Гемотрансфузии
проводят лишь при значительном снижении
гемоглобина и проявлении симптомов
коматозного состояния. Рекомендуется
вводить эритроцитную массу по 250 — 300 мл
(5 — 6 трансфузий).
Преднизолон (20 — 30
мг/сут) рекомендуется при аутоиммунной
природе заболевания.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
B12
– дефицитная анемия
— заболевание, обусловленное нарушением
синтеза ДНК в эритрокариоцитах вследствие
дефицита витамина В12
и
характеризующимся мегалобластным типом
кроветворения
Клиника
Клиническая
картина В12-дефицитной
анемии характеризуется поражением трех
систем: пищеварительной, кроветворной
и нервной.
—Поражение
пищеварительной системы:
ощущение тяжести и полноты в подложечной
области после еды, отрыжку съеденной
пищей и воздухом, боль и жжение в языке,
в области десен, губ, иногда в области
прямой кишки. При осмотре полости рта
обращают на себя внимание
воспалительно-атрофические изменения
слизистой оболочки полости рта и языка.
Для В12-дефицитной
анемии характерен гладкий «лакированный»
язык с атрофированными сосочками,
потрескавшийся, с участками воспаления
ярко-красного цвета. При пальпации
живота определяется неинтенсивная боль
в эпигастральной области (непостоянный
признак), нередко наблюдается увеличение
печени и селезенки.
-Поражение
кроветворной системы:
больные жалуются на значительную общую
слабость; одышку и сердцебиения;
головокружение; иногда обморочные
состояния; шум в ушах, потемнение в
глазах и мелькание мушек пред глазами.
При осмотре обращают на себя внимание
цвет кожи и внешний вид больных. Кожа
обычно бледная, очень часто с лимонно-желтым
оттенком (в связи с гипербилирубинемией,
обусловленной гемолизом). Анемия
обусловливает развитие синдрома
миокардиодистрофии, которая проявляется
тахикардией, иногда экстрасистолической
аритмией, небольшим расширением границы
относительной тупости сердца влево,
приглушенностью тонов сердца, негромким
систолическим шумом в области верхушки,
изменениями ЭКГ. Вследствие анемии,
особенно если она значительно выражена,
снижается память, умственная
работоспособность.
—Поражение
нервной системы при
В12-дефицитной
анемии называется фуникулярным миелозом
и характеризуется вовлечением в процесс
задних и боковых столбов спинного мозга.
Наступает демиелинизация, а затем
дегенерация нервных волокон в спинном
мозге и спинномозговых нервах.
Больные
жалуются на слабость в ногах, особенно
при подъеме по лестнице, при быстрой
ходьбе, ощущение ползания мурашек по
ногам, онемение ног; появляются сенсорная
атаксия, затруднения при ходьбе; снижаются
сухожильные рефлексы; наблюдается
атрофия мышц нижних конечностей. При
выраженном поражении задних столбов
спинного мозга может наступить нарушение
функции тазовых органов (недержание
мочи, недержание кала).
Диагностика:
Лабораторные
данные
Общий
анализ крови:
—гиперхромная
макроцитарная анемии (цветовой
показатель более 1.1),
-во
многих мегалоцитах (макроцитах)
обнаруживаются остатки ядра (тельца
Жолли, кольца Кебота),
-обнаруживаются
нормобласты,
-количество
лейкоцитов снижено, определяются
нейтропения, эозинопения, относительный
лимфоцитоз.
-чрезвычайно
характерно появление больших
сегментоядерных нейтрофилов с
полисегментированным ядром.
-количество
тромбоцитов снижено.
Миелограмма:
-гиперплазия
красного кроветворного ростка — клетки
красного ряда преобладают над клетками
белого ряда, отношение лейко/эритро
становится равным 1:2,1:3 (при норме
3:1,4:1); появление мегалобластного типа
кроветворения.
Биохимический
анализ крови:
неконъюгированная
гипербилирубинемией,возможно
повышение содержания в крови ЛДГ1
и
ЛДГ2
Анализ
мочи и кала —
при развитии гемолиза в моче выявляется
уробилин, в кале — увеличено количество
стеркобилина.
Тест
Шеллинга — позволяет
оценить всасывание витамина В12
в
кишечнике.
Инструментальные
исследования
Эзофагогастродуоденоскопия
— атрофические
изменения слизистой оболочки
пищеварительного тракта, развитие
диффузного атрофического гастрита,
дуоденита, мо- жет обнаруживаться
атрофический эзофагит. Биопсия
слизистой оболочки подтверждает
наличие атрофического гастрита.
Исследование
желудочной секреции — выявляется
резкое уменьшение количества желудочного
сока, отсутствие соляной кислоты
(ахилия) и пепсина, иногда соляная кислота
обнаруживается, но уровень ее очень
низкий.
УЗИ
печени и селезенки — выявляется
незначительное увеличение размеров
селезенки, иногда печени.
Рентгеноскопия
желудка — обнаруживаются
нарушения эвакуаторной функции желудка,
уплощение и сглаженность складок
слизистой оболочки.
Лечение:
Воздействие
на этиологический фактор:
-дегельминтизация
-при
органических поражениях кишечника –
ферменты, закрепляющие средства,
-нормализация
кишечной флоры,
-сбалансированное
питание с достаточным количеством
белка, витаминов, отказ от алкоголя.
Патогенетическая
терапия
-Цианкобаламин
внутримышечно по 1000 мкг 1 раз в неделю
в течение 8 недель,
—
при тяжелой анемии цианкобаламин
вводится внутримышечно по 200-500 мкг/сут
в течение 4-6 недель до наступления
гематологической ремиссии.
—
после нормализации гематологических
показателей в периферической крови и
костном мозге цианкобаламин профилактически
пожизненно вводится внутримышечно 1
раз в месяц по 1000 мкг.
—
переливание эритроцитарной массы
(200-300 мл) – при анемии тяжелой степения
и анемической коме
—
при аутоимнной природе болезни –
преднизолон 20-30 мг/сут.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
Мегалобластные
анемии
— группа заболеваний, хар-ся появлением
в красном костном мозге мегалобластов
— клеток красного ядра больших размеров
с измененной структурой ядра, которые
прослеживаются на всех стадиях
дифференцировки эритроидных
предшественников. Появление мегалобластов
связано с нарушением синтеза ДНК и
замедлением созревания клеток.
Витамин
B12-дефицитная
анемия
— группа заболеваний, связанных с
дефицитом цианокобаламина (витамин
B12)
или нарушением его метаболизма.
Причины
дефицита витамина В12:
1)
неполноценное питание (исключительно
вегетарианское);
2) дефицит внутреннего
фактора: гастрит типа А, иммунные антитела
к фактору Кастля или к париетальным
клеткам желудка, гастроэктомия, врожденный
дефицит его без нарушения функции
желудка, рак желудка;
3) хронический
панкреатит, синдром Золингера-Эллисона,
заболевания конечного отдела подвздошной
кишки (болезнь Крона, тяжелый энтерит),
синдром «приводящей кишки»;
4)
дисбактериоз (развитие бактерий в слепых
петлях);
5) наличие гельминтов (широкий
лентец);
6) хронический алкоголизм;
7)
заболевания печени (цирроз, гепатит);
8)
прием некоторых лекарственных средств,
избыточное применение антиметаболитов
при лечении опухолей также может вызвать
нарушение синтеза ДНК.
Клиника.
Болеют
лица в возрасте 45-65 лет, редко клиника
встречается у людей до 30 лет, чаще болеют
женщины. Обычно манифестация (прогрессия)
наступает весной или осенью. Заболевание
развивается постепенно, нередко долгое
время болезненное состояние проявляется
поражением ЖКТ, иногда признаками
поражения нервной системы (радикулиты),
адаптированной (легкой степени) анемией.
Выражены синдромы: поражение кроветворной
системы, ЖКТ и нервной системы. Клиника
проявляется слабостью, одышкой,
тахикардией, периодической диареей,
жгучими болями в языке при приеме острой
и кислой пищи, парестезиями, снижением
чувствительности, а при тяжелых анемиях
— спутанностью сознания, депрессией,
деменцией. Объективно: покровы бледные
с матовым и лимонно-желтым оттенком.
Язык гладкий, сглаженный, атрофичный
(иногда, гиперпластичный), блестящий,
влажный, иногда красный и воспаленный
(«лакированный» язык, глоссит Хантера).
Селезенка часто увеличена, иногда
увеличена печень. Парестезии пальцев
рук и ног. Атрофия мышц, полиневриты,
расстройства координации (неуверенная
или шаткая походка, нескоординированные
движения).
Диагностика:
— очень
низкое содержание витамина В12
в плазме (менее 100 пг/л, N 160-950 пг/л),
увеличение ферритина, уменьшение
гаптоглобина, повышение ЛДГ; — антитела
к внутреннему фактору или к париетальным
клеткам в сыворотке крови (обнаруживаются
в 50% случаев). — гиперхромия,
макроцитарная
гипо-, норморегенераторная (диспластическая)
анемия.
Обнаруживаются мегалоциты (11-14 мкм),
макроформы и анизоцитоз, включения в
эритроцитах (тельца Жолли, кольца Кебота,
зернистость Гейнца), полисегментация
нейтрофилов. — мегалобластный костный
мозг («синий» при окраске по Романовскому);
— отрицательный тест Шиллинга (при
экскреции мочи после приема радиоактивного
витамина В12
внутрь уменьшается выделение кобаламина);
— при Ph-метрии желудочного сока гипо- и
ахлоргидрия; — при биопсии слизистой
желудка — фундальный гастрит, гипертрофия
бокаловидных клеток, атрофия париетальных
и главных клеток, клеточный атипизм; —
увеличение билирубина за счет непрямого
(неконъюгированного).
Лечение.
Режим
амбулаторный или стационарный в
зависимости от тяжести анемии. Диета:
с повышенным содержанием белков,
преимущественно продукты животного
происхождения. Лекарственная терапия
заключается в назначении цианкобаламина
по 1000 мкг в/м 1 раз в день, далее по 500 мкг
3-4 недели, затем по 200 мкг/сут в течение
1-1,5 месяца или по 500 мкг 1 раз в неделю 1
месяц. С целью профилактики рецидивов
пожизненно вводят цианкобаламин
по 500 мкг 2 раза в месяц. Уже в первые
сутки после в/м введения витамина В12
происходит трансформация мегалобластного
типа в нормоцитарный, усиливается
эритропоэз. Через 48-72 часа после первой
инъекции витамина
В12начинает
увеличиваться число ретикулоцитов.
Ретикулоцитарный
криз нарастает
к 7-12 дню, что может быть оценено как
результат эффективной терапии. В
клинических условиях фолиевая кислота
не должна использоваться для лечения
В12-дефицитной
анемии, так как могут развиться серьезные
неврологические расстройства даже при
ликвидации анемии. Трансфузии эритроцитов
проводят при угрозе анемической комы
— наиболее грозного и плохо поддающегося
лечению осложнения В12-дефицитной
анемии. Прогноз
при адекватном лечении благоприятный.
Хронизация анемии отмечается при
алкоголизме и у лиц после тотальной
резекции желудка или кишечника. После
достижения ремиссии больные подлежат
диспансерному наблюдению, проведению
ФГС с биопсией слизистой желудка и
противорецидивному лечению витамином
В12
весной
и осенью.
Фолиеводефицитная
анемия
— анемия, обусловленная дефицитом
фолиевой кислоты или нарушения ее
утилизации в процессе эритропоэза, что
приводит к мегалобластному типу
кроветворения.
Патогенез.
Фолиевая
кислота
и ее соединения известны под названием
фолатов. Организм получает фолаты при
расщеплении содержащихся в пище
полиглютаматов в моноглютаматы в тонком
кишечнике. В плазме происходит превращение
метилтетрафолата в присутствии витамина
В12
в тетрагидрофолаты. Последние превращаются
в формил-ТГФ (фолиновая кислота), затем
в дезокситимидин-монофосфат с последующим
синтезирующим действием на ДНК. Таким
образом, дефицит витамина В12
ведет к нарушению синтеза фолиновой
кислоты и развитию В12-дефицитной
анемии. Дефицит фолиевой кислоты ведет
к развитию фолиеводефицитной анемии.
Суточная потребность фолатов составляет
100 мкг. Запасы, создаваемые в тканях
(печень), достаточны для синтезирования
ДНК в течение 1-3 мес.
Этиология.
1.
Недостаток фолиевой кислоты в пище (в
том числе вскармливание новорожденных
козьим или порошковым молоком). 2.
Нарушения всасывания в тонком кишечнике
и нарушения депонирования в печени (в
том числе при злоупотреблении алкоголем).
3. Прием антагонистов фолиевой кислоты
(метотрексата), аналогов пурина и
пиримидина, противосудорожных препаратов
— дифенина, фенобарбитала. 4. Повышение
потребности в фолиевой кислоте
(беременность, новорожденные,
миелопролиферативные синдромы,
хронический гемолиз). 5. При очень активной
пролиферации клеток (гемолиз, лейкозы
и другие опухоли, инфекции, псориаз).
6.
Угнетение системы дигидрофолат-редуктазы
(при приеме ЛС, при алкоголизме).
Клиника
сходна с В12-дефицитной
анемией. Не характерен атрофический
гастрит с ахилией, нет фуникулярного
миелоза. Не наблюдается геморрагический
диатез. Более выражены функциональные
признаки поражения ЦНС. Встречается
чаще у детей, молодых женщин, алкоголиков,
больных эпилепсией.
Диагностические
критерии дефицита фолиевой кислоты:
низкий уровень содержания фолатов в
сыворотке (натощак) 3-25 нг/мл; низкий
уровень содержания фолатов в эритроцитах
(N 100-415 нг/мл); макроцитарная диспластическая
анемия; мегалобластный костный мозг;
нормальный или несколько сниженный
уровень витамина В12
в сыворотке крови (менее 100 мг/мл, N
160-930 мг/мл).
Гемограмма
и миелограмма
сходны с витамин В12-дефицитной
анемией.
Дифференциальный
диагноз
с В12-дефицитной
анемией представлен в таблице.
Основные
дифференциально-диагностические
признаки витамин В12—
(2 столбик) и фолиеводефицитной анемий
(3 столбик)
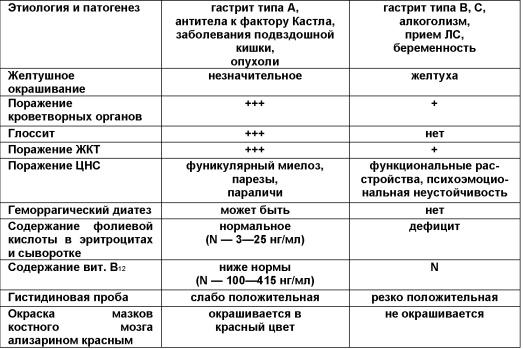
Лечение.
Фолиевая
кислота внутрь
5-15 мг/сут на протяжении 4-6 недель до
получения ремиссии. В последующем при
неустраненной причине — поддерживающая
терапия 1-5 мг/сут.
40.
Хронический миелолейкоз: этиология,
патогенез, роль хромосомных аббераций
в развитии лейкоза, фазы лейкемического
процесса, терапия 1-ой линии, терапия
резерва. Показания к трансплантации
костного мозга, исходы и осложнения
ХМЛ.
Хронический
миелолейкоз (ХМЛ)
–
хронически протекающее миелопролиферативное
заболевание, при котором наблюдается
повышенное образование
гранулоцитов, преимущественно нейтрофилов,
являющихся субстратом опухоли. Источник
опухоли –
клетка-предшественник
миелопоэза.
Этиология.
Причиной
патологического роста клеток считается
мутация клетки-предшественника
миелопоэза (частично детерминированная
полипотентная клетка). Это доказывается
обнаружением у больных ХМЛ патологической
Ph-хромосомы
(филадельфийской) в клетках миелоидного,
эритроидного,
моноцитарного и тромбоцитарного рядов.
Ph-хромосома
является частым
клеточным маркером, подтверждающим
происхождение всего патологического
клона клеток при ХМЛ от одной материнской.
Несмотря на то, что лейкозными
являются все три ростка костного мозга,
в развернутой стадии ХМЛ
наблюдается безграничный рост, только
одного ростка –
гранулоцитарного. Существенно повышается
продукция и мегакариоцитов (тромбоцитов).
Классификация.
Заболевание закономерно проходит в
своем развитии две стадии –
моноклоновую (развернутая доброкачественная)
и поликлоновую (терминальную
злокачественную). Этому соответствуют
три фазы хронического миелолейкоза в
клиническом отображении:
—
хроническая –гиперплазия
гранулоцитарного ростка кроветворения
в красном костном мозге, при этом
способность клеток к дифференцировке
и созреванию сохранена; миелоидная
пролиферация костного мозга +
небольшие изменения
в крови без явлений интоксикации;
наблюдается умеренный лейкоцитоз, со
сдвигом лейкоцитарной формулы до
миелоцитов, увеличением содержания
зрелых и созревающих гранулоцитов в
красном костном мозге, эритро-
тромбоцитопоэз сохранены, селезенка
нормальных размеров;
—
фаза акселерации –
через 3-3,5 года выраженные
клинико-гематологические проявления
(интоксикация
продуктами распада лейкозных клеток,
увеличение печени и селезенки,
миелоидная пролиферация костного
мозга + изменения в крови: появляются
бластные клетки, анемия, тромбоцитопения;
нарастают симптомы интоксикации —
лихорадка, потливость, слабость, снижение
массы тела. Важный признак — резистентность
к успешно применявшейся ранее
химиотерапии);
—
бластный криз или терминальная
(соответствует
развитию поликлоновой опухоли) –
рефрактерность
к проводимой цитостатической терапии,
истощение, значительное увеличение
селезенки и печени, дистрофические
изменения внутренних органов,
выраженные изменения крови (анемия,
тромбоцитопения).
Появление
в периферической крови бластных клеток
(до 30–90%),
в связи с чем заболевание приобретает
черты острого лейкоза. Чаще
всего в костном мозге и периферической
крови бластный криз хар-ся
появлением миелобластов, однако могут
встретиться и недифференцируемые
бластные клетки. Одновременно
происходит значительное
угнетение тромбоцитопоэза, развивается
геморрагический синдром.
Клиническая
картина.
Миелопролиферативный
синдром (обусловлен
миелоидной пролиферацией костного
мозга) включает:
а)
общие
симптомы, вызванные интоксикацией,
разрастаниями лейкозных клеток
в костном мозге, селезенке и печени
(потливость, слабость, снижение массы
тела, тяжесть и боль в области селезенки
и печени), оссалгии.
б)
увеличение
печени и селезенки;
в)
лейкемические
инфильтраты в коже;
г)
характерные
изменения в костном мозге и
периферической крови.
Синдром,
обусловленный осложнениями:
а)
геморрагический
диатез (геморрагии и тромбозы вследствие
нарушения
прокоагулянтного и тромбоцитарного
звеньев гемостаза);
б)
гнойно-воспалительные
(пневмонии, плевриты, бронхиты, гнойные
поражения
кожи и подкожной клетчатки), обусловленные
резким снижением активности
иммунитета;
в)
мочекислый диатез (гиперурикемия
вследствие повышенного распада
гранулоцитов).
При
исследовании периферической
кровиобнаруживают:
лейкоцитоз
(кол-во
лейкоцитов колеблется в широких
пределах)
с появлением в лейкоцитарной формуле
пролиферирующих форм
(миелобласты и промиелоциты) и созревающих
гранулоцитов (миелоциты,
метамиелоциты). Функциональные
свойства лейкоцитов и содержание в них
ферментов изменены: снижена активность
щелочной фосфатазы нейтрофилов, нарушена
способность
к фагоцитозу.имеется
базофильно-эозинофильная ассоциация.в
ранних стадиях болезни
возможно обнаружение гипертромбоцитоза,
в дальнейшем — тромбоцитопения.развитие
нормоцитарной,
нормохромной анемии, связанной в
основном с вытеснением лейкозным клоном
красного
ростка кроветворения, можно наблюдать
в развернутой клинико-гематологической
стадии. В терминальной стадии анемия
становится еще более выраженной.ускорение
СОЭ
При
исследовании костного
мозга:
1) обнаруживают миелоидную пролиферацию
костного мозга, нормальный миелопоэз
полностью замещен патологическим
клоном. 2) В мазке костного мозга
преобладают гранулоциты: соотношение
лейкоциты/эритроциты достигает 10:1,
20:1
за счет увеличения гранулоцитов.
3) Если в периферической крови высокий
тромбоцитоз, в костном мозге
отмечается большое количество
мегакариоцитов.
При
пункции
увеличенной
селезенкиобнаруживается
преобладание миелоидных клеток.
Диагностическими
критериямизаболевания
являются:
лейкоцитоз
более 20 — 103
в 1 мкл крови;появление
в лейкоцитарной формуле пролиферирующих
форм (миелобласты и промиелоциты) и
созревающих гранулоцитов (миелоциты,
метамиелоциты);миелоидная
пролиферация костного мозга (по данным
миелограммы и
трепанобиопсии);снижение
активности щелочной фосфатазы нейтрофилов
(менее 25 ед);обнаружение
Ph-хромосомы
в кроветворных клетках;расширение
плацдарма кроветворения (по данным
сцинтиграфии костей);увеличение
размеров селезенки и печени.
ХМЛ
следует дифференцировать от так
называемых лейкемоидных реакций,
которые могут возникать при ряде
заболеваний (туберкулез, рак, различные
инфекции, почечная недостаточность и
пр.). По определению А.
И. Воробьева (1985), лейкемоидная
реакция
–
это «изменения в крови и органах
кроветворения, напоминающие лейкозы и
другие опухоли кроветворной системы,
но не трансформирующиеся в ту опухоль,
на которую они похожи». При лейкемоидной
реакции наблюдается высокий лейкоцитоз,
в периферической
крови появляются незрелые нейтрофилы,
однако базофильно-эозинофильная
ассоциация не обнаруживается.
Дифференциальный
диагноз
основывается
на выявлении основного заболевания
(рак, туберкулез и пр.), на
повышении активности щелочной фосфатазы
нейтрофилов (вместо ее снижения при
ХМЛ). При стернальной пункции для
лейкемоидной реакции характерно
увеличение содержания миелоцитов,
однако Ph-хромосома
никогда не
определяется.
Лечение.
Воздействие
на функционирование онкогена препаратом
иматиниб мезилат (торговое название —
Гливек) — ингибитор
ABL-тирозинкиназы.
Он соединяется с активными центрами
BCR-ABL-тирозинкиназы, что приводит к гибели
клеток, содержащих ее, т.е. Ph-положительных
клеток. Эффективность превосходит все
ранее известные терапевтические
средства, применяемые у больных ХМЛ
(миелосан, гидроксимочевина, интерферон-α,
аллотрансплатация). В настоящее время
во всем мире Гливек
является препаратом 1-й линии терапии.
Назначается по 400 мг в I стадии, по 600 мг
во II стадии, до 800 мг в III стадии курсами.
Аллотрансплантация гемопоэтических
стволовых клеток и препараты новой
генерации ингибиторов тирозинкиназ
(растительный алкалоид гомогаррингтоин,
который проявил высокую эффективность
в хронической фазе, в фазе акселерации
и даже в бластном кризе ХМЛ. Назначается
по 2,5 мг/кг в/в курсом до 14 дней, затем по
7 дней в месяц для поддержания ремиссии)
используются в качестве 2-й и последующих
линий терапии у больных в хронической
фазе ХМЛ с резистентностью к Гливеку
или его непереносимостью.
ПОКАЗАНИЯ
К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА:
—
Аллогенная
трансплантация костного мозга: острые
лейкозы; хронический миелолейкоз;
тяжелая апластическая анемия;
гемоглобинопатии; врожденные иммунодефициты
и нарушения метаболизма.
—
Аутологичная
трансплантация костного мозга:
злокачественные лимфомы; некоторые
солидные опухоли; аутоиммунные
заболевания.
Прогноз.
Длительность
жизни больных ХМЛ в среднем составляет
3–5
лет,
у отдельных больных достигает 10 лет и
более. Осложнения
ХМЛ. Острая
сердечно-сосудистая недостаточность,
инфекционные осложнения, ДВС-синдром
и др.
Профилактика.
Точных мер предупреждения ХМЛ не
существует, в связи с
чем можно говорить лишь о вторичной
профилактике болезни, которая состоит
в предупреждении обострений болезни
(поддерживающая терапия, исключение
инсоляции, простудных заболеваний).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

