Стенокардия на фоне анемии
Ишемическая болезнь сердца (ИБС) – патология, в основе которой лежит поражение миокарда, обусловленное недостаточным его кровоснабжением. Атеросклеротическое сужение коронарных артерий является патогенетической основой ИБС, но для развития ишемии миокарда требуется еще дополнительный фактор, ведущий к нарушению баланса пропускной способности коронарных артерий и потребности миокарда в кислороде.
Чаще всего это увеличение работы ЛЖ (тахикардия, повышение систолического АД) или недостаточность коронарного кровотока (тромбообразование в венечных артериях, спазм). Реже как факторы, способствующие развитию или прогрессированию ИБС, рассматриваются снижение перфузионного давления (ДАД) или нарушение кислород-транспортной функции крови и т. д.
Для наглядности приводим выписки из историй болезни пациентов, у которых эти факторы играли роль «запускающего механизма». Мнение о том, что штаны принято носить только мужчинам, а женщины должны быть утонченные и элегантные, отдавая предпочтение юбкам и платьям, в нынешнее время абсолютно не актуально.
Клинический случай 1
Больной Ш., 84 года, был госпитализирован в мае 2013 г. с жалобами на давящие боли за грудиной при небольшой физической нагрузке и в покое.
Более 30 лет регистрируются высокие цифры АД (до 200/120 мм рт. ст.), сахарный диабет 2-го типа.
4 мес. назад перенес острый инфаркт миокарда без зубца Q боковой стенки левого желудочка. При коронарографии: передняя межжелудочковая ветвь (ПМЖВ) левой коронарной артерии (ЛКА) стенозирована в проксимальной трети на 50%, в дистальной трети — последовательные стенозы 30–50%; огибающая артерия (ОА) стенозирована в средней трети на 70%, правая коронарная артерия (ПКА) субокклюзирована в передней трети, окклюзирована в средней трети, дистальная часть слабо контрастируется по меж- и интраартериальным анастомозам. Выполнено стентирование средней трети ОА. Реканализацию ПКА выполнить не удалось.
Обращено внимание на наличие гипохромной анемии легкой степени (гемоглобин -106 г/л). Проведенное обследование возможного источника кровотечения не выявило. Выписан в удовлетворительном состоянии с рекомендацией приема ацетилсалициловой кислоты и клопидогрела, сахароснижающей терапии, препаратов железа.
Дома рекомендованные препараты принимал нерегулярно, врача не посещал.
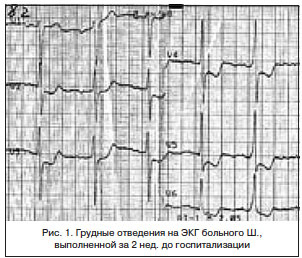
Около 2 мес. назад отметил нарастание слабости. Стали беспокоить редкие приступы загрудинных болей. На ЭКГ от 10.05.13 г.: на фоне синусового ритма с ЧСС 75 уд./мин — выраженная депрессия сегмента ST в отведениях V2-6 (рис. 1). От предложенной госпитализации отказался.
Последние 2 нед. участились приступы загрудинных болей давящего характера, они стали возникать при минимальной физической нагрузке и в покое, сублингвальный прием нитроглицерина оказывал кратковременное действие, появилось чувство нехватки воздуха. Обратился в поликлинику, откуда был доставлен в ЦКБ с диагнозом «ИБС, прогрессирующая стенокардия».
При поступлении: кожные покровы бледные. Отеков нет. ЧД — 18 в 1 мин. Дыхание жесткое. Пульс — 72, АД — 140/70 мм рт. ст. на обеих руках. Систолический шум в точке Боткина и на верхушке, проводящийся в левую подмышечную область.
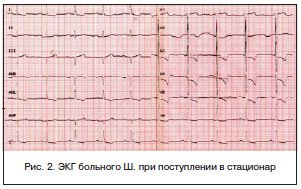
ЭКГ при поступлении (рис. 2): синусовый ритм с ЧСС 59 уд./мин, замедление атриовентрикулярной проводимости (PQ — 0,24 с). Замедление проводимости по левому предсердию и желудочку. Гипертрофия левого желудочка. Нарушение реполяризации в V2-5.
ЭхоКГ: гипертрофия миокарда ЛЖ (ММЛЖ — 240 г). Утолщение межжелудочковой перегородки (МЖП), более выраженное в базальной части (1,6–1,8 см), без признаков обструкции выходного отдела ЛЖ. Толщина ЗСЛЖ — 1,5 см. Сократительная способность миокарда ЛЖ удовлетворительная (ФВ по Тейхольцу — 63%), КСР — 3,6 см, КДР — 5,5 см, ЛП — 5,1 см. Зон нарушенной кинетики не выявлено. Изменение диастолической функции ЛЖ по первому типу.
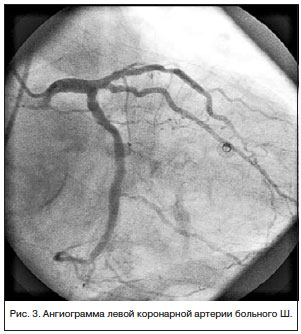
В экстренном порядке выполнена коронароангиография (КАГ) (рис. 3): ствол ЛКА не изменен. ПМЖВ стенозирована на границе передней и средней третей на 50%, на протяжении дистальной трети — последовательные стенозы 30–60%. 1ДВ — анатомически некрупная, стенозирована в устье на 80%, окклюзирована в средней трети, дистальная часть слабо контрастируется по интерартериальным коллатералям. ВТК стенозирована в устье до 50%. ОВ анатомически крупная, проходима на всем протяжении, ранее имплантированные стенты — без стенотических изменений. ПКА субокклюзирована в передней трети, окклюзирована в средней трети, дистальная часть слабо контрастируется по меж- и интраартериальным анастомозам. Сбалансированный тип коронарного кровоснабжения.
Учитывая отсутствие динамики стенозов-КА по сравнению с КАГ от января 2013 г., чрескожное коронарное вмешательство не проводилось.
В анализе крови: гемоглобин — 61 г/л, эритроциты — 2,30×10*12, ЦП — 0,8, гематокрит — 18,5, лейкоциты — 7,7×10*9.
Кардиоспецифические ферменты (КФК МВ, тропонин Т) находились в пределах референсных значений.
В анализе мочи: удельный вес — 1020, белок — 0,15, лейкоциты — 0–5 в поле зрения, эритроциты — 100–150 в поле зрения.
Дополнительный целенаправленный расспрос позволил выяснить, что на протяжении последних 4 мес. неоднократно были эпизоды выделения темно-красной мочи, иногда длившиеся по несколько дней (макрогематурия?).
Убедительных данных, говорящих об остром очаговом поражении миокарда, на момент госпитализации не получено. Учитывая наличие анемии тяжелой степени, произведена трансфузия отмытых эритроцитов (1150 мл за 2 сут) с положительным эффектом: уровень гемоглобина повысился до 100 г/л, число эритроцитов — до 3,59×10*12, гематокрит — до 29,4.
На ЭКГ через 1 сут после последней гемотранфузии отмечается нормализация конечной части желудочковых комплексов в грудных отведениях (в V4 — зубец Т слабоотрицательный).
Самочувствие пациента значительно улучшилось: в течение последующих 3 сут при расширении двигательного режима до уровня физических нагрузок, соответствующих 3 функциональному классу, боли в грудной клетке не возникали, выраженность одышки существенно уменьшилась, объем нагрузок ограничивался главным образом мышечной утомляемостью. Эпизоды макрогематурии не повторялись. В удовлетворительном состоянии больной переведен для дообследования в урологическое отделение.
Клинический случай 2
Больной К., 50 лет, госпитализирован в стационар в декабре 2014 г. с клиникой прогрессирования стенокардии напряжения, одышки, возникающих при минимальной физической нагрузке, в покое, с нарастанием общей слабости в течение последнего месяца.
В анамнезе: АГ с максимально известными значениями АД 200/100 мм рт. ст. давностью более 15 лет; регулярно принимает антигипертензивные препараты, однако контроль АД нерегулярный. В 2002 г. перенес ОИМ, в этом же году выполнено аортокоронарное шунтирование (АКШ) ПМЖА, ПКА, ОА. В 2009 г. развилась клиника прогрессирующей стенокардии, в связи с чем выполнено стентирование шунта к ОВ ЛКА. В мае 2014 г. — повторный ОИМ задней стенки левого желудочка, проводился системный тромболизис, чрескожное коронарное вмешательство с реканализацией и стентированием АКШ к ОА. После выписки и до настоящей госпитализации — состояние стабильное.
Сопутствующие заболевания: сахарный диабет 2-го типа, мочекаменная болезнь, хронический геморрой, железодефицитная анемия легкой степени регистрируется с 2009 г. (препараты железа не принимал).
При поступлении: кожные покровы бледные, сухие. ЧД — 18 уд./мин. Дыхание жесткое, небольшое количество свистящих хрипов на выдохе. Тоны сердца глухие. ЧСС -76 уд./мин. АД — 150/90 мм рт. ст. на обеих руках.
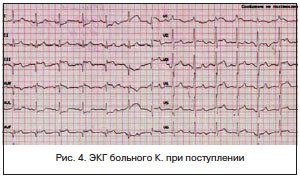
ЭКГ зарегистрирована на фоне болевого приступа (рис. 4): ритм синусовый, ЧСС — 88 уд./мин, смещение сегмента ST вверх от изолинии в отведениях III, aVF, V1. В отведениях I и aVL смещение сегмента ST книзу от изолинии. Зубец Q длительностью 0,04 с во II, III, aVF отведениях.
ЭхоКГ: гипертрофия миокарда ЛЖ (ММЛЖ — 213 г, МЖП — 1,5 см, ЗСЛЖ — 1,2 см). Дилатация левого предсердия (5,3×6,1 см). Нарушение диастолической функции левого желудочка по первому типу. Гипокинез диафрагмального, заднебазального и заднебоковых сегментов. ФВ — 54% по Тейхольцу.
В общем анализе крови: гемоглобин — 70 г/л, эритроциты — 4,29×10*12, гематокрит -23,5, ЦП — 0,48, гипохромия, анизоцитоз, пойкилоцитоз (овалоциты, мишеневидные эритроциты), лейкоциты — 5,9×10*9. Сывороточное железо — 1,9.
Кардиоспецифические ферменты (КФК МВ, тропонин Т) находились в пределах референсных значений.
Таким образом, убедительных данных, свидетельствующих об остром очаговом поражении миокарда, на момент госпитализации не получено. Высказано предположение, что причиной прогрессирования стенокардии являлась тяжелая железодефицитная анемия, вероятнее всего, постгеморрагическая. Проведена трансфузия эритроцитной взвеси 630 мл за первые сутки, начато парентеральное введение препаратов железа.
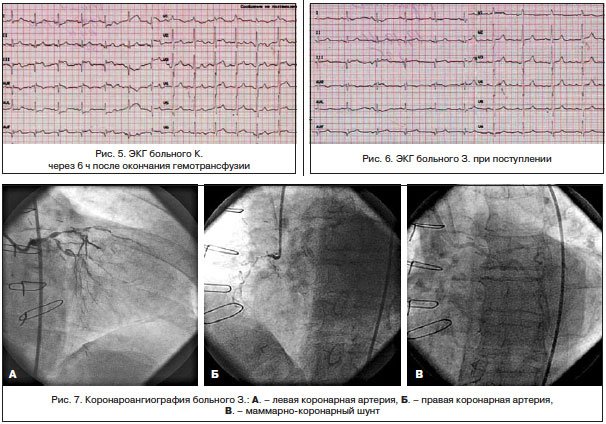
Трансфузионную терапию перенес хорошо. Ангинозные боли не рецидивировали. На ЭКГ, зарегистрированной после гемотрансфузии (рис. 5): ЧСС — 62 уд./мин. Сегмент ST вернулся к изолинии.
В анализе крови спустя 1 сут: уровень гемоглобина возрос до 105 г/л, число эритроцитов — до 5,71×10*12, гематокрит — 38,3, ЦП — 0,55, гипохромия, анизоцитоз сохраняются. Лейкоциты — 8×10*9.
В течение 3 сут пациент находился в ОРИТ, антиангинальной терапии не требовалось, т. к. приступы стенокардии не рецидивировали.
Проводился поиск возможного источника кровопотери, онкопоиск: при колоноскопии выявлен хронический комбинированный геморрой 3 ст. Другой патологии, которая могла бы объяснить наличие анемии, не найдено.
Проводилось постепенное расширение двигательного режима. Физические нагрузки, соответствующие уровню 3 функционального класса, приступов стенокардии и ЭКГ-признаков ишемии миокарда не вызывают.
Через 12 дней в стабильном состоянии пациент выписан для дальнейшего лечения в амбулаторных условиях. Хирургом рекомендовано выполнение в плановом порядке дезартеризации геморроидальных узлов под ультразвуковым контролем.
Клинический случай 3
Больной З., 82 года, госпитализирован в стационар с жалобами на дискомфорт за грудиной, нехватку воздуха, возникающие без четкой связи с физической нагрузкой, длительностью до 4–5 мин, накануне был затяжной приступ длительностью более 1 ч, выраженную слабость, потливость. Настоящее ухудшение состояния отмечает в течение последних 3 дней на фоне появившейся гипотонии.
В течение 2 нед. до госпитализации принимал по поводу дорсалгии нестероидные противовоспалительные препараты (НПВП) (кеторолак). 4 дня назад отметил появление учащенного жидкого стула темной окраски, необычно низкое АД — 80/40 мм рт. ст.
В 1995 г. перенес ОИМ нижней стенки ЛЖ. В этом же году выполнено маммарно-коронарное шунтирование ПМЖА, АКШ ЗБВ ОА и ПКА. В 2003 г. — линейное аортобедренное шунтирование синтетическим протезом слева. Ранний послеоперационный период осложнился развитием повторного ОИМ нижней стенки ЛЖ.
С 2009 г. — пароксизмы мерцательной тахиаритмии.
Постоянно принимает бисопролол — 2,5 мг/сут, периндоприл — 5 мг/сут, аторвастатин — 20 мг/сут, варфарин — 5 мг/сут. Контроль МНО не проводился более года.
При поступлении: кожные покровы и видимые слизистые бледные. Число дыханий — 20 в 1 мин. Дыхание ослабленное, жесткое. Тоны сердца глухие, ритмичные. ЧСС — 76 уд./мин. АД — 110/70 мм рт. ст.
Лабораторные данные: гемоглобин — 91 г/л, эритроциты — 3,93×10*12, гематокрит — 33,0, ЦП — 0,84, лейкоциты — 10,2–10,6×10*9, тромбоциты — 223×10*9, анизоцитоз, анизохромия.
Кардиоспецифические ферменты: КФК — 268 при поступлении, через 10 ч — 319, КФК МВ — 30 при поступлении, через 10 ч — 42, тропонин Т при поступлении — 177, через 10 ч — 538.
Сывороточное железо — 13 мкмоль, белки транспорта железа в границах нормы. Коагулограмма: АЧТВ — нет коагуляции, МНО — нет коагуляции, фибриноген — 3,3 г/л, Д-димер — 1147.
ЭКГ (рис. 6) при поступлении: синусовый ритм, АВ-блокада I ст., рубцовые изменения нижней стенки ЛЖ, смещение сегмента ST во II, III и avF отведениях, высокий R — в V1-2. Архив ЭКГ не предоставлен.
ЭхоКГ: склероз и кальциноз стенок аорты, кольца и створок АК. ММЛЖ — 204 г, толщина МЖП — 1,0 см, ЗСЛЖ — 1,0 см. Дилатация левых отделов сердца (ЛП — 4,5×5,5 см, левый желудочек: КСО — 92, КДО — 171). Относительная недостаточность МК II степени. Гипокинез среднего заднего и заднебокового сегментов ЛЖ. Снижение глобальной сократительной способности миокарда ЛЖ (ФВ по Тейхольцу — 47%). Диастолическая дисфункция левого желудочка первого типа.
С учетом жалоб, анамнеза, лабораторно-инструментальных данных у больного диагностирован повторный ОИМ диафрагмальной и заднебазальной локализации.
Не исключалось состоявшееся желудочно-кишечное кровотечение на фоне приема НПВП и орального антикоагулянта, в связи с чем экстренно выполнена ЭГДС: эндоскопические признаки хронического эзофагита, язва нижней трети пищевода Forrest II C. Острая язва желудка Forrest II B (без признаков продолжающегося кровотечения). Язва привратника Forrest I B (с признаками продолжающегося кровотечения). После эндоскопического инъекционного гемостаза кровотечение остановлено.
Причиной ОИМ, вероятно, явилась гипотония и анемия на фоне желудочно-кишечного кровотечения. Начата консервативная гемостатическая, противоязвенная терапия. От проведения КАГ с возможным чрескожным коронарным вмешательством решено воздержаться до стабилизации состояния.
На фоне лечения цифры АД стабилизировались на уровне 120/85 мм рт. ст., уровень гемоглобина повысился до 110 г/л, возросло число эритроцитов — до 5,71×10*12, гематокрит — 38,3, ЦП — 0,55, лейкоциты — 8×10*9, гипохромия, анизоцитоз сохраняются.
Уровень активности КФК снизился до 113 ед, МВ КФК — до 12,7, тропонина Т — до 225.
ЭГДС через 2 сут: язва нижней трети пищевода Forrest III, острая язва желудка Forrest III, язва привратника Forrest II С (отсутствие признаков кровотечения, появление в области дна фибрина).
На 3-й день пребывания в стационаре возобновились кратковременные приступы сжимающих болей за грудиной (2 приступа: во время приема пищи и при попытке сесть в кровати).
По экстренным показаниям выполнена коронароангиография (рис. 7): ствол ЛКА стенозирован на протяжении передней и средней трети до 70%, субокклюзирован в дистальной трети с переходом на устья ОВ и ПМЖВ; ПМЖВ субокклюзирована в устье, стенозирована в передней трети на 80%, окклюзирована в средней трети, дистальная часть контрастируется по функционирующему маммарно-коронарному шунту. ОВ субокклюзирована в устье, стенозирована в передней трети на 80%; ПКА субокклюзирована на протяжении передней и средней трети, окклюзирована на границе средней и дистальной третей, дистальная часть контрастируется по межартериальным анастомозам.
Правый тип коронарного кровоснабжения.
Маммарно-коронарный шунт из правой маммарной артерии в дистальной трети ПМЖВ проходим. Шунты к ОА и ПКА не визуализируются.
Попытка реканализации стенозированных артерий — без успеха в связи с выраженным кальцинозом.
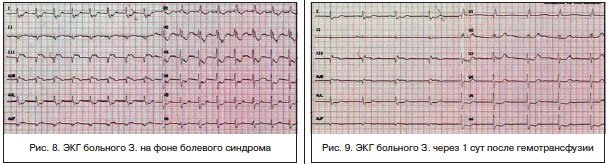
В течение последующих суток — состояние с отрицательной динамикой: в виде учащения кратковременных приступов стенокардии, сопровождающихся выраженными ЭКГ-признаками ишемии миокарда (рис. 8). Отмечено снижение гемоглобина со 110 до 87 г/л, гематокрита — до 26,0.
Кардиоспецифические ферменты в пределах нормальных значений. ЭхоКГ: размер левых отделов сердца прежний, новых участков нарушения движений стенок ЛЖ не выявлено.
Гастроскопия: активное кровотечение из острого дефекта слизистой кардиоэзофагеального перехода (Forrest I). Эндоскопическая остановка кровотечения.
После переливания 600 мл эритроцитной взвеси состояние с положительной динамикой: ангинозные боли и ЭКГ-признаки ишемии миокарда не рецидивируют (рис. 9), восстановление уровня гемоглобина (110 г/л), эритроцитов (3,85×10*12), гематокрита -33,7.
При контрольной ЭГДС через 10 дней положительная динамика — уменьшение в размерах язвенных дефектов без признаков кровотечения.
На фоне терапии ингибиторами протонной помпы, β-блокаторами, клопидогрелом 75 мг/сут показатели красной крови стабильны, двигательный режим расширен и по уровню нагрузок соответствует 3 ФК.
ХМЭКГ: ритм синусовый, ЧСС (за сут/днем/ночью): 78/77/78 уд/мин, максимальная ЧСС — 99 уд/мин, минимальная — 64 уд/мин. Отмечается появление депрессии сегмента ST при увеличении ЧСС свыше 90 уд/мин.
Приведенные случаи демонстрируют возможность проявления коронарной недостаточности на фоне снижения кислород-транспортной способности крови как у пациентов с тяжелым, так и умеренным поражением коронарного русла. Устранение анемии во всех трех случаях способствовало повышению коронарного резерва и стабилизации состояния.
Источник
Особенности течения ИБС на фоне анемического синдрома различной
этиологии
Обследованы 54 больных ИБС (стабильная стенокардия III–IV функциональных классов), осложненной железодефицитной анемией (ЖДА), диагноз которой был установлен на основании сниженного уровня сывороточного железа. Лечение ИБС проводили с помощью антиангинальных препаратов (нитраты, антагонисты кальциевых каналов). Для терапии ЖДА использовались железосодержащие препараты Венофер и Ферро-Фольгамма. Коррекция уровня гемоглобина (c 99,51 ± 3,7 до 111,2 ± 3,7 г/л), достигнутая за счет увеличения содержания сывороточного железа (с 5,86 ± 0,9 до 12,47 ± 1,4 мкмоль/л), приводила к значительному улучшению клинического состояния больных. Это проявлялось резким снижением частоты приступов стенокардии, троекратным уменьшением суточной потребности в нитроглицерине, многие больные полностью отказались от приема антиангинальных препаратов. На фоне нормализации уровней сывороточного железа и гемоглобина наблюдалось улучшение насосной деятельности сердца, что выражалось в увеличении фракции выброса практически до нормального уровня. Сделан вывод, что ранняя диагностика ЖДА имеет большое значение в общей проблеме профилактики, лечения и улучшения прогноза при ИБС, а ее коррекция является необходимым компонентом комплексной терапии сердечно-сосудистых заболеваний, способствующих развитию хронической сердечной недостаточности.
Введение
Ишемическая болезнь сердца (ИБС) была выделена как “самостоятельное заболевание” Всемирной организацией здравоохранения лишь в 1965 г. В настоящее время ИБС широко распространена во всем мире, особенно в экономически развитых странах, и занимает ведущее место в структуре смертности от сердечно–сосудистых заболеваний [6].
В основе ИБС лежит несоответствие объема коронарного кровотока (Q) величине потребления миокардом кислорода (ПМО2).
Величина коронарного кровотока регулируется тоническим состоянием коронарных сосудов и градиентом давления в восходящем отделе аорты и полости левого желудочка:
Р1 – давление в восходящем отделе аорты;
Р2 – давление в левом желудочке;
R – сопротивление коронарных сосудов.
Энергетическое обеспечение насосной деятельности сердца в широком диапазоне его деятельности – от состояния покоя до уровня максимальной нагрузки – происходит за счет коронарного резерва. Коронарный резерв – способность коронарного сосудистого русла во много раз увеличивать коронарный кровоток адекватно уровню ПМО2 за счет дилатации коронарных сосудов (рис. 1). Величина коронарного резерва (I) в зависимости от давления в коронарных сосудах заключена между прямой, соответствующей коронарному кровотоку при максимально дилатированных сосудах (А, Б), и кривой величинами коронарного кровотока при нормальном сосудистом тонусе (область ауторегуляции). При снижении уровня гемоглобина (Hb), являющегося носителем О2, для адекватного обеспечения ПМО2 происходит увеличение коронарного кровотока в области ауторегуляции, что ведет к уменьшению коронарного резерва (II), особенно при атеросклеротическом поражении (Б) коронарных сосудов.
Если ИБС развивается на соматически отягощенном фоне, в частности на фоне анемии, это утяжеляет течение заболевания, создает дополнительные сложности в диагностике и тактике ведения данного контингента независимо от их возраста.
Исследования на животных показали, что ишемизированный или гипертрофированный миокард высокочувствителен даже к незначительному снижению уровня гемоглобина. Негативный эффект анемии на работу сердца как насоса был отмечен и у людей [1, 6]. Снижение уровня гемоглобина способствует и уменьшению оксигенации крови в легких, что также способствует снижению доставки кислорода к миокарду.
Результаты сравнительно недавно законченного ретроспективного исследования, включившего 79 тыс. пациентов в возрасте 65 лет и старше с острым инфарктом миокарда, показали, что более низкий уровень гематокрита (Ht < 35 %) при госпитализации ассоциируется с более высоким показателем летальности в первые 30 дней пребывания в стационаре. В то же время среди больных, которым проводилась гемотрансфузия, смертность значительно снижалась [8, 12].
Анемия – это снижение концентрации Hb (< 120 г/л) и/или уменьшение общего объема эритроцитов (Ht < 40 %) периферической крови. В настоящее время выделяют следующие типы анемий:
- гипопролиферативные;
- вследствие нарушения образования эритроцитов и гемоглобина (в первую очередь железодефицитная);
- анемии повреждения (гемолиз, кровотечения) [4, 7].
Под анемическим синдромом подразумевают обусловленный органно–клеточной гипоксией симптомокомплекс, включающий головокружение, шум в ушах, головные боли, мелькание мушек перед глазами, слабость, утомляемость, снижение работоспособности, хроническую усталость, бледность кожи и слизистых, сердцебиение, одышку и боли в области сердца при незначительной физической нагрузке [7].
Результаты обследования
и комплексного лечения
больных ИБС с анемическим синдромом
Под нашим наблюдением находились 54 пациента с ИБС (стабильная стенокардия III–IV функциональных классов – ФК), осложненной железодефицитной анемией (ЖДА), диагноз которой был установлен на основании сниженного уровня сывороточного железа.
В общую группу входили 24 женщины (средний возраст – 64,2 ± 3,2 года) и 30 мужчин (средний возраст – 58,2 ± 3,8 года). Из исследования исключались онкологические больные и пациенты с хронической почечной недостаточностью.
Функциональный класс стенокардии оценивали с помощью нагрузочного теста: определялась дистанция (м), пройденная за 6 минут без “дискомфорта в области сердца” с оценкой фракции сердечного выброса (ФВ) по данным ЭхоКГ до и после лечения.
Критериями анемии являлись снижение уровня гемоглобина <120 г/л и показатели лабораторного исследования крови. Для ЖДА характерна гипохромия: цветной показатель < 0,85; среднее содержание Hb в эритроците (МСН) < 24 пг; средняя концентрация Hb в эритроците (МСНС) < 30 г/дл; микроцитоз – средний объем эритроцита (МСV) < 75 мкм3; сывороточное железо (СЖ) < 12,0 мкмоль/л; насыщение трансферрина железом (НТЖ) < 25 %.
Снижение количества ретикулоцитов < 2 % свидетельствует о нарушении пролиферативной функции костного мозга на стимуляцию эритропоэтином (ЭПЭ) при дефиците железа [2, 5].
Средний уровень гемоглобина в крови до лечения в целом по группе составил 99,51 ± 3,7 г/л, в т. ч. у женщин – 96,4 ± 4,2 г/л, у мужчин – 102,0 ± 3,6 г/л. Концентрация СЖ до лечения в среднем по группе составляла 5,86 ± 0,9 мкмоль/л, в т. ч. у женщин – 5,2 ± 1,7 мкмоль/л, у мужчин – 6,39 ± 2,5 мкмоль/л. Результаты обследования больных до и после лечения представлены в таблице.
Лечение основного заболевания – ИБС – проводили с помощью антиангинальных препаратов (нитраты, антагонисты кальциевых каналов) на фоне терапии ЖДА с исключением ацетилсалициловой кислоты и ингибиторов АПФ, которые, по данным различных авторов, ингибируют синтез ЭПЭ в почках и блокируют его действие на уровне костного мозга [11].
Доза вводимого железосодержащего препарата рассчитывалась в соответствии с общим дефицитом железа (ОДЖ) в организме согласно формуле:
ОДЖ = МТ (кг) × 0,24 × (150 г/л – Hb больного) + депонированное железо.
Для массы тела (МТ) более 35 кг количество депонированного железа – 500 мг, Hb – 150 г/л; коэффициент 0,24 = 0,0034 × 0,07 × 1000 (содержание железа в Hb = 0,34 %, объем крови = 7 % от массы тела, коэффициент 1000 = перевод “г” в “мг”) [3, 7].
У 32 больных стартовое лечение ЖДА начинали с внутривенного введения железосодержащего препарата Венофер в течение 1–2 недель с последующей терапией пероральным препаратом Ферро–Фольгамма.
Общий объем вводимого Венофера, который в 1 мл содержит 20 мг железо(III)–гидроксид сахарозного комплекса, для каждого пациента рассчитывали исходя из ОДЖ: объем (мл) = ОДЖ (мг)/20 (мг/мл).
Суммарно одному больному за 1–2 недели с Венофером вводили в среднем 1444 ± 25,4 мг железа.
У остальных больных (22 пациента) лечение ЖДА проводили только препаратом Ферро–Фольгамма из расчета 300–400 мг железа в сутки (в среднем по группе – 384,4 ± 27,3 мг/сут) в течение 2–3 недель.
Ферро–Фольгамма – комбинированный препарат, 1 капсула которого содержит 100 мг железа (II) сульфата, 5 мг фолиевой кислоты, 10 мкг цианокобаламина и 100 мг аскорбиновой кислоты, с минимальными побочными эффектами по сравнению с другими железосодержащими препаратами для перорального применения.
Как следует из таблицы, в результате лечения железосодержащими препаратами произошел рост концентрации гемоглобина в целом по группе на 11,7 % в результате увеличения уровня СЖ на 112,8 % (более чем в 2 раза).
На фоне нормализации уровней СЖ и гемоглобина наблюдалось улучшение насосной деятельности сердца, что выражалось в увеличении ФВ практически до нормального уровня.
Толерантность к физической нагрузке в целом по группе к концу стационарного лечения (3 недели) в среднем возросла на 39,8 %, что позволило у многих больных изменить ФК стенокардии. Если до начала лечения III и IV ФК регистрировались в 100 % наблюдений, то к концу терапии у 29 (53,7 %) больных имел место I ФК, у 21 (38,9 %) – II ФК и только у 4 (7,4 %) – III ФК. Ни у одного из пациентов после проведенной терапии не регистрировался IV ФК стенокардии (рис. 2).
При оценке клинической картины ИБС количество приступов стенокардии до лечения в среднем составило 10 в день, после лечения – 4. Двенадцать пациентов (22,2 %) полностью отказались от приема антиангинальных препаратов. Суточная потребность больных в нитроглицерине сократилась более чем в 3 раза: до лечения средняя суммарная доза составляла 10,5 ±1,5 мг, после лечения – 3,25 ± 1 мг.
Обсуждение полученных результатов
ИБС – это группа патологических состояний, обусловленных абсолютной или относительной недостаточностью коронарного кровообращения. Энергетику (доставка кислорода) нормальной работы сердца как насоса обеспечивает поток крови по коронарным артериям. Сужение или закупорка одной или нескольких коронарных артерий лишает сердечную мышцу необходимого ей количества кислорода.
Эпидемиологические исследования свидетельствуют, что заболевания сердечно–сосудистой системы, прежде всего ИБС, занимают ведущее место как среди причин нетрудоспособности, так и в структуре смертности. Чаще болеют мужчины в возрасте 40–65 лет. В развитых странах на 1 млн населения приходится 30–40 тыс. больных ИБС [6].
В настоящее время абсолютно ясно, что, несмотря на очевидные достижения в изучении патогенеза ИБС, ее лечение представляет собой трудно решаемую проблему из–за комплексности механизмов развития этого заболевания. Своеобразие возникновения и течения ИБС, а также фазность самого процесса обусловливает тот простой факт, что лечение на начальном этапе и в период развернутой клинической картины не может быть идентичным, т. к. наличие осложнений и сопутствующих заболеваний (в частности, анемии) существенно влияет на характер и результаты лечебных мероприятий.
Способность анемии ухудшать течение ИБС очевидна. В работе Wu W.C. и соавт., в которую включен ретроспективный анализ течения ИБС у 78 984 пациентов в возрасте ≥ 65 лет, показана сильная обратная корреляционная зависимость между смертностью в первые 30 дней стационарного лечения острого инфаркта миокарда и уровнем Ht при поступлении. Анализ показал, что у пациентов с Ht > 39 % летальность составляла 17,2 %, при Ht от 30,1 до 33 % смертность повышалась до 30 %, а при Ht < 30 % погибало 36 % больных. Кроме того, было обнаружено, что при ИБС анемия встречалась значительно чаще и сильнее влияла на прогноз, чем считалось ранее. Эти данные указывают, что диагностика и коррекция анемии имею большое значение в лечении ИБС [12].
Факторами, способствующими развитию анемии и анемического синдрома у больных ИБС, могут быть:
- ишемическое повреждение костного мозга;
- снижение высвобождения железа из ретикулоэндотелиальной системы;
- мальабсорбция (как результат венозного застоя в желудочно–кишечном тракте);
- применение ацетилсалициловой кислоты (латентные формы потери крови).
Длительное использование ингибиторов АПФ при лечении ИБС также может приводить к снижению уровня гемоглобина за счет подавления секреции ЭПЭ эндотелием почечных канальцев и блокады действия ЭПЭ на уровне костного мозга [8–11, 13, 14]. Определенное значение в развитии анемии может иметь фактор некроза опухоли, уровень которого повышается у пациентов с хронической сердечной недостаточностью как исходом ИБС и коррелирует с тяжестью анемии.
В нашем исследовании коррекция уровня Hb (c 99,51 ± 3,7 до 111,2 ± 3,7 г/л) у пациентов с ИБС, сочетающейся с ЖДА, достигнутая за счет увеличения содержания сывороточного железа (с 5,86 ± 0,9 до 12,47 ± 1,4 мкмоль/л) в результате применения железосодержащих препаратов Венофер и Ферро–Фольгамма, приводила к значительному улучшению клинического состояния больных. Это проявлялось резким снижением частоты приступов стенокардии, уменьшением ее ФК (повышение толерантности к физической нагрузке), троекратным понижением суточной потребности в нитроглицерине, многие больные полностью отказались от приема антиангинальных препаратов. Подобная положительная динамика со стороны клинической картины произошла на фоне улучшения показателей насосной деятельности сердца: ФВ возросла на 27,4 %, приблизившись к нормальному уровню.
Таким образом, увеличение уровня Hb (основного носителя кислорода) у больных ИБС с ЖДА способствует нормализации соответствий между потреблением кислорода миокардом и величиной коронарного кровотока, что обеспечивает необходимый энергобаланс для эффективной работы сердца как насоса. С учетом всего вышеизложенного можно утверждать, что ранняя диагностика ЖДА имеет большое значение в общей проблеме профилактики, лечения и улучшения прогноза при ИБС, а ее коррекция является необходимым компонентом комплексной терапии сердечно–сосудистых заболеваний, способствующих развитию хронической сердечной недостаточности.
- Арутюнов Г.П. Анемия у больных с ХСН // Сердечная недостаточность. 2003. Т. 4. № 5. С. 224–227.
- Вуд Мари Э., Банн Пол А., Токарев Ю. и др. Секреты гематологии и онкологии // РМЖ. 2002. № 28.
- Дворецкий Л.И. Клинические рекомендации по лечению больных железодефицитной анемией // РМЖ. 2004. Т. 12. № 14. С. 893–897.
- Городецкий В.В., Годулян О.В. Железодефицитные состояния и железодефицитная анемия: лечение и диагностика. Медпрактика-М. 2004. Т. 3. 28 с.
- Луговская С.А. Патогенез и диагностика анемий при хронических заболеваниях // Клиническая лабораторная диагностика. 1997. № 112. С. 19–22.
- Клюжев В.М., Ардашев В.Н., Брюховецкий А.Г. и др. Ишемическая болезнь сердца. М., 2004.
- Протокол ведения больных. Железодефицитная анемия. М., 2005.
- Fonarow GC, Horwich TB, Hamilton MA, et al. Anemia is associated with worse symptoms, greater impairment in functional capacity, and a significant increase in mortality in patients with advanced heart failure. J Am Coll Cardiol 2002;39:184A.
- Kalra PR, Bolger AP, Francis DP, et al. Effect of anemia on exercise tolerance in chronic heart failure. J Cardiol 2003;91:888—91.
- Okonko DO, Van Veldhuisen DJ, Poole-Wilson, et al. Anemia of chronic disease in chronic heart failure: the emerging evidence. Europ Heart J 2005;26:2213–14.
- Opasich C, Cazzola M, Scelsi L,et al. Blanted erythropoietin production and defective iron supply for erythropoiesis as major causes of anemia in patients with chronic heart failure. Europ Heart J 2005;26:2232–37.
- Wu WC, Rathore SS, Wang Y, et al. Blood transfusion in elderly patients with acute myocardial infarction. N Engl J 2001;345:1230–36.
- Silverberg DS, Wexler D, Blum M, et al. The interact between Heart Failure, Renal Failure and Anemia. The Cardio-Renal Anemia Syndrom Blood Pursification 2004;22:277—84.
- Silverberg DS, Wexler D, Sheps D, et al. The effect of correction of mild anemia in severe, resistant congestiv heart failure using subcutaneous erythropoietin and intravenous iron. A randomized controlled study. J Am Coll Cardiol 2001;37:177–80.
Источник