Респираторная инфекция и бронхиальная астма у детей
Комментарии
Опубликовано в журнале:
В мире лекарств »» №1 1999 Н.А. ГЕППЕ, ПРОФЕССОР КАФЕДРЫ ДЕТСКИХ БОЛЕЗНЕЙ МОСКОВСКОЙ МЕДИЦИНСКОЙ АКАДЕМИЯ ИМ. И.М. СЕЧЕНОВА
Главным фактором риска развития астмы в детстве рассматривается генетическая предрасположенность к аллергии, совместно с ранним воздействием аэроаллергенов и сенсибилизацией к ним дыхательных путей. В то время как экспозиция аллергенов может действительно вызывать обострение, большинство острых атак астмы у детей, особенно раннего возраста, сочетается с респираторной вирусной инфекцией. Взаимоотношения между респираторной вирусной инфекцией и обострениями астмы являются крайне интересными и важными, так как нередко возникают сложности в диагностике астмы у детей раннего возраста и трактовке роли ОРВИ в развитии астмы и ее обострений
Иммунологические исследования показали, что в дыхательных путях существует две субпопуляции лимфоцитов-хелперов Th1 и Th2. Th1 подтип секретирует определенные цитокины, включая интерферон-гамма и интерлейкин-10, которые важны в защите от бактериальной и вирусной инфекций. Th2 подтип рассматривается как «проатопический», так как секретирует такие цитокины, как ИЛ-4 и ИЛ-5, которые способствуют пролиферации тучных клеток, продукции IgE, дифференциации, привлечению и выживанию эозинофилов. Продукция цитокинов этими двумя субтипами лимфоцитов взаимно контролируется: интерферон-гамма и ИЛ-10 ингибируют дифференцировку Th2, а ИЛ-4 — дифференцировку Th1. Снижение частоты ОРВИ в детстве таким образом гипотетически может способствовать Th2-ответу к аэроаллергенам.
Вирусы, провоцирующие обструкцию, у детей зависят от возраста. Так у детей до двух лет провоцируют обструкцию (при этом астмы может не быть) главным образом респираторно-синцитиальный вирус и вирус парагриппа.
У детей первого года жизни, не страдающих астмой, обструкцию в раннем возрасте в результате вирусной инфекции связывают с действием воспаления на мелкие дыхательные пути, имеющие анатомические особенности. У них выявляется более низкая максимальная скорость выдоха, даже когда они здоровы, по сравнению с детьми, у которых никогда не было обструкции, и это различие сохраняется в дальнейшей жизни, хотя бронхиальной гиперреактивности не наблюдается.
Когда дети становятся старше и у них есть астма, профиль вирусов существенно изменяется, доминируя риновирусная инфекция. С внедрением высокочувствительных и высокоспецифичных методов полимеразной цепной реакции для определения вирусов, показано, что более 80% обострений астмы у детей сочетается с ОРВИ, и риновирус находят более чем в 60% среди определяемых вирусов. Обструкцию у детей с астмой может также вызывать грипп и парагрипп, но в меньшей степени. Кроме того, наблюдается сезонность ОРВИ, вызывающих обструкцию. У детей с астмой нередки обострения в сентябре, после летних каникул, и ранней весной, а также в ноябре и в начале зимы, когда развивается эпидемия гриппа.
Эпидемиологические исследования детей, страдающих инфекцией нижних дыхательных путей с обструктивным синдромом, в первые 2 года жизни показали, что обструктивный синдром у детей раннего возраста не увеличивает риск развития астмы в последующие годы. Даже у большинства детей из семей с атопическим анамнезом не отмечается обструкции после 3 лет. Однако у детей и взрослых, у которых уже есть астма, наиболее частой причиной обострении являются вирусные респираторные инфекции. Многочисленные изменения в дыхательных путях во время ОРВИ могут усиливать существующее воспаление в дыхательных путях и гиперреактивность. Обследование пациентов, попадающих в отделения неотложной терапии с обострением астмы на фоне ОРВИ, показывает, что мокрота у них содержит высокую пропорцию полиморфонуклеарных лейкоцитов и высокую концентрацию нейтрофильной эластазы, альбумина, муцина, триптазы тучных клеток и ИЛ-8 и ИЛ-6. Увеличение полиморфонуклеарных лейкоцитов особенно выражено у тех больных, у которых симптомы респираторной вирусной инфекции предшествуют обострению астмы. Все это позволило установить, что механизм обострения вовлекает нормальный воспалительный ответ к вирусной инфекции.
На практике не всегда возможно определить, какой именно вирус вызвал обострение астмы и соответственно изучить его влияние на течение болезни. В экспериментальных исследованиях показано, что вирусы (особенно интенсивно риновирус) усиливают бронхиальную реактивность, ключевой признак астмы. Бронхиальная гиперреактивность после риновирусной инфекции может быть длительностью до 15 дней; риновирусная инфекция увеличивает риск развития поздних аллергических реакций и выраженность таких компонентов, как увеличение секреции тучных клеток, увеличение притока эозинофилов в бронхиальную слизистую, снижается чувствительность бета-адренергических рецепторов. Вирусы могут усиливать холинергическую активность, увеличивая ответ дыхательных путей на вагальную стимуляцию, неспецифические триггеры.
На сегодняшний день существует точка зрения, что дети, у которых риновирус вызывает обструкцию, имеют астму, и вирус вызывает проявление болезни, ухудшает ее течение. В диагностике астмы в этой группе детей помогают следующие критерии: повторение обструкции в течение года более трех раз, затяжной характер обструкции, хороший ответ на бронхолитическую терапию, нередко отягощенная по аллергическим заболеваниям наследственность, ранние аллергические проявления у ребенка.
Биопсия назальной слизистой во время ОРВИ показывает небольшие признаки повреждения эпителия или воспаления, даже когда воспалительные клетки в изобилии присутствуют в назальном секрете, однако в эксперименте показано нарушение функции циллиарных клеток. Так как эпителий существенно не нарушен, внимание переносится на роль воспалительных медиаторов, вызывающих клинические и физиологические последствия вирусной респираторной инфекции в нижних дыхательных путях. Возможную роль играют межклеточные адгезивные молекулы (IСАМ 1), которые находятся на поверхности назальных эпителиальных клеток и являются рецептором для основной группы риновирусов и цитокина ИЛ-11, который активирует В-клетки через Т-клеточнозависимый механизм.
Несмотря на выраженное сочетание риновирусной инфекции с обострениями астмы в эпидемиологических исследованиях, экспериментальные вирусологические исследования предполагают, что риновирусная инфекция сама не достаточна, чтобы спровоцировать обострение. Только некоторые вирусы или серотипы способны вызвать астматическую атаку у чувствительного хозяина. Возможно, что провоцируют усиленный воспалительный ответ к вирусной инфекции цитокины, присутствующие в дыхательных путях. Те же цитокины, которые вызывают воспаление, провоцируемое контактом со специфическими аллергенами у индивидуумов с аллергией, могут даже направить иммунный ответ слизистой оболочки к респираторным вирусам от обычного защитного ответа Th1 к Th2, и вместо ответа к вирусной пептидной стимуляции в обычном плане с продукцией интерферон-гамма и цитолитическим эффектом инфицированных эпителиальных клеток, продуцируются Th2 цитокины и наиболее важный из них ИЛ-4, привлекающий клетки, участвующие в аллергическом воспалении, а также ИЛ-8, туморнекротизирующий фактор и др. Цитокины взаимодействуют также с другими клетками, такими как макрофаги, и эти клетки секретируют свой профиль цитокинов. Таким образом, нарушается регуляция существующего воспаления и возникает каскад взаимно усиливающих эффектов.
Другой медиатор, который продуцируется эпителием, вовлекается в развитие астмы — оксид азота (NO). Оксид азота может оказывать антивирусный эффект и является частью ответа на вирусные инфекции верхних дыхательных путей. Он также является медиатором, усиливающим бронхиальный кровоток, эозинофильную инфильтрацию, повреждение дыхательного эпителия, и может ингибировать пролиферацию Th1 Т-клеток, сдвигая профиль Т-клеточных цитокинов в сторону Тh2 фенотипа. Кинины, представляющие пептидные гормоны, образующиеся в тканях и жидкостях, вовлекаются в патогенез астмы в связи с бронхоконстрикторным и провоспалительным действием. При экспериментальной риновирусной инфекции существенно повышается уровень кининов, а также общий уровень IgE в сыворотке. Повышение уровня вирус- и аллергенспецифических IgE может отражать нарушение регуляции продукции IgE.
Понимание механизмов, по которым респираторная вирусная инфекция ведет к воспалению, предполагает возможные направления терапевтических воздействий. Так как аллергическое воспаление изменяет иммунный ответ к вирусной инфекции, превентивная антивоспалительная терапия может способствовать восстановлению обычного механизма защиты против инфекций. Уменьшение интенсивности аллергического воспаления в дыхательных путях будет уменьшать также вероятность тяжелых атак астмы, связанных с инфекцией вирусами. Кроме того, интенсивность реакций на вирусы связана с интенсивностью существующей обструкции дыхательных путей у детей с астмой, т.е. при более тяжелой астме, когда наиболее выражена секреция провоспалительных цитокинов, ответ на вирусную инфекцию будет более выраженным. Важным фактором является количество эозинофилов в дыхательных путях.
Таким образом, основной путь — это уменьшение процессов воспаления в дыхательных путях. В соответствии с российской Национальной программой «Бронхиальная астма у детей. Стратегия лечения и профилактика» у детей с легкой и среднетяжелой астмой базисными противовоспалительными препаратами являются кромогликат натрия (интал) и недокромил натрия (тайлед). Длительное, не менее двух месяцев, применение этих препаратов приводит к уменьшению числа эозинофилов как в слизистой дыхательных путей, так и в сыворотке крови, уменьшению секреции цитокинов, снижению бронхиальной гиперреактивности. Соответственно уменьшаются клинические проявления бронхиальной астмы, потребность в бронхолитиках, уменьшается частота возникновения обструктивного синдрома в период присоединения респираторных вирусных инфекций.
Ингибиция продукции цитокинов может быть достигнута такими препаратами, как кортикостероиды. Ингаляционные кортикостероиды (беклометазон, флюнизолид, будесонца, флютиказон пропионат) являются препаратами первого выбора для базисной терапии астмы тяжелого течения, а также используются у детей при неэффективности нестероидных противовоспалительных препаратов. Использование ингаляционных кортикостероидов у детей с астмой при первом появлении симптомов простуды уменьшает на 90% частоту госпитализаций по поводу астмы. Использование назальных спреев нестероидных препаратов (ломузол, кромоглин) и кортикостероидных (фликсоназе, беконазе) у детей с сочетанием бронхиальной астмы и аллергического ринита уменьшает аллергическое воспаление со стороны верхних дыхательных путей, снижает ответную реакцию на вирусные инфекции.
Другой путь — это повышение неспецифической резистентности организма детей, который может быть достигнут, как использованием иммуностимулирующей терапии, так и не медикаментозными методами. В многочисленных исследованиях была доказана эффективность иммуностимулятора микробного происхождения рибомунила, объединяющего в себе свойства специфических и неспецифических иммуностимуляторов, что связано с наличием в его составе рибосом наиболее частых возбудителей инфекций дыхательных путей (диплококки пневмонии, стрептококки, клебсиелла пневмонии). Рибомунил стимулирует полинуклеары и макрофаги, способствуют выработке ИЛ-1 и ИЛ-6, увеличивает выработку специфических антител, активность естественных киллеров. Хороший эффект оказывает на заболеваемость ОРВИ у детей с бронхиальной астмой метод интервальной гипоксической тренировки с использованием ингаляций газовой смеси с пониженным содержанием кислорода. Проведение таких повторных курсов с интервалом 3-4 месяца в 2,5-3 раза снижает частоту ОРВИ и соответственно обострения бронхиальной астмы, нормализует вегетативный тонус, стимулирует функцию надпочечников. Как правило, медикаментозные и немедикаментозные методы используются в комплексе, дополняя друг друга. Врач должен провести оценку факторов внешней среды, устранить или уменьшить воздействие домашней пыли, табака, возможных провоцирующих аллергических факторов, провести санацию носоглотки при наличии хронических очагов инфекции, использовать закаливание, дозированные физические нагрузки. Дальнейшее изучение вирусиндуцированных обострений астмы, понимание механизмов, лежащих в их основе, позволит разрабатывать новые пути терапевтических вмешательств.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
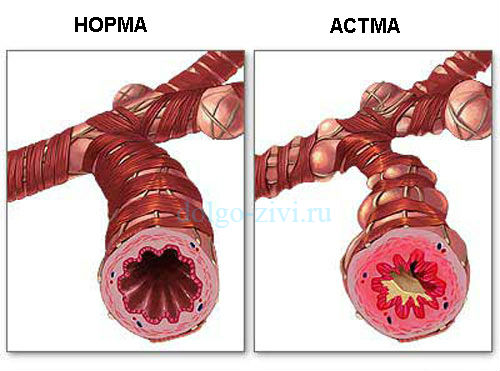
Бронхиальная астма (БА) – хроническое заболевание, в основе которого – аллергическое воспаление бронхов и их гиперреактивность [1–3]. Современные методы базисной терапии БА, направленные на основное звено патогенеза – хронический аллергический воспалительный процесс в бронхах, позволяют существенно повысить эффективность лечения пациентов с БА [4–7]. Однако в ряде случаев, несмотря на адекватно проводимую терапию, не удается добиться полного контроля над течением заболевания. Поиск причин недостаточной эффективности лечебных мероприятий при БА у детей по-прежнему остается одной из актуальных проблем современной педиатрии [7–13], что и определило цель и задачи настоящего исследования.
Для решения поставленных задач были обследованы 128 детей и подростков в возрасте 9–17 лет с персистирующей легкой и среднетяжелой атопической БА, у которых изучали особенности течения и триггеры рецидивов заболевания. Установлено, что наиболее часто – в 70% случаев (OR=7,5; р<0,05) приступы БА провоцировались переносимой ОРВИ. Значительно реже обострения БА были обусловлены сменой климатических условий (15%) и воздействием различных аллергенов (13,4%). В единичных случаях (1,7%) рецидив заболевания провоцировала физическая нагрузка (рис. 1).
Учитывая, что ОРВИ выступали в качестве основных триггеров обострения БА, на следующем этапе исследования было проведено изучение эффективности и безопасности различных способов иммунопрофилактики ОРВИ и гриппа у детей с БА. При этом в качестве стандартного метода иммунопрофилактики использовали вакцинацию против гриппа, которую проводили в строгом соответствии с официальными рекомендациями. Анализ результатов 12-месячного клинико-лабораторного наблюдения за 60 детьми с БА, вакцинированными против гриппа, свидетельствовал о том, что иммунизация хорошо переносилась, была безопасна и не приводила к увеличению частоты обострений БА и других аллергических заболеваний. Особый интерес вызывало изучение особенностей формирования прививочного иммунитета у детей с БА по сравнению со здоровыми детьми (n=30). Было установлено, что уровень поствакцинальной серопротекции через 1 мес. после прививки у пациентов с БА не отличался от показателей у здоровых детей и составлял 91,7–93,2% к вакцинному штамму вируса гриппа А(H1N1), 94,3–96,7% – к вакцинному штамму вируса гриппа А(H3N2) и 93,3–95,1% – к вакцинному штамму вируса гриппа В. Особо следует подчеркнуть, что скорость формирования, напряженность и продолжительность прививочного иммунитета у детей с БА также не отличались от аналогичных показателей у здоровых детей. При этом у 85–91,7% привитых протективный уровень поствакцинального иммунитета сохранялся на протяжении всего эпидемического сезона.
У части детей с БА вакцинация против гриппа была потенцирована 6-месячным курсом рибосомальной иммунизации (основная группа, n=19). Группу сравнения составили дети с БА, у которых использовали только прививку против гриппа (n=17). В группу контроля были включены дети с БА, у которых в период наблюдения иммунопрофилактика респираторных инфекций не проводилась вообще (n=20). Анализ течения поствакцинального и последующих периодов наблюдения свидетельствовал о том, что побочных эффектов, нежелательных явлений и прививочных осложнений как в основной группе, так и в группе сравнения зарегистрировано не было. Данные 12-месячного мониторинга показали, что у иммунизированных не повышалась частота обострений аллергических заболеваний.
Результаты анализа иммунологической эффективности вакцинации против гриппа у детей с БА свидетельствовали, что 4-кратный прирост титра антител хотя бы к одному из вакцинных штаммов вирусов гриппа наблюдался у 68,4% пациентов в основной группе и у 64,7% в группе сравнения (p>0,1). 4-кратная сероконверсия, как правило, отмечалась у тех пациентов, которые исходно были серонегативны или имели исходно низкие концентрации специфических антител. При этом уровень серопротекции через 1 мес. после вакцинации составил: к вирусу гриппа А(H1N1) – 94,7 и 100%; к вирусу гриппа А(H3N2) – 100 и 100%; к вирусу гриппа В – 94,7 и 94,1% в основной и сравнительной группах соответственно. Особо следует отметить, что у 93,8–100% привитых защитные титры антител к вакцинным штаммам вирусов гриппа сохранялись на протяжении всего эпидемического периода.
Анализ показателей клинико-профилактической эффективности различных способов иммунопрофилактики ОРВИ и гриппа у детей с БА свидетельствовал о том, что снижение заболеваемости респираторными инфекциями было отмечено только при комбинированной иммунизации. В группе сравнения частота ОРВИ и гриппа практически не изменилась, а в группе контроля появилась тенденция к ее увеличению. Кроме того, было также установлено, что средняя продолжительность каждого эпизода ОРВИ у иммунизированных детей, в отличие от группы контроля, сократилась с 9,54±0,63 до 7,46±0,62 дня (р<0,05). Отмечено, что высокий уровень иммунологической эффективности противогриппозной вакцинации определил ее профилактическую эффективность – ни у одного привитого ребенка не было манифестных форм гриппозной инфекции. Единичные случаи заболевания гриппом протекали по типу легких ОРВИ и были верифицированы только на основании результатов специальных лабораторных исследований.
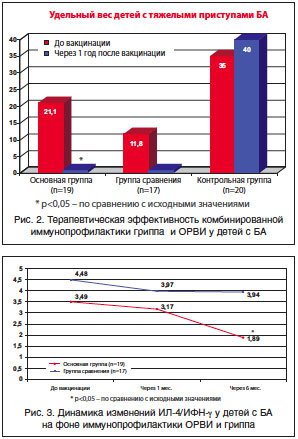
Особое внимание было уделено влиянию способа иммунопрофилактики на эффективность контроля над течением БА. При этом было установлено, что на фоне применения комбинированной иммунопрофилактики средняя частота обострений БА снизилась на 61,2% (р<0,05), в то время как в группе сравнения существенных изменений анализируемого показателя за отчетный период выявлено не было, а в группе контроля – имелась тенденция к его увеличению. Следует подчеркнуть, что у иммунизированных детей не было тяжелых приступов БА, в то время как у детей из контрольной группы по-прежнему имели место тяжелые рецидивы заболевания, требовавшие госпитализации (рис. 2). В целом было отмечено, что стабилизация течения заболевания и достижение контроля над БА позволили 13 из 19 детей основной группы перейти на более низкую ступень базисной терапии, в то время как в группе контроля из-за сохраняющихся рецидивов и возрастания числа тяжелых приступов у 1/3 пациентов базисную терапию приходилось усиливать.
Результаты исследования цитокинового профиля свидетельствуют о том, что у детей, привитых против гриппа в комбинации с рибосомальной иммунизацией, чаще имела место положительная динамика. Так, через 1 мес. от начала иммунопрофилактических мероприятий тенденция к снижению уровня интерлейкина-4 (ИЛ-4) была отмечена у всех детей основной группы с исходно повышенным уровнем указанного цитокина (q=1,0), а в группе сравнения – только у 4 из 9 пациентов (q=0,44) (p>0,05). Кроме того, если в основной группе на фоне комбинированной иммунизации полную нормализацию исходно высокого уровня ИЛ-4 выявляли у 7 из 9 детей (q=0,78), то в группе сравнения – только у 1 из 9 детей (q=0,13). Изменения концентрации интерферона-γ (ИФН–γ) в сыворотке крови на фоне проводимых иммунопрофилактических мероприятий были однонаправленными и не имели межгрупповых различий. Полная нормализация уровня ИФН-γ была отмечена у каждого 2–3-го ребенка с исходно значимо сниженным уровнем данного цитокина.
Оценку влияния изучаемых способов иммунопрофилактики на цитокиновый профиль проводили, используя не только сравнение динамики индивидуальных и средних значений каждого из цитокинов, но и анализируя изменения показателя отношения концентраций ИЛ-4 и ИФН-γ (ИЛ-4/ИФН-γ). Установлено, что при использовании комбинированной иммунизации имела место более благоприятная динамика изменений цитокинового профиля (рис. 3). При этом в основной группе отношение концентраций ИЛ-4 и ИФН-γ (p<0,05) уменьшалось за счет более выраженного снижения продукции ИЛ-4. Вероятно, это являлось отражением изменения вектора дифференцировки Т-хелперов (Тh): с Тh0→Тh2 на Тh0→Тh1, что в свою очередь и определяло нормализацию синтеза цитокинов и снижение активности аллергического воспаления. Не исключено, что именно это помогало лучше контролировать течение БА у пациентов при использовании комбинированной иммунизации. В то же время у детей с изолированной вакцинацией против гриппа значения коэффициента ИЛ-4/ИФН-γ после незначительного снижения через 1 мес. после прививки в дальнейшем практически не изменялись на протяжении последующих 5 мес. наблюдения (рис. 3), что, по всей видимости, и определило меньшую клинико-профилактическую эффективность.
Вероятно, нормализация уровней продукции ИЛ-4 и ИФН-γ, а также сбалансированность процессов дифференцировки Тh0-клеток в Тh1 и Тh2, отмеченные при комбинированной иммунизации у пациентов с БА, лежат в основе положительного клинического эффекта. В литературе имеются данные, подтверждающие высказанное предположение. Так, показано, что под действием протеогликанов рибосомального иммуномодулятора повышается активность фагоцитирующих и дендритных клеток, увеличивается продукция ИФН-γ натуральными киллерами, а также инициируются процессы дифференцировки Тh0 в Тh1-клетки и уменьшается продукция иммуноглобулина (Ig) Е [14–17]. Учитывая, что повышение синтеза и продукции IgE напрямую связывают с Th2-направленностью вектора иммунного ответа, становится понятным механизм положительного влияния комбинированной иммунопрофилактики на течение БА (переключение дифференцировки Th0-клеток в направлении Th1, повышение уровня ИФН-γ, снижение уровня ИЛ-4, уменьшение синтеза IgЕ).
Таким образом, основными триггерами рецидивов при легкой и среднетяжелой атопической БА у детей являются ОРВИ. При этом благодаря комбинированной иммунопрофилактике ОРВИ и гриппа в настоящее время имеется реальная возможность улучшения контроля за течением БА. Особо следует отметить, что лечебно-профилактический эффект комбинированной иммунопрофилактики обусловлен как непосредственным уменьшением неблагоприятного воздействия триггерных факторов (снижение частоты острых респираторных инфекций за счет иммунизации), так и иммуномодулирующим действием, направленным на устранение дисбаланса Тh1/Тh2 и ИЛ-4/ИФН-γ.

Литература
1. Национальная программа «Бронхиальная астма у детей: стратегия лечения и профилактика», 4-е изд., испр. и доп. М., 2012.
2. Global Initiative for Asthma. Pediatric guidelines for children ages 5 and Younger, 2009. https://www.guideline.gov/content.aspx?id=25315.
3. Global Initiative for Asthma. Global strategy for asthma management and prevention, 2010. https://www.ginasthma.org.
4. Намазова Л.С. Патогенетические основы дифференцированного лечения бронхиальной астмы у детей: Автореф. дисс. … докт. мед. наук. М., 2000. 48 с.
5. Бронхиальная астма / В кн.: Аллергология и иммунология / под ред. А.А. Баранова, Р.М. Хаитова. 3-е изд., испр. и доп. М.: Союз педиатров России, 2011. С. 93–162.
6. Новик Г.А. Бронхиальная астма у детей. СПб.: Фолиант, 2009.
7. Геппе Н.А. Актуальность проблемы бронхиальной астмы у детей // Педиатрия. 2012 . Т. 91. № 3. С. 76–82.
8. Солдатов Д.Г. / В кн.: Бронхиальная астма / под ред. А.Г. Чучалина. В 2 тт. М.: Агар, 1997. Т. 2. С. 83–117.
9. Зайцева О.В., Зайцева С.В. Бронхиальная астма и респираторные инфекции у детей // Вестник педиатрической фармакологии и нутрициологии. 2008. № 1 (5). С. 54–60.
10. Булгакова В.А., Балаболкин И.И., Катосова Л.К. и др. Персистирующая вирусная инфекция у детей с бронхиальной астмой // Аллергология и иммунология в педиатрии. 2011. № 2 (25). С. 6–11.
11. Kramarz P. Does influenza vaccination exacerbate asthma? Analysis of a large cohort of children with asthma // J Pediatr. 2001. Vol. 138 (3). Р. 301–303.
12. Carroll K.N., Hartert T.V. The Impact of Respiratory Viral Infection on Wheezing Illnesses and Asthma Exacerbations // Immunol Allergy Clin North Am. 2008. Vol. 28 (3). Р. 539–561.
13. Мизерницкий Ю.Л., Мельникова И.М., Марушков В.И., Доровская Н.Л., Буркастова Л.Н. Опыт профилактики респираторных инфекций у детей с рецидивирующими, хроническими заболеваниями органов дыхания // Педагогика здоровья. 2008. № 1. С. 48–50.
14. Boccaccio C., Jacod S., Kaiser A. et al. Identification of a clinical-grade maturation factor fo dendritic cells // J Immunoter. 2002. Vol. 25. Р. 88–96.
15. Jongmans W., Tiemessen D.M., van Vlodrop I.J. et al. Th1-polarizing capacity of clinical-grade dendritic cells triggered Ribomunil but is compromised by PGE2 // J Immunother. 2005. Vol. 28. Р. 480–487.
16. Chahtour A., Jeannin P., Gauchat J.E. et al. Direct bacteril protein PAMPs recognition by human NK cell involves TLRs and triggers α-defensin production // Blood. 2004. Vol. 24. Р. 778–783.
17. Moine V., Corvaia N., Libon C. Inhibition of immunoglobulin E: synthesis by a membrane fraction from Int // J Immunother. 2002. Vol. 18. Р. 73–81.