Рекомендации по лечению анемии
 26.07.2019
26.07.2019
Практические рекомендации по лечению анемии при злокачественных новообразованиях
Анемия при злокачественных новообразованиях (АЗН) определяется как снижение концентрации Hb ниже нормального значения (обычно 120 г/л) и может быть обусловлена как наличием самой опухоли, так и её лечением.
Анемия при злокачественных новообразованиях (АЗН) определяется как снижение концентрации Hb ниже нормального значения (обычно 120 г/л) и может быть обусловлена как наличием самой опухоли, так и её лечением.
Слабая степень анемии представляет собой снижение концентрации Hb в диапазоне от 100 до 119 г/л, анемия средней степени — концентрация Hb от 80 до 99 г/л, тяжёлая анемия — концентрация Hb ниже 80 г/л.
Клиническая значимость анемии определяется:
• отрицательным влиянием на качество жизни онкологических больных с развитием слабости;
• отрицательным влиянием на продолжительность жизни при большинстве типов опухолей;
• снижением эффективности противоопухолевого лечения (отдельных цитотоксических препаратов и ЛТ).
1. ДИАГНОСТИКА
1.1. Анамнез
При сборе анамнеза у больных с анемией необходимо оценить:
• возможность наследственной анемии или гемоглобинопатии;
• характер и длительность предшествующей противоопухолевой терапии (вид лекарственной терапии, количество курсов, миелотоксичность, включение препаратов платины);
• наличие острого или хронического кровотечения;
• хронические воспалительные заболевания почек;
• наличие аутоиммунных заболеваний.
1.2. Лабораторные показатели
• общий анализ крови с определением концентрации Hb, количества эритроцитов и ретикулоцитов, гематокрита (Hct), среднего объёма эритроцита (MCV), среднего содержания Hb в эритроците (MCH), средней концентрации Hb в эритроците (MCHC), среднего содержания Hb в ретикулоците;
• исследование костного мозга — по показаниям;
• оценка показателей обмена железа: содержание сывороточного ферритина с поправкой на содержание С-реактивного белка (повышение ферритина как белка острой фазы при воспалении), насыщение сывороточного трансферрина железом, содержание в крови фолатов и витамина В12;
• оценка возможности скрытого кровотечения из ЖКТ(пробы на скрытую кровь в кале, эндоскопическое исследование), почечной недостаточности (клиренс креатинина <60мл/мин.) с нарушением продукции эндогенного эритропоэтина;
• проба Кумбса (при хроническом лимфолейкозе, неходжкинских лимфомах, аутоиммунных заболеваниях в анамнезе);
• определение концентрация эндогенного эритропоэтина (при подозрении на миелодиспластический синдром);
Диагностику анемии и выявление причин необходимо проводить до проведения заместительных трансфузий эритроцитов (если нет экстренных показаний) или назначения эритропоэз-стимулирующих препаратов (ЭСП) и препаратов железа. Алгоритм диагностики анемии у онкологического больного представлен на рис. 1.
2. ЛЕЧЕНИЕ
2.1. Гемотрансфузии
Традиционным методом коррекции сниженного Hb и жизнеугрожающих ситуаций, связанных с острой кровопотерей (обширные операции), являются заместительные трансфузии эритромассы. Однако, для лечения анемии, связанной с опухолевым процессом (распад опухоли, интоксикация) и противоопухолевым лечением, гемотрансфузии не являются безопасным и эффективным методом.
Переливания эритромассы могут сопровождаться гемолитическими реакциями, в том числе фатальными (частота — 1:1 000), трансфузионными поражениями лёгких (частота — 1:5000), бактериальной контаминацией, в том числе фатальным сепсисом (частота — 1:10 000), передачей вирусов гепатита В (частота — 1:30 000), гепатита С и вируса иммунодефицита человека (частота — 1:1 000 000).
Кроме того, многие потенциально опасные вирусные инфекции в настоящее время у доноров не тестируются.
Наряду с вышесказанным, иммунодепрессия, вызванная переливанием эритроцитов, приводит к повышению риска тромбозов, инфекционных осложнений и снижением безрецидивной и общей выживаемости при ряде опухолевых заболеваний (колоректальный рак, рак мочевого пузыря).
Повышение концентрации Hb после гемотрансфузий является кратковременным, и для поддержания его нормального значения их необходимо повторять.
В связи с этим ВОЗ рекомендует максимально регламентировать заместительные гемотрансфузии у онкологических больных и использовать альтернативные методики коррекции Hb. Согласно приказу Министерства Здравоохранения Российской Федерации № 363 от 25.11.2002 г., гемотрансфузии при снижении концентрации Hb <70-80 г/л показаны только в случае острых постгеморрагических анемий при одномоментном снижении гематокрита до <25%.
При хронических анемиях главной задачей является устранение причины, вызвавшей анемию, и гемотрансфузии назначаются только для коррекции клинически значимых симптомов, обусловленных гипоксией вследствие снижения Hb и не поддающихся патогенетической терапии.
2.2. Лекарственная терапия
2.2.1. Эритропоэз-стимулирующие препараты
2.2.1.1. Показания
Альтернативным методом коррекции АЗН является назначение ЭСП в монотерапии или в комбинации с препаратами железа. Использование ЭСП позволяет повысить продукцию эритроцитов костным мозгом и увеличить содержание Hb без переливания донорских эритроцитов.
Результаты контролируемых исследований показали, что применение ЭСП при АЗН, а также при анемии, вызванной ХТ, повышает концентрацию Hb в 60-70% случаев и сопровождается существенным снижением потребности в заместительных гемотрансфузиях (относительный риск 0,64; 95% ДИ 0,6-0,68).
У больных с солидными опухолями и больных, получающих платиносодержащую ХТ, применение ЭСП более эффективно, чем при других типах опухолей и других видах ХТ.
В ряде исследований продемонстрировано улучшение качества жизни при применении ЭСП. Однако в других исследованиях различия в показателях качества жизни признаны незначимыми.
Применение ЭСП повышает вероятность тромботических осложнений, относительный риск которых увеличивается на 67% по сравнению с плацебо (ОР 1,67; 95% ДИ: 1,35-2,06). Влияние ЭСП на выживаемость онкологических больных изучается, однако результаты исследований неоднозначны.
Данные трёх мета-анализов показали негативное влияние ЭСП на общую выживаемость, а результаты двух других мета-анализов подобного влияния не выявили.
Однако во всех мета-анализах не было выявлено значимого негативного влияния ЭСП у больных, получающих ХТ. В связи с этим большинство экспертов считает нецелесообразным применение ЭСП у больных, не получающих ХТ, за исключением пациентов с миелодиспластическим синдромом.
2.2.1.2. Противопоказания
• известная гиперчувствительность к ЭСП или их компонентам;
• неконтролируемая АГ;
• высокий риск тромбоэмболических осложнений (тромбоз в анамнезе, обширное хирургическое вмешательство, длительная иммобилизация или ограничение активности, лечение талидомидом или леналидомидом в комбинации с доксорубицином и ГКС);
данные о роли профилактического использования антикоагулянтов или аспирина отсутствуют;
• хроническая почечная недостаточность (возможны случаи истинной эритроцитарной аплазии, вызванной нейтрализующими антиэритропоэтиновыми антителами;
случаев истинной эритроцитарной аплазии среди онкологических больных не описано).
2.2.1.3. Осложнения
• редкие аллергические реакции, включая удушье, кожную сыпь и крапивницу;
• артралгии;
• периферические отёки;
• незначительная и преходящая боль в месте инъекции.
Рекомендуемые дозы ЭСП и принципы их коррекции у взрослых онкологических больных, получающих ХТ, представлены в табл. 1.
2.2.2. Препараты железа
У части больных на фоне терапии ЭСП быстро развивается абсолютный или функциональный дефицит железа, в связи с чем необходимо исходное и пе- риодическое измерение насыщения железом сывороточного трансферрина, содержания сывороточного ферритина и С-реактивного белка.
Показателями нарушения обмена железа являются содержание сывороточного ферритина <100 нг/мл и насыщения железом сывороточного трансферрина <20%.
Содержание сывороточного ферритина <100 нг/мл у онкологического больногосвидетельствует об абсолютном дефиците железа и необходимости терапии препаратами железа; предпочтительны в/в лекарственные формы, т.к. при приёме внутрь железо плохо всасывается. Более высокое содержание сывороточного ферритина (100-800 нг/мл) и насыщение железом сывороточного трансферрина <20% свидетельствует о функциональном дефиците железа.
У больных с анемией и дефицитом железа парентеральное введение препаратов железа приводит к значительно большему повышению концентрации Hb, чем без применения железосодержащих препаратов или при назначении препаратов железа внутрь. Поддержка препаратами железа уменьшает также число больных, нуждающихся в трансфузиях эритроцитов.
В связи с возможным взаимодействием железа и некоторых цитостатиков(антрациклины, препараты платины) необходимо воздерживаться от введения препаратов железа в дни введения противоопухолевых препаратов.
Рекомендуемые дозы и режим введения препаратов железа представлены в табл. 2.
В табл. 3 представлена сводная информация о лекарственных препаратах, рекомендуемых для лечения анемии у онкологических больных.
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ АНЕМИИ
• общий анализ крови с определением концентрации Hb, гематокрита (Hct), количества эритроцитов и ретикулоцитов, среднего объема эритроцитов (MCV), среднего содержания Hb вэритроците (MCH) и средней концентрации Hb в эритроците (MCHC); кровотечение (кал на скрытую кровь, эндоскопическое обследование);
• гемолиз (проба Кумбса, ДВС-панель, гаптаглобин, непрямой билирубин, ЛДГ);
• алиментарная анемия (сывороточное железо, ОЖСС, ферритин, витамин В12, фолиевая кислота);
• наследственность (семейный анамнез);
• почечная дисфункция (клубочковая фильтрация);
• миелосупрессия, вызванная противоопухолевой терапией (ЛТ, ХТ);
• метастатическое поражение костного мозга
ЛЕЧЕНИЕ АНЕМИИ В ЗАВИСИМОСТИ ОТ ДОМИНИРУЮЩЕЙ ПРИЧИНЫ
Рисунок 1. Рекомендуемый алгоритм обследования онкологического больного с анемией.
Функциональный дефицит железа
Дефицит железа?
Оценить:
• уровень ферритина;
• уровень насыщения трансферрина железом.
Дополнительно:
• доля гипохромных эритроцитов, уровень Hb в ретикулоцитах
Абсолютный дефицит железа:
• уровень ферритина <100 нг/мл;
• насыщение трансферрина железом <20%;
• процент гипохромных эритроцитов > 5%;
• содержание Hb в ретикулоцитах < 26 пг.
Функциональный дефицит железа:
• • уровень ферритина >100 нг/мл;
• • насыщение трансферрина железом <20%;
• • доля гипохромных эритроцитов >5%;
• • содержание Hb в ретикулоцитах < 26 пг.
Рисунок 2. Рекомендуемый алгоритм лечения анемии
Коллектив авторов: Орлова Р. В., Гладков О. А., Жуков Н. В., Копп М. В., Королева И. А., Ларионова В. Б., Моисеенко В. М., Поддубная И. В., Птушкин В. В
Теги: анемия
Начало активности (дата): 26.07.2019 13:50:00
Кем создан (ID): 989
Ключевые слова:
поддерживающая терапия, анемия, эритропоэтин, железодефицитная анемия, анемия онкологических больных
В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
В настоящей публикации на основании данных литературы и анализа собственных наблюдений представлены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий, а также принципы их лечения у детей. Установлено, что основной формой дефицитных анемий (ДА) в педиатрической популяции является анемия, обусловленная недостаточным содержанием в организме железа. При этом особо подчеркивается, что железодефицитная анемия (ЖДА) не только наиболее распространенная ДА, но и самое частое гематологическое заболевание у детей [1–3]. С учетом того, что другие типы анемий (в т. ч. развивающиеся при дефиците таких витаминов, как фолиевая кислота и В12) хуже известны врачам-педиатрам, их верификация, как правило, запаздывает, т. к. они ошибочно принимаются за ЖДА. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма и ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения дифференциальной диагностики и лечения анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Дифференциальная диагностика ДА у детей
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).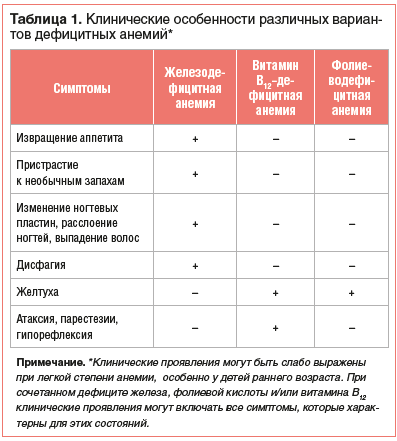
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).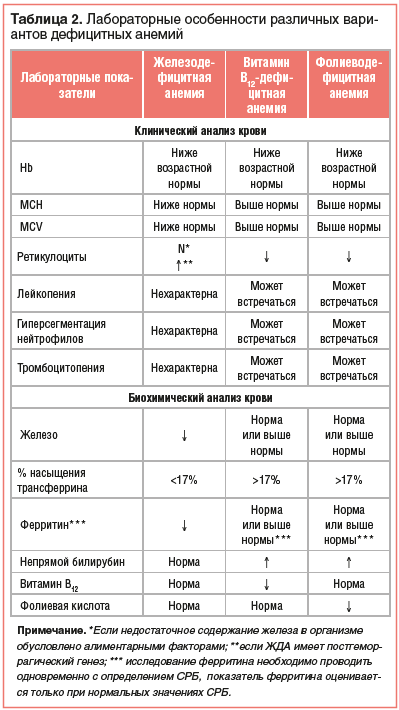
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Лечение ДА у детей
Корректная трактовка клинико-анамнестических данных и результатов лабораторного обследования позволяет верифицировать причину ДА и своевременно назначить адекватную терапию. Принципиально важным при этом является положение о том, что компенсировать дефицитные состояния невозможно только за счет нормализации рациона питания. Основная роль в купировании дефицита железа, фолиевой кислоты и витамина В12 принадлежит заместительной фармакотерапии [1–7]. При этом для лечения ЖДА используются солевые препараты железа или препараты на основе железа гидроксид полимальтозата. Суточная доза препаратов зависит от массы тела и возраста ребенка, расчет при этом проводится по элементарному железу. Так, для солевых препаратов железа, назначаемых внутрь, используются следующие дозы (расчет по элементарному железу!): для детей до 3 лет — 3 мг/кг/сут, для детей старше 3 лет — 45–60 мг/сут, для подростков —
до 120 мг/сут. При использовании пероральных форм железа гидроксид полимальтозата рекомендованные дозы составляют 5 мг/кг/сут (расчет по элементарному железу!). Продолжительность терапии препаратами железа зависит от степени тяжести ЖДА. При легкой ЖДА курс лечения составляет 3 мес., при среднетяжелой форме — 4,5 мес., при тяжелой — до 6 мес. [3].
В случае диагностики фолиеводефицитной анемии заместительная терапия проводится препаратами фолиевой кислоты. Рекомендовано использовать следующие суточные дозы фолиевой кислоты: для детей до 1 года — 0,25–0,5 мг/сут, для детей старше 1 года — 1,0 мг/сут. При синдроме мальабсорбции доза может быть повышена до 5–15 мг фолиевой кислоты в сутки. Терапия проводится в указанных дозах ежедневно на протяжении 4–6 нед. Через 7 дней от начала лечения необходимо выполнить клинический анализ крови с обязательным подсчетом ретикулоцитов (рис. 1). Повышение уровня ретикулоцитов на фоне приема фолиевой кислоты указывает на правильно установленный диагноз и является обоснованием для продолжения терапии. Купирование анемии достигается через 4–6 нед. от начала лечения [6].
Для лечения витамин В12-дефицитной анемии используют препараты цианокобаламина для парентерального введения. При этом рекомендовано придерживаться следующего режима дозирования: для детей до 1 года — 5 мкг/кг/сут, для детей старше 1 года — 100 мкг/сут, для подростков — 200 мкг/сут. Препарат вводится внутримышечно 1 р./сут ежедневно. На 7–10-й день терапии проводят клинический анализ. Выявление ретикулоцитоза позволяет сделать вывод об эффективности проводимого лечения. Терапию следует продолжить в том же режиме дозирования еще в течение 3–4 нед. В дальнейшем, при достижении нормализации уровня гемоглобина, переходят на поддерживающее лечение: цианокобаламин вводят в терапевтической дозе 1 раз в 7 дней в течение 2 мес., а затем 1 раз в 14 дней в течение 6 мес. (рис. 2). Учитывая, что дефицит витамина В12, как правило, редко обусловлен алиментарными факторами, одновременно проводят поиск причин данного патологического состояния (болезнь Крона, целиакия, инвазия широким лентецом, наследственные нарушения всасывания и/или транспортировки витамина В12 и др.) [7]. В тех случаях, когда имеют место полидефицитные состояния с развитием анемического синдрома, оправданно комбинированное заместительное лечение. Чаще всего у детей встречается сочетанный дефицит железа и фолиевой кислоты, что требует одновременного назначения препаратов железа и фолиевой кислоты.
Заключение
Таким образом, выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. Своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка. Авторы выражают надежду, что информация, представленная в настоящей публикации, будет полезна практикующим врачам-педиатрам.


