Реферат по патологии атеросклероз
Ïîâûøåíèå óðîâíÿ õîëåñòåðèíà ëèïîïðîòåèíîâ íèçêîé ïëîòíîñòè. Ãèïåðòðèãëèöåðèäåìèÿ èëè íåäîñòàòî÷íàÿ êîíöåíòðàöèÿ â êðîâè àíòèàòåðîãåííîãî õîëåñòåðèíà ëèïîïðîòåèíîâ. Íåìåäèêàìåíòîçíûå ìåðû ïðîôèëàêòèêè àòåðîñêëåðîçà. Ôèçè÷åñêàÿ àêòèâíîñòü ïàöèåíòà.
Ñòóäåíòû, àñïèðàíòû, ìîëîäûå ó÷åíûå, èñïîëüçóþùèå áàçó çíàíèé â ñâîåé ó÷åáå è ðàáîòå, áóäóò âàì î÷åíü áëàãîäàðíû.
Ðàçìåùåíî íà https://www.allbest.ru/
ÃÁÎÓ ÂÏÎ ÓÃÌÓ Ìèíçäðàâà Ðîññèè
Êàôåäðà áèîõèìèè
ÄÎÊËÀÄ
Òåìà:
Àòåðîñêëåðîç
Âûïîëíèëà: Èñàáåêîâà Ï.Ø.
Ñòóäåíòêà 2 êóðñà ëå÷åáíî-ïðîôèëàêòè÷åñêîãî ôàêóëüòåòà
Åêàòåðèíáóðã, 2013 ã.
Àòåðîñêëåðîç
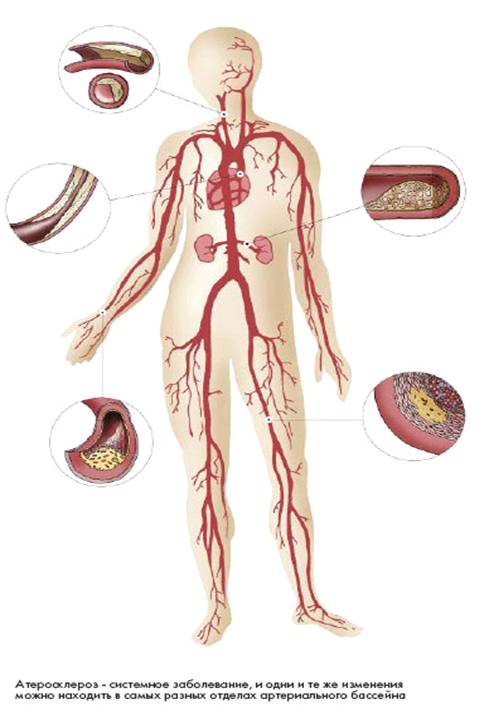
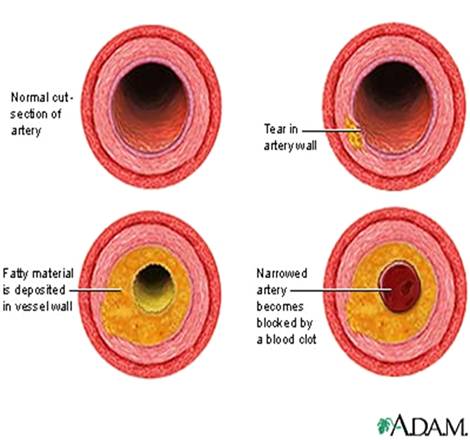
Àòåðîñêëåðîç — íàèáîëåå ðàñïðîñòðàíåííîå õðîíè÷åñêîå çàáîëåâàíèå àðòåðèé ýëàñòè÷åñêîãî è ìûøå÷íî-ýëàñòè÷åñêîãî òèïà, ñ ôîðìèðîâàíèåì îäèíî÷íûõ è ìíîæåñòâåííûõ î÷àãîâ ëèïèäíûõ, ãëàâíûì îáðàçîì õîëåñòåðèíîâûõ îòëîæåíèé — àòåðîìàòîçíûõ áëÿøåê — âî âíóòðåííåé îáîëî÷êå àðòåðèé. Ïîñëåäóþùèå ðàçðàñòàíèÿ â íåé ñîåäèíèòåëüíîé òêàíè (ñêëåðîç) è êàëüöèíîç ñòåíêè ñîñóäà ïðèâîäÿò ê ìåäëåííî ïðîãðåññèðóþùåé äåôîðìàöèè è ñóæåíèþ åãî ïðîñâåòà âïëîòü äî ïîëíîãî çàïóñòåâàíèÿ (îáëèòåðàöèè) àðòåðèè è òåì ñàìûì âûçûâàþò õðîíè÷åñêóþ, ìåäëåííî íàðàñòàþùóþ íåäîñòàòî÷íîñòü êðîâîñíàáæåíèÿ îðãàíà, ïèòàåìîãî ÷åðåç ïîðàæåííóþ àðòåðèþ. Êðîìå òîãî, âîçìîæíà îñòðàÿ çàêóïîðêà (îêêëþçèÿ) ïðîñâåòà àðòåðèè ëèáî òðîìáîì, ëèáî (çíà÷èòåëüíî ðåæå) ñîäåðæèìûì ðàñïàâøåéñÿ àòåðîìàòîçíîé áëÿøêè, ëèáî è òåì è äðóãèì îäíîâðåìåííî, ÷òî âåäåò ê îáðàçîâàíèþ î÷àãîâ íåêðîçà (èíôàðêò) èëè ãàíãðåíû â ïèòàåìîì àðòåðèåé îðãàíå (÷àñòè òåëà).
 ïëàçìå êðîâè ÷åëîâåêà è æèâîòíûõ âåñü õîëåñòåðèí íàõîäèòñÿ íå â ñâîáîäíîì âèäå, à â âèäå êîìïëåêñîâ ñ áåëêàìè è ëèïèäàìè — â ò.í. ëèïîïðîòåèäàõ, ñ ïîìîùüþ êîòîðûõ è îñóùåñòâëÿåòñÿ åãî òðàíñïîðò. Ëèïîïðîòåèäû áûâàþò àòåðîãåííûìè (ëèïîïðîòåèäû íèçêîé ïëîòíîñòè — ËÏÍÏ è ëèïîïðîòåèäû î÷åíü íèçêîé ïëîòíîñòè — ËÏÎÍÏ) è àíòèàòåðîãåííûìè (ëèïîïðîòåèäû âûñîêîé ïëîòíîñòè — ËÏÂÏ). Çàäà÷à àòåðîãåííûõ ëèïîïðîòåèäîâ — äîñòàâëÿòü õîëåñòåðèí â òå êëåòêè è òêàíè, ãäå îí òðåáóåòñÿ; çàäà÷à àíòèàòåðîãåííûõ — ñîáèðàòü ëèøíèé õîëåñòåðèí ñ öåëüþ åãî óäàëåíèÿ. Ïðè÷¸ì ñáîð èä¸ò è ñî ñòåíîê àðòåðèé, òî åñòü ïðè àòåðîñêëåðîçå ËÏÂÏ îêàçûâàþò ÿâíî ëå÷åáíîå äåéñòâèå. Ðîñò äîëè ýòîé ôðàêöèè — ôàêòîð, ñïîñîáñòâóþùèé çäîðîâüþ è äîëãîëåòèþ. Ïîýòîìó â ïðîñòîðå÷èè ËÏÍÏ è ËÏÎÍÏ íàçûâàþò ïëîõèì õîëåñòåðèíîì, à ËÏÂÏ — õîðîøèì.
Íàñëåäñòâåííûå ïðè÷èíû
Äèñëèïèäåìèè, ïðè êîòîðûõ îñíîâíûå èçìåíåíèÿ çàêëþ÷àþòñÿ â ïîâûøåíèè óðîâíÿ õîëåñòåðèíà ëèïîïðîòåèíîâ íèçêîé ïëîòíîñòè (ÕÑ ËÍÏ), ãèïåðòðèãëèöåðèäåìèè èëè íåäîñòàòî÷íîé êîíöåíòðàöèè â êðîâè àíòèàòåðîãåííîãî õîëåñòåðèíà ëèïîïðîòåèíîâ âûñîêîé ïëîòíîñòè (ÕÑ ËÂÏ).
Ãåíåòè÷åñêè äåôåêòû:
-Äåôåêò ðåöåïòîðîâ ê ËÏÍÏ, ìóòàöèÿ ãåíà ÀïîÂ-100.
-Äåôåêò â ñòðóêòóðå àïî Å (ñèíòåçèðóåòñÿ èçîôîðìà)
-Èçáûòî÷íàÿ ïðîäóêöèÿ ËÏÎÍÏ
-Ñåìåéíàÿ ãèïåðõîëåñòåðèíåìèÿ.
Èññëåäîâàíèÿ, ïðîâîäèìûå íà ñòûêå ôóíäàìåíòàëüíîé è êëèíè÷åñêîé êàðäèîëîãèè â 80-å ãîäû ÕÕ âåêà, áûëè îòìå÷åíû ïðîðûâîì â èçó÷åíèè ñåìåéíîé ãèïåðõîëåñòåðèíåìèè (ÑÃÕÑ) — íàñëåäñòâåííîãî çàáîëåâàíèÿ, ïðèâîäÿùåãî ê ðàçâèòèþ ÀÑ óæå â ìîëîäîì âîçðàñòå. Áåç ñîîòâåòñòâóþùåãî ëå÷åíèÿ ýòè ïàöèåíòû, îñîáåííî ñ ãîìîçèãîòíîé ôîðìîé çàáîëåâàíèÿ, ðåäêî äîæèâàëè äî 30 ëåò. Àìåðèêàíñêèå ó÷åíûå J.Goldstein è Ì.Braun óñòàíîâèëè ïðèðîäó ýòîãî çàáîëåâàíèÿ, êîòîðîå îáóñëîâëåíî äåôåêòîì ãåíà, êîäèðóþùåãî áåëêè-ðåöåïòîðû ê ëèïîïðîòåèäàì íèçêîé ïëîòíîñòè (ËÏÍÏ).  ðåçóëüòàòå óðîâåíü ÕÑ â ñûâîðîòêå êðîâè ýòèõ ïàöèåíòîâ äîñòèãàåò 500 è äàæå 1000 ìã/äë. Ýòî èññëåäîâàíèå â 1986 ã. áûëî îòìå÷åíî Íîáåëåâñêîé ïðåìèåé.
(Â.Â. Êóõàð÷óê, Ý.Ì. Òàðàðàê Àòåðîñêëåðîç: îò À.Ë. Ìÿñíèêîâà äî íàøèõ äíåé, 2010)
Íåíàñëåäñòâåííûå ïðè÷èíû:
1. Ïîâðåæäåíèå ËÏÍÏ
— ïîä äåéñòâèåì ÏÎË èçìåíåíèå ñòðóêòóðû ïîëèíåíàñûùåííûõ êèñëîò â ñîñòàâå ÒÃ è ÔË
— ãëèêîçèëèðîâàíèå áåëêîâ â ËÏÎÍÏ è ËÏÍÏ ïðè äëèòåëüíîé ãèïåðãëèêåìèè.
2. Ïðèíàäëåæíîñòü ê ìóæñêîìó ïîëó.
3. Ãèïåðòåíçèÿ
4. Íåñáàëàíñèðîâàííîå ïèòàíèå
5. Ýìîöèîíàëüíûé ñòðåññ
6. Ãîðìîíàëüíûå íàðóøåíèÿ
Òÿæåñòü
Êàê èçâåñòíî, áîëüøèíñòâî çàáîëåâàíèé ñåðäå÷íî-ñîñóäèñòîé ñèñòåìû, îáóñëîâëåííûõ àòåðîñêëåðîçîì, êëèíè÷åñêè ïðîÿâëÿåò ñåáÿ â ñòàðøåì è ïîæèëîì âîçðàñòå. Îäíàêî â ïîñëåäíèå ãîäû ñòàëè îòìå÷àòüñÿ ëåòàëüíûå èñõîäû îò îñëîæíåíèé àòåðîñêëåðîçà è ó ìîëîäûõ. Ïðè÷åì, åñëè â ÑØÀ è ñòðàíàõ Åâðîïû ñðåäè ìîëîäûõ ëèö îáúåêòèâíî ðåãèñòðèðóåòñÿ ñíèæåíèå ñìåðòíîñòè îò ÑÑÇ, òî â Ðîññèè îòìå÷àåòñÿ óâåëè÷åíèå ýòîãî ïîêàçàòåëÿ. Òàê, ñìåðòíîñòü îò ÑÑÇ â òðóäîñïîñîáíîì âîçðàñòå â íàøåé ñòðàíå ñîñòàâëÿëà â 1990 ã. — 137, à â 2000 ã. — 206 ñëó÷àåâ íà 100 òûñ. íàñåëåíèÿ.
Ïðè ïîðàæåíèè àðòåðèé ñåðäöà (àòåðîñêëåðîç êîðîíàðíûõ àðòåðèé) âîçíèêàåò èøåìè÷åñêàÿ áîëåçíü ñåðäöà (ÈÁÑ), ñòåíîêàðäèÿ, èíôàðêò ìèîêàðäà, ñåðäå÷íàÿ íåäîñòàòî÷íîñòü. Ïðè ïîðàæåíèè ñîñóäîâ ìîçãà — ìîçãîâîé èíñóëüò, äåìåíöèÿ (ñëàáîóìèå), ñîñóäèñòûé ïàðêèíñîíèçì. Ïîðàæåíèå ñîñóäîâ íèæíèõ êîíå÷íîñòåé ñîïðîâîæäàåòñÿ áîëÿìè â íîãàõ, ñèíäðîìîì «ïåðåìåæàþùåéñÿ õðîìîòû», òðîôè÷åñêèìè íàðóøåíèÿìè, ãàíãðåíîé.
(äèàãíîñòèêà è ëå÷åíèå àòåðîñêëåðîçà È. À. ÌÈÍÅÍÊÎ, Ð. Í. ÕÀÉÐÓËËÈÍ)
Ðàñïðîñòðàííåíîñòü
Óæå ïîñëå 30-35 ëåò àòåðîñêëåðîçîì çàáîëåâàåò 75% ìóæ÷èí è 38% æåíùèí.  âîçðàñòå 55-60 ëåò ýòè öèôðû ïðèáëèæàþòñÿ ïî÷òè ê 100%. Îäíàêî, ñìåðòíîñòü îò àòåðîñêëåðîçà ñîñòàâëÿåò â ñðåäíåì 58% (â îñíîâíîì îò îñòðûõ èíôàðêòîâ è èíñóëüòîâ), õîòÿ â íåêîòîðûõ ñòðàíàõ îíà äîñòèãàåò 69%. Àòåðîñêëåðîç ðàçâèâàåòñÿ ïîñòåïåííî, â ñðåäíåì, 15-20 ëåò, ïðåæäå ÷åì ïîÿâÿòñÿ ïåðâûå êëèíè÷åñêèå åãî ñèìïòîìû.  íàñòîÿùåå âðåìÿ, â ðÿäå ñëó÷àåâ êàðäèîëîãè îòìå÷àþò íà÷àëî ðàçâèòèÿ àòåðîñêëåðîçà óæå â ïîäðîñòêîâîì âîçðàñòå, ÷òî åùå 100 ëåò íàçàä ñ÷èòàëîñü íåâåðîÿòíûì ôàêòîì. Êñòàòè, ñìåðòíîñòü îò ýòîãî çàáîëåâàíèÿ íå ïðåâûøàëî òîãäà 5-6%. À âî âðåìåíà âåäè÷åñêîé öèâèëèçàöèè — áûëà ëèøü îäíèì èç ïðèçíàêîâ ãëóáîêîé ñòàðîñòè.
Àòåðîñêëåðîç íàèáîëåå ðàçâèò â òåõíîêðàòè÷åñêè ðàçâèòûõ ñòðàíàõ, îñîáåííî â ÑØÀ, Ãåðìàíèè, Øâåöèè, Àíãëèè, Ôèíëÿíäèè è Äàíèè.  ïîñëåäíåå âðåìÿ èõ ñòðåìèòåëüíî ñòàëè äîãîíÿòü êðóïíûå ãîðîäà Ðîññèè è Óêðàèíû. Íàïðèìåð, â Ìîñêâå, Ñ-Ïåòåðáóðãå, Åêàòåðèíáóðãå, Êèåâå è Äíåïðîïåòðîâñêå ñìåðòíîñòü îò îñòðûõ èíôàðêòîâ è èíñóëüòîâ äîñòèãëî â íàñòîÿùåå âðåìÿ 65%. Ñïåöèàëüíûå êàðäèîëîãè÷åñêèå ïðîãðàììû ïî áîðüáå ñ ñåðäå÷íî-ñîñóäèñòûìè çàáîëåâàíèÿìè â ÑØÀ, íà÷àòûå îêîëî 25 ëåò íàçàä, ñíèçèëè ñìåðòíîñòü îò àòåðîñêëåðîçà ñ 69% äî 45%. Íàèáîëåå íèçêàÿ ñìåðòíîñòü îò äàííîé ïàòîëîãèè îòìå÷àåòñÿ â ßïîíèè, Èíäèè, Íåïàëå, Áèðìå è â íåêîòîðûõ ëàòèíîàìåðèêàíñêèõ ñòðàíàõ.  ñòðàíàõ Ñðåäèçåìíîìîðüÿ, ãäå â ïèùåâûõ íàáîðàõ íàñåëåíèÿ áîëüøå ðàñòèòåëüíîé ïèùè, à æèðîâîé êîìïîíåíò ðàöèîíîâ ïðåäñòàâëåí áîëüøåé äîëåé ìîíîíåíàñûùåííûõ (ÌÍÆÊ) è ïîëèíåíàñûùåííûõ æèðíûõ êèñëîò (ÏÍÆÊ) è â ìåíüøåé ñòåïåíè íàñûùåííûìè æèðàìè (ÍÆ), ñóùåñòâåííî íèæå óðîâíè ñìåðòíîñòè îò ÈÁÑ, èøåìè÷åñêîãî ìîçãîâîãî èíñóëüòà (ÌÈ), à òàêæå ìåíüøå ðàñïðîñòðàíåííîñòü àðòåðèàëüíîé ãèïåðòîíèè (ÀÃ), ñàõàðíîãî äèàáåòà 2-ãî òèïà è ÔÐ ÑÑÇ. Õîðîøî èëëþñòðèðóþò çíà÷åíèå ôàêòîðîâ ïèòàíèÿ â ðàçâèòèè ïàòîëîãèè, ñâÿçàííîé ñ àòåðîñêëåðîçîì, îñîáåííîñòè ïîòðåáëåíèÿ ðàñòèòåëüíîé ïèùè è æèðîâ â ñòðàíàõ Åâðîïû è ßïîíèè. Ñðåäè âñåõ ñòðàí ìèðà ßïîíèÿ çàíèìàåò ïîñëåäíåå ìåñòî ïî ñìåðòíîñòè îò ÑÑÇ, Ôðàíöèÿ, îñîáåííî åå þã — ïðåäïîñëåäíåå. Àíàëèç ïîêàçûâàåò, ÷òî ýêîíîìè÷åñêè ýòè ñòðàíû òàê æå, êàê ìíîãèå äðóãèå ñòðàíû Çàïàäíîé Åâðîïû, ÑØÀ è Êàíàäà, îòíîñÿòñÿ ê ÷èñëó âûñîêîðàçâèòûõ.
Ê ñîæàëåíèþ, Ðîññèÿ çàíèìàåò îäíî èç ïåðâûõ ìåñò ñðåäè ðàçâèòûõ ñòðàí ïî ñìåðòíîñòè îò ÑÑÇ, ïðè÷¸ì íà÷èíàÿ ñ ñåðåäèíû 1960-õ ãã. XX âåêà è äî íàñòîÿùåãî âðåìåíè ýòîò ïîêàçàòåëü âîçðàñòàåò.  çàïàäíîåâðîïåéñêèõ ñòðàíàõ, íàïðîòèâ, ïðîñëåæèâàåòñÿ òåíäåíöèÿ ê ñíèæåíèþ ñìåðòíîñòè îò ÑÑÇ.
Ïàòîãåíåç
Ãëàâíîé è ÷àñòî âñòðå÷àþùåéñÿ ïðè÷èíîé äèñôóíêöèè ýíäîòåëèÿ ÿâëÿåòñÿ èìåííî ãèïåðõîëåñòåðèíåìèÿ. Èíà÷å ãîâîðÿ, ãèïåðõîëåñòåðèíåìèÿ — ýòèîëîãè÷åñêèé ôàêòîð àòåðîñêëåðîçà; îíà çàïóñêàåò ìåõàíèçì àòåðîãåíåçà, íà÷àëîì êîòîðîãî ÿâëÿåòñÿ äèñôóíêöèÿ ýíäîòåëèÿ.
Äèñëèïèäåìèÿ Ãèïåðòåíçèÿ Êóðåíèå
Ïîâðåæäåíèå ýíäîòåëèÿ: Àãðåãàöèÿ òðîìáîöèòîâ
— ïîâûøåíà ïðîíèöàåìîñòü;
-ïîíèæåíà ñåêðåöèÿ NO;
— ïîâûøåíà ñåêðåöèÿ òðîìáîêñàíà À2.
Àêêóìóëÿöèÿ ëèïîïðîòåèíîâ â ñóáýíäîòåëèàëüíîì ïðîñòðàíñòâå
Õèìè÷åñêàÿ ìîäèôèêàöèÿ ëèïîïðîòåèíîâ
(Íàïðèìåð, îêèñëåíèå, ãëèêîçèëèðîâàíèå)
Ïðèâëå÷åíèå ìîíîöèòîâ â ñòåíêó ñîñóäà
Ïðåâðàùåíèå èõ â ìàêðîôàãè ñ ðåöåïòîðàìè ê ìîäèôèöèðîâàííûì ËÍÏ Òðîìáîöèòàðíûé
ôàêòîð ðîñòà, TGF
Íåðåãóëèðóåìûé çàõâàò ìàêðîôàãàìè
ìîäèôèöèðîâàííûõ ËÍÏ ÔÍÎ,ÈË, ôàêòîðû ðîñòà
Ïåíèñòûå êëåòêè (æèðîâûå ïîëîñêè)
Ãëàäêîìûøå÷íûå êëåòêè:
— ìèãðàöèÿ â èíòèìó;
— ïðîëèôåðàöèÿ;
— çàõâàò ËÏÍÏ.
Àòåðîñêëåðîòè÷åñêàÿ áëÿøêà
— ðèñê îáðàçîâàíèÿ òðîìáà
— ñîëè êàëüöèÿ äåëàþò áëÿøêó ïëîòíîé
(Àðîíîâ Ä.Ì., Ëóïàíîâ Â.Ï. Íåêîòîðûå àñïåêòû ïàòîãåíåçà àòåðîñêëåðîçà. 2011)
Äèàãíîñòèêà
Íàòîùàê îïðåäåëÿþò:
— îáùèå ëèïèäû
— îáùèé õîëåñòåðèí
— ëèïèäíûé ñïåêòð: ËÏÎÍÏ, ËÏÍÏ, ËÏÂÏ.
 êà÷åñòâå ïðåäèêòîðîâ àòåðîñêëåðîçà â íàñòîÿùåå âðåìÿ ðàññìàòðèâàþòñÿ òàêèå ìàðêåðû ïîâðåæäåíèÿ ýíäîòåëèÿ è ôàêòîðû âîñïàëåíèÿ, êàê ÈË-1â, ÈË-6, ÔÍÎ-á, îêñèä àçîòà, MCP-1, ÔÐÝÑ, ýíäîòåëèí-1, Ñ-ðåàêòèâíûé áåëîê, íàòðèéóðåòè÷åñêèé ïåïòèä. Íàèáîëüøåå çíà÷åíèå ïðè àòåðîñêëåðîçå ïðèäàåòñÿ ÈË-1 è ÈË-6. Óñëîâèåì âûðàáîòêè ÈË-1 ìîíîöèòàìè è ìàêðîôàãàìè ÿâëÿåòñÿ èõ àêòèâàöèÿ áàêòåðèàëüíûìè è èíûìè ïðîäóêòàìè (ëèïîïîëèñàõàðèäàìè, íåêîòîðûìè ýêçîòîêñèíàìè, ìèòîãåíàìè), à òàêæå âñëåäñòâèå àäãåçèè è ôàãîöèòîçà.
Ó âñåõ áîëüíûõ ñ ïîìîùüþ áèîõèìè÷åñêèõ àâòîìàòè÷åñêèõ àíàëèçàòîðîâ Olimpus AU-680 è Hitachi 912 â ñûâîðîòêå êðîâè îïðåäåëÿëè ïîêàçàòåëè áåëêîâîãî (ìî÷åâèíà), ïóðèíîâîãî (ìî÷åâàÿ êèñëîòà), ýëåêòðîëèòíîãî (Ê, Na,Cl, Ca) è ëèïèäíîãî îáìåíîâ — îáùåãî õîëåñòåðèíà (ÎÕÑ), òðèàöèëãëèöåðèäîâ (ÒÀÃ), ëèïîïðîòåèäîâ âûñîêîé (ËÏÂÏ) è íèçêîé (ËÏÍÏ) ïëîòíîñòè ñ ïîñëåäóþùèì ðàñ÷¸òîì ëèïîïðîòåèäîâ î÷åíü íèçêîé ïëîòíîñòè (ËÏÎÍÏ) è êîýôôèöèåíòà àòåðîãåííîñòè (Ê).
Ê = (ÎÕÑ — ËÏÂÏ)/ËÏÂÏ.
Ýòîò ïîêàçàòåëü äîëæåí áûòü â ïðåäåëàõ îò 2 äî 2,5. Ïðè êîýôôèöèåíòå àòåðîãåííîñòè 3-4 èìååòñÿ óìåðåííàÿ âåðîÿòíîñòü ðàçâèòèÿ àòåðîñêëåðîçà, ïðè âåëè÷èíå áîëåå 4-õ — âûñîêàÿ âåðîÿòíîñòü. Ó ëèö ñ ñèëüíî âûðàæåííûì àòåðîñêëåðîçîì ýòîò êîýôôèöèåíò ìîæåò äîñòèãàòü 7 åäèíèö è áîëåå.
(Ãèïåðôèëüòðàöèÿ è àòåðîñêëåðîç, Ì. Ñ. Ñóðîâèêèíà, Í. Ï. Âåëè÷êèíà, Î. À. Èâàíîâà, Þ. Ñ. ×óãóíîâà, Â. Â. Ñóðîâèêèí, 2011)
Ìåòàáîëè÷åñêàÿ òåðàïèÿ
×òîáû ïðîâîäèòü ìåäèêàìåíòîçíîå ëå÷åíèå, íàäî ñíà÷àëà ïîëó÷èòü äàííûå áèîõèìè÷åñêîãî àíàëèçà êðîâè. Ýòî ïîçâîëÿåò óòî÷íèòü ñîäåðæàíèå â íåé õîëåñòåðèíà è ðàçëè÷íûõ ôðàêöèé ëèïèäîâ.
 íà÷àëå 70-õ ãîäîâ ÕÕ âåêà ïðîèçîøëî ñîáûòèå, êîòîðîå êîðåííûì îáðàçîì èçìåíèëî ñèòóàöèþ â ëå÷åíèè ÀÑ. ßïîíñêèé ó÷åíûé À.Endo ñîçäàë ïåðâûé ñòàòèí, ÿâëÿþùèéñÿ èíãèáèòîðîì ôåðìåíòà
— ðåäóêòàçû 3-ãèäðîêñè-3-ìåòèëãëþòàðèë-êîýíçèìà À (ÃÌÃ-ÊîÀ), êîòîðûé èíãèáèðîâàë ñèíòåç ÕÑ íà ðàííåé ñòàäèè åãî îáðàçîâàíèÿ. Ïðåïàðàò íàçûâàëñÿ ìåâàñòàòèí è áûë âûäåëåí èç ïðîäóêòîâ æèçíåäåÿòåëüíîñòè Penicillium citrinum. Îí íå íàøåë êëèíè÷åñêîãî ïðèìåíåíèÿ, íî äðóãîé ñòàòèí, ðàçðàáîòàííûé â ëàáîðàòîðèè A.Endo, ïðàâàñòàòèí, ïîëó÷èë â äàëüíåéøåì øèðîêîå êëèíè÷åñêîå ïðèìåíåíèå. Âñêîðå âñëåä çà òåì àìåðèêàíñêèå ó÷åíûå èç ôàðìàöåâòè÷åñêîé êîìïàíèèMerck&Company âûäåëèëè ìåâèíîëèí èç ãðèáà Aspergillus terreus. Êëèíè÷åñêèå èñïûòàíèÿ ýòîãî ïðåïàðàòà ïîêàçàëè åãî âûñîêóþ ýôôåêòèâíîñòü â ñíèæåíèè óðîâíÿ îáùåãî ÕÑ è ÕÑ ËÏÍÏ.  1987 ã. íà ôàðìàöåâòè÷åñêîì ðûíêå ïîÿâèëñÿ ëîâàñòàòèí.  òå÷åíèå ñëåäóþùåãî äåñÿòèëåòèÿ ïîÿâëÿëèñü íîâûå ïîëóñèíòåòè÷åñêèå è ñèíòåòè÷åñêèå ñòàòèíû, êîòîðûå óâåðåííî çàíèìàëè ñâîå ìåñòî â êîððåêöèè ãèïåðõîëåñòåðèíåìèè è íîðìàëèçàöèè íàðóøåíèé ëèïèäíîãî îáìåíà.
Ñòàòèíû
Èíãèáèðîâàíèå ôåðìåíòà ÃÌÃ-ÊîÀ
ðåäóêòàçû, êëþ÷åâîãî ôåðìåíòà ñèíòåçà ÕÑ.
 ðåçóëüòàòå ñíèæåíèÿ âíóòðèêëåòî÷íîãî ñîäåðæàíèÿ ÕÑ, ïå÷åíî÷íàÿ êëåòêà óâåëè÷èâàåò êîëè÷åñòâî ìåìáðàííûõ ðåöåïòîðîâ ê ËÍÏ íà ñâîåé ïîâåðõíîñòè, êîòîðûå ñâÿçûâàþò è âûâîäÿò èç êðîâîòîêà ËÍÏ, òàêèì îáðàçîì ñíèæàÿ êîíöåíòðàöèþ ÕÑ â êðîâè.
Ñîâðåìåííûå ñòàòèíû ñíèæàþò óðîâåíü ÕÑ ËÏÍÏ íà 35-50%, óðîâåíü òðèãëèöåðèäîâ íà 8-15% è óìåðåííî ïîâûøàþò óðîâåíü ÕÑ ËÏÂÏ. Ñ ïîìîùüþ ñòàòèíîâ ïðàêòè÷åñêè ó 90% áîëüíûõòìîæíî äîñòè÷ü ðåêîìåíäóåìûõ óðîâíåé ÕÑ ËÏÍÏ âíå çàâèñèìîñòè îò åãî èñõîäíîãî óðîâíÿ.ò íàñòîÿùåå âðåìÿ â Ðîññèè èìåþòñÿ ñëåäóþùèå ïðåïàðàòû èç ãðóïïû ñòàòèíîâ: ñèìâàñòà òèí (Çîêîð®), àòîðâàñòàòèí (Ëèïðèìàð®), ïðàâàñòàòèí (Ëèïîñòàò®), ôëóâàñòàòèí (Ëåñêîë®), ðîçóâàñòàòèí (Êðåñòîð®), ëîâàñòàòèí (Ìåâàêîð®). Ïåðâûå ñòàòèíû (ñèìâàñòàòèí, ïðàâàñòàòèí è ëîâàñòàòèí) áûëè âûäåëåíû èç êóëüòóðû ïåíèöèëëèíîâûõ ãðèáîâ è ãðèáîâ Aspergillus terrens; ôëóâàñòàòèí è àòîðâàñòàòèí — ñèíòåòè÷åñêèå ïðåïàðàòû.
Íèêîòèíîâàÿ êèñëîòà
Ñîêðàùåíèå ñèíòåçà ËÎÍÏ â ïå÷åíè è ÷àñòè÷íîå áëîêèðîâàíèå âûñâîáîæäåíèå ÆÊ èç æèðîâîé òêàíè, ñîçäàâàÿ èõ äåôèöèò â ïëàçìå.
Ýôôåêòèâíî ñíèæàåò óðîâåíü õîëåñòåðèíà è òðèãëèöåðèäîâ â êðîâè, ïîâûøàåò óðîâåíü àíòèàòåðîãåííûõ ëèïîïðîòåèíîâ âûñîêîé ïëîòíîñòè.
Ñåêâåñòðàíòû æåë÷íûõ êèñëîò
Ñâÿçûâàþò æåë÷íûå êèñëîòû -ïðîäóêòû îáìåíà ÕÑ, â ïðîñâåòå òîíêîãî êèøå÷íèêà è óñèëèâàþò èõ ýêñêðåöèþ.
Ñíèæåíèå óðîâíÿ õîëåñòåðèíà è æèðîâ â êðîâè.
Ïðîèçâîäíûå ôèáðîåâîé êèñëîòû (ôèáðàòû)
Àêòèâàöèÿ ëèïîïðîòåèäëèïàç ïëàçìû è ïå÷åíè, ôåðìåíòîâ, ðåãóëèðóþùèõ ãèäðîëèç ÕÌ, ËÎÍÏ, ËÏÏ
Ñíèæåíèå èõ óðîâíÿ â ïëàçìå êðîâè, ïîâûøåíèå êîíöåíòðàöèè ÕÑ ËÂÏ.
Íåìåäèêàìåíòîçíûå ìåðû ïðîôèëàêòèêè àòåðîñêëåðîçà
Íåìåäèêàìåíòîçíàÿ òåðàïèÿ ïðåäóñìàòðèâàåò íàçíà÷åíèå äèåòû, êîððåêöèþ âåñà, ïîâûøåíèå ôèçè÷åñêîé àêòèâíîñòè, ïðåêðàùåíèå êóðåíèÿ.
Îáùèå ïðèíöèïû äèåòè÷åñêèõ ðåêîìåíäàöèé.
-Ðåêîìåíäóåòñÿ óïîòðåáëÿòü áîëüøå ñâåæèõ îâîùåé è ôðóêòîâ, õëåá ãðóáîãî ïîìîëà, çëàêè, ìîëî÷íûå ïðîäóêòû ñ íèçêèì ñîäåðæàíèåì æèðà, íåæèðíûå ñîðòà ìÿñà, ðûáó. Ïðåäïî÷òåíèå ñëåäóåò îòäàâàòü ðûáå ñåâåðíûõ ìîðåé, ñîäåðæàùåé áîëüøîå êîëè÷åñòâî ù-3 ÏÍÆÊ, êîòîðûå èãðàþò âàæíóþ ðîëü â ïðîôèëàêòèêå àòåðîñêëåðîçà è ÈÌ;
— Êîëè÷åñòâî ïîòðåáëÿåìîãî æèðà, âêëþ÷àÿ ðàñòèòåëüíûå æèðû íå äîëæíî ïðåâûøàòü 30% îò îáùåãî êàëîðàæà, ïðè÷åì íà äîëþ ÍÆÊ äîëæíî ïðèõîäèòüñÿ íå áîëåå 10% îò ýòîãî êîëè÷åñòâà.
Ôèçè÷åñêàÿ àêòèâíîñòü
àòåðîñêëåðîç êðîâü àêòèâíîñòü ïðîôèëàêòèêà
Âñåì ïàöèåíòàì ñ íàðóøåíèÿìè ëèïèäíîãî îáìåíà, èçáûòî÷íûì âåñîì è äðóãèìè ÔÐ ðåêîìåíäóåòñÿ ïîâûñèòü ôèçè÷åñêóþ àêòèâíîñòü, åñòåñòâåííî ñ ó÷åòîì âîçðàñòà, ñîñòîÿíèÿ ñåðäå÷íî-ñîñóäèñòîé ñèñòåìû, îïîðíî-äâèãàòåëüíîãî àïïàðàòà, äðóãèõ îðãàíîâ è ñèñòåì. Ëèöàì áåç êëèíè÷åñêèõ ïðîÿâëåíèé ÈÁÑ ìîæíî ðåêîìåíäîâàòü íàèáîëåå óäîáíûé è ïðèâû÷íûé äëÿ íèõ âèä ôèçè÷åñêîé àêòèâíîñòè — áåçîïàñíûé è äîñòóïíûé âèä àýðîáíûõ ôèçè÷åñêèõ óïðàæíåíèé — õîäüáó. Çàíèìàòüñÿ ñëåäóåò ïî 30-45 ìèíóò 4-5 ðàç â íåäåëþ ñ ×ÑÑ ðàâíîé 65-70% îò ìàêñèìàëüíîé äëÿ äàííîãî âîçðàñòà. Áîëüíûì ÈÁÑ è äðóãèìè çàáîëåâàíèÿìè ñåðäå÷íî-ñîñóäèñòîé ñèñòåìû ðåæèì òðåíèðîâî÷íûõ íàãðóçîê ïîäáèðàåòñÿ ñòðîãî èíäèâèäóàëüíî ñ ó÷åòîì ðåçóëüòàòîâ òåñòà ñ ÔÍ (âåëîýðãîìåòðèÿ èëè òðåäìèë).
Ñïèñîê èñïîëüçóåìîé ëèòåðàòóðû
1. Êóõàð÷óê Â.Â., Òàðàðàê Ý.Ì. Àòåðîñêëåðîç: îò À.Ë. Ìÿñíèêîâà äî íàøèõ äíåé// Êàðäèîëîãè÷åñêèé âåñòíèê — 2010. — ÒÎÌ V (XVII) | ¹ 1. — ñòð. 12-20
2. Ìèíåíêî È.À., Õàéðóëëèí Ð.Í. Äèàãíîñòèêà è ëå÷åíèå àòåðîñêëåðîçà// Âåñòíèê íîâûõ ìåäèöèíñêèõ òåõíîëîãèé -2010. — Ò. ÕVII, ¹ 1 — ñòð. 52-54
3. Àðîíîâ Ä.Ì., Ëóïàíîâ Â.Ï. Íåêîòîðûå àñïåêòû ïàòîãåíåçà àòåðîñêëåðîçà// Àòåðîñêëåðîç è äèñëèïèäåìèè -2011. — ¹ 1. — ñòð. 48-56
4. Ñóðîâèêèíà Ì.Ñ.,Âåëè÷êèíà Í.Ï.,Èâàíîâà Î.À., ×óãóíîâà Þ.Ñ.,Ñóðîâèêèí Â.Â. Ãèïåðôèëüòðàöèÿ è àòåðîñêëåðîç// Ìåäèöèíñêèé àëôàâèò. Ñîâðåìåííàÿ ëàáîðàòîðèÿ -2011. -¹1 -ñòð. 50-54
5. https://ashtanga.narod.ru/ateroscleroz.html, Âåòðîâ È.È. Àòåðîñêëåðîç — ïðè÷èíû è ëå÷åíèå.
6. www.cardiosite.ru — âñå î êàðäèîëîãèè. Åôðåìîâà Î.À. Àòåðîñêëåðîç. Ñîâðåìåííûå ïðåäñòàâëåíèÿ è ïðèíöèïû ëå÷åíèÿ.
Ðàçìåùåíî íà Allbest.ru
Атеросклероз: особенности заболевания
Министерство
здравоохранения Красноярского края
Краевое
государственное образовательное учреждение среднего профессионального
образования
Дивногорск
медицинский техникум
Реферат
Проверил: Никитина С.М.
Выполнила: Шкобенева Алёна
Содержание
1.
Определение
.
Статистика
.
Этиология
.
Клиническая картина
.
Патогенез
.
Классификация
.
Профилактика
Литература
1. Определение
Атеросклероз — хроническое заболевание артерий
эластического и мышечно-эластического типа, возникающее вследствие нарушения
липидного обмена и сопровождающееся отложением холестерина и некоторых фракций
липопротеидов в интиме сосудов. Отложения формируются в виде атероматозных
бляшек. Последующее разрастание в них соединительной ткани (склероз), и
кальциноз стенки сосуда приводят к деформации и сужению просвета вплоть до
облитерации (закупорки).
Статистика атеросклероза весьма неутешительна.
Уже после 30-35 лет атеросклерозом заболевает 75% мужчин и 38% женщин. В
возрасте 55-60 лет эти цифры приближаются почти к 100%. Однако, смертность от
атеросклероза составляет в среднем 58% (в основном от острых инфарктов и
инсультов), хотя в некоторых странах она достигает 69%. Понятно, что не каждый
человек, заболевший атеросклерозом умирает от него, поскольку прежде он может
завершить свою жизнь от рака, сахарного диабета или каких-либо иных болезней
цивилизации. Многие же, кто перенес инсульты, на всю жизнь остаются
прикованными к кровати или инвалидной коляске. Атеросклероз развивается
постепенно, в среднем, 15-20 лет, прежде чем появятся первые клинические его
симптомы. В настоящее время, в ряде случаев кардиологи отмечают начало развития
атеросклероза уже в подростковом возрасте, что еще 100 лет назад считалось невероятным
фактом. Кстати, смертность от этого заболевания не превышало тогда 5-6%. А во
времена ведической цивилизации — была лишь одним из признаков глубокой
старости.
Атеросклероз наиболее развит в технократически
развитых странах, особенно в США, Германии, Швеции, Англии, Финляндии и Дании.
В последнее время их стремительно стали догонять крупные города России и
Украины. Например, в Москве, С-Петербурге, Екатеринбурге, Киеве и
Днепропетровске смертность от острых инфарктов и инсультов достигло в настоящее
время 65%. Специальные кардиологические программы по борьбе с
сердечно-сосудистыми заболеваниями в США, начатые около 25 лет назад, снизили
смертность от атеросклероза с 69% до 45%. Наиболее низкая смертность от данной
патологии отмечается в Японии, Индии, Непале, Бирме и в некоторых
латиноамериканских странах.
. Этиология
Как таковой единой теории возникновения данного
заболевания нет. Выдвигаются следующие варианты, а также их сочетания:
· теория липопротеидной инфильтрации —
первично накопление липопротеидов в сосудистой стенке,
· теория дисфункции эндотелия —
первично нарушение защитных свойств эндотелия и его медиаторов,
· аутоиммунная — первично нарушение
функции макрофагов и лейкоцитов, инфильтрация ими сосудистой стенки,
· моноклональная — первично возникновение
патологического клона гладкомышечных клеток,
· вирусная — первично вирусное
повреждение эндотелия (герпес, цитомегаловирус и др.),
· перекисная — первично нарушение
антиоксидантной системы,
· генетическая — первичен
наследственный дефект сосудистой стенки,
· хламидиозная — первичное поражение
сосудистой стенки хламидиями, в основном, Chlamydia pneumoniae.
Однако из всех данных теорий можно выделить 2
основные:
Согласно первой, атеросклероз развивается
вследствие отложения липидов на стенке сосудов в результате увеличения
абсолютного содержания липидов крови или нарушения метаболизма липопротеинов
(ЛП).
Вторая теория основана на том, что для
возникновения болезни необходимо повреждение стенки сосуда (механическое,
химическое или иммунологическое), причем отложение липидов хотя и играет важную
роль в прогрессировании повреждения, но является вторичным. Накопление
холестерина (ХС) в зонах атеросклеротического поражения стенки сосуда было
отмечено еще в конце прошлого столетия, однако особое значение этот факт
приобрел после опытов Н. Н. Аничкова и С. С. Халатова, в которых добавление ХС
в рацион кроликов приводило к образованию повреждений аорты, напоминающих
атеросклеротические повреждения сосудов человека.
Факторы, способствующие развитию атеросклероза:
. Наследственно — конституциональное
предрасположение;
. Алиментарный фактор — неправильное
питание, содержащее избыток жиров и углеводов и недостаток витамина С;
. Психоэмоциональное напряжение;
. Повышенное артериальное давление;
. Сосудистый фактор, связанный с
нарушением нервной регуляции сосудов, их поражением при различных инфекционных
и инфекционно — аллергических заболеваниях.
. Клиническая картина
Клиническая картина зависит от того, какие
артерии поражены преимущественно. Для клинической практики наибольшее значение
имеет атеросклеротическое поражение аорты, коронарных артерий(венечных) артерий
сердца, артерий мозга и нижних конечностей; могут поражаться почечные и
мезентеральные артерии. При атеросклерозе аорты, какие — либо характерные
жалобы отсутствуют, и такой атеросклероз распознается лишь при непосредственном
обследовании больного и проведении инструментальных методов исследования.
Атеросклероз сосудов головного мозга наиболее
характерен для лиц пожилого и старческого возраста. Отмечается постоянное
снижение кровоснабжения мозга и вследствие этого постоянное кислородное
голодание. Проявляется такой атеросклероз снижением памяти, головокружениями,
снижением умственной работоспособности, способности к концентрации внимания.
Данное вид заболевание заканчивается развитием старческого слабоумия.
Если просвет мозговых артерий закрывается
бляшками значительно, может развиться ишемический инсульт. При развитии данного
осложнения появляется так называемая мозговая симптоматика в виде нарушения
речи, глотания, появления парезов и параличей, а в дальнейшем и к смерти.
При атеросклерозе сосудов нижних конечностей
вследствие снижения кровоснабжения главным симптомом является похолодание стоп
и пальцев, а также слабость в ногах. Характерный симптом — перемеживающая
хромота: возникновение болей в икроножных мышцах при ходьбе и прекращение их
при остановке. Со временем в нижней части голени могут появиться трофические
язвы, а в тяжелых случаях развивается атеросклеротическая гангрена —
омертвление пальцев ног.
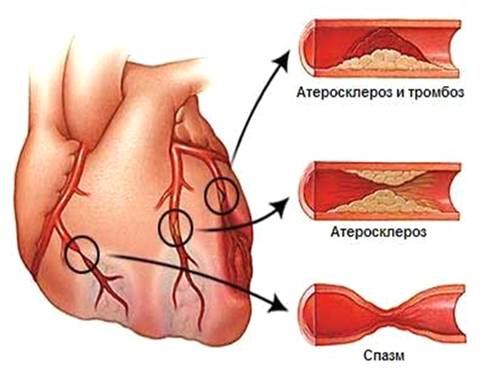
Атеросклероз коронарных (венечных) артерий
сердца проявляется приступами стенокардии и приводит к развитию инфаркта
миокарда.
Атеросклеретические бляшки часто возникают в
бифуркации артерий — там, где кровоток неравномерен; иными словами, в
расположении бляшек играет роль локальная гемодинамика.
5. Патогенез
Патогенез атеросклероза называют атерогенезом.
Он происходит в несколько этапов. Развитие атеросклеротического поражения — это
совокупность процессов поступления в интиму и выхода из нее липопротеидов и
лейкоцитов, пролиферации и гибели клеток, образования и перестройки
межклеточного вещества, а также разрастания сосудов и обызвествления. Эти
процессы управляются множеством сигналов, часто разнонаправленных.
Накапливается все больше данных о сложной патогенетической связи между
изменением функции клеток сосудистой стенки и мигрировавших в нее лейкоцитов и
факторами риска атеросклероза.
Накопление и модификация липопротеидов. В норме
интима артерий образована одноклеточным эндотелиальным слоем, под которым
находятся гладкомышечные клетки, погруженные в межклеточное вещество. Первые
проявления болезни — так называемые липидные пятна. Их появление связано с
местным отложением липопротеидов в интиме. Атерогенными свойствами обладают не
все липопротеиды, а только низкой (ЛПНП) и очень низкой плотности (ЛПОНП).
Изначально они накапливаются в интиме преимущественно за счет связывания с компонентами
межклеточного вещества — протеогликанами. В местах образования липидных пятен
большую роль играет преобладание гепарансульфатов над двумя другими
гликозаминогликанами — кератансульфатами и хондроитинсульфатами. В интиме
липопротеиды, особенно связанные с протеогликанами, могут вступать в химические
реакции. Основную роль играют две: окисление и неферментативное
гликозилирование. В интиме в отличие от плазмы содержится мало антиоксидантов.
Образуется смесь окисленных ЛПНП, причем окисляются как липиды, так и белковый
компонент. При окислении липидов образуются гидроперекиси, лизофосфолипиды,
оксистерины и альдегиды (при перекисном окислении жирных кислот). Окисление
апопротеинов ведет к разрыву пептидных связей и соединению боковых цепей аминокислот
(обычно ?-аминогруппы лизина) с продуктами расщепления жирных кислот
(4-гидроксиноненалем и малоновым диальдегидом). Стойкая гипергликемия при
сахарном диабете способствует неферментативному гликозилированию апопротеинов и
собственных белков интимы, что тоже нарушает их функции и ускоряет атерогенез.
Миграция лейкоцитов и образование ксантомных
(пенистых) клеток Кальцификация стенки сосуда. Миграция лейкоцитов, в основном
моноцитов и лимфоцитов, — вторая стадия развития липидного пятна. Их миграцию в
интиму обеспечивают расположенные на эндотелии рецепторы — молекулы адгезии.
Особого внимания заслуживают молекулы VCAM-1 и ICAM-1 (из суперсемейства
иммуноглобулинов) и Р-селектины. Синтез молекул адгезии могут увеличивать
цитокины. Так, интерлейкин-1 (ИЛ-1) и фактор некроза опухолей (ФНО?) вызывают
или усиливают синтез эндотелиальными клетками VCAM-1 и ICAM-1. В свою очередь,
выброс цитокинов клетками сосудистой стенки стимулируется модифицированными
липопротеидами. Образуется порочный круг. Играет роль и характер тока крови. В
большинстве участков неизмененной артерии кровь течет ламинарно, и возникающие
при этом силы снижают экспрессию (проявление) на поверхности эндотелиальных
клеток молекул адгезии. Также ламинарный кровоток способствует образованию в эндотелии
окиси азота NO. Кроме сосудорасширяющего действия, в низкой концентрации,
поддерживаемой эндотелием, NO обладает противовоспалительной активностью,
снижая, например, синтез VCAM-1. Но в местах ветвления ламинарный ток часто
нарушен, именно там обычно возникают атеросклеротические бляшки. После адгезии
лейкоциты проходят через эндотелий и попадают в интиму. Липопротеиды могут
непосредственно усиливать миграцию: окисленные ЛПНП способствуют хемотаксису
лейкоцитов. К дальнейшему образованию липидного пятна причастны моноциты. В
интиме моноциты становятся макрофагами, из которых за счет опосредованного
рецепторами эндоцитоза липопротеидов возникают заполненные липидами ксантомные
(пенистые) клетки. Раньше предполагали, что в эндоцитозе участвуют хорошо известные
рецепторы ЛПНП, но при дефекте этих рецепторов как у экспериментальных
животных, так и у больных (например, при семейной гиперхолестеринемии) все
равно имеются многочисленные ксантомы и атеросклеротические бляшки, заполненные
ксантомными клетками. Кроме того, экзогенный холестерин тормозит синтез этих
рецепторов, и при гиперхолестеринемии их мало. Теперь предполагается роль
скэвенджер-рецепторов макрофагов (связывающих в основном модифицированные
липопротеиды) и других рецепторов для окисленных ЛПНП и мелких атерогенных
ЛПОНП. Некоторые ксантомные клетки, поглотившие липопротеиды из межклеточного
вещества, покидают стенку артерии, препятствуя тем самым накоплению в ней
липидов. Если же поступление липопротеидов в интиму преобладает над их выведением
с макрофагами (или другими путями), липиды накапливаются и в итоге образуется
атеросклеротическая бляшка. В растущей бляшке некоторые ксантомные клетки
подвергаются апоптозу или некрозу. В результате в центре бляшки образуется
полость, заполненная богатыми липидами массами, что характерно для поздних
стадий атерогенеза.
Про- и антиатерогенные факторы. При поглощении
модифицированных липопротеидов макрофаги выделяют цитокины и факторы роста,
способствующие развитию бляшки. Одни цитокины и факторы роста стимулируют
деление гладкомышечных клеток и синтез межклеточного вещества, которое
накапливается в бляшке. Другие цитокины, особенно интерферон-? из
активированных Т-лимфоцитов, тормозят деление гладкомышечных клеток и синтез
коллагена. Такие факторы, как ИЛ-1 и ФНО, вызывают выработку в интиме
тромбоцитарного фактора роста и фактора роста фибробластов, которые играют роль
в дальнейшей судьбе бляшки. Таким образом, происходит сложное взаимодействие
факторов, как ускоряющих, так и тормозящих атерогенез. Велика роль и небелковых
медиаторов. Активированные макрофаги и клетки сосудистой стенки (эндотелиальные
и гладкомышечные) вырабатывают свободные радикалы кислорода, которые
стимулируют пролиферацию гладкомышечных клеток, усиливают синтез цитокинов, а
также связывают NO. С другой стороны, активированные макрофаги способны к
синтезу индуцируемой NO-синтазы. Этот высокоактивный фермент вырабатывает NO в
высоких, потенциально токсичных концентрациях — в отличие от небольшой
концентрации NO, создаваемой конститутивной формой фермента — эндотелиальной
NO-синтазой. Помимо макрофагов, в удалении холестерина из пораженной интимы
участвуют липопротеиды высокой плотности (ЛПВП), обеспечивающие так называемый
обратный транспорт холестерина. Доказана четкая обратная зависимость между
концентрацией холестерина ЛПВП и риском ИБС. У женщин детородного возраста
концентрация холестерина ЛПВП выше, чем у сверстников-мужчин, и во многом
благодаря этому женщины реже страдают атеросклерозом. В эксперименте показано,
что ЛПВП способны удалять холестерин из ксантомных клеток.
Участие гладкомышечных клеток.
Атеросклеротическая бляшка развивается из липидного пятна, но не все пятна
становятся бляшками. Если для липидных пятен характерно накопление ксантомных
клеток, то для бляшек — фиброз. Межклеточное вещество в бляшке синтезируют в
основном гладкомышечные клетки, миграция и пролиферация которых — вероятно,
критический момент в образовании фиброзной бляшки на месте скопления ксантомных
клеток. Миграцию в липидное пятно гладкомышечных клеток, их пролиферацию и
синтез межклеточного вещества вызывают цитокины и факторы роста, выделяемые под
влиянием модифицированных липопротеидов и других веществ макрофагами и клетками
сосудистой стенки. Так, тромбоцитарный фактор роста, выделяемый активированными
эндотелиальными клетками, стимулирует миграцию гладкомышечных клеток из медии в
интиму. Образуемые локально факторы роста вызывают деление как собственных
гладкомышечных клеток интимы, так и клеток, пришедших из медии. Один из мощных
стимуляторов синтеза этими клетками коллагена — трансформирующий фактор роста
р. Кроме паракринной (факторы поступают от соседних клеток) происходит и
аутокринная (фактор вырабатывается самой клеткой) регуляция гладкомышечных
клеток. В результате происходящих с ними изменений ускоряется переход липидного
пятна в атеросклеротическую бляшку, содержащую много гладкомышечных клеток и
межклеточного вещества. Как и макрофаги, эти клетки могут вступать в апоптоз:
его вызывают цитокины, способствующие развитию атеросклероза.
. Классификация
От того, какие артерии поражены преимущественно
атеросклероз различают:
· атеросклеротическое поражение аорты,
· атеросклеротическое поражение
коронарных артерий(венечных) артерий сердца,
· атеросклеротическое поражение
артерий мозга и нижних конечностей;
· атеросклеротическое поражение
почечных и мезентеральных артерии.
Атеросклерозу способствует малоподвижный образ
жизни, курение, жирная пища, а также неумеренная прибавка в весе. Профилактика
атеросклероза требует перехода на пищу, содержащую мало жира и холестерина,
отказа от курения; необходимо регулировать кровяное давление с помощью диеты и,
если нужно, лекарственных препаратов; важны для профилактики атеросклероза
также физические упражнения и поддержание нормального веса. Когда клинические
признаки атеросклероза уже появились, можно замедлить его прогрессирование, а в
некоторых случаях и вызвать обратное развитие атеросклеротических изменений,
используя средства, снижающие содержание холестерина в составе ЛПНП и
повышающие уровень связанного с ЛПВП холестерина в крови.
Мы можем воздействовать лишь на один из четырех
механизмов формирования атеросклероза — нарушенный липидный, холестериновый
обмен.
атеросклероз эластический бляшка клинический
Литература
1.
Внутренние болезни по Тинсли и Харри. Том 2.-Москва:Практика,2002
.
Атеросклероз/А. Л. Раков, В. Н. Колесников//Новая аптека.-2002.-№ 6
.
Атеросклероз-основные теории развития/Мкртчян//Диабет. Образ жизни.-2004.-№ 6
.
Атеросклероз: клиническая значимость и возможности предупреждения/Марцевич//Лечащий
врач.-2004.-№ 2
.
Немедикаментозные методы коррекции гиперлипидемии/Д. М. Аронов//Лечащий
врач.-2002.-№ 7-8
Приложение
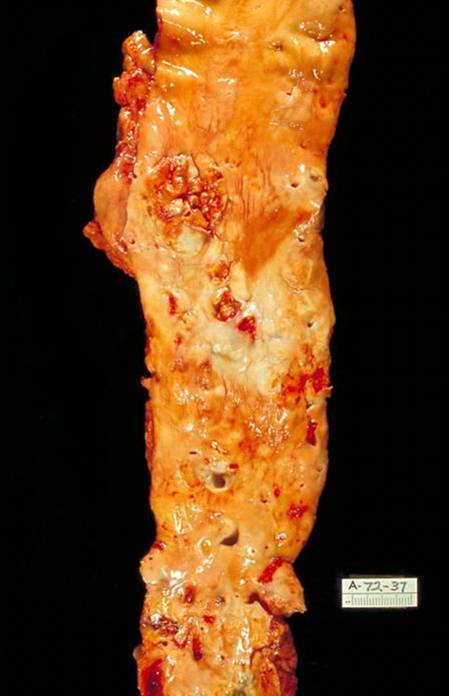
Вид пораженной артерии атеросклерозом


