При острой постгеморрагической анемии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 30 декабря 2019;
проверки требует 1 правка.
Постгеморрагическая анемия — развивается после кровопотери. Постгеморрагические анемии подразделяются на острые и хронические. Острая постгеморрагическая анемия развивается после обильных, остро возникающих кровотечений(кровотечение органов) Хронические постгеморрагические анемии развиваются после длительных необильных кровотечений(язвы).
История заболевания[править | править код]
Этиология[править | править код]
- травмы
- геморрагические заболевания (тромбоцитопатии, коагулопатии, ДВС-синдром, геморрагический васкулит, лейкозы, апластические анемии, дизовариальные меноррагии у девушек).
- легочное кровотечение, ЖК кровотечения
Патогенез[править | править код]
При быстрой кровопотере уменьшается объём циркулирующей крови (олигемическая фаза). В ответ на уменьшение объёма циркулирующей крови возникает компенсаторная реакция : возбуждение симпатического отдела нервной системы и рефлекторный спазм сосудов, артериально-венозное шунтирование, что первоначально способствует поддержанию артериального давления, адекватному венозному притоку и сердечному выбросу. Пульс ускорен и ослаблен. Максимально сужены сосуды в коже и мышцах, минимально — сосуды мозга, коронарные, что обеспечивает лучшее кровоснабжение жизненно-важных органов. С продолжением процесса начинаются явления постгеморрагического шока.
Клиника[править | править код]
При постгеморрагической анемии клинически на первый план выходят явления острой сосудистой недостаточности вследствие резкого опустошения сосудистого русла (гиповолемии): — это сердцебиение, одышка, ортостатический коллапс. Тяжесть состояния определяется не только количеством, но и скоростью кровопотери. Наблюдается снижение диуреза соответственно степени кровопотери. Уровень гемоглобина и количество эритроцитов не являются надежным критерием степени кровопотери.
В первые минуты содержание Hb из-за уменьшения ОЦК может быть даже высоким. При поступлении тканевой жидкости в сосудистое русло эти показатели снижаются даже при прекращении кровотечения. Цветовой показатель, как правило, нормален, так как происходит одновременная потеря и эритроцитов и железа, то есть анемия нормохромная. На вторые сутки увеличивается количество ретикулоцитов, достигающее максимума на 4 — 7 день, то есть анемия является гиперрегенераторной.
Диагностика[править | править код]
В диагностике постгеморрагической анемии учитывают сведения о произошедшей острой кровопотере при внешнем кровотечении; в случае массивного внутреннего кровотечения диагноз основывается на клинических признаках в сочетании с лабораторными пробами (Грегерсена, Вебера), повышении уровня остаточного азота при кровотечении из верхних отделов желудочно-кишечного тракта.
При внешнем кровотечении диагноз поставить несложно. При внутреннем кровотечении из органа надо исключать коллапс иного генеза.
Лечение[править | править код]
Самое главное — устранить источник кровотечения. Затем восполняют кровопотерю (в зависимости от степени тяжести анемии — эритроцитарная масса, на фоне введения гепарина). Общий объём гемотрансфузии не должен превышать 60 % дефицита объёма циркулирующей крови. Остальной объём восполняется кровезаменителями (5 % раствором альбумина, реополиглюкином, раствором Рингера и т. д.). Пределом гемодилюции считают гематокрит 30 и эритроциты более
3*10¹²/л. По окончании острого периода необходимо лечение препаратами железа, витаминами группы В, С, Е.
После ликвидации анемии препараты железа назначают в половинной дозе до 6-ти месяцев.
Прогноз[править | править код]
Прогноз зависит от причины кровотечения, скорости, объёма кровопотери, рациональной терапии. При кровопотере с дефицитом объёма циркулирующей крови более 50 % прогноз неблагоприятный.
См. также[править | править код]
- Анемия
- Кровотечение
Примечания[править | править код]
Ссылки[править | править код]
- Постгеморрагические анемии
- Неотложная помощь при постгеморрагической анемии
Литература[править | править код]
- У. Россе, Ф. Бонн. ГЕМОЛИТИЧЕСКИЕ И ОСТРАЯ ПОСТГЕМОРРАГИЧЕСКАЯ АНЕМИИ. From Harrison’s Principles of Internal Medicine. 14-th edition.
- Н. Н. Зайко, Ю. В. Быць, А. В. Атаман и др. К.: «Логос», 1996 Патологическая физиология
Постгеморрагическая анемия – комплекс клинических и гематологических изменений, возникающий вследствие острой или хронической кровопотери. Постгеморрагическая анемия характеризуется бледностью, одышкой, потемнением в глазах, головокружением, гипотермией, артериальной гипотонией; в тяжелых случаях — заторможенностью, нитевидным пульсом, шоком, потерей сознания. Постгеморрагическую анемию диагностируют по данным клинической картины и общего анализа крови; для установления источника кровотечения проводятся инструментальные исследования. При развитии данного состояния необходимо устранение источника кровопотери, проведение трансфузионной и симптоматической терапии.
Общие сведения
Постгеморрагическая анемия – гипогемоглобинемия, развивающаяся вследствие геморрагического синдрома и сопровождающаяся ощутимым снижением объема циркулирующей крови (ОЦК). Постгеморрагическая анемия протекает с эритропенией, но часто без уменьшения концентрации гемоглобина (Hb). В норме уровень общего Hb и объем циркулирующих эритроцитов крови составляет соответственно: у мужчин – не ниже 130 г/л и 29-30 мл/кг веса, у женщин – не ниже 120 г/л и 22-23 мл/кг. Постгеморрагическая анемия может осложнять течение самых различных патологический состояний в хирургии, гематологии, гинекологии, гастроэнтерологии, кардиологии и др. Постгеморрагическая анемия может носить острый или хронический характер. Хроническая форма является вариантом железодефицитной анемии, так как механизм развития и симптомы патологии обусловлены усиливающимся дефицитом железа.
Постгеморрагическая анемия
Причины постгеморрагической анемии
Непосредственной причиной постгеморрагической анемии выступает острая или хроническая потеря крови, возникшая вследствие наружного или внутреннего кровотечения. Острая постгеморрагическая анемия возникает при быстрых, массивных кровопотерях, вызванных обычно механическим повреждением стенок крупных кровеносных сосудов или полостей сердца при различных травмах и хирургических операциях, разрывом стенок сердечных камер в зоне инфаркта, разрывом аневризмы аорты и ветвей легочной артерии, разрывом селезенки, разрывом фаллопиевой трубы при внематочной беременности.
Острая постгеморрагическая анемия характерна для обильных маточных кровотечений (менорагий, метрорагий), может сопровождать течение язвы желудка и 12-перстной кишки. У новорожденных постгеморрагическая анемия может быть вызвана плацентарным кровотечением, родовой травмой.
Хроническая постгеморрагическая анемия обусловлена продолжительными, часто возникающими потерями небольших объемов крови при желудочно-кишечных, геморроидальных, почечных, носовых кровотечениях, нарушениях механизмов свертывания крови (ДВС-синдроме, гемофилии). Опухолевые процессы (рак желудка, рак толстой кишки), протекающие с разрушением тканей и органов, проводят к развитию внутреннего кровотечения и постгеморрагической анемии. Гипогемоглобинемия может быть связана с повышением проницаемости стенок капилляров при лейкозах, лучевой болезни, инфекционно-септических процессах, недостаточности витамина C.
Патогенез постгеморрагической анемии
Основными факторами развития постгеморрагической анемии выступают явления сосудистой недостаточности, гиповолемия с уменьшением общего объема плазмы и циркулирующих форменных элементов, в частности, эритроцитов, осуществляющих транспорт кислорода. Этот процесс сопровождается снижением артериального давления, кровенаполнения внутренних органов и тканей, гипоксемией, гипоксией и ишемией, развитием шока.
Степень выраженности защитно-приспособительных реакций организма определяется объемом, скоростью и источником кровотечения. В раннюю рефлекторно-сосудистую фазу компенсации кровопотери (первые сутки) благодаря возбуждению симпатико-адреналовой системы наблюдается вазоконстрикция и усиление сопротивления периферических сосудов, стабилизация гемодинамики за счет централизации кровообращения с первоочередным кровоснабжением головного мозга и сердца, уменьшение возврата крови к сердцу и сердечного выброса. Концентрация эритроцитов, Hb и гематокрит пока близки к норме («скрытая» анемия).
Вторая гидремическая фаза компенсации (2-3 сутки) сопровождается аутогемодилюцией — поступлением в кровеносное русло тканевой жидкости и восполнением объема плазмы. Усиление секреции катехоламинов и альдостерона надпочечниками, вазопрессина – гипоталамусом способствует стабильности уровня электролитов в плазме крови. Происходит прогрессирующее снижение показателей эритроцитов и Hb (общего и в единице объема), гематокрита; значение цветового показателя в норме (постгеморрагическая нормохромная анемия).
В третью, костномозговую фазу компенсации (4-5 сутки) из-за недостатка железа анемия становится гипохромной, усиливается образование эритропоэтина почками с активацией ретикулоэндотелиальной системы, эритропоэза костного мозга, очагов экстрамедуллярного кроветворения. В красном костном мозге наблюдается гиперплазия эритроидного ростка и увеличение общего числа нормоцитов, в периферической крови — значительное повышение количества молодых форм эритроцитов (ретикулоцитов) и лейкоцитов. Уровни Hb, эритроцитов и гематокрит понижены. Нормализация уровня эритроцитов и Hb при отсутствии дальнейшей кровопотери происходит через 2-3 недели. При массивной или длительной кровопотере постгеморрагическая анемия приобретает гипорегенеративный характер, при истощении адаптационных систем организма развивается шок.
Симптомы постгеморрагической анемии
Клинические признаки постгеморрагической анемии однотипны вне зависимости от причины кровопотери, определяются ее объемом и длительностью.
В первые сутки после острой кровопотери у пациентов отмечается резкая слабость, бледный оттенок кожи и слизистых, одышка, потемнение и мелькание мушек в глазах, головокружение, шум в ушах, пересыхание во рту, снижение температуры тела (особенно, конечностей), холодный пот. Пульс становится частым и слабым, появляется артериальная гипотония. Следствием геморрагического синдрома является малокровие внутренних органов, жировая дистрофия миокарда, печени, ЦНС и других органов. Дети, особенно новорожденные и 1-го года жизни, кровопотерю переносят намного тяжелее, чем взрослые пациенты.
Постгеморрагическая анемия при массивной и быстрой кровопотере сопровождается геморрагическим коллапсом, резким падением артериального давления, нитевидным аритмичным пульсом, адинамией и заторможенностью, учащенным поверхностным дыханием с возможным развитием рвоты, судорог, потерей сознания. Если давление падает до критического уровня, вызывая острое нарушение кровоснабжения и гипоксию органов и систем, смерть наступает от паралича дыхательного центра и остановки сердца.
Медленно развивающаяся постгеморрагическая анемия характеризуется менее выраженными проявлениями, так как успевает частично компенсироваться за счет адаптационных механизмов.
Диагностика постгеморрагической анемии
Диагностика постгеморрагической анемии проводится по данным клинической картины, лабораторных и инструментальных исследований (общего и биохимического анализов крови и мочи, ЭКГ, УЗ-диагностики, пункции костного мозга, трепанобиопсии). При осмотре пациента с острой постгеморрагической анемией обращает внимание гипотония, частое дыхание, слабый аритмичный пульс, тахикардия, приглушенность сердечных тонов, небольшой систолический шум на верхушке сердца.
В крови — абсолютное снижение эритроцитарной массы; при продолжающейся кровопотере наблюдается прогрессирующее равномерное падение содержания Hb и эритроцитов. При умеренной кровопотере гематологические признаки постгеморрагической анемии обнаруживается только на 2-4 сутки. Обязателен контроль диуреза, уровня тромбоцитов, электролитов и азотистых продуктов в крови, АД и ОЦК.
При острой постгеморрагической анемии нет необходимости в исследовании костного мозга, его проводят при трудно диагностируемых кровопотерях. В образцах костномозговой пункции признаками анемии являются повышение активности красного костного мозга, в препаратах трепанобиопсии – замещение жировой ткани костного мозга красным кроветворным мозгом.
При диагностике внутренних кровотечений показателен синдром острого малокровия и лабораторные данные. В селезенке, печени, лимфоузлах выявляются очаги экстрамедуллярного кроветворения, указывающие на повышенную нагрузку на гемопоэтическую систему; в крови — транзиторное понижение уровня железа, небольшое увеличение АлТ.
Для выявления и устранения источника кровопотери больные нуждаются в консультациях гематолога, хирурга, гинеколога, гастроэнтеролога и других специалистов; проведении УЗИ органов брюшной полости и малого таза, ФГДС и пр. ЭКГ при постгеморрагической анемии может демонстрировать снижение амплитуды Т-зубца в стандартном и грудном отведении.
Лечение и прогноз постгеморрагической анемии
Первостепенным в лечении постгеморрагической анемии является установление источника кровотечения и его немедленная ликвидация за счет перевязки и ушивания сосудов, резекции и ушивания поврежденных органов и тканей, повышения свертываемости крови и т. д.
Для восстановления ОЦК и снижения степени гемодинамических нарушений по наблюдением трансфузиолога проводится неотложное переливание консервированной крови, кровезаменителей, плазмы и плазмозаменителей. При незначительном, но продолжительном кровотечении трансфузия цельной крови или плазмы показана в небольших гемостатических дозах. При значительной потере ОЦК трансфузии должны выполняться в дозах, превышающих кровопотерю на 20-30%. Тяжелая постгеморрагическая анемия лечится переливаниями больших доз крови («трансплантация крови»). В период коллапса гемотрансфузии дополняют гипертоническими кровозамещающими растворами.
После восстановления ОЦК проводится коррекция качественного состава крови – восполнение ее компонентов: эритроцитов, лейкоцитов, тромбоцитов. При большой одномоментной кровопотере и остановившемся кровотечении необходимы массивные дозы эритроцитарной массы (> 500 мл). Об эффективности гемотрансфузий судят по повышению АД, гематологическим сдвигам.
Также необходимо введение белковых и электролитных растворов (альбумина, физ. раствора, глюкозы), восстанавливающих водно-солевой баланс. В лечении постгеморрагической анемии используются препараты железа, витамины группы B. Назначается симптоматическая терапия, направленная на нормализацию функциональных нарушений со стороны сердечно-сосудистой и дыхательной систем, печени, почек и др.
Прогноз постгеморрагической анемии зависит от длительности и объема кровотечения. Резкая потеря 1/4 ОЦК приводит к острой анемии и состоянию гиповолемического шока, а потеря 1/2 ОЦК является несовместимой с жизнью. Постгеморрагическая анемия при медленной потере даже значительных объемов крови не столь опасна, поскольку может компенсироваться.
Этиология
Острая
постгеморрагическая анемияхарактеризуется
быстрой потерей гемоглобина и эритроцитов
в крови и появляется в результате
кровотечений.
В основе анемии
лежит уменьшение массы циркулирующих
эритроцитов, приводящее к нарушению
оксигенации тканей организма.
Патогенез
Гиповолемия
– сопровождается стимуляцией
симпатико-адреналовой системы. Развиваются
перераспределительные реакции на уровне
капиллярной сети, вследствие чего
возникают явления внутрисосудистой
агрегации форменных элементов крови.
Нарушение капиллярного кровотока
приводит к развитию гипоксии тканей и
органов, наполнению недоокисленных и
патологических продуктов обмена веществ
и интоксикации, уменьшается венозный
возврат, который ведет к уменьшению
сердечного выброса. Наступает декомпенсация
микроциркуляции, обусловленная сочетанием
сосудистого спазма с агрегацией
эритроцитов, что создает условия для
образования тромбов. С момента образования
признаков агрегации эритроцитов шок
становится необратимым.
Клиника
острой постгемморагической анемии
Клиническая
картина зависит от количества потерянной
крови, длительности кровотечения и
источника кровопотери.
Фаза
острая —
после кровопотери ведущими клиническими
проявлениями являются гемодинамические
расстройства (снижение АД, тахикардия,
бледность кожных покровов, нарушение
координации, плоть до развития шокового
состояния, потери сознания)
Фаза
рефлекторно — сосудистая,
после кровопотери происходит компенсаторное
поступление крови, депонированной в
мышцах, печени, селезенке, в кровеносное
русло
Гидремическая
фаза компенсации,
которая длится 1-2 дня после кровотечения,
при этом выявляют анемию в анализах
крови
Костномозговой
стадия компенсации кровопотери,
через 4-5 дней после кровопотери развивается
ретикулоцитарный
криз, который
характеризуется: ретикулоцитозом,
лейкоцитозом.
После
7 дня наступает фаза восстановления
кровопотери,
если кровотечение не повторяется, то
через 2-3 недели красная кровь полностью
восстанавливается, при этом нет признаков
железодефецитной анемии.
Диагностика
постгемморагической анемии
Анализ
крови: снижение
НВ, количества эритроцитов, она
нормохромная, нормоцитарная, регенераторная
— ретикулоцитов более 1%
Лечение
острой постгеморрагической анемии:
Лечение
острой постгемморагической анемии
начинают с остановки кровотечения и
противошоковых мероприятий. С целью
улучшения капиллярного кровотока
следует восполнить ОЦК в организме;
воздействовать на физико-химические
свойства крови. При тяжелой кровопотере
переливают солевые растворы, поддерживая
электролитный баланс организма. Прогноз
зависит от скорости кровопотери –
быстрая утрата до 25% общего объема крови,
может привести к развитию шока, а
медленная кровопотеря даже в пределах
75% всей массы тела может закончиться
благоприятно!
ЖЕЛЕЗОДЕФИЦИТНАЯ
АНЕМИЯ
ЖДА
– клинико-гематологический синдром, в
основе которого лежит нарушение синтеза
гемоглобина, из-за дефицита железа в
организме или вследствие негативного
балансаэтого
микроэлемента длительное время.
Различают три
стадии развития дефицита железа:
Предлатентный
дефицит железа
или уменьшение запасов железа.Латентный
дефицит железа
характеризуется истощением железа в
депо, но концентрация Нв периферической
крови остается выше нижней границы
нормы. Клинические симптомы на этой
стадии мало выражены, проявляются
снижением толерантности к физическим
нагрузкам.Железодефицитная
анемия развивается
при падении концентрации Нв ниже
физиологических величин.
Этиологические
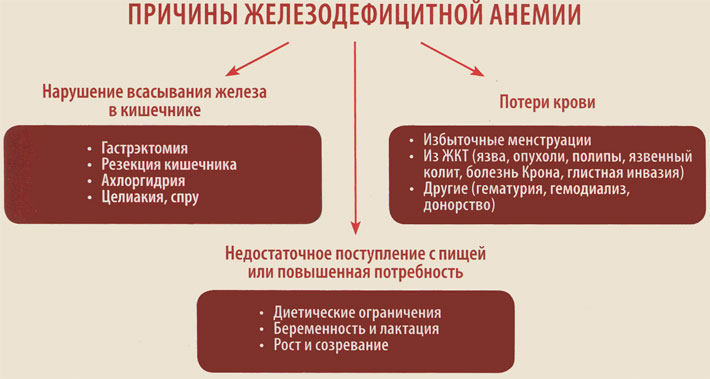
факторы ЖДА
ЖДА
наиболее распространенная анемия, она
встречается у 10-30% взрослого населения
Украины. Причинами развития данной
патологии являются: неполноценное
питание,
заболевания пищеварительного тракта,
сопровождающиеся хроническими
кровопотерями и нарушением всасывания
железа (геморрой и трещины прямой кишки,
гастриты, язвенная болезнь желудка и
т.д.) Заболевания мочеполовой системы,
осложненные микро- и макрогематуриею
(хронический гломеруло- и пиелонефрит,
полипоз мочевого пузыря и т.д) Повышенная
потребность в железе: беременность,
лактация, не контролируемое донорство,
частые воспаления.
Патогенез ЖДА
Железо
очень важный микроэлемент в организме
человека он принимает участие в транспорте
кислорода, окислительно-восстановительных
и иммунобиологических реакциях.
Недостаточное количество железа для
организма пополняется с пищей. Для
нормального всасывания пищевого железа
необходима свободная соляная кислота
в желудке, которая переводит его в
окисленную форму, последняя в тонкой
кишке связывается с белком апоферетином,
образуя ферретин, который и всасывается
в кровь.т
Железо,
которое появляется при разрушении
эритроцитов в селезенке ( из гемма)
включается в состав феретина и гемосидерина
( резервное железо) и так же частично
попадает в костный мозг и используется
эритробластами.
Железо,
содержащееся в организме, условно можно
разделить на функциональное (в составе
гемоглобина, миоглобина, ферментов и
коферментов), транспортное (трансферин),
депонированное (ферритин, гемосидерин)
и железо, которое образует свободный
пул. Из железа, которое содержится в
организме (3-4,5 мг), только 1 мг участвует
в обмене с внешней средой: выделяется
с испражнениями, теряется при выпадении
волос, деструкции клеток.
Суточная потребность
в железе взрослого человека в состоянии
физиологического равновесия составляет
(1 — 1, 5) мг, у женщин во время менструаций
— (2,5 — 3,3) мг.
Клиническая
картина ЖДА
Кроме
АНЕМИЧЕСКОГО СИНДРОМА
для ЖДА характерен и СИДЕРОПЕНИЧЕСКИЙ
СИНДРОМ, который
связан с нарушением трофики эпителиальных
клеток в результате снижения активности
железосодержащих ферментов – цитохромов.
Он проявляется изменениями
на коже и ее придатках
– кожа становиться сухой вялой снижается
тургор появляется ломкость ногтей
выпадения волос, изменяется восприятие
запахов и вкуса – возникает пристрастие
к запахам бензина, мела ацетона и т.д.
Изменениями
в слизистых оболочках желудочно-кишечного
тракта
хейлит, ангулярный стоматит, склонность
к парадантозу, дисфагия (синдром
Пламера-Винсона) атрофический гастрит.
Происходит атрофия
слизистых оболочек глаз
в виде сухости глазного яблока, «симптома
синих склер», изменяютя
слизистые оболочеки верхних и нижних
дыхательных путей, развиваются
атрофические риниты, фарингиты, бронхиты.
Поражается мышечная система — происходит
задержка роста и физического развития,
мышечная слабость ослабление мышечного
аппарата сфинктеров – императивные
позывы на мочеиспускание, ночной анурез
и т.д.
Диагностика
железодефицитной
анемии
Общий
анализ крови
– снижение НВ, количества эритроцитов,
гипохромия, анизоцито-, пойкилоцитоз,
микроцитоз.
Биохимический
анализ крови
Уменьшение
содержания железа в сыворотке крови
Увеличение
общей железосвязывающей способности
сыворотки крови
Уменьшение
содержания ферритина и трансферина
Лечение
железодефицитной анемии: выявление
и устранение причины развития ЖДА;коррекция
дефицита железа, путем назначения
железосодержащих препаратов для
внутреннего употребления.
Принципы лечения
препаратами железа:
Пищевое железо
не корригирует дефицит железа.Предпочтение
препаратам с содержанием двухвалентного
железа.Избегать прием
пищевых веществ, которые уменьшают
всасывание железа (препараты кальция,
творог, молоко, танин в чае).Нецелесообразно
одновременное назначение витаминов
группы В и фолиевой кислоты, если нет
сочетанной анемии.Не рекомендуют
назначать с едой, антацидами.Лечение в течение
12 месяцев после нормализации содержания
Нв в поддерживающих дозах для пополнения
запасов железа;Парентерально
препараты железа назначают только при
нарушении всасывания при патологии
кишечника, обострении язвенной болезни,
непереносимости препаратов железа
внутрь, необходимости быстрого насыщения
организма железом.
Мегалобластные
анемии
(обусловленные
дефицитом витамина В12 и фолиевой кислоты)
В12-
(фолиево)-дефицитные анемии — группа
анемий, при которых наблюдается нарушение
синтеза ДНК и РНК, что приводит к нарушению
кроветворения, появлению в костном
мозге мегалобластов, к разрушение
эритрокариоцитов в костном мозге.
Этиология
B12 и фолевой анемий
Дефицит
витамина В12 может развиваться вследствие
нарушения всасывания. Это связано со
снижением секреции внутреннего фактора
Кастла (больные после резекции желудка,
гастрит типа А).
Поражением
тонкой кишки ( целиакия, синдром «слепой
петли», множественный дивертикулез,
тонкой кишки).
С
конкурентным поглощением большого
количества витамина В12 в кишечнике
(дифиллоботриоз).
Иногда,
но не часто может встречаться экзогенный
дефицит витамина В12 (дефицит витамина
в продуктах питания или длительная
термическая обработка продуктов).
Причины
развития фолиеводефицитной анемии чаще
связаны с приемом антогонистов фолиевой
кислоты (метотрксат, ацикловир,
триамтерен), с хроническим алкоголизмом,
недостатком питания, заболеваниями
тонкой кишки.
Патогенез
Дефицит
витамина B12
приводит к недостатку кофермента
метилкоболамина, это в свою очередь
влияет на синтез ДНК, нарушается гемопоэз,
происходит атрофия слизистых оболочек
ЖКТ. При данной анемии снижается
активность кофермента дезоксиаденозилкоболамина,
что ведет к нарушению обмена жирных
кислот, накоплению метилмалоната и
пропионата, это обуславливает поражение
нервной системы и развитию функулярного
миелоза.
Дефицит
фолевой кислоты приводит к неэффективности
кроветворения с укороченной
продолжительностью жизни не только
эритроцитов, но и других ядросодержащих
клеток (гемолиз и цитолиз гранулоцитов,
тромбоцитов), снижению количества
эритроцитов и в меньшей степени
гемоглобина, лейкопении, нейтропении,
тромбоцитопении, а также к изменениям
работы некоторых органов и систем
организма.
Клиника
B12 и фолиево- дефицитной анемии
При
B12 и
фолиево-дефицитной анемии происходит
поражение
нервной
системы,
развивается фуникулярный миелоз
(демиелизация нервных окончаний) —
появляются парастезии, нарушается
чувствительность конечностей, появляется
спастический спинальный паралич.
Изменения
в ЖКТ
проявляются
в виде
диспепсического
синдрома (поносы вздутие урчание тошнота
снижение аппетита),
поражаются
слизистые оболочки — чувство жжения
языка, слизистой оболочки рта и прямой
кишки, «лакированный» с участками
воспаления язык – глоссит Хантера,
происходит потеря
вкусовых ощущений
Нарушения
психики –
галлюцинации депрессивный синдром,
шаткая походка, нарушение тактильной
и температурной чувствительности,
Изменения
со стороны кожи
– бледные кожные покровы с лимонно-желтым
оттенком (умеренная анемия), субэктеричность
склер
Возможна
умеренная гепатоспленомегалия
–
увеличение печени и
селезенки
Диагностика
B12-дефицитной
анемии
Анализ
крови:
снижение количества гемоглобина и
эритроцитов, макроцитарная, гиперхромная
анемия, выявляется базофильная пунктация
эритроцитов, которая больше характерна
для В12 анемии (тельца Жолли, кольца
Кебота);
Костный
мозг:
эритроидная гиперплазия с характерными
мегалобластным типом кроветворения в
костном мозге («синий костный мозг»);
Лечение
Важным
в лечении данных анемий являетсяустранение
этиологического фактора и лечебное
питание:
достаточное количество мяса, печени,
молока, сыра, яиц.
Лечение
B12-дефицитной
анемии:
Препараты
вит. В12
для парентерального введения
цианкобаламин,
гидроксикобаламин
Курсовое лечение:
400-500 мкг/сут. в/м в течение первых двух
недель; затем 400-500 мкг через 1-2 дня до
нормализации показателей красной крови.
При наличии
признаков фуникулярного миелоза –
курсовое лечение по 1000 мкг/сут. до
исчезновения всех неврологических
симптомов.
Лечение
фолево-дефицитной
анемии
Фолевую
кислоту назначают в дозе 3-5 мг/день до
достижения клинической ремиссии.
Беременным назначают в профилактической
дозе 1 мг/день. Показателем эффективности
является ретикулоцитарный криз на 6-7
сутки от начала лечения и наличие
нормобластного типа кроветворения, с
постепенным наступление полной
клинико-гемматологической ремиссии.
ГЕМОЛИТИЧЕСКИЕ
АНЕМИИ
Гемолитические
анемии –
группа анемий, которая характеризуется
уменьшением средней продолжительности
жизни эритроцитов, что обусловлено
усиленным их разрушением и накоплением
в крови продуктов распада эритроцитов
– билирубина и появлением гемосидерина
в моче.
Этиология
гемолитических анемий –
Выделяют
приобретенные и наследственно
обусловленные гемолитические анемии.
Приобретенные
анемии
могут быть связаны с механическим
разрушением эритроцитов, с дефицитом
витамина Е,действием
антител,обусловленные
разрушением эритроцитов паразитами
(малярия, токсоплазмоз).
Наследственные
гемолитические анемии
могут быть связаны с
нарушением структуры мембраны эритроцитов;
обусловленны нарушением активности
ферментов эритроцитов,
нарушением структуры или синтеза
гемоглобина.
Патогенез
Длительность
жизни эритроцитов в норме составляет
100-120 дней. Важно сказать, что анемия
развивается в том случае, если
компенсаторные возможности эритропоэза
отстают от скорости разрушения
эритроцитов.
При
гемолитической анемии длительность
жизни эритроцитов может сокращаться
до 12 дней. При этом повышается активность
свободного билирубина, который обладает
токсическим воздействием на ткани
организма и гемосидерина, который может
откладываться во внутренних органах и
приводить к гемосидерозу. При этом
увеличивается количество уробилина с
мочой, стеркобилина с калом, При
гемолитической анемии часто развивается
склонность к образованию камней в
желчном пузыре из-за повышенного
содержания билирубина в желче.
Клиника
Для
гемолиза характерна триада:
желтуха, спленомегалия, анемия разной
степени тяжести. Выраженность
желтухи зависит от степени разрушения
эритроцитов с одной стороны и от
функциональной способности печени
связывать билирубин т.к. желтуха
появляется на фоне анемии, то кожа
становиться лимонно-желтой. При
гемолитической анемии может развиваться
желчекаменная болезнь и как осложнения
холестатический гепатит и цирроз печени.
Появление
гемолитической анемии приводит к
нарушению физического и умственного
развития.
Наследственные
анемии, в частности, микросфероцитоз,
может проявляется гипопластическими
кризами: падением уровня гемоглобина,
повышением концентрации непрямого
билирубина, ретикулоцитозом, усилением
желтухи, повышением температуры, болями
в животе, слабостью.
Диагностика
анемии
Анализ
крови:
снижение
НВ, количества эритроцитов, нормохромная
анемия, ретикулоцитоз, количество
лейкоцитов и тромбоцитов не меняется,
только после криза возможен лейкоцитоз.
Осмотическая резистентность эритроцитов
может быть снижена (наследственный
овалоцитоз).
Для
исключения наследственных гемолитических
анемий необходимо выявлять морфологию
эритроцитов (сфероцитоз,
овалоцитоз,
эллиптоцитоз).
Проведение
генетического анализа — все анемии
связанные с дефектом белковых мембран
наследуются за доминантным типом, а
ферментопатии за рецесивным типом.
Биохимический
анализ
крови: повышенное количество билирубина
за счет непрямого, повышение количества
железа.
В
моче выявляется уробилин, в кале
стеркобилин.
При
аутоиммунных гемолитических анемиях
выявляется положительная проба Кумбса,
выявляются антитела к эритроцитам.
Костный
мозг:
гиперплазия красного костного мозга
за счет эритрокариоцитов.
Лечение
Лечение
гемолитической анемии, зависит от
патогенеза заболевания.
При
аутоиммунных гемолитических анемиях
назначаетя патогенетическая терапия
— кортикостерииды, если они неэффективны
больные могут получать цитостатические
препараты
такие
как циклофосфан
или азатиоприн.
Лечение
обычно
проводится в комбинации с преднизолоном.
Лицам с
дефицитом Г-6-ФДГ необходимо запретить
прием «оксидантных» лекарственных
препаратов (сульфаниламиды,
противомалярийные препараты, сульфоны,
аналгетики, химические вещества,
нитрофураны).
Трансфузии
эритроцитарной массы назначаются только
в случаях тяжелого дефицита
фермента.
Необходимы мероприятия, направленные
на улучшение диуреза при гемоглобинурии.
Спленэктомия проводится только по
строгим показаниям:
• тяжелое течение
заболевания с функциональными нарушениями;
• если необходима
холецистэктомия, одновременно должна
быть проведена спленэктомия.
Вследствие
повышенного разрушения эритроцитов в
терапию необходимо включать
фолиевую
кислоту.
(ГИПО)
-АПЛАСТИЧЕСКАЯ АНЕМИЯ
Апластическая
анемия характеризуется глубоким
угнетением костномозгового кроветворения
и панцитопенией, обусловливающей
основные проявления заболевания.
По этиологическому
фактору выделяют:
Приобретенные
формы (воздействие
химических и физических агентов,
лекарственных препаратов, токсинов,
вирусов).
Идиопатические
формы.
Наследственные
формы (анемия
Фанкони, наследственный дефицит гормонов
поджелудочной железы, наследственный
дискератоз)
Клиника
гипо-апластической анемии
Для
апластической анемии с поражением трех
листков кроветворения характерными
являетюся такие синдромы как анемический,
гемморагический, иммунодефицита и
лихорадочный.
Гемморагический
синдром за счет угнетения тромбоцитарного
листка, проявляется в виде высыпаний
по петихиально – пятнистому типу,
гемморагий по всему телу, кровотечений
носовых, маточных, желудочно кишечных
и других. Синдром иммунодефицита
проявляется за счет угнетения активности
лейкоцитов и снижения иммунной
резистентности организма. Это проявляется
частыми простудными заболеваниями:
ангины, бронхиты, пневмонии. Для
лихорадочного синдрома характерно
повышение температуры до субфебрильных
цифр, слабость, ознобы.
Диагностика
гипо-апластической анемии
Общий
анализ крови
— анемия нормохромная умеренный анизоцитоз
и пойкилоцитоз, количество ретикулоцитов
снижено, лейкоцитопения, тромбопения
Биохимический
анализ крови:
концентрация сывороточного железа
повышена. Определение почечного
комплекса, билирубина и его фракций
(гемолитические и анемии, связанные с
нарушением регуляции эритропоэза).
Иммунные нарушения: ауто-антитела к
клеткам крови и костного мозга, ауто- и
аллосенсибилизация у 35% больных, угнетение
фагоцитарной
реакции нейтрофилов.
Костный
мозг: угнетение
ростков кроветворения, гипоклеточность
с относительным лимфоцитозом при
классическом типе приобретенной
апластической анемии.
Лечение:
Режим:
отмена всех лекарственных средств, к
которым имеется индивидуальная повышенная
чувствительность.
Медикаментозное
лечение:
1. Гемостатическая
терапия: кортикостероиды — преднизолон
60-80 мг, дексаметазон, полькорталон.
2. Анаболические
стероидные средства (особенно после
спленэктомии): ретаболил, нероболил,
метандр