Полипозного риносинусита у больных с бронхиальной астмой
Комментарии
Д. м. н., проф. А.Ю. Овчинников, к. м. н И.Г. Колбанова
ФПДО МГМСУ, кафедра оториноларингологии, ГКБ им. С.П. Боткина
На сегодняшний день взаимосвязь между заболеваниями верхних и нижних дыхательных путей можно считать доказанной. Особенное беспокойство вызывает тот факт, что такие болезни, как полипозный и полипозно-гнойный риносинусит при переходе их в хроническую форму не только являются фактором риска развития бронхиальной астмы (БА) сами по себе, но даже лечение этих заболеваний может негативно повлиять на течение уже имеющейся у пациента астмы. Ситуация осложняется непереносимостью антибиотиков, нередко встречающейся у пациентов с БА. Все это ставит перед лечащим врачом непростую задачу подбора эффективной и безопасной терапии.
Болезни верхних и нижних дыхательных путей
Полость носа и околоносовые пазухи представляют собой высокоорганизованную структуру с тонкими и сложными механизмами регуляции, обладающую множеством специфических функций. Подобная морфофункцио-нальная сложность обеспечивает создание первого барьера на пути проникновения инфекции. Очевидна тонкая функциональная связь полости носа и околоносовых пазух с другими органами и системами, в первую очередь с бронхолегочной [1, 2, 3].
Медицинская статистика последних лет убедительно свидетельствует о росте числа заболеваний носа и околоносовых пазух, причем увеличиваются как общая заболеваемость риносинуситами, так и удельный вес этой патологии в структуре ЛОР-болезней. Наличие тесной анатомической и физиологической взаимосвязи между верхними и нижними дыхательными путями приводит к тому, что рост числа риноси-нуситов происходит синхронно с увеличением заболеваемости бронхитами и бронхиальной астмой, и эту тенденцию пока не удается изменить, несмотря на совместные усилия ведущих специалистов всего мира [4].
Доказано, что хронические воспалительные процессы в верхних и нижних дыхательных путей имеют сходную этиологию [5, 6]. Это обусловлено тем, что слизистая оболочка воздухоносных путей от носовой полости до средних бронхов имеет сходное анатомическое и гистологическое строение.
Полипозный риносинусит (ПРС) является одним из наиболее распространенных хронических заболеваний полости носа и околоносовых пазух. Безусловно, ПРС не является угрожающим жизни заболеванием, но он существенно ухудшает качество жизни пациентов и играет определенную роль в патогенезе БА. [7, 8]. Именно поэтому ПРС рассматривается многими исследователями как фактор риска развития такого серьезного, тяжелого и иногда даже смертельного заболевания, как астма, распространенность которой, согласно статистике, растет повсеместно.
Адекватное и эффективное лечение ПРС часто приводит к улучшению течения БА при их сочетанном течении.
Успех лечения больных ПРС во многом обусловлен выраженностью патологического процесса в полости носа.
Лечение таких больных всегда должно оставаться комплексным, включающим применение различных групп лекарственных препаратов (топические глюкокортикостероиды, анти-лейкотриеновые препараты, блока-торы Н1-гистаминовых рецепторов последних поколений и др.) и проведение хирургического лечения. Диапазон хирургических методов лечения ПРС очень широк — от традиционной полипотомии носа до полисинусотомии.
Однако хирургическое лечение ПРС у больных БА является мощным провоцирующим фактором, в результате которого могут развиться нежелательные явления со стороны бронхолегочной системы: от обострения БА до присоединения пневмоний. Подобные осложнения возникают благодаря существованию ринобронхиального рефлекса [9, 10]. Это обстоятельство заставляет искать оптимальные методы предоперационного и послеоперационного лечения, разрабатывать методы щадящей хирургии для предотвращения ухудшения со стороны бронхолегоч-ной системы и, по возможности, сокращать число оперативных вмешательств за счет увеличения эффективности консервативного лечения.
Инфекционный процесс и развитие гнойного риносинусита
Известно, что одним из факторов, способствующих развитию БА либо ее обострению, служит бактериальная инфекция. Получены убедительные доказательства связи между характером хронической бактериальной инфекции дыхательных путей и тяжестью БА и числом ее обострений [11-14]. Это, безусловно, необходимо учитывать при лечении больных с сочетанной патологией верхних и нижних отделов дыхательного тракта. Сочетание ПРС с БА в перспективе очень часто приводит к более тяжелым поражениям дыхательных путей, особенно при присоединении инфекционного процесса [15]. Инфекционно-воспалительный процесс, возникший на неблагоприятном аллергическом фоне, приводит к формированию полипозно-гнойного рино-синусита (ПГРС) — патологического состояния верхних дыхательных путей, способного в еще большей степени вызывать и поддерживать легочные заболевания и оказывать негативное влияние на бронхолегочную систему [16]. Последнее может быть объяснено следующим образом: во-первых, гнойный воспалительный процесс, идущий в пазухах, оказывает токсическое воздействие на другие структуры организма; во-вторых, отсутствие нормального носового дыхания отрицательно сказывается на состоянии бронхолегочной системы; в-третьих, под влиянием гнойного воспаления происходит снижение иммунитета и развивается дополнительная сенсибилизация организма. Подтверждена высокая распространенность полипозно-гнойных риносинуситов у больных инфекционно-зависимой бронхиальной астмой, что указывает на агрессивное влияние инфекционного агента на состояние как верхнего, так и нижнего отдела дыхательного тракта. Существуют непрямые доказательства того, что инфекционный риносинусит утяжеляет течение БА, т. к. его лечение антибактериальными препаратами облегчает течение БА.
По-видимому, одной из причин низкой эффективности лечения и частого рецидивирования полипозно-гнойного процесса или его латентного течения, является отсутствие сведений об особенностях микробного пейзажа конкретного больного. Подобная ситуация, в свою очередь, может привести к обострению БА или стать причиной развития осложнений.
Поэтому непосредственными результатами разрабатываемых схем ведения больных с полипозно-гнойным риносинуситом в сочетании с бронхиальной астмой должно стать создание комплексных методов обследования и лечения, учитывающих и распространенность полипозного процесса, и его длительность, и характер возбудителя и степень тяжести бронхиальной астмы.
Таким образом, перед современной оториноларингологией стоит задача создания комплексных эффективных методов обследования, консервативного и хирургического лечения с адекватной дооперационной подготовкой и послеоперационным ведением больных с сочетанной патологией верхнего и нижнего отделов дыхательного тракта для предупреждения обострения БА и увеличения сроков ремиссии полипоз-ного и полипозно-гнойного процессов.
При ПГРС воспаление слизистой оболочки носа и околоносовых пазух, практически всегда вызвано застоем секрета, нарушением аэрации пазух и, как следствие, колонизацией слизистой и пазух инфекционными агентами.
Для возникновения инфекционного процесса ведущее значение, наряду с вирулентными свойствами возбудителя, имеет состояние макроорганизма. Оно определяется сложным комплексом факторов и механизмов, тесно связанных между собой, и характеризуется как чувствительность и резистентность к инфекции. Не менее важное значение в развитии синусита имеют аномалии строения внутриносовых структур и решетчатого лабиринта. Особенно большое влияние они оказывают на хронизацию патологического процесса. Нарушение нормальных анатомических взаимоотношений в полости носа изменяет аэродинамику, способствуя попаданию неочищенного воздуха в околоносовые пазухи и повышая риск развития воспаления. Полипы, отечная слизистая оболочка, искривленная перегородка носа, шипы и гребни перегородки носа, расположенные на уровне среднего носового хода, и тому подобные анатомические аномалии нарушают проходимость естественных отверстий околоносовых пазух и приводят к стагнации секрета и снижению парциального давления кислорода в околоносовых пазухах.
Тактика лечения ПГРС до настоящего времени была жестко предопределена и предусматривала обязательное хирургическое лечение. Однако любое оперативное вмешательство в полости носа и ОНП у больных БА является мощным провоцирующим фактором благодаря существованию ринобронхиального рефлекса, результат которого — ухудшение состояния бронхолегочной системы: от обострений БА до присоединения пневмоний. Кроме того, логичнее и безопаснее проводить оперативное вмешательство в период ремиссии воспалительного процесса при ПГРС.
При хронических синуситах микробная флора отличается большим разнообразием, причем микробный пейзаж варьирует в зависимости от тяжести и продолжительности заболевания, по мере развития болезни спектр возбудителей несколько смещается в сторону анаэробной флоры. Одним из наиболее значимых факторов возникновения инфекционного процесса является неблагоприятный аллергический фон, частые полипотомии носа, нерациональное назначение антибактериальных препаратов в виде как местной, так и общей терапии. Самой рациональной позицией антибактериальной терапии остается учет всех наиболее вероятных возбудителей или определение возбудителя в каждом конкретном случае синусита.
Непереносимость антибиотиков и антибактериальная терапия
Однако на практике все чаще возникают ситуации, когда назначение, точнее, выбор метода лечения синусита осложняется непереносимостью антибиотиков. И таких пациентов становится все больше. Это, с одной стороны, связано с увеличением аллергической нагрузки на организм, с другой стороны — с неаллергическими факторами, которые потенцируют действие аллергенов, например большая загазованность крупных промышленных городов, курение, все более широкое применение различных химических иммунотропных веществ. Все эти факторы усиливают аллергический ответ на этапе сенсибилизации, изменяя структуру заболеваемости инфекционными/неинфекционными болезнями. Также в последнее время изменилась иммунологическая реактивность населения, появились так называемые транзиторные иммунодефицитные состояния, на фоне которых легко развиваются острые и хронические инфекционно-воспалительные заболевания. Данные обстоятельства и стали стимулом к поиску нового решения описанной выше проблемы.
Карбоцистеин — единственный из мукоактивных препаратов, который обладает одновременно мукорегулирующим и муколитическим эффектом. Препарат нормализует количественное соотношение кислых и нейтральных муцинов бронхиального секрета, восстанавливая вязкость и эластичность слизи. Данный эффект достигается за счет активации фермента сиаловой трансферазы, вырабатываемого бокаловидными железами слизистой оболочки.
На фоне применения препарата восстанавливается секреция IgA, улучшается мукоцилиарный транспорт, происходит регенерация структур слизистой оболочки. Действие препарата распространяется на слизистую оболочку всех отделов дыхательного тракта.
Одновременное назначение карбо-цистеина и антибиотиков потенцирует лечебную эффективность последних при воспалительных процессах в области как верхнего, так и нижнего отделов дыхательного тракта. Кроме того, карбоцистеин взаимно повышает эффективность глюкокортикостероиднойтерапии, усиливает бронхолитический эффект теофиллина. Активность карбоцистеина ослабляют противокашлевые и атропиноподобные средства.
Исследование эффективности карбоцистеина
Под нашим наблюдением находились 32 пациента, страдающих ПГРС необ-турирующей степени и БА, с длительностью заболевания не превышающей 10 лет и непереносимостью некоторых групп антибактериальных препаратов. Дизайн исследования предусматривал осмотр врачом оториноларингологом. Выраженность жалоб регистрировалась по 5-балльной визуально-аналоговой шкале (ВАШ). Всем больным проводилось: компьютерная томография носа и околоносовых пазух, стандартное клиническое обследование, включающее сбор жалоб, анамнеза жизни и заболевания, физикальный осмотр, лабораторная диагностика (клинический и биохимический анализ крови), осмотр врача пульмонолога, исследование функции внешнего дыхания (ФВД) на 1-й и 28-й день.
В связи с непереносимостью некоторых групп антибактериальных препаратов, наблюдавшейся у пациентов, больным этой группы проводилось лечение, включающее мометазона фуроат (Назонекс) по 200 мкг 2 раза в сутки (суточная доза 400 мг) и карбоци-стеин (Флюдитек) по 1 столовой ложке 3 раза в день. Курс комплексной терапии составил 10 дней. Монотерапия мометазона фуроатом продолжалась до 28-го дня. Всем больным проводилась базисная терапия по поводу БА.
Итоговая оценка результата лечения проводилась по следующим параметрам:
• «Положительный» — значительное уменьшение всех симптомов заболевания (улучшение самочувствия, регрессия симптоматики), положительная динамика данных инструментальных исследований;
• «Удовлетворительный» — незначительное улучшение общего состояния и умеренно положительная динамика показателей инструментальных исследований;
• «Отсутствие эффекта» — отсутствие динамики всех симптомов заболевания, показателей инструментальных исследований, а также, при невозможности оценить эффект, в случаях прекращения лечения;
• «Ухудшение» — утяжеление общего состояния и отрицательная динамика показателей инструментальных исследований, потребность в дополнительном лечении.
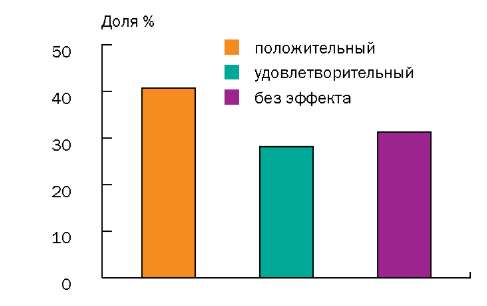
По окончании лечения положительный результат был отмечен у 13 (40,62%) человек из 32, удовлетворительный — у 9 (28,12%) человек, у 10 (31,25%) больных эффект отсутствовал, ухудшения состояния не отмечено ни у одного пациента (рис.).
Результаты риноманометрии показали, что в данной группе среднее значение суммарного объемного потока (СОП) до лечения (420 ± 144,1 см3/с) было достоверно меньше (р < 0,05), чем среднее значения СОП после лечения (523 ± 228,3 см3/с).
У 10 (31,2%) пациентов отмечено улучшение течения БА, выражавшееся в исчезновении приступов удушья, кашля, одышки и других признаков бронхиальной обструкции, а также в достоверном повышении показателей ФВД (табл.).
Таблица. Изменение средних значений показателей ФВД до и после комплексного лечения (Флюдитек, ГКС)
ОФВ1 (%) | МОС 25 (%) | МОС 50 (%) | МОС 75 (%) | ||||
До лечения | После лечения | До лечения | После лечения | До лечения | После лечения | До лечения | После лечения |
65 ± 2,24 | 76 ± 2,21 | 44 ± 2,17 | 72 ± 2,15 | 47 ± 2,27 | 60 ± 2,23 | 63 ± 4,23 | 73 ± 4,32 |
р < 0,01 | р < 0,05 | р < 0,01 | р = 0,055 (тенденция) | ||||
На основании вышеизложенного мы пришли к выводу, что в терапии полипозно-гнойного риносинусита для достижения ремиссии воспалительного процесса, необходимой для подготовки к хирургическому лечению, у больных БА при непереносимости антибактериальных препаратов целесообразно использовать комплексное лечение, включающее топические глюкокортикостероиды и карбоцистеин (Флюдитек).
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Изобретение относится к медицине, а именно к пульмонологии и отоларингологии, может быть использовано для лечения полипозного риносинусита у больных бронхиальной астмой. Воздействуют в течение 15 дней ежедневно низкоинтенсивным лазерным излучением с длиной волны 630 нм и мощностью 50 мВт/см2. Наружно-накожно облучают: переносицу носа 1 минут, в центре спинки носа 20 секунд, в точке fossa canina с обеих сторон по 1 минуте. Интраназально — световод вводят поочередно в оба носовых хода на глубину 1 см, экспозиция облучения — 15 секунд. Облучение крови производят транскутанным надвенным способом, в области локтевой вены, экспозиция — 15 минут. Одновременно с курсом лазеротерапии больной получает интраназально комбинированный ингалятор серетид, который содержит салметерол и флутиказона пропионат в дозе 25/125 мкг, во время вдоха, в каждый носовой ход, два раза в день. Способ комплексного лечения позволяет повысить эффективность лечения, добиться более быстрого регресса полипозной ткани. 1 ил., 1 табл.
Изобретение относится к медицине, а именно к пульмонологии и отоларингологии.
В основе патогенеза полипозного риносинусита лежит воспалительная реакция, определенную роль в которой играют выделение гистамина и других медиаторов воспаления из тучных клеток, эозинофильная инфильтрация и апоптоз эозинофилов в слизистой оболочке, экссудация и отек собственной пластинки слизистой оболочки, нарушение мукоцилиарного транспорта и пролиферация фибробластов (Лопатин А.С. Медикаментозное и хирургическое лечение полипозного риносинусита. Лечение синусита, ассоциированного с бронхиальной астмой. — Рос. ринология. — 1999, №1. — С.65-68). Эти компоненты естественно раздражают β2-адренорецепторы слизистой оболочки носа, приводя к ее пролиферации. В настоящее время известен способ лечения полипозного риносинусита у больных бронхиальной астмой с помощью новых форм интраназальных кортикостероидных препаратов, в частности ингакортом, с применением лазерного излучения (Пат. 2229317 Российская Федерация, МПК А61N 5/067; А61К 37/24. Способ лечения полипозного риносинусита у больных с бронхиальной астмой. / Самсонов В.П., Луценко М.Т., Заварзина Е.В.; патентообладатель ГУ ДНЦ ФПД СО РАМН. — №2002121207; заявлен 05.08.2002; опубл. 27.05.2004, Бюл. №15). Если рассмотреть фармакодинамику кортикостероидов применительно приведенной схеме патогенеза полипозного риносинусита, мы увидим, что эти препараты воздействуют на большинство патогенетических моментов.
Известный способ обладает существенным недостатком, а именно при применении интраназально ингакорта отсутствовал препарат, воздействующий на β2-адренорецепторы слизистой оболочки носа, а в комплексном лечении не давало возможности в полной мере оптимизировать контроль и результаты лечения бронхиальной астмы у тех больных, которым использование одного глюкокортикостероида было не достаточно эффективно. Таким пациентам назначались дополнительно, ингаляционно, через полость рта, агонисты β2-адренорецепторов, что было более эффективно в отношении контроля симптомов астмы и ее позитивных результатов лечения, чем просто наращивание дозы ингаляционного кортикостероида.
Цель предложенного способа — оптимизировать контроль и результаты лечения полипозного риносинусита и бронхиальной астмы при комплексном консервативном методе лечения обоих заболеваний.
Поставленная цель достигается тем, что лечение полипов носа, сочетающихся с бронхиальной астмой, проводится путем применения низкоинтенсивной лазерной терапии, через кровь и через нос, с интраназальным ингаляционным лечением комбинированным лекарственным препаратом — серетидом, содержащим глюкокортикостероид — флутиказона пропионат и агонист β2-адренорецепторов — салметерол.
Способ осуществляется следующим образом. Низкоинтенсивное лазерное облучение производится гелий-неоновым лазером (установка ЛА-2).
Длина волны излучения — 630 нм, мощность излучения с дистального конца световода — 50 мВт/см2.
Облучение носа осуществляется: 1) наружно-накожное: переносица носа 1 минута, в центре спинки носа 20 секунд, в точке fossa canina с обеих сторон по 1 минуте; 2) интраназальное — световод вводится поочередно в оба носовых хода на глубину 1 см, экспозиция облучения — 15 секунд. Облучение крови производится транскутанным надвенным способом в области локтевой вены, экспозиция — 15 минут. Курс лечения — 15 сеансов. Дополнительно 2 раза в сутки больной интраназально ингалирует комбинированный препарат — серетид, в разовой дозе 25/125 мкг, во время вдоха в каждый носовой ход. Нами впервые применен агонист β2-адренорецепторов — салметерол, входящий в состав комбинированного препарата серетид по новому назначению, а именно интранозально. Ранее этот препарат применяли для ингаляции через ротовую полость для лечения бронхиальной астмы. При изучении фармакодинамики лекарственных средств, относящихся к группе селективных длительно действующих (до 12 часов) агонистов β2-адренорецепторов, а в частности салметерола, было установлено, что данный препарат препятствует поступлению ионов кальция в клетки, ингибирует активированное аллергеном высвобождение медиаторов аллергии (гистамина, лейкотриенов и др.) из тучных клеток, обладает некоторыми противовоспалительными эффектами, в частности уменьшая проницаемость сосудов, увеличивает мукоцилиарный транспорт, даже однократное введение салметерола ослабляет гиперреактивность дыхательных путей (Рациональная фармакотерапия заболеваний органов дыхания, руководство для практикующих врачей./Под ред. А.Г.Чучалина. — М., Изд. «Литтерра». — 2004. — С.34-41). Вышеописанные фармакологические эффекты данной группы лекарственных средств позволяют воздействовать на многие моменты в патогенезе полипозных риносинуситов. Лекарственное взаимодействие агонистов β2-адренорецепторов с глюкокортикостероидами является синергичным: повышается чувствительность β2-адренорецепторов, что позволяет улучшить контроль за течением бронхиальной астмы и повышает качество жизни больных.
Вышеприведенное лечение проводилось на фоне традиционной схемы лечения бронхиальной астмы: назначением базисного препарата, бронходилататора, разжижающих и отхаркивающих мокроту лекарственных средств.
Предложенным методом пролечено 32 пациента с полипозным риносинуситом, ассоциированным с бронхиальной астмой инфекционно-аллергической формы средней степени тяжести.
Сравнительная оценка результатов лечения больных с полипозным риносинуситом, ассоциированным с бронхиальной астмой, низкоинтенсивным лазером и интраназальными ингаляциями серетида и ингакорта.
| Клинико-лабораторные и инструментальные данные | День лечения | |||
| Первый | Пятнадцатый | |||
| Серетид | Ингакорт | Серетид | Ингакорт | |
| 1. Носовое дыхание | ||||
| — отсутствует | у 14 больных | у 12 больных | ||
| — частичное | у 18 больных | у 18 больных | у 2 больных | у 3 больных |
| 2. Визуальный осмотр полости носа | У всех больных слизистая оболочка, носовые раковины цианотичные, отечные, плохо сокращаются при смазывании адреналином. В просвете носовых ходов видны полипы серого цвета, блестящие, подвижные, которые заполняли средний и общий носовой ходы. | У всех больных слизистая оболочка, носовые раковины цианотичные, отечные, плохо сокращаются при смазывании адреналином. В просвете носовых ходов видны полипы серого цвета, блестящие, подвижные, которые заполняли средний и общий носовой ходы. | У всех больных уменьшился цианоз слизистой оболочки носовых раковин. Отека носовых раковин нет. В просвете носовых ходов у 30 (93,8%) больных полипозная ткань редуцирована, у 2 (6,2%) пациентов сохранялись единичные полипы в области решетчатого лабиринта, уменьшенные в размерах по сравнению с исходным состоянием, не мешающие свободному носовому дыханию. | У всех больных цианоз слизистой оболочки носовых раковин уменьшился. Отека носовых раковин нет. В просвете носовых ходов у 27 (90%) больных полипозная ткань исчезла, у 3 (10%) больных в области решетчатого лабиринта сохранялись единичные полипы, уменьшенные в размерах, не мешающие носовому дыханию. |
| 3. Лейкоциты периферической крови (×109/л) | 6,4±0,5 | 5,9±0,7 | 5,8±0,2 | 5,6±0,4 |
| 4. Молекулы средней массы (ед. опт. плот.) | 0,382±0,081 | 0,357±0,081 | 0,321±0,042 | 0,336±0,052 |
| 5. Спирографические показатели бронхиальной проходимости | ||||
| ОФВ1 | 51±1 | 52±1,* | 71±2 | 64±2,** |
| ЖЕЛ | 96±1 | 92±2,* | 110±1 | 101±1,*** |
| МОС 25 | 24±1 | 26±1,* | 39±2 | 31±2,*** |
| МОС 50 | 31±1 | 33±1,* | 52±2 | 45±2,** |
| МОС 75 | 42±1 | 41±1,* | 59±2 | 53±3,* |
| 6. Приступы удушья | ||||
| больше 5 раз в сутки | у 20 больных | у 17 больных | ||
| меньше 5 раз в сутки | у 12 больных | у 13 больных | у 4 больных | у 5 больных |
| 7. Гистологический анализ полипозной ткани носа в месте биопсии. | Слизистая оболочка гиперплазирована и полипозно изменена. Отмечается десквамация и плоскоклеточная метаплазия эпителия. В строме есть явления отека, кровеносные сосуды расширены. | Слизистая оболочка гиперплазирована и поли- позно изменена. Отмечается десквамация и плоскоклеточная метаплазия эпителия. В строме есть явления отека, кровеносные сосуды расширены. | У всех больных в эпителии слизистой оболочки носа отмечается тенденция к восстановлению ее нормального плана строения, в строме отмечается значительное уменьшение отека. | У всех больных в эпителии слизистой оболочки носа отмечается тенденция к восстановлению ее нормального плана строения, в строме отмечается значительное уменьшение отека. |
| Примечание: * — р>0,05; ** — р<0,01; *** — р<0,001 по сравнению с серетидом. |
В качестве контроля была пролечена группа из 30 больных бронхиальной астмой инфекционно-аллергического генеза средней степени тяжести, сочетающейся с полипозным риносинуситом интраназальными ингаляциями ингакорта в разовой дозе 250 мкг, во время вдоха в каждый носовой ход 2 раза в сутки и вышеописанной лазерной терапии.
Возраст пациентов был от 27 до 62 лет, все они находились на стационарном лечении в пульмонологическом отделении. Всем больным проводилось тщательное обследование до и после курса лечения: анализ клинических, лабораторных, функционально-диагностических данных, а также диагностическая биопсия полипозной ткани с последующим гистологическим исследованием материала.
Сравнительные результаты лечения представлены в таблице. Из таблицы видно, что после проведенного лечения серетидом полипозная ткань редуцировалась у 30 (93,8%) больных, у 2 (6,2%) пациентов сохранились единичные уменьшившиеся в размерах полипы в задне-верхних отделах решетчатого лабиринта, не мешающие свободному носовому дыханию, в то время как в группе больных, получающих интраназально ингакорт, полипозная ткань редуцировалась у 27 (90%) больных, сохранились единичные уменьшенные в размерах и расположенные в задних отделах носовой полости полипы у 3 (10%) пациентов. У всех пациентов, учитывая применение комбинированного кортикостероидного препарата — серетида, который благодаря содержанию в нем, помимо глюкокортикостероида, и селективный, длительно действующий (до 12 часов) агонист β2-адренорецептор, происходило более быстрое купирование приступов удушья бронхиальной астмы и регресс полипозной ткани наступал на 13-14 день от начала курса лечения, чем при применении отдельно кортикостероида (например, ингакорта) и агониста β2-адренорецепторов, при применении которых положительный эффект наблюдался в среднем на 15-16 день. У всех больных, получивших курс облучения гелий-неоновым лазером с параллельным применением интраназально серетида, зарегистрировано улучшение в течении бронхиальной астмы, что подтверждается уменьшением частоты приступов удушья в сутки, достоверным увеличением спирографических показателей бронхиальной проходимости, снижением показателей эндотоксикоза в сравнении с применением интраназально ингакорта,. При гистологических исследованиях биоптатов до и после курса лечения происходил регресс полипозной ткани, вплоть до ее исчезновения в обеих группах (см.чертеж).
Способ комплексного лечения полипозного риносинусита у больных бронхиальной астмой, заключающийся в лечении полипозного риносинусита у больных бронхиальной астмой интраназальным применением глюкокортикостероидного препарата и облучением гелий-неоновым лазером с длиной волны 630 нм и мощностью излучения с дистального конца световода — 50 мВт/см2; наружно-накожно: переносица носа — 1 мин, в центре спинки носа — 20 с, в точке fossa canina с обеих сторон по 1 мин; интраназально — световод вводится поочередно в оба носовых хода на глубину 1 см, экспозиция облучения — 15 с; облучение крови производится транскутанным надвенным способом, в области локтевой вены, экспозиция — 15 мин; курс лечения проводится ежедневно в течение 15 дней, отличающийся тем, что одновременно с курсом лазеротерапии больной получает интраназально ингаляции комбинированного лекарственного препарата серетида, который содержит салметерол (селективный, длительно действующий агонист β2-адренорецепторов) и флутиказона пропионат (глюкокортикостероид) в дозе 25/125 мкг, во время вдоха, в каждый носовой ход, два раза в день.


