Переливание эритроцитарной массы при анемии у детей
Методика переливания эритроцитарной массы у новорожденных детей
Рекомендации по переливанию эритроцитарной массы у пациентов младше 4 мес:
1. Гематокрит менее 20% с маленьким количеством ретикулоцитов и симптомами анемии1.
2. Гематокрит менее 30% у новорожденных:
а. Оксигенотерапия более 35%.
б. Оксигенотерапия через носовые катетеры.
в. Постоянное положительное давление в дыхательных путях и/или периодическая принудительная ИВЛ со средним давлением в дыхательных путях менее 6 см вод.ст.
г. Выраженное апноэ или брадикардия2.
д. Выраженная тахикардия или тахипноэ3.
е. Медленная прибавка массы тела4.
3. Гематокрит менее 35% у новорожденных:
а. Оксигенотерапия более 35%.
б. Постоянное положительное давление в дыхательных путях/периодическая принудительная ИВЛ со средним давлением в дыхательных путях более 6 см.вод.ст.
4. Гематокрит меньше 45% у новорожденных:
а. Экстракорпоральная мембранная оксигенация.
б. Врожденный «синий» порок сердца.
* 1 Тахикардия, тахипноэ, плохо питающиеся.
2 Более шести эпизодов в течение 12 ч или два эпизода за 24 ч, требующих вентиляции мешком через маску, в то время как пациент получает терапевтические дозы метилксантинов.
3 ЧСС более 180 в минуту, ЧДД более 80 в минуту в течение 24 ч.
4 Набор менее 10 г/день, наблюдаемый в течение 4 дней, при одновременном получении более 100 ккал/кг в день.
Методика переливания эритроцитарной массы
1. Определение общего количества крови, которую необходимо перелить:
а. Расчет объема крови для трансфузии. Большинству новорожденных переливают 10-15 мл/кг ЭМ, которая увеличивает гемоглобин на 3 г/дл.
б. Расчет требуемого объема ЭМ: [ПОК х (Ht желаемый — Ht наблюдаемый)] х Ht-единицы ЭМ,
где ПОК — предполагаемый объем крови (примерно 80-85 мл/кг массы тела у доношенных новорожденных и 100-120 мл/кг массы тела у недоношенных); Ht — гематокрит.
2. Учитывают объем крови, необходимый для заполнения мертвого пространства трубок, фильтра, механизма насоса (варьирует в зависимости от систем, может достигать 30 мл).
3. Получают препарат крови:
а. В нескольких исследованиях зафиксирована информация о безопасности использования ЭМ, с добавлением антикоагулянта.
б. Не следует хранить ЭМ с добавлением дополнительных растворов для массивных трансфузий, за исключением удаления добавки путем центрифугирования (предполагается риск гиперосмолярности, гипергликемии, гипернатриемии, гиперкалиемии, гиперфосфатемии).
в. У новорожденных, получающих 10-15 мл ЭМ, количество ионов калия, получаемых при переливании, оценивается только в 0,15 ммоль/кг и не предполагает существенного риска для большинства новорожденных.
г. Снижается риск возможных отрицательных эффектов от донорской крови путем деления одной дозы на несколько более мелких для одного ребенка и их использования до истечения срока годности.
4. На этикетки выносится информация о необходимости перекрестных проб.
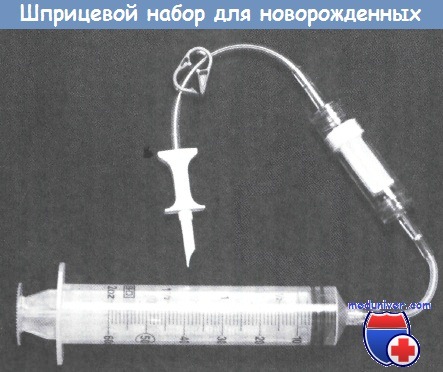
Шприцевый набор для новорожденных с фильтром. (Фотография любезно предоставлена Charter Medical Ltd., Winston-Salem, NC, USA.).
Эта система, при условии использования со стерильной методикой соединения, обеспечивает закрытый способ введения, который поддерживает постепенное опорожнение крови.
Шприц, заполненный компонентом крови (ЭМ, плазмой) должен быть введен пациенту в течение 24 ч, а шприц, заполненный разведенными тромбоцитами, — в течение 4 ч.
5. Подтверждают, что ограничения применены к препаратам крови и помечены на трансфузионной бирке:
а. ЦМВ: проверялось/не проверялось.
б. Облучение: да/нет.
в. Прямой (семейный) донор: да/нет.
г. Антиэритроцитарные антитела отрицательны: да/нет.
д. Серповидноклеточный тест отрицателен: да/нет.
е. Другие ограничения: да/нет.
6. Проверяют соответствие выбранной крови путем сравнения препарата крови, полученной от пациента, и информации на этикетке на пакете с донорским препаратом.
Рекомендуют применение устройства для чтения штрихкода:
а. Информация о группе крови на этикетке и результатами исследования этой крови.
б. Номер пациента в госпитале или истории болезни.
в. Идентификация пациента с помощью браслета на руке или ноге.
г. Группа и Rh-фактор крови у донора и реципиента.
д. Срок годности и срок заготовки.
е. Ограничения, как предписано врачом или указаниями лечебного учреждения.
7. Согревание ЭМ (эритроцитарной массы):
а. Нет необходимости в согревании небольших объемов разведенной ЭМ, особенно если трансфузия будет проведена в течение 2-3 ч.
б. ЭМ масса может быть согрета путем помещения шприца в инкубатор с обогреваемым воздухом на 30 мин перед трансфузией.
в. Нельзя согревать кровь путем воздействия на нее нагревательных ламп или фототерапевтического света, так как это может вызвать гемолиз.
8. Строго соблюдают стерильность во время всей процедуры.
9. Если банком крови предоставлена заранее профильтрованная ЭМ в шприце, присоединяют трубку прямо к нему.
10. Если ЭМ предоставлена в мешке, используют иглу с крупным просветом (18-го размера или более) для забора объема в шприц. Фильтр следует расположить между мешком и шприцем.
11. Заполняют трубку кровью. Освобождают шприц и трубку от пузырьков и монтируют в инфузионное устройство.

Использование стерильного соединительного приспособления:
а — единица эритроцитов для переливания у взрослых показана вместе с педиатрическим транспортным пакетом.
Его можно присоединить путем прокола пакета, из-за чего ЭМ следует использовать в течение 24 ч; или транспортный пакет может быть соединен с помощью стерильного соединительного устройства;
а, б — отдельные трубочки помещаются в держатели. Крышку закрывают;
в — сварочная пластина нагревается до 260 °С, расплавляя трубки. Благодаря держателю трубок они спаиваются вместе;
г — теперь из пакета можно извлекать столько препарата крови, сколько нужно. Поскольку поддерживается замкнутая система, срок использования крови не изменяется.
12. Проверяют проходимость сосудистого доступа.
13. Промывают катетер физиологическим раствором.
14. Записывают и следят за жизненно важными признаками.
15. Определяют гематокрит. Повторяют каждый час, если необходимо.
16. Начинают переливание при установленной скорости 5 мл/кг в час.
17. Осторожно переворачивают контейнер с кровью каждые 15-30 минут для уменьшения осаждения.
18. Останавливают переливание при появлении любых побочных изменений в состоянии пациента.
19. В конце инфузии промывают катетер физиологическим раствором.
20. Проверяют концентрацию гемоглобина и гематокрит у пациента, если необходимо, не ранее чем через 2 ч после трансфузии.
21. Если после трансфузии гематокрит/гемоглобин не поднялся до ожидаемого уровня, рассматривают следующие варианты:
а. Низкий гематокрит в пакете с эритроцитарной массой (ЭМ).
б. Неправильный расчет требуемой инфузии.
в. Продолжающаяся кровопотеря.
г. Трансфузионная реакция.
д. Гемолиз из-за несовместимости по системе AB0 или другой:
(1) Новорожденный имеет циркулирующие анти-А-, анти-В- и анти-АВ-антитела, которые связываются с А- или В-антигенами при трансфузии эритроцитов.
(2) Прямой антиглобулиновый тест (ПАТ) первоначально отрицательный стал положительным.
(3) Неожиданное повышение уровня билирубина.
(4) Новорожденный имеет эритроцитарные антитела другой системы, кроме AB0.
(5) Гемолиз вследствие механического повреждения эритроцитов или заболевания донора, сопровождающегося гемолизом.
— Также рекомендуем «Переливание цельной крови у новорожденных детей — показания, методика»
Оглавление темы «Неонатология»:
- Проблемы с кожей вокруг стомы и ее осложнения
- Уход за гастростомой и гастростомической трубкой
- Проблемы применения гастростомической трубки
- Особенности переливания крови и ее компонентов у новорожденных детей
- Исследования крови и ее компонентов перед переливанием
- Оборудование для переливания крови и ее компонентов у новорожденных детей
- Показания и противопоказания для переливания эритроцитарной массы у новорожденных детей
- Методика переливания эритроцитарной массы у новорожденных детей
- Переливание цельной крови у новорожденных детей — показания, методика
- Показания и противопоказания для переливания тромбоцитов у новорожденных детей
Лечение больного с острой кровопотерей зависит от клинической картины и объема кровопотери. Госпитализации подлежат все дети, у которых по клиническим или анамнестическим данным предполагается кровопотеря более 10 % ОЦК.
Объем циркулирующей крови и показатели гемодинамики должны быть оценены немедленно. Исключительно важно многократно и точно определять основные показатели центральной гемодинамики (ЧСС, артериальное давление и их ортостатические изменения). Внезапное увеличение ЧСС может быть единственным признаком рецидива кровотечения (особенно при остром желудочно-кишечном кровотечении). Ортостатическая гипотония (снижение систолического артериального давления > 10 мм рт. ст. и увеличение ЧСС > 20 уд./мин при переходе в вертикальное положение) свидетельствуют об умеренной кровопотере (10-20 % ОЦК). Артериальная гипотония в положении лежа свидетельствует о большой кровопотере (> 20 % ОЦК).
Общепринято, что при острой кровопотере гипоксия возникает у ребенка после потери > 20 % ОЦК. Дети ввиду более низкого, чем у взрослых, сродства гемоглобина к кислороду способны в ряде случаев компенсировать кровопотерю и при уровне Нb
Лечение больного начинается как с немедленной остановки кровотечения, так и выведения ребенка из шока. В борьбе с шоком основную роль играет восстановление ОЦК кровезаменителями и компонентами крови. Объем кровопотери должен быть замещен эритроцитной массой или (при ее отсутствии) цельной кровью малых (до 5-7 дней) сроков хранения. Трансфузии кристаллоидных (раствор Рингера, 0,9 % раствор NaCl, лактасол) и/или коллоидных (реополиглюкин, 8 % раствор желатиноля, 5 % раствор альбумина) кровезаменителей должны предшествовать гемотрансфузиям, что позволяет восстановить ОЦК, купировать нарушения микроциркуляции и гиповолемию. Целесообразно первоначально ввести 20 % раствор глюкозы (5 мл/кг) с инсулином, витамином B12 и кокарбоксилазой (10-20 мг/кг). Скорость введения кровезаменителей в условиях остановленного кровотечения должна быть минимум 10 мл/кг/ч. Объем переливаемых кровезамещающих растворов должен превышать (приблизительно в 2-3 раза) объем эритроцитной массы.
При восстановлении ОЦК кровезаменителями необходимо следить, чтобы гематокрит был не ниже 0,25 л/л в связи с опасностью развития гемической гипоксии. Трансфузия эритроцитной массы возмещает дефицит эритроцитов и купирует острую гипоксию. Дозу гемотрансфузии выбирают индивидуально в зависимости от величины кровопотери: 10-15-20 мл/кг массы, при необходимости и более. Восстановление гемодинамики, в том числе центрального венозного давления (до 6-7 мм вод. ст.), является показателем достаточности и эффективности инфузионно-трансфузионной терапии острой кровопотери.
Показаниями к трансфузии эритроцитной массы при острой кровопотери являются:
- острая кровопотеря > 15-20 % ОЦК с признаками гиповолемии, не купируемая трансфузиями кровезаменителей;
- операционная кровопотеря > 15-20 % ОЦК (в сочетании с кровезаменителями);
- послеоперационный Ht
- Ht
- ятрогенная анемия (
Показания к переливаниям крови: острая массивная кровопотеря, операции на открытом сердце. Необходимо помнить, что при переливании крови велик риск передачи вирусных инфекций (гепатита, цитомегаловируса, ВИЧ), сенсибилизации.
Новорожденные с острой постгеморрагической анемией и геморрагическим шоком требуют интенсивной терапии. Новорожденный в состоянии шока должен быть помещен в кувез или под источник лучистого тепла, чтобы поддержать температуру тела на уровне 36,5 °С, и обеспечен ингаляциями кислородно-воздушных смесей.
Показаниями к гемотрансфузиям у новорожденных являются:
- анемия с сократительной сердечной недостаточностью (по 1 мл/кг массы тела, медленно в течение 2- 4 ч); повторные переливания, если необходимо;
- Нb
- Нb
- Hb
- потеря ОЦК 5-10 %.
Для трансфузии используют эритроцитную массу (давностью не более 3 дней консервации), которую в количестве 10-15 мл/кг массы тела вводят медленно (3-4 капли в минуту). Это приводит к повышению уровня гемоглобина иа 20-40 г/л. При тяжелых анемиях необходимое количество эритроцитной массы для переливания рассчитывают по формуле Найбурта-Стокмана:
V = m (кг) х дефицит Нb (г/л) х OЦK (мл/кг) / 200, где V — необходимое количество эритроцитной массы, 200 — обычный уровень гемоглобина в эритроцитной массе в г/л.
Например, у ребенка с массой тела 3 кг выявлена анемия с уровнем гемоглобина 150 г/л, значит дефицит гемоглобина = 150 -100 = 50 г/л. Требуемое количество эритроцитной массы составит 3,0 х 85 х 50/200 = 64 мл. При очень низких уровнях гемоглобина у ребенка желательным уровнем Нb, по которому определяют дефицит гемоглобина, считают величину 130 г/л.
Показаниями к переливанию эритроцитной массы у детей старше первых дней жизни являются уровни гемоглобина ниже 100 г/л, а у детей старше 10 дней — 81-90 г/л.
Во избежание осложнений массивной гемотрансфузии (острая сердечная недостаточность, цитратная интоксикация, калиевая интоксикация, синдром гомологичной крови) общий объем гемотрансфузии не должен превышать 60 % ОЦК. Остальной объем восполняется плазмозаменителями: коллоидными (реополиглюкин, 5 % раствор альбумина) или кристаллоидными (раствор Рингера, 0,9 % раствор NaCl). Если ребенку, находящемуся в постгеморрагическом шоке, невозможно срочно произвести гемотрансфузию, то начинают лечение плазмозаменителями, поскольку несоответствие объема циркулирующей крови и емкости сосудистого русла должно быть ликвидировано немедленно. Пределом гемодилюции в первые часы жизни считают показатель гематокрита 0,35 л/л и количество эритроцитов 3,5 х 1012/л. При достижении этой границы восполнение ОЦК необходимо продолжить гемотрансфузиями.
Об эффективности терапии острой постгеморрагической анемии судят по нормализации окраски и температуры кожи и слизистых оболочек, повышению систолического артериального давления до 60 мм рт. ст., восстановлению диуреза. При лабораторном контроле: уровень Нb 120-140 г/л, гематокрит 0,45-0,5 л/л, ЦВД в пределах 4-8 см вод. ст. (0,392-0,784 кПа), ОЦК выше 70-75 мл/кг.
Больному с острой постгеморрагической анемией необходим постельный режим. Ребенка согревают, дают обильное питье.
По показаниям назначают сердечно-сосудистые средства, препараты, улучшающие микроциркуляцию.
По окончанию острого периода назначают полноценную диету, обогащенную белками, микроэлементами, витаминами. Учитывая истощение запасов железа, назначают лечение препаратами железа.


Анемия является одной из наиболее частых
патологий у детей раннего возраста.
Около 20% доношенных детей страдают
данным заболеванием, а среди недоношенных
на первом году жизни анемия развивается
практически у всех. При этом тяжесть
анемии тем выше, чем меньше гестационный
возраст ре6енка. В первые месяцы жизни
у недоношенных детей с очень низкой
массой тела при рождении (менее 1500 г) и
гестационным возрастом менее 30 нед.
тяжелая анемия, требующая переливание
эритроцитарной массы, составляет до
90%.
Выделяют раннюю и позднюю анемии
недоношенных.
Ранняя анемия недоношенных — это
выраженная форма физиологической анемии
новорожденных. Она развивается к концу
первого-началу второго месяца жизни,
имеет нормохромно-нормоцитарный тип и
является гипорегенераторной анемией
в результате транзиторной гипопродукции
эндогенного эритропоэтина.
В последние годы изменился взгляд на
патогенез ранней анемии недоношенных.
Основные звенья в патогенезе РАН: дефицит
гемопоэтических факторов (железа,
фолиевой кислоты, белка) и недостаточность
гуморального фактора — эритропоэтина
(ЭП), ответственного за эритропоэз в
организме, повышенный гемолиз эритроцитов,
особенность типов гемоглобина,
физиологическая гемодилюция, лабораторные
потери и другие факторы.
Регуляция эритропоэза осуществляется
эритропоэтином по принципу обратной
связи. Интенсивность его обусловлена
уровнем эритропоэтина в крови,
физиологическим стимулом продукции
которого является гипоксия. Внутриутробно
он продуцируется в печени, которая
сохраняет за собой эту функцию (в меньшей
степени) как после рождения, так и на
протяжении всей последующей жизни.
После рождения основным органом,
продуцирующим эритропоэтин (до 90%),
являются почки. Процесс перехода
начинается с 32-й недели гестации. Это
объясняется тем, что печеночные
О2-рецепторы менее чувствительны к
гипоксии и реагируют на уровень рО2,
равный 25-30 мм Hg (кислородное насыщение
крови при этом составляет 50-60%), что
защищает плод в условиях относительной
гипоксии от избыточной полицитемии.
Частота развития и тяжесть клинического
течения РАН обратно пропорциональна
сроку гестации и массе тела при рождении.
Степени тяжести РАН, соответствующие
общепринятой классификации по А. И.
Хазанову, следующие: I степень — колебания
гемоглобина в пределах 100-85 г/л; II степень
— 84-70 г/л; III степень — ниже 70 г/л.
Основными клиническими симптомами РАН
являются: увеличение частоты сердечных
сокращений и частоты дыхания, появление
функционального систолического шума,
усиление бледности кожных покровов,
снижение двигательной активности,
мышечного тонуса и суточной прибавки
массы тела. Все эти клинические симптомы
у здоровых недоношенных новорожденных
можно рассматривать как включение
компенсаторных механизмов организма
в ответ на снижение количества клеток
— переносчиков кислорода. У детей с
кардио-респираторными проблемами эти
симптомы являются угрожающими. Нужно
помнить, что компенсаторные возможности
у недоношенных детей ограничены ввиду
общей незрелости организма и наличия
сопутствующей пери- и постнатальной
патологии.
Одним из основных методов лечения ранней
анемии недоношенных до настоящего
времени остаются гемотрансфузии.
Наиболее часто для гемотрансфузий
используется донорская эритроцитарная
масса. Показаниями для переливаний
эритроцитарной массы при анемии
недоношенных являются: снижение
гемоглобина ниже 130 г/л и гемотокрита
ниже 0,4 в период ранней адаптации (первые
7 дней жизни) в сочетании с тяжелыми
нарушениями дыхания и сердечной
деятельности. Широкое использование
гемотрансфузий у недоношенных детей
сопряжено хотя и с невысоким, но
существенным риском. Это прежде всего
возможность передачи с трансфузиями
вирусных инфекций (ВИЧ, ЦМВ), возможны
также перегрузки сосудистого русла
жидкостью, развития состояния
«трансплантант против хозяина»,
электролитного дисбаланса. В настоящее
время ведется поиск альтернативных
путей решения этой проблемы. Одной из
них является применение рекомбинантного
человеческого эритропоэтина (Эпоэтин
бета), полученного с помощью методов
генной инженерии и внедренного в
клиническую практику во всех возрастных
группах.
Данные о том, что эритропоэтин является
главным фактором в регуляции фетального
и неонатального эритропоэза и что РАН
характеризуется временной остановкой
синтеза эндогенного эритропоэтина,
дают возможность использования
рекомбинантного эритропоэтина (Эпоэтин
бета) у этой категории детей, обеспечивая
не только хорошую терапевтическую
эффективность, но и являясь физиологическим
методом терапии.
Необходимо подчеркнуть, что одновременно
с введением Эпоэтин бета, в результате
активации эритропоэза, а также для
достижения лучшего терапевтического
эффекта, возрастает необходимость в
адекватной обеспеченности белком и
назначении препаратов железа (от 2 до 6
мг/кг/день), особенно у недоношенных
детей, так как у них ограничен запас
железа, а при его недостатке действие
Эпоэтин бета снижается. Введение Эпоэтин
бета повышает утилизацию клетками
костного мозга железа из железосодержащих
препаратов.
Снижение потребности в продуктах
аллогенной крови и предупреждение
осложнений, связанных с ними, является
важным преимуществом включения Эпоэтин
бета в терапевтический комплекс для
профилактики и лечения ранней анемии
недоношенных. Этот метод биологически
безопасен и экономически доступен, что
дает основание рекомендовать его для
применения в неонатологической практике
при выхаживании недоношенных детей,
особенно гестационного возраста <32
недель и массой тела при рождении <1500
г.
Известно, что кроветворение недоношенных
новорожденных с 2,5-3-месячного возраста
вступает в железодефицитную фазу с
развитием у большинства из них, без
дополнительного введения железа, поздней
анемии недоношенных (ПАН), характеризующейся
всеми признаками дефицита этого
микроэлемента. Развитие ПАН объясняется
первоначально небольшим депо железа
(в результате недостаточных фетальных
запасов железа к моменту рождения),
большей потребностью в железе в процессе
роста и недостаточным его поступлением
с пищей.
Частота возникновения ПАН составляет
50-100% и зависит от степени недоношенности,
вредных факторов перинатального периода
(гестоз, ЖДА беременных II-III степеней,
хронические болезни матери, инфекции,
перинатальные кровопотери), характера
выхаживания и вскармливания, патологии
постнатального периода (дисбактериоз,
гипотрофия, рахит), а также от своевременности
и качества профилактики анемии препаратами
железа.
Клиническая картина ПАН характеризуется
снижением аппетита, уплощением весовой
кривой, бледностью кожи и слизистых
оболочек, сухостью кожи, увеличением
печени и селезенки. Отмечается снижение
сывороточного железа – гипохромия, с
тенденцией к микроцитозу и гиперрегенераторной
реакцией костного мозга.
После рождения источниками железа для
развивающегося организма являются
поступление экзогенного железа в составе
пищевых продуктов и его утилизация из
эндогенных запасов.
Попытки обогащения рациона питания
введением адаптированных смесей, в том
числе и обогащенных железом, не приводят
к желаемому результату, поскольку
последнее плохо всасывается. Для
недоношенных детей, особенно первых
месяцев жизни, единственным физиологическим
продуктом питания, который обеспечивает
равновесие обмена железа в организме,
является материнское молоко,
сбалансированное по всем ингредиентам
в соответствии с физиологическим
потребностям растущего организма. Хотя
в женском молоке содержание железа
невелико (0,2–1,5 мг/л), существуют
специальные механизмы для более
эффективного его усвоения (до 50%) [8].
Вместе с тем большой проблемой является
поддержание лактации у женщин, находящихся
в состоянии стресса в результате досрочно
прерванной беременности и больного
ребенка. Просветительская работа,
психологическая поддержка матери
являются единственным способом
обеспечения грудным вскармливанием
недоношенного ребенка.
Для диетической коррекции железодефицита
требуется своевременное (но не ранее
4–5-го месяца жизни) введение продуктов
прикорма (фруктов, овощей, в дальнейшем,
после 8 мес. – мяса). В то же время
исследованиями доказано, что для лечения
анемии (но не для ее профилактики)
недостаточно только повышения уровня
пищевого железа, а требуется медикаментозная
дотация.
Чем же так опасна железодефицитная
анемия?
Железодефицитная анемия способствует
развитию хронической гипоксии, которая
в свою очередь может приводить к
замедлению умственного и психомоторного
развития ребенка.
В связи с этим лечение анемии у недоношенных
детей и профилактика дефицита железа
у всех детей является важной и обязательной
составной частью в общей схеме наблюдения
за детьми на 1-м году жизни [9]. Кроме
немаловажных диетических подходов,
актуально раннее назначение профилактических
доз препаратов железа всем недоношенным
детям. Препаратами выбора в этом случае
являются современные представители
гидроксид полимальтозного комплекса
трехвалентного железа: Мальтофер и
Феррум Лек.
Недоношенным детям с первых недель
жизни до 1-го года рекомендуется
профилактический прием указанных
препаратов железа из расчета 2 мг/кг/сут
элементарного железа. Лечебная доза
составляет 5 мг/кг/сут элементарного
железа и не меняется до нормализации
уровня гемоглобина. Контроль показателей
красной крови (уровень гемоглобина, ЦП,
эритроциты) недоношенным детям после
выписки из отделений выхаживания
необходимо проводить в обязательном
порядке в 3, 6 и 12 мес, затем 2 раза в год,
а при выявлении анемии – каждые 14 дней
до стабилизации показателей гемограммы.
Учитывая особенности патогенеза анемии
недоношенных детей, тенденцию к развитию
гипорегенераторной реакции костного
мозга, мегалобластозу, макроцитозу,
повышенному гемолизу эритроцитов, детям
с низкой массой тела при рождении
необходимо раннее, с 7 дней жизни, введение
фолиевой кислоты по 1 мг в сутки, витамина
Е по 20 мг/кг в сутки, витаминов группы
В.
Врач отделения
новорожденных МОДБ Ткач Н.Н.
Заведующая отделением
новорожденных МОДБ Болвинова С.А.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

