Патогенез анемий апластическая анемия
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 января 2019;
проверки требуют 2 правки.
Апласти́ческая анеми́я — заболевание кроветворной системы, характеризуется угнетением кроветворной функции костного мозга и проявляется недостаточным образованием эритроцитов, лейкоцитов и тромбоцитов (пангемоцитопенией) или только одних эритроцитов (парциальная гипопластическая анемия, синонимы: апластическая анемия, арегенераторная анемия, геморрагическая алейкия, миелопарез, миелофтиз, панмиелофтиз, прогрессирующая гипоцитемия). Для апластических анемий характерна выраженная панцитопения — анемия, лейкопения, тромбоцитопения и лимфопения[3].
История заболевания[править | править код]
Впервые это заболевание было описано Паулем Эрлихом в 1888 году у 21-летней женщины. Термин «апластическая анемия» был предложен Чауфордом в 1904 году. Апластическая анемия — одно из самых тяжёлых расстройств гемопоэза. Без лечения больные тяжёлыми формами апластической анемии погибают в течение нескольких месяцев. При своевременном адекватном лечении прогноз достаточно хороший. Длительный период времени апластическая (гипопластическая) анемия рассматривалась как синдром, объединяющий патологические состояния костного мозга протекающие с выраженной гипоплазией кроветворения. Современная медицина относит апластическую анемию к арегенераторному виду анемий (гипо-, апластические анемии)[4].
Этиология[править | править код]
Причинами апластической анемии могут быть:
- Химические вещества (мышьяк, ароматические углеводороды, в частности бензол, соли тяжёлых металлов).
- Ионизирующее излучение (см. Мария Склодовская-Кюри)
- Лекарственные препараты (НПВС, цитостатики, мерказолил, анальгин, левомицетин).
- Инфекционные агенты (вирусы, м/о).
- Аутоиммунные процессы (СКВ, синдром Шегрена).
Патогенез[править | править код]
Апластическая анемия может развиться при воздействии ряда миелотоксических факторов: ионизирующего излучения, химических веществ — бензола, солей золота, мышьяка; лекарственных средств — хлорамфеникола (левомицетина), фенилбутазона (бутадион), хлорпромазина (аминазин), мепробамата, дилантина, антиметаболитов (6-меркаптопурина, метотрексата), алкилирующих (циклофосфана, хлорбутина) и некоторых других средств. Миелотоксический эффект от воздействия одних факторов (ионизирующее излучение, антиметаболиты) возникает всегда при достаточно большой дозе, других — проявляется индивидуально. Причина индивидуальной чувствительности, в частности к некоторым лекарственным средствам не всегда ясна, но может быть связана с генетическими дефектами кроветворных клеток. Это относится, например, к хлорамфениколу и фенилбутазону, которые вызывают супрессию (в зависимости от дозы) эритропоэза с частотой соответственно 1:24000 и 1:40000 лиц, их принимающих.
Наследственный характер индивидуальной чувствительности эритропоэтических клеток к данным лекарственным веществам подтверждается развитием аплазии костного мозга у разных членов одной семьи и у однояйцевых близнецов. В других случаях вероятна связь индуцированного лекарственными веществами угнетения кроветворения с иммунными механизмами появлением антител к эритроцитарным предшественникам. Описаны случаи возникновения апластической анемии после острого вирусного гепатита (возможно, вследствие способности вируса гепатита изменять кариотип клеток, что было прослежено на культуре лейкоцитов), перенесенной инфекции вирусом Эпштейна — Барр, парвовирусом.
Существует и наследственная форма апластической анемии — анемия Фанкони.
Более чем у половины больных не удается выявить какие-либо причинные факторы — это так называемая идиопатическая апластическая анемия. Механизмы, лежащие в основе идиопатической формы анемии, неясны. Возможен аутоиммунный механизм, связанный с воздействием на клетки костного мозга аутоантител при участии иммунных лимфоцитов. Показано, что лимфоциты (Т-супрессоры) больных тормозят образование эритроцитных колоний костного мозга донора и могут нарушать дифференциацию и пролиферацию гематопоэтических предшественников.
Предполагают также, что основой апластической анемии может быть поражение (внутренний дефект) стволовой клетки, о чём свидетельствует восстановление кроветворения у больных после трансплантации им аллогенного костного мозга, содержащего нормальные стволовые клетки. Существуют экспериментальные данные, свидетельствующие о значении для развития апластического процесса и нарушений микроокружения — первичного дефекта стромальных клеток костного мозга. Однако суть этих клеточных дефектов остается неясной, так же как и их первичность. Возможно, что при разных формах апластической анемии патогенетические механизмы неодинаковы.
Клиника[править | править код]
- Анемический синдром (головокружение, снижение работоспособности, утомляемость, бледность кожных покровов и слизистых, сердцебиение, непереносимость длительных физических нагрузок и т. д.)
- Геморрагический синдром (кровоточивость, склонность к диапедезам, геморрагии)
- Инфекционные осложнения.
Диагностика[править | править код]
Картина периферической крови представлена трицитопенией. Снижение гемоглобина значительно и может достигать критического уровня 20 — 30 г/л. Цветовой показатель обычно равен единице, но в ряде случаев может быть гиперхромия и макроцитоз эритроцитов. Количество ретикулоцитов резко снижено. Характерна выраженная лейкопения (агранулоцитоз). Абсолютное содержание лимфоцитов не изменено или снижено. Количество тромбоцитов всегда снижено, в некоторых случаях не удается обнаружить их вообще. В большинстве случаев увеличивается СОЭ (до 40 — 60 мм/час).
Клиническая картина заболевания позволяет сформировать первичное представление о патологии системы крови. Отправной точкой диагностического поиска является клиническое исследование крови с подсчетом количества ретикулоцитов и тромбоцитов. Выявление би- или трицитопении при исследовании периферической крови служит основанием для выполнения морфологического исследования костного мозга.
Диагноз АА устанавливают на основании типичной гистологической картины костного мозга, получаемого методом трепанобиопсии гребня подвздошной кости. Для получения качественного (информативного) биоптата используются трепаны, выпускаемые промышленным способом (Sherwood medical).
При гистологическом исследовании костного мозга обнаруживается большое количество жировой ткани, содержание которой может достигать 90 %. Среди доминирующей жировой ткани встречаются стромальные и лимфоидные элементы. Гематогенные клетки представлены крайне скудно: в небольшом количестве встречаются эритроидные и гранулоцитарные предшественники. Мегакариоциты отсутствуют.
Лечение[править | править код]
Лечение апластической анемии представляет собой очень сложную задачу.
- Лечение с глюкокортикоидами эффективно, если болезнь обусловлена аутоиммунными механизмами, появлением антител против клеток крови.
- Лечение анаболическими препаратами стимулируют кроветворение.
- Лечение андрогенами обладает анаболическим эффектом и стимулируют эритропоэз.
- Лечение цитостатиками (иммунодепресантами) — назначается лишь при отсутствии эффекта от других методов лечение у больных с аутоиммунной формой, в том числе при парциальной красноклеточной аплазии.
- Спленэктомия
- Лечение антилимфоцитарным глобулином рекомендуется при отсутствии эффекта от спленэктомии и других методов лечения.
- Лечение циклоспорином. Циклоспорин А (сандиммун) обладает иммунодепрессантным эффектом, селективно ингибирует транскрипцию гена интерлейкина-2 в Т-лимфоцитах, подавляет продукцию Гамма интерферона и альфа фактора некроза опухоли.
- Трансплантация костного мозга.
Основным и единственным патогенетическим методом лечения апластической анемии, позволяющим рассчитывать на спасение жизни больного, является трансплантация костного мозга от совместимого донора.
При невозможности подобрать донора проводится паллиативная терапия. В качестве базисного препарата используется иммунодепрессант циклоспорин А. У больных нетяжёлой апластической анемией использование данного препарата позволяет рассчитывать в ряде случаев на успех. Кроме того использование циклоспорина А целесообразно и с тех позиций, что глюкокортикоиды, андрогены и антилимфоцитарный глобулин способны улучшить состояние гемопоэза у больных нетяжёлой апластической анемией, но, однако, при этом следует принимать во внимание повышенный риск развития в последующем клональных заболеваний костного мозга. Применение циклоспорина А сводит такой риск к минимуму. Следует также отметить, что у части больных нетяжёлой апластической анемией, преодолевших 6-месячный порог выживаемости, может наступить спонтанное улучшение даже если им не проводилось никакой иммуносупрессивной терапии. Эффект от иммуносупрессивной терапии у больных тяжёлой и крайне тяжелой апластической анемией сомнителен.
- Лечение колониестимулирующими факторами или миелоидными факторами роста — эти гликопротеиды, стимулирующие пролиферацию и дифференциацию клеток-предшественниц гемопоэза различных типов.
- Трансфузии эритроцитов; показания: выраженная анемия, гипоксия мозга, гемодинамические нарушения.
Все больные апластической анемией нуждаются в заместительной трансфузионной терапии эритроцитарной и/или тромбоцитарной массой. Объём трансфузионной терапии определяется показателями периферической крови и клиническими проявлениями заболевания. Кроме того, проводится антибактериальная и микостатическая терапия с целью профилактики или лечения инфекционных осложнений.
Прогноз[править | править код]
Ремиссию удаётся получить примерно у половины больных. Прогноз несколько лучше у детей, чем у взрослых. Наличие большого количества жира в костном мозге не говорит о необратимости процесса. Бывают случаи, когда и у таких больных наступает полная ремиссия и полная репарация костномозгового кроветворения. Прогноз лучше, когда увеличено содержание ретикулоцитов, когда в костном мозге имеется более полиморфная картина, когда имеется небольшое увеличение размеров селезёнки и хотя бы небольшой, но чёткий эффект от кортикостероидных гормонов. В этих случаях спленэктомия оказывает чаще хороший эффект вплоть до полного выздоровления. У части больных апластический синдром является началом острого лейкоза. Иногда признаки гемобластоза выявляются лишь через несколько лет от начала болезни.
Примечания[править | править код]
Апластическая анемия — это синдром хронической первичной недостаточности гемопоэза с одновременным присутствием панцитопении (анемии, нейтро-пении и тромбоцитопении). По всей видимости, у большинства пациентов развитие заболевания инициируют аутоиммунные механизмы. Способствующим фактором, по крайней мере у некоторых пациентов, вероятно, служат наследственные или приобретенные нарушения КСК.
а) Этиология. Наиболее распространенные причины апластической анемии перечислены в таблице ниже. Большинство случаев известной этиологии связано с воздействием химических веществ и лекарственных средств. Некоторые препараты и химические вещества (включая многие противоопухолевые химиотерапевтические вещества и органический растворитель бензол) вызывают дозозависимую и обратимую супрессию костного мозга.
В других случаях апластическая анемия возникает непредсказуемым образом по типу идиосинкразии в ответ на лекарственные средства (например, хлорамфеникол и соли золота), обычно не вызывающие супрессию костного мозга.
Персистирующая аплазия костного мозга может появиться после различных вирусных инфекций; чаще всего после вирусного гепатита типа не-А, не-В, не-С, не-G (5-10% случаев). Почему апластическая анемия возникает только у некоторых индивидов, до сих пор неизвестно.
Облучение всего тела может разрушать КСК в зависимости от дозы облучения. У лиц, получавших терапевтическое облучение или подвергшихся облучению в результате несчастного случая (например, как это было в Чернобыле), существует риск развития аплазии костного мозга.
В основе некоторых форм апластической анемии лежат наследственные дефекты. Анемия Фанкони представляет собой редкое аутосомно-рецессивное заболевание, вызываемое дефектами мультибелкового комплекса, необходимого для репарации ДНК. Гипофункция костного мозга становится очевидной в раннем периоде жизни и обычно сопровождается множественными врожденными аномалиями, например гипоплазией почек и селезенки, аномалиями костей, чаще всего большого пальца кисти и лучевых костей.
Наследственные дефекты теломеразы обнаруживаются в 5-10% случаев апластической анемии, возникающей у взрослых. Напомним, что теломераза необходима для клеточного «бессмертия» и неограниченной репликации, поэтому последствием частичного дефицита активности теломеразы могут быть преждевременное истощение КСК и аплазия костного мозга. Аномально короткие теломеры, которые обнаруживаются в клетках костного мозга у 50% лиц, страдающих апластической анемией, встречаются более часто, чем мутации теломеразы. Остается неясным, обусловлено ли это укорочение какими-то другими дефектами теломеразы или является следствием избыточной репликации стволовых клеток.
В большинстве случаев инициирующий фактор идентифицировать не удается; 65% случаев попадает в эту идиопатическую категорию.

б) Патогенез. Патогенез апластической анемии изучен не полностью. Маловероятно, что в основе всех случаев лежит единый механизм. Однако очевидно, что существуют два основных этиологических фактора: внешняя, иммуноопосредованная супрессия костномозговых клеток-предшественников и внутренняя аномалия стволовых клеток.
Все большее внимание привлекает экспериментальная модель, в которой активированные Т-клетки супрессируют КСК. Вначале могут произойти антигенные изменения стволовых клеток в результате действия лекарственных средств, инфекционных агентов или других, неизвестных внешних воздействий. Это вызывает клеточный иммунный ответ, в течение которого активированные Тh1 -клетки продуцируют цитокины, например IFN-y и TNF, которые супрессируют и убивают гемопоэтические клетки-предшественники. Такое представление подкрепляется рядом наблюдений.
Исследование немногих сохраняющихся при апластической анемии стволовых клеток костного мозга показало, что у них повышена экспрессия генов, участвующих в апоптозе и активирующих пути клеточной гибели. Примечательно, что экспрессия тех же генов повышена у нормальных стволовых клеток, подвергнутых действию IFN-y.
Еще более убедительные (основанные на клиническом опыте) данные получены при изучении эффектов иммуносупрессивной терапии. Антитимоцитарный глобулин и другие иммуносупрессивные агенты, например циклоспорин, вызывают реакцию в 60-70% случаев. Предполагают, что действие этих лекарственных средств основано на супрессии или гибели клонов аутореактивных Т-клеток. Природа антигенов, распознаваемых аутореактивными Т-клетками, изучена недостаточно. В некоторых случаях мишенями могут быть связанные с GPI белки. Этим можно объяснить связь апластической анемии и пароксизмальной ночной гемоглобинурии.
Альтернативное предположение о том, что апластическая анемия возникает в результате фундаментальных дефектов стволовых клеток, подтверждается присутствием кариотипических аберраций, случайной трансформацией аплазии в миелоидную неоплазию (например, в миелодиспластический синдром либо острую миелоидную лейкемию) и связью с аномально короткими теломерами. Некоторые воздействия на костный мозг (или предрасположенность к повреждению ДНК), вероятно, влекут за собой нарушения, ограничивающие способность стволовых клеток к пролиферации и дифференцировке. Если повреждение значительное, развивается апластическая анемия.
Указанные механизмы не являются взаимоисключающими, поскольку генетически измененные стволовые клетки также могут экспрессировать неоантигены и тем самым служить мишенями для Т-клеток.
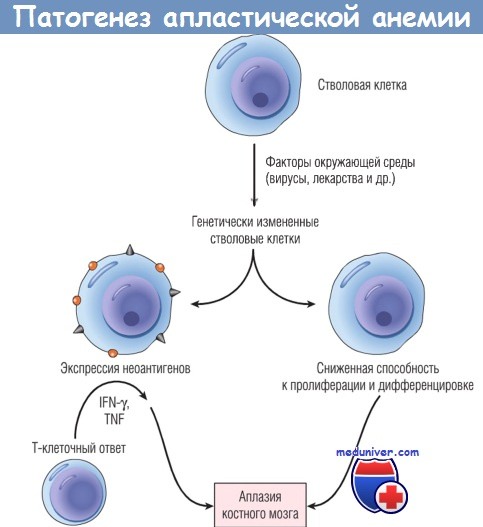
Патофизиология апластической анемии.
Поврежденные стволовые клетки могут продуцировать дочерние клетки, экспрессирующие неоантигены,
которые вызывают аутоиммунную реакцию, или же образуют клональную популяцию со сниженной пролиферативной активностью.
В обоих случаях возможна аплазия костного мозга.
IFN — интерферон; TNF — фактор некроза опухоли.
в) Морфология. Заметно обедненный клетками костный мозг в значительной степени лишен гемопоэтических клеток. Нередко остаются только жировые клетки, фиброзная строма, рассеянные лимфоциты и плазматические клетки. Аспирация костного мозга часто дает мало материала («сухой прокол»), поэтому для исследования лучше всего использовать биоптаты костного мозга. Другие неспецифические патологические изменения — гранулоцитопения и тромбоцитопения — обусловлены мукокутанными бактериальными инфекциями и аномальным кровотечением соответственно. Проведение множественных трансфузий при анемии индуцирует развитие системного гемосидероза.
г) Клинические признаки. Апластическая анемия наблюдается в любом возрасте и не зависит от пола. Обычно начало болезни бессимптомно. Первые проявления варьируют в зависимости от того, какая клеточная линия преимущественно поражена, однако в конечном итоге возникает панцитопения с ожидаемыми последствиями. Анемия вызывает прогрессирующую слабость, бледность и одышку. О тромбоцитопении свидетельствуют петехии и экхимозы. Нейтропения приводит к развитию частых и персистирующих минорных инфекций или внезапных озноба, лихорадки и общей слабости. Спленомегалия, как правило, отсутствует.
Если же она есть, то диагноз «апластическая анемия» должен быть подвергнут тщательной проверке. Со стороны эритроцитов обычно отмечается слабо выраженный нормохромный макроцитоз, а ретикуло-цитопения присутствует всегда.
Диагноз основывают данными исследований биоптатов костного мозга. Важно отличить апластическую анемию от других типов панцитопении, таких как алейкемическая лейкемия и МДС, которые могут иметь идентичные клинические проявления. При апластической анемии костный мозг обычно значительно обеднен клетками, тогда как миелоидные неоплазии ассоциируются с гиперклеточным костным мозгом, заполненным неопластическими клетками-предшественниками.
Прогноз вариабелен. Трансплантация костного мозга — терапия выбора, если есть подходящий донор, что обеспечивает 5-летнюю выживаемость в 75% случаев. Организм пожилых пациентов и тех больных, которым не смогли подобрать подходящего донора, часто хорошо отвечает на иммуносупрессивную терапию.
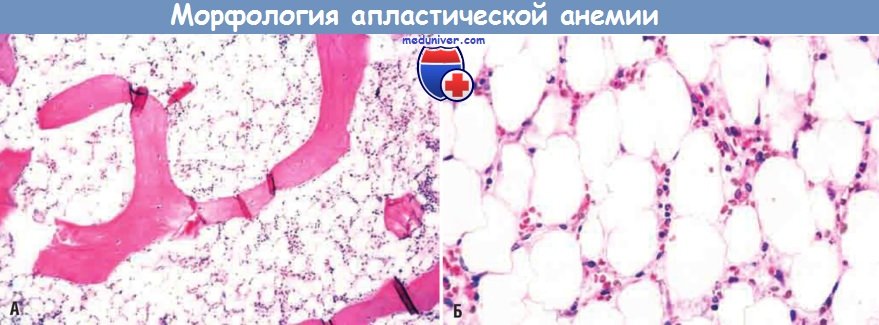
Апластическая анемия (биоптат костного мозга).
Заметное снижение количества клеток в костном мозге, содержащем в основном жировые клетки.
(А) Малое увеличение. (Б) Большое увеличение.
— Рекомендуем ознакомиться со следующей статьей «Механизмы развития (патогенез) эритроцитарной аплазии»
Оглавление темы «Патогенез анемий и кровотечений»:
- Механизмы развития (патогенез) апластической анемии
- Механизмы развития (патогенез) эритроцитарной аплазии
- Механизмы развития (патогенез) недостаточности костного мозга
- Механизмы развития (патогенез) полицитемий
- Классификация геморрагических заболеваний
- Механизмы развития (патогенез) геморрагии из-за патологии сосудистой стенки
- Механизмы развития (патогенез) кровотечения из-за тромбоцитопении
- Механизмы развития (патогенез) иммунной тромбоцитопенической пурпуры
- Механизмы развития (патогенез) лекарственной тромбоцитопении
- Механизмы развития (патогенез) тромбоцитопении при ВИЧ-инфекции
