Нобелевская премия по атеросклерозу
Кандидат биологических наук Анна Шаланда,
интернет-журнал «Коммерческая биотехнология»
- 13 Нобелевских премий
- Без вины виноватый?
- Вся правда о нем
- Пути холестерина
- Эх, прокачусь!
- Еще один подозреваемый
- Медвежья услуга
- «Судьба всякой истины — сначала быть осмеянной, а потом уже признанной»
На протяжении XX столетия за изучение холестерина были присуждены 13 Нобелевских премий. Повышенный интерес ученых к этой жироподобной субстанции явно не случаен.
Заслуга открытия холестерина всецело принадлежит французским химикам. В 1769 году Пулетье де ла Саль получил из желчных камней плотное белое вещество («жировоск»), обладавшее свойствами жиров. В чистом виде холестерин был выделен химиком, членом национального Конвента и министром просвещения А.Фуркруа в 1789 году. И лишь в 1815 году Мишель Шеврель, также выделивший это соединение, неудачно окрестил его холестерином («холе» — желчь, «стерол» — жирный). В 1859 году Пьер Бертло доказал, что холестерин принадлежит к классу спиртов. Это обязывало иметь в химическом названии вещества суффикс «-ол», поэтому в 1900 году холестерин был переименован в холестерол. Однако в России осталось прежнее название — «холестерин». Путаница в названиях химических веществ — дело обычное. Но изучение роли холестерина в организме привело к тому, что ничем другим, кроме как холестериновым безумием, не назовешь.
В начале ХХ века несколько русских ученых во главе с Н. Н. Аничковым проводили эксперименты на кроликах, скармливая им пищу животного происхождения. Спустя какое-то время травоядные кролики от такого противоестественного рациона погибли в результате закупорки коронарных артерий. Отложения на стенках коронарных артерий содержали сгустки жира, холестерина и солей кальция (атероматозные бляшки), напоминающие атеросклеротические повреждения сосудов человека. Был вынесен следующий вердикт: вещества, содержащие холестерин, приводят к возникновению атеросклероза. На волне этого открытия пошли разговоры, что холестерин — яд, что он смертельно опасен для организма. Его сочли главным виновником атеросклероза и тут же сформулировали постулат: чтобы уберечь себя от атеросклероза и заболеваний, им обусловленных, достаточно отказаться от продуктов, богатых холестерином.
Кстати сказать, путешествуя по www, вы обнаружите, что:
а) Аничкова в ряде публикаций обзывают Анитечко;
б) кролики — вуаля — превратились в голубей;
в) пища, которую скармливали кроликам, представлена мясом, молоком, сливочным маслом, яйцами, кедровыми орешками, якобы богатыми холестерином (!), и, наконец, просто чистым холестерином, растворенным в сливочном масле.
Вот вам яркий пример трансформации информации!
Удивительно, что результаты базовых экспериментов, имевших совершенно неверную установку (травоядные кролики на мясной диете не являются адекватной моделью для экспериментального атеросклероза у всеядного человека), дали жизнь «холестериновой» теории возникновения атеросклероза, в основе которой лежало представление об этом процессе как результате инфильтрации холестерина в стенку сосуда. Но еще больше изумляет то, что эта теория завладела умами мировой общественности и породила очень жизнеспособную и долгоживущую (около века) страшилку, а человечество так вдохновенно включилось в антихолестериновую кампанию. В чем же суть этой психологической загадки?
Нобелевскими лауреатами 2019 года по физиологии и медицине стали Уильям Кэлин (США), сэр Питер Рэтклифф (Великобритания) и Грегг Семенза (США) за открытие молекулярного механизма реакции клетки на кислород. Их премия стала третьей по счету Нобелевской премией за открытия в области клеточного дыхания.
В 1931 году Нобелевскую премию получил немецкий биохимик Отто Варбург за открытие белков — ферментов, которые обеспечивают процесс клеточного дыхания — расщепления биополимеров до воды и углекислого газа с использованием кислорода. В 1938 году нобелевским лауреатом стал бельгийский физиолог Корней Хейманс, который в опытах на собаках установил, что периферические рецепторы играют основную роль в регуляции частоты дыхания, а значит, и количества кислорода в крови.
Тогда же, в 1930-е годы, стал окончательно понятен механизм реакции на недостаток кислорода на уровне организма. В ответ на хронический недостаток кислорода в клетках и тканях организм вырабатывает гормон — эритропоэтин, в крови увеличивается число красных кровяных клеток эритроцитов, переносчиков кислорода с кровью от органов дыхания к тканям. А третья Нобелевская премия за дыхание была вручена за раскрытие молекулярного механизма реакции клеток на недостаток кислорода.
Работая параллельно и независимо друг от друга на генетически модифицированных мышах и на культуре клеток печени, Питер Рэтклифф и Грегг Семенза обнаружили, что механизм ответа на недостаток кислорода одинаков во всех тканях, а не только в почках и печени — основных источниках эритропоэтина, а мутации в регуляторной области гена эритропоэтина приводят к развитию кислородного голодания — гипоксии.
Питер Рэтклифф
Фото: Reuters
Продолжая исследования, Грегг Семенза открыл индуцируемый гипоксией фактор (HIF), он обнаружил, что HIF состоит из двух различных ДНК-связывающих белков, так называемых транскрипционных факторов, HIF-1-альфа и ARNT. Оказалось, что HIF, связываясь с геном эритропоэтина, усиливает его наработку. Оставался нерешенным вопрос — как HIF определяет момент, когда нужно активировать ген эритропоэтина.
Было известно, что белок HIF-1-альфа, находясь в цитоплазме, постоянно утилизируется в протеасомах, из-за этого в норме его очень мало. При гипоксии HIF-1-альфа приобретает защиту от протеасомной деградации — с него пропадает убиквитиновая метка. Но как это происходит?
Грегг Семенза
Фото: REUTERS/Theresa Keil, Reuters
Подсказка, которая помогла найти ответ на этот вопрос, была получена Уильямом Кэлином в ходе исследования болезни Гиппеля-Линдау. Это генетическое заболевание приводит к повышенному риску онкологических заболеваний на фоне мутаций в гене, который кодирует белок VHL. В отсутствие белка VHL в опухолях активировались гены, связанные с гипоксией, а при его возвращении в клетку эти гены подавлялись. Исследователям удалось показать, что белок VHL способен взаимодействовать с HIF-1-альфа, метить его убиквитином, что и требуется для его деградации в норме.
Оставался неясным один вопрос: чем белок HIF-1-альфа при нормоксии отличается от белка HIF-1-альфа при гипоксии. В 2001 году Рэтклифф и Семенза одновременно опубликовали статьи, обнаружив, что при нормальном количестве кислорода происходит модификация белка HIF-1-альфа — пролилгидроксилирование, что позволяет белку VHL узнать и связать HIF-1-альфа. При недостатке кислорода этот процесс нарушается, и HIF-1-альфа идет в ядро клетки.
Реакция клетки на кислород
Когда уровень кислорода (О2) низок (гипоксия), белок HIF-1-альфа защищен от деградации и накапливается в ядре, где он связывается с белком ARNT и связывается со специфическими последовательностями ДНК (HRE) в генах, регулируемых гипоксией (1). При нормальном уровне кислорода HIF-1-альфа быстро деградируется протеасомой (2). Кислород регулирует процесс деградации путем добавления гидроксильных групп (OH) к HIF-1-альфа (3). Белок VHL может затем образовывать комплекс с HIF-1-альфа, что приводит к его деградации кислородзависимым способом (4)
Рисунок: Иллюстратор: Маттиас Карлен, Нобелевский комитет по физиологии и медицине.
В 2016 году трио Кэлин, Рэтклифф и Семенза получило премию Ласкера, ее присуждают в США за фундаментальные медицинские исследования, и она уже стала своего рода предсказанием, что ее обладатель в скором времени получит Нобелевскую премию. Во всяком случае, более 80 лауреатов премии Ласкера стали нобелевскими лауреатами. Так что вручение Нобелевской премии по физиологии и медицине именно этому коллективу ученых было ожидаемо.
Уильям Кэлин
Фото: REUTERS/Brian Snyder, Reuters
Сейчас много пишут и говорят о том, что открытие молекулярного механизма клеточной гипоксии открывает новые возможности для лечения рака. Об этом же сказано в пресс-релизе Нобелевской ассамблеи шведского Каролинского института (The Nobel Assembly at Karolinska Institute), которая, собственно, и присуждает Нобелевские премии по физиологии и медицине.
Все это верно, только, наверное, не стоит забывать одну деталь. Первым идею о том, что клетки злокачественных опухолей можно и нужно в буквально смысле душить контролируемой гипоксией, еще больше полувека назад высказал Отто Варбург, лауреат самой первой премии за клеточное дыхание. Сказал он об этом и предложил свой вариант «удушения» раковых клеток в 1966 году в лекции на встрече нобелевских лауреатов в Линдау на берегу Боденского озера.
Его алгоритм борьбы с раковыми клетками в итоге оказался бесперспективным, но сам подход к проблеме остался верным, а теперь снова приобрел актуальность.
Вся история открытия говорит о важности процесса адаптации к гипоксии клеток при канцерогенезе, такие состояния возникают при атеросклерозе, инсульте, ишемии, при инфекциях и просто интенсивных нагрузках.
И сейчас окончательно стало понятно, в каких случаях нужно бороться с гипоксией, в каких ее усиливать и, главное, на какие мишени нужно воздействовать. А это позволяет рассчитывать на появление нового класса противораковых препаратов и разработку новых подходов к борьбе с кислородным голоданием клетки при других недугах
Алексей Дейкин, кандидат биологических наук, Институт биологии гена РАН
Углевод трегалоза помогает иммунным макрофагам уничтожать избытки липидов из атеросклеротических бляшек в кровеносных сосудах.
Все мы слышали про антиопухолевую иммунотерапию, когда иммунитет стараются натравить на раковые клетки. Собственно, иммунная система сама по себе должна их истреблять, но бывает, что она их не замечает, и вот тогда-то приходят на помощь разные средства, созданные в научно-исследовательских лабораториях и призванные активировать противораковые свойства иммунитета.
Но с помощью иммунной системы можно лечить не только злокачественные опухоли. В статье в Nature Communications исследователи из Вашингтонского университета пишут, что иммунные клетки макрофаги можно заставить бороться с атеросклеротическими бляшками.
Как известно, одна из главных задач макрофагов вообще – поглощение разнообразного клеточного мусора: мертвых клеток, обломков мембран, белковых агрегатов, избыток липидов. Атеросклеротические бляшки как раз и состоят во многом из такого мусора: сначала на стенках кровеносных сосудов формируются жировые отложения, которые разрастаются в крупные наросты, состоящие из холестерина, соединительнотканных белков, кальция, иммунных клеток и т. д. Собственно, макрофаги и сами по себе пытаются разобрать эти завалы, однако тут возникает проблема: не справляясь с избытком липидов, они начинают выделять воспалительные сигналы. Из-за воспаления окружающие клетки гибнут, добавляя строительного материала атеросклеротическому наросту.
Если бы удалось усилить способность макрофагов перерабатывать поглощенные липиды, это предотвратило бы воспаление и уменьшило бы сами бляшки. Бабак Разани (Babak Razani) и его коллеги обнаружили, что улучшить «пищеварение» иммунным клеткам можно с помощью сахара трегалозы. Она состоит из двух остатков глюкозы, а встретить ее можно в растениях и насекомых. Про трегалозу известно, что она стимулирует аутофагию, или клеточное самопоедание. Суть аутофагии в том, что клетка переваривает внутри себя разные ненужные вещи: вышедшие из строя органеллы, испорченные белки и т. д. Переваривание происходит в особых мембранных пузырьках – лизосомах, наполненных пищеварительными ферментами. В лизосомную топку отправляются также и то, что клетка проглотила снаружи. (Напомним, что Нобелевскую премию по физиологии и медицине в прошлом году дали как раз за описание молекулярного механизма аутофагии.)
У макрофагов в ходе аутофагии перерабатываются, среди прочего, и поглощенные липиды. Трегалоза же, попав в клетку, связывается с белком, от которого зависит работа генов, управляющих аутофагией, так что в результате в макрофагах появляется больше лизосом и они начинают активнее сжигать мусор. Если трегалозу вводили мышам с атеросклерозом, то средняя площадь бляшек в аорте уменьшалась примерно на 30%. При этом сахар нужно было вводить прямо в кровь; если мыши просто ели трегалозу, никакого эффекта от нее не было – очевидно, из-за того, что ее расщепляли пищеварительные ферменты.
Напомним, что в прошлом году мы писали о похожей работе исследователей из Боннского университета, которые выяснили, что углеводы циклодекстрины тормозят развитие новых атеросклерозных бляшек в сосудах и помогают рассасываться старым. Тогда речь шла тоже о макрофагах: циклодекстрины помогали им справиться с избытком холестерина и подавляли воспаление. Возможно, в перспективе удастся создать какой-нибудь комплексный иммуномодулятор из нескольких углеводов, который станет достаточно эффективным средством против атеросклероза.

Поиск не дал результатов
По вашему запросу ничего не найдено
Подписаться
08 октября 2019
Автор
-
 Дмитрий Лебедев
Дмитрий Лебедев
-
Утром 7 октября были объявлены лауреаты Нобелевской премии по физиологии или медицине 2019 года. Ими оказались Уильям Келин, Питер Рэтклифф и Грэгг Семенза, награжденные за «открытие того, как клетки ощущают кислород и адаптируются к изменению его доступности».
Жизнь — очень энергозатратный процесс. Особенно когда организму приходится поддерживать не только свою сложную организацию, но и постоянную температуру, а иногда и способность к активному движению и — представьте себе — разумному поведению. Наши познания в эволюции жизни показывают, что вся эта фантастически энергозатратная деятельность, обеспечивающая существование многоклеточных животных с высоким уровнем активности, возможна только за счет высокоэффективного метаболизма, связанного с полным окислением органических веществ с помощью кислорода. Поэтому нехватка O2 (гипоксия) становится серьезным вызовом, требующим значительных изменений обмена веществ и целого каскада реакций как на уровне клетки, так и на уровне всего организма и его отдельных систем. Подобную нехватку переживают клетки мышц человека при физической нагрузке, раковые клетки опухоли во время ее безудержного роста или весь организм — при подъеме в высокогорье или во время внутриутробного развития. Не удивительно, что каскады, обеспечивающие адаптацию к гипоксии, оказались встроены в число самых фундаментальных и базовых регуляторных путей клетки. Именно поэтому их открытие оказалось в центре внимания Нобелевского комитета и нашего обсуждения. Но — обо всем по порядку.
Вообще, нобелевская история изучения процессов дыхания и их регуляции довольно насыщенна. В 1931 году премию по физиологии или медицине присудили Отто Варбургу за открытие цитохромоксидазы — одного из центральных звеньев дыхательной цепи мембраны митохондрий. Спустя всего семь лет, в 1938 году, лауреатом премии стал бельгийский физиолог Корней Хейманс, открывший роль каротидных тел в регуляции дыхания.
В адаптации нашего организма к гипоксии принимают участие множество механизмов. Самый верхний из них — физиологическая реакция увеличения интенсивности дыхательных движений при гипоксии. За этот быстрый, рефлекторный ответ на гипоксию отвечают хеморецепторы, локализованные в уже упомянутых каротидных телах и в среднем мозге. При длительном воздействии гипоксии, например, при долгих физических тренировках у бегунов-марафонцев или при акклиматизации у альпинистов в условиях высокогорья, происходит увеличение содержания эритроцитов в крови. Делением и дифференцировкой предшественников-эритробластов в зрелые эритроциты управляет белковый гормон эритропоэтин. Ген этого центрального физиологического регулятора эритропоэза был клонирован и охарактеризован в 1985 году [1]. Сегодня рекомбинантный эритропоэтин используется для лечения самых разных анемий, однако истинную славу ему принесла роль одного из самых распространенных и универсальных допинг-препаратов.
То есть интенсивностью эритропоэза управляет эритропоэтин, но что определяет интенсивность его экспрессии? Тут мы и подбираемся к первому виновнику свеженькой Нобелевской премии — профессору Школы медицины при Университете Джонса Хопкинса Грэггу Семензе. Работая с клетками печени и почек, ему удалось показать, что в условиях гипоксии экспрессия эритропоэтина в них индуцируется благодаря одному и тому же транскрипционному фактору, связывающемуся с энхансером гена эритропоэтина (рис. 1) [2]. Вскоре структура этого фактора была установлена, а сам он был назван HIF-1α (сокр. от hypoxia-inducible factor 1). Строго говоря, активатором оказался гетеродимер из целых двух транскрипционных факторов: HIF-1α (или просто HIF-1) и HIF-1β (более известного как ARNT). Именно в виде двойного комплекса HIF-1α/ARNT способен к переносу в ядро и связыванию c ДНК-последовательностью-энхансером [3].
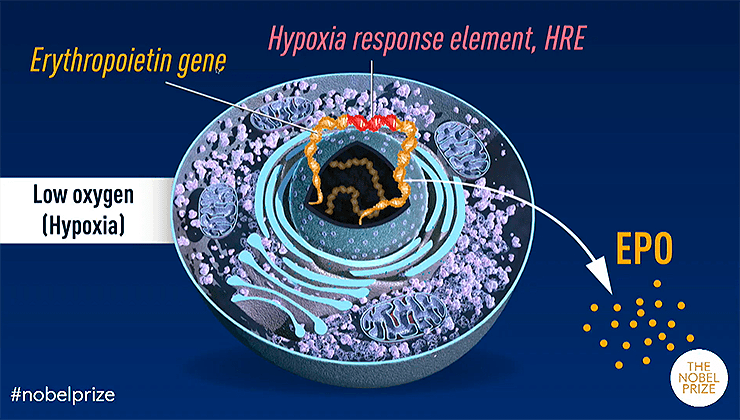
Рисунок 1. Экспрессия гена эритропоэтина (EPO) регулируется фактором HIF-1α, который связывается с энхансером (HRE)
Одновременно регуляцией активности гена эритропоэтина занимался [4] и другой герой сегодняшнего рассказа — нынешний профессор Оксфорда, англичанин Питер Рэтклифф. К середине 1990-х работы научных групп, возглавляемых обоими нашими героями, показали, что HIF-1α является не просто активатором экспрессии эритропоэтина в отдельных клетках почек, а одним из важнейших транскрипционных факторов, управляющим множеством метаболических процессов во всех клетках тела [5], [6]. Более того, на рубеже 2000-х были опубликованы работы, продемонстрировавшие вовлечение HIF-1α в регуляцию пролиферации раковых клеток [7], ангиогенез, апоптоз и еще ряд других клинически значимых процессов [8]. Стало очевидно, что открытый не так давно белок уверенно входит в компанию пары дюжин ключевых для жизнедеятельности клетки транскрипционных факторов.
И тут, наконец, мы подходим к третьему герою нашего сегодняшнего рассказа — профессору Гарвардского университета Уильяму Келину. На рубеже веков основным направлением работы Келина было изучение болезни Гиппеля—Линдау. Это довольно редкое наследственное аутосомно-доминантное заболевание проявляется в предрасположенности пациента к целому набору различных сильно васкуляризированных опухолей, вырабатывающих большое количества фактора роста эндотелия сосудов. К тому моменту уже был идентифицирован белок [9], мутация в котором приводит к болезни Гиппеля—Линдау. Сегодня он известен как опухолевый супрессор VHL, или pVHL (сокр. от von Hippel—Lindau disease). Индуцировав синтез нормального pVHL в клетках карциномы почки, несущих мутантный ген VHL, исследователям из группы Келина еще в середине 90-х удалось добиться снижения производства целого ряда белков гипоксического ответа — VEGF, глюкозного транспортера GLUT1 и тромбоцитарного фактора роста PDGFβ [10]. Спустя несколько лет, уже знакомая нам оксфордская группа Рэтклиффа показала, что белок pVHL каким-то образом дестабилизирует транскрипционный фактор HIF-1, отправляя его на протеасомную деградацию [11]. Однако сам характер взаимодействия двух белков всё еще оставался неуловим. Удалось выяснить лишь то, что это взаимодействие каким-то образом зависит от присутствия достаточных количеств кислорода.
Кажется, что все элементы мозаики регуляторного каскада уже легли на стол перед учеными. Оставалось только собрать их в нужном порядке. Эту задачу выполнила опубликованная в 2001 году в Science работа гарвардской группы Уильяма Келина и его соавторов [12]. Оказалось, что pVHL является частью комплекса убиквитинлигазы E3, навешивающей на белки убиквитин и отправляющей их в клеточную машину разрушения — протеасому [13–15]. При этом сам pVHL выполняет роль своеобразного умного адаптера, заставляя убиквитинлигазу садится на HIF-1 и приговаривать его к смерти, но только тогда, когда на его поверхности появляется подходящая «посадочная площадка». А появляется эта посадочная площадка только под действием кислорода благодаря ферменту пролилгидроксилазе (а точнее — Fe(II)-/2-оксоглутаратзависимой HIF-пролилгидроксилазе [16]), гидроксилирующей ряд аминокислотных остатков на поверхности HIF-1 под действием кислорода. Этот фермент и является кислородным сенсором, отправляющим HIF-1 на деградацию в оксигенных условиях и прекращающим свое действие (и сохраняющим тем самым HIF-1) в условиях гипоксии (рис. 2). (Подробнее о гипоксии и кислород-чувствительных системах эукариот вы можете прочитать в обзоре «Гипоксия, негипоксическая гипоксия и иммунитет» [17].)
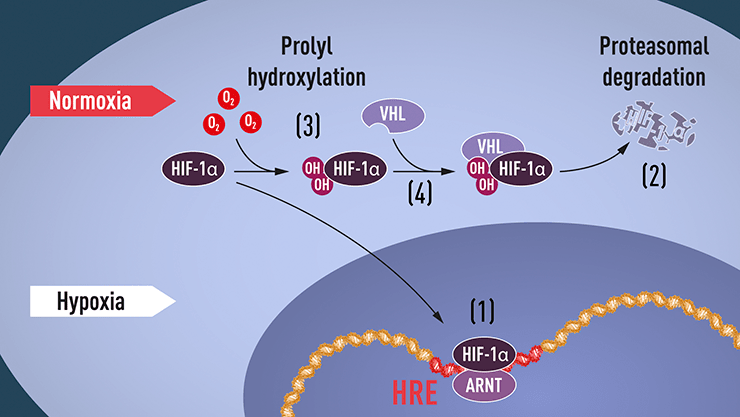
Рисунок 2. При низком уровне кислорода транскрипционный фактор HIF-1α защищен от деградации и накапливается в ядре, где он в составе гетеродимера с ARNT связывается с энхансерной последовательностью HRE, активируя ряд генов (в том числе ген эритропоэтина) (1). При нормальном уровне кислорода HIF-1α быстро разрушается в протеасоме (2). Этот процесс обусловлен тем, что в присутствии кислорода HIF-1α гидроксилируется пролилгидроксилазой (3), что позволяет белку VHL связаться с ним, обеспечив его убиквитинирование убиквитинлигазой E3 и последующее расщепление в протеасоме (4).
Позднейшие исследования показали, что открытый героями нашего рассказа механизм кислородной рецепции является довольно древним эволюционным приобретением; он консервативен для всех многоклеточных животных [18]. По-видимому, именно эта эволюционная древность сделала HIF-1 важным компонентов сразу нескольких регуляторных каскадов, поставив его буквально на перекресток гипоксии, воспаления и онкогенеза [19]. По современным данным, транскрипционный фактор HIF-1 управляет экспрессией более чем 300 различных генов (рис. 3). Сейчас HIF-1 рассматривается в качестве перспективной мишени противораковых препаратов [20]. По-видимому, именно это одновременно фундаментальное и потенциально прикладное значение открытия заставило Нобелевский комитет сделать свой выбор в пользу трио Келина, Рэтклиффа и Семензы.
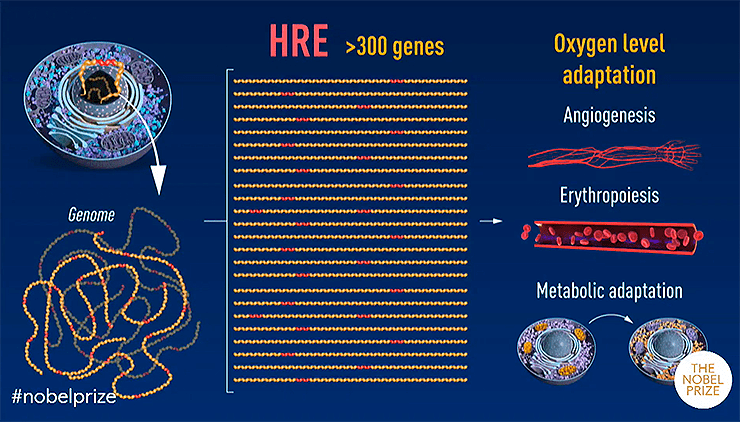
Рисунок 3. Транскрипционный фактор HIF-1 управляет экспрессией более чем 300 различных генов
Чтобы лучше разобраться в значении работ, удостоившихся столь высокой оценки, мы попросили прокомментировать этот вопрос Всеволода Белоусова — заведующего Отделом метаболизма и редокс-биологии ИБХ РАН. Всеволод дал «Биомолекуле» развернутый комментарий:
Значение регуляции HIF в биологии трудно переоценить. Во-первых, кислород является центральным условием существования аэробной жизни, а значит, от его доступности зависят практически все процессы в аэробных живых системах. Клетке очень важно чувствовать малейшие отклонения в уровне кислорода и быстро реагировать на них. Во-вторых, это открытие, несомненно, важно для медицины, поскольку ингибиторы HIF — потенциальные противораковые препараты, и в настоящее время ведется интенсивный поиск таких соединений. Нет практически ни одного аспекта онкогенеза, который не регулировался бы каскадом HIF, нет только хороших ингибиторов. В-третьих, HIF — это красивый пример того, как природа решила проблему быстрого ответа на гипоксию. Если бы ответ на гипоксию реализовывался “традиционным” образом, были бы белки-сенсоры на кислород, они бы при гипоксии связывались с промотором HIF, запускали бы экспрессию этого гена, уровень HIF постепенно возрастал бы, что приводило бы к активации таргетных HIF-зависимых генов. Просто, но долго. Но клетке важно очень быстро реагировать на гипоксию. Поэтому она постоянно синтезирует HIF, который тут же гидроксилируется и деградирует в протеасоме. При гипоксии его экспрессию не нужно активировать, она и так активна, HIF просто перестает гидроксилироваться и деградировать, мгновенно накапливается, идет в ядро и запускает свои таргетные гены.
Возможно, выбор Нобелевского комитета оставил кого-то в удивлении. Ведь пока не удостоились премии ни создатели нашумевшей системы CRISPR-Cas9 [21], ни отцы современных NGS-технологий [22] и прочих методов, изменивших лицо современных наук о жизни. Действительно, открытия наших сегодняшних героев не привели к революции в методах исследования и пока что не совершили переворот в медицине, как это было с лауреатами прошлого года [23]. Однако нет ни малейшего сомнения, что их фундаментальная работа сделала прорыв в понимании регуляторных механизмов клетки, дав мощный толчок множеству дальнейших, в том числе и прикладных, исследований, плоды которых нам еще предстоит увидеть.
Литература
- F. K. Lin, S. Suggs, C. H. Lin, J. K. Browne, R. Smalling, et. al.. (1985). Cloning and expression of the human erythropoietin gene.. Proceedings of the National Academy of Sciences. 82, 7580-7584;
- G. L. Semenza, M. K. Nejfelt, S. M. Chi, S. E. Antonarakis. (1991). Hypoxia-inducible nuclear factors bind to an enhancer element located 3′ to the human erythropoietin gene.. Proceedings of the National Academy of Sciences. 88, 5680-5684;
- G. L. Wang, B. H. Jiang, E. A. Rue, G. L. Semenza. (1995). Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension.. Proceedings of the National Academy of Sciences. 92, 5510-5514;
- Patrick H. Maxwell, Mark K. Osmond, Christopher W. Pugh, Andrew Heryet, Lynn G. Nicholls, et. al.. (1993). Identification of the renal erythropoietin-producing cells using transgenic mice. Kidney International. 44, 1149-1162;
- John D. Firth, Benjamin L. Ebert, Peter J. Ratcliffe. (1995). Hypoxic Regulation of Lactate Dehydrogenase A. J. Biol. Chem.. 270, 21021-21027;
- Charles M. Wiener, Greg Booth, Gregg L. Semenza. (1996). In VivoExpression of mRNAs Encoding Hypoxia-Inducible Factor 1. Biochemical and Biophysical Research Communications. 225, 485-488;
- Zhong H., De Marzo A.M., Laughner E., Lim M., Hilton D.A., Zagzag D. et al. (1999). Overexpression of hypoxia-inducible factor 1alpha in common human cancers and their metastases. Cancer Res. 59, 5830–5835;
- Semenza G.L. (2000). HIF-1 and human disease: one highly involved factor. Genes Dev. 14, 1983–1991;
- F Latif, K Tory, J Gnarra, M Yao, F. Duh, et. al.. (1993). Identification of the von Hippel-Lindau disease tumor suppressor gene. Science. 260, 1317-1320;
- O. Iliopoulos, A. P. Levy, C. Jiang, W. G. Kaelin, M. A. Goldberg. (1996). Negative regulation of hypoxia-inducible genes by the von Hippel-Lindau protein.. Proceedings of the National Academy of Sciences. 93, 10595-10599;
- Patrick H. Maxwell, Michael S. Wiesener, Gin-Wen Chang, Steven C. Clifford, Emma C. Vaux, et. al.. (1999). The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature. 399, 271-275;
- M. Ivan, K. Kondo, H. Yang, W. Kim, J. Valiando, et. al.. (2001). HIFalpha Targeted for VHL-Mediated Destruction by Proline Hydroxylation: Implications for O2 Sensing. Science. 292, 464-468;
- Вездесущий убиквитин;
- «Вездесущий убиквитин» возвращается;
- Как клетка убирает мусор;
- John S. Scotti, Ivanhoe K. H. Leung, Wei Ge, Michael A. Bentley, Jordi Paps, et. al.. (2014). Human oxygen sensing may have origins in prokaryotic elongation factor Tu prolyl-hydroxylation. Proc Natl Acad Sci USA. 111, 13331-13336;
- Гипоксия, негипоксическая гипоксия и иммунитет;
- William G. Kaelin, Peter J. Ratcliffe. (2008). Oxygen Sensing by Metazoans: The Central Role of the HIF Hydroxylase Pathway. Molecular Cell. 30, 393-402;
- Kuppusamy Balamurugan. (2016). HIF-1 at the crossroads of hypoxia, inflammation, and cancer. Int. J. Cancer. 138, 1058-1066;
- Georgina N. Masoud, Wei Li. (2015). HIF-1α pathway: role, regulation and intervention for cancer therapy. Acta Pharmaceutica Sinica B. 5, 378-389;
- Как CRISPR/Cas работает не по специальности;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018).
Комментарии
Публикация отправлена в дорогую редакцию

Что-то пошло не так. Проверьте ваше интернет-соединение