Научные статьи железодефицитная анемия у детей
Библиографическое описание:
Махмудова Б. Ш., Алматова Н. Профилактика железодефицитной анемии у детей // Молодой ученый. 2017. №25. С. 185-187. URL https://moluch.ru/archive/159/44922/ (дата обращения: 23.03.2020).
Весьма актуальной остается проблема дефицита железа (ДЖ) беременных женщин в связи с ее частотой, высоким уровнем распространенности, тяжёлыми последствиями для плода и новорожденного.
По данным ВОЗ даже в экономически развитых странах дефицит железа встречается у 20–80 % женщин. Частота ДЖ в регионах СНГ различна.
Это связано с различными климатогеографическими условиями, с характером питания, с неоднозначным воздействием вредных факторов внешней среды на организм детей [1, 2, 3, 4, 6]. Важнейшей задачей практического здравоохранения является определение комплекса мероприятий, направленных на раннюю диагностику, профилактику у женщин детородного возраста, ибо одна из клинических форм ДЖ — анемия вызывает состояние хронической гипоксии, что обусловливает нарушение развития плода и организма ребенка в любой гестационный период.
Особое значение в проведении предупреждения развития ДЖ имеет ферропрофилактика, как конструктивный вид мероприятия. При выборе препарата железа нами учитывались органолептические свойства, побочные действия и сроки применения препаратов с целью создания стабильного депо железа в организме. Исходя из нашего опыта, таким препаратом железа был Актиферрин, применяемый с лечебной целью, показавший высокий терапевтический эффект при отсутствии побочных действий, хорошие органолептические свойства. Мы использовали этот препарат для профилактики ДЖ. Исходя из этого, нами поставлена цель изучить эффективность применения Актиферрина для антенатальной профилактики дефицита железа у детей.
Материалы иметоды исследования: Втаблице 1 представлены сведения о контингенте, количестве лиц, которым проводилась ферропрофилактика.
Таблица 1
Контингент лиц, количество наблюдений, продолжительность дачи препарата (абс. число)
Контингент | Количество | Продолжительность дачи препарата |
− от матерей, получавших Актиферрин. − от матерей, не получавших препараты железа | 50 15 15 | Актиферрин в течение 1 мес. в 1 и в 2 триместрах |
Всего | 150 ч. |
Актиферрин (Австрия) беременным женщинам назначался из расчета — ежесуточный прием по одной капсуле, содержащий 171 мг сульфата железа и 129 мг Д,L серина. Препарат принимали женщины в течение 2-х месяцев (по 1 месяцу в 1 и 2 триместре беременности).
Определение гемоглобина производили гемоглобинцианидным методом, который является наиболее воспроизводимым и точным методом. Этот метод признан и рекомендован Международным комитетом по стандартизации в гематологии (1CSH) как наиболее надежный.
Определение железа в сыворотке производили с помощью биотеста «Железо» выпускаемый фирмой Lachema (Чехия).
Результаты иобсуждение. Как показали наши наблюдения, уже на 5–7 день приема препарата происходило максимальное увеличение содержания железа в сыворотке и интенсивное повышение уровня гемоглобина на фоне хорошей переносимости.
Исследования Sadowsky et all. [6, 7] сравнили резорбцию железо-серинового комплекса сульфата железа: у лиц, получавших Актиферрин уже через 2 часа достигались максимальной активности плазмы по Fe-59, которая значительно превышала таковую в группе сравнения.
Динамика уровня гемоглобина и сывороточного железа у беременных женщин в процессе ферропрофилактики дефицита железа (М±m).
Таблица 2
Показатели | Исходный уровень | Сроки исследования | |||
1триместр | III триместр | После родов | Через 1 мес. | ||
Нb, г/л | 124±1,45 128 ±2,42 | 138±1,68 120±1,94 | 156±1,84 110±1,8 | 140±2.02 90±1,24 | 150±24 82±0,92 |
СЖ, мкмоль/л | 11,6±1,2 12,0±0,9 | 15,2±0,9 10,0±0,8 | 18,8±1,4 9,4±0,7 | 16,0±1,5 8,2±0,7 | 17,0±0,8 7,4±0,6 |
Примечание: вчислителе — показатели крови беременных женщин, получавших в знаменателе — контрольная группа (показатели беременных женщин, не ферропрофилактику)
В таблице 2 показана динамика содержания сывороточного железа и гемоглобина у беременных женщин в процессе ферропрофилактики.
Исследование уровней гемоглобина и сывороточного железа у беременных на фоне ферропрофилактики показало положительную динамику интенсивного увеличения концентрации железа в сыворотке крови и значительный рост уровня гемоглобина, что не происходло у беременных сравниваемой группы, которым проводилась превентивная профилактика ДЖ. Следует отметить, что после отмены препарата, спустя месяц, содержание сывороточного гемоглобина оставалось на высоком уровне, что свидетельствует о стабильности и депо железа в организме женщины — матери в постнатальном периоде.
Доказательством ликвидации эндогенного дефицита железа явились результаты исследования содержания сывороточного железа и гемоглобина у новорожденных от матерей, которым, проводилась ферропрофилактика, что представлено в таблице 3, в которой показаны данные высокого уровня гемоглабина.
Таблица 3
Содержание гемоглобина и сывороточного железа у новорожденных от матерей, получавших актиферрин во время беременности (М ± т)
Показатели | Группа детей | Сроки исследования | ||
1-й день жизни | 30-й день жизни | Р | ||
Гемоглобин,г/л | I группа | 190 ±2,40 | 160±2,20 | |
II группа | 140±1,90 | 110±2,06 | ||
Сывороточная железа, мкмоль/л | I группа | 20,0 ±1,4 | 19,8±0,9 | |
II группа | 10,2 ±0,8 | 8,7±0,7 | ||
Примечение:
1 группа — новорожденные дети от матерей, получавших ферропрофилактику.
2 группа — новорожденные дети от матерей, не получавших ферропрофилактику, железа и гемоглобина у детей от матерей, получавших препараты железа, в пределах нормальных величин, эти показатели сохранялись и на 30-й день жизни ребенка.
Выводы.
В результате применения железосеринового комплекса у беременных женщин и их детей происходило интенсивное накопление железа в организме, ликвидация дефицита его, нормализа I гемоглобина, стабильная сохранность содержания железа и гемоглобина в отдаленные сроки наблюдения. Высокая эффективность ферропрофилактики ДЖ у беременных с использованием Актиферрина позволяет его считать препаратом выбора.
Литература:
- Азимжанова М. М. Особенности эритроцитарной системы и развития детей, рожденных от матерей с ЖДА Ташкент, 2003.
- Железодефицитная анемия в педиатрической практики. СПВ// Журнал Медикал экспресс. 2004.
- Таточенко В. К. Педиатру на каждый день. Справочник по лекарственной терапии. Москва. 2003.
- Новый подход к лечению анемии у новорожденных // Информационное письмо. МЗ РУз УМС. Отдел научной медицинской информации ГНМБ 2004.
- Детские болезни Под. ред. Н. П. Шабалов Л. 2008.
- Болезни детей старшего возраста. Под. ред. Баранова М. М., М., 2008.
- Руководства по гематологии. Под. ред. А. И. Воробьёва. 1–2 том. М., 2005.
- Новые педагогические технологии в подготовке врача общей практики. Методическая рекомендация. Ташкент. 2012 г.
Основные термины (генерируются автоматически): сывороточное железо, женщина, высокий уровень, III, продолжительность дачи препарата, беременная, мать, таблица.
В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
В настоящей публикации на основании данных литературы и анализа собственных наблюдений представлены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий, а также принципы их лечения у детей. Установлено, что основной формой дефицитных анемий (ДА) в педиатрической популяции является анемия, обусловленная недостаточным содержанием в организме железа. При этом особо подчеркивается, что железодефицитная анемия (ЖДА) не только наиболее распространенная ДА, но и самое частое гематологическое заболевание у детей [1–3]. С учетом того, что другие типы анемий (в т. ч. развивающиеся при дефиците таких витаминов, как фолиевая кислота и В12) хуже известны врачам-педиатрам, их верификация, как правило, запаздывает, т. к. они ошибочно принимаются за ЖДА. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма и ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения дифференциальной диагностики и лечения анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Дифференциальная диагностика ДА у детей
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).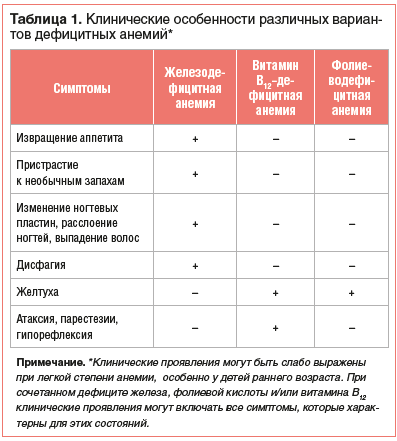
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).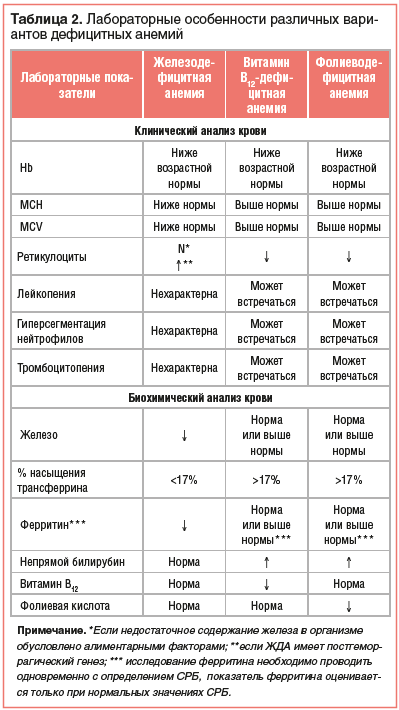
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Лечение ДА у детей
Корректная трактовка клинико-анамнестических данных и результатов лабораторного обследования позволяет верифицировать причину ДА и своевременно назначить адекватную терапию. Принципиально важным при этом является положение о том, что компенсировать дефицитные состояния невозможно только за счет нормализации рациона питания. Основная роль в купировании дефицита железа, фолиевой кислоты и витамина В12 принадлежит заместительной фармакотерапии [1–7]. При этом для лечения ЖДА используются солевые препараты железа или препараты на основе железа гидроксид полимальтозата. Суточная доза препаратов зависит от массы тела и возраста ребенка, расчет при этом проводится по элементарному железу. Так, для солевых препаратов железа, назначаемых внутрь, используются следующие дозы (расчет по элементарному железу!): для детей до 3 лет — 3 мг/кг/сут, для детей старше 3 лет — 45–60 мг/сут, для подростков —
до 120 мг/сут. При использовании пероральных форм железа гидроксид полимальтозата рекомендованные дозы составляют 5 мг/кг/сут (расчет по элементарному железу!). Продолжительность терапии препаратами железа зависит от степени тяжести ЖДА. При легкой ЖДА курс лечения составляет 3 мес., при среднетяжелой форме — 4,5 мес., при тяжелой — до 6 мес. [3].
В случае диагностики фолиеводефицитной анемии заместительная терапия проводится препаратами фолиевой кислоты. Рекомендовано использовать следующие суточные дозы фолиевой кислоты: для детей до 1 года — 0,25–0,5 мг/сут, для детей старше 1 года — 1,0 мг/сут. При синдроме мальабсорбции доза может быть повышена до 5–15 мг фолиевой кислоты в сутки. Терапия проводится в указанных дозах ежедневно на протяжении 4–6 нед. Через 7 дней от начала лечения необходимо выполнить клинический анализ крови с обязательным подсчетом ретикулоцитов (рис. 1). Повышение уровня ретикулоцитов на фоне приема фолиевой кислоты указывает на правильно установленный диагноз и является обоснованием для продолжения терапии. Купирование анемии достигается через 4–6 нед. от начала лечения [6].
Для лечения витамин В12-дефицитной анемии используют препараты цианокобаламина для парентерального введения. При этом рекомендовано придерживаться следующего режима дозирования: для детей до 1 года — 5 мкг/кг/сут, для детей старше 1 года — 100 мкг/сут, для подростков — 200 мкг/сут. Препарат вводится внутримышечно 1 р./сут ежедневно. На 7–10-й день терапии проводят клинический анализ. Выявление ретикулоцитоза позволяет сделать вывод об эффективности проводимого лечения. Терапию следует продолжить в том же режиме дозирования еще в течение 3–4 нед. В дальнейшем, при достижении нормализации уровня гемоглобина, переходят на поддерживающее лечение: цианокобаламин вводят в терапевтической дозе 1 раз в 7 дней в течение 2 мес., а затем 1 раз в 14 дней в течение 6 мес. (рис. 2). Учитывая, что дефицит витамина В12, как правило, редко обусловлен алиментарными факторами, одновременно проводят поиск причин данного патологического состояния (болезнь Крона, целиакия, инвазия широким лентецом, наследственные нарушения всасывания и/или транспортировки витамина В12 и др.) [7]. В тех случаях, когда имеют место полидефицитные состояния с развитием анемического синдрома, оправданно комбинированное заместительное лечение. Чаще всего у детей встречается сочетанный дефицит железа и фолиевой кислоты, что требует одновременного назначения препаратов железа и фолиевой кислоты.
Заключение
Таким образом, выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. Своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка. Авторы выражают надежду, что информация, представленная в настоящей публикации, будет полезна практикующим врачам-педиатрам.
Комментарии
Опубликовано в журнале:
«Вопросы практической педиатрии», 2014, т. 9, №1, с. 1-4 М.В.Эрман
Санкт-Петербургский государственный университет, Санкт-Петербург, Российская Федерация
Железодефицитная анемия является часто встречающимся заболеванием у детей различных возрастных групп. В статье обсуждаются современные проблемы дефицита железа, железодефицитных анемий у детей, распространенность, механизмы развития. Представлены профилактика и лечение железодефицитной анемии. Ключевые слова: дети, железодефицитные состояния, железодефицитная анемия, лечение, Тотема®
Iron-deficiency anemia in children
M.V.Erman
Saint Petersburg State University, Saint Petersburg, Russian Federation
Iron-deficiency anemia is a frequently disease in children of different age groups. The problems concerning deficiency of iron, iron-deficiency anemia in children, frequency, the pathogenesis are discussed during the article. Prophylaxis and treatment of iron-deficiency anemia are represented. Keywords: children, iron–deficiency, iron–deficiency anemia, treatment
Железодефицитные состояния (анемия) являются самой распространенной патологией в мире. Дефицит железа имеют более 3 580 000 000 человек, а железодефицитную анемию – 1 987 300 000 жителей планеты [1]. К анемиям, по классификации ВОЗ, относят состояние, при котором снижено содержание гемоглобина ниже 110 г/л у детей до 6 лет и ниже 120 г/л – старше 6 лет. В материалах заседания Коллегии Министерства здравоохранения РФ «Совершенствование организации специализированной помощи детям с гематологическими и онкологическими заболеваниями» отмечен рост заболеваемости гематологическими заболеваниями за последние 5 лет на 43%, причем в структуре гематологической заболеваемости детей на первом месте стоят анемии. Даже в индустриально развитых странах анемия встречается у 20,1% детей до 4 лет, у 5,9% детей до 14 лет и 22,7% беременных женщин [2].
Особенности обмена железа в детском организме
Антенатальный период. Запасы железа начинают создаваться при поступлении через плаценту. На протяжении нормально протекающей беременности женщина передает плоду 300 мг железа, в среднем 70–75 мг/кг массы тела. Наиболее активно этот процесс протекает, начиная с 28–32-й недели беременности. К плаценте железо матери доставляется трансферрином. Плацента непреодолима для трансферрина беременной. Точный механизм переноса железа не известен. Транспорт железа – активный процесс, который осуществляется против градиента концентрации и только в одном направлении. Предполагается, что в плаценте имеется высокоактивная ферментная система, которая извлекает железо из материнского трансферрина и передает его плацентарному ферритину или фетальному трансферрину. Трансферрин плода «доставляет» железо в костный мозг, где синтезируются эритроциты; в ткани, где железо входит в состав различных ферментных систем. Избыток железа депонируется в печени и мышцах в виде ферритина. Пато логическое течение беременности, сопровождающееся нарушением маточно-плацентарного кровотока и плацентарной недостаточностью, приводят к уменьшению поступления железа в организм плода. Причины нарушения формирования депо железа у плода: недоношенность; патологическое течение беременности (гестозы, угроза прерывания, перенашивание, острые и обострения хронических заболеваний); многоплодие; фетоматеринские и фетоплацентарные кровотечения; профессиональные вредности; железодефицитная анемия у беременной. Решающую роль в депонировании железа играют нарушения маточно-плацентарного кровотока и функциональный статус плаценты [3]. В проекте Viva (США) был изучено потребление железа, уровень гемоглобина во время беременности у 1167 женщин, и в проекте Avon в Великобритании дана оценка материнского статуса железа во время беременности 1225 женщин. Авторы пришли к заключению, что потребление железа во время беременности влияет на уровень железа у новорожденных и детей.
Постнатальный период. После рождения источники железа: экзогенное железо в составе пищевых продуктов; утилизация железа из эндогенных запасов. Антенатальные запасы быстро истощаются. Ежедневная физиологическая потребность в железе детей – 0,5–1,2 мг/сут; рекомендации ВОЗ – 5,0–10,0 мг/сут. В течение первых 3–4 мес жизни материнское молоко является единственным продуктом, который обеспечивает равновесие обмена железа. Причем, железо из женского молока усваивается более эффективно – 38–49%. Из коровьего молока абсорбция железа не превышает 10%. Если не проводится профилактическая терапия сидеропении, то даже при естественном вскармливании к 3-му месяцу у недоношенных и 5–6-му месяцу у доношенных возможно развитие железодефицитной анемии. Полноценная и сбалансированная по основным ингредиентам диета позволяют лишь покрыть физиологическую потребность в железе, но не устранить дефицит. Восполнить дефицит железа только диетотерапией невозможно.
Факторы, нарушающие всасывание железа в желудочно-кишечном тракте: хронические заболевания, синдром мальабсорбции; железодефицитные состояния; пищевые и лекарственные вещества; недостаток эритропоэтина.
Вещества, стимулирующие всасывание Fe: аскорбиновая кислота, янтарная кислота, молочная кислота, лимонная кислота, спазмолитики, средства, стимулирующие желудочную секрецию.
Вещества, тормозящие всасывание Fe: фитаты, полифенол, оксалаты, карбонаты, фосфаты, кальций, антациды, нестероидные противовоспалительные средства.
Последствия недостатка железа у детей. Уменьшение содержания железа в сыворотке крови, костном мозге и тканевых депо приводит к снижению темпов синтеза и нарушению образования гемоглобина; развитию гипохромной анемии; трофическим расстройствам в тканях; замедленному моторному развитию и нарушению координации; замедленному развитию речи; психологическим и поведенческим отклонениям (невнимание, слабость, неуверенность и т.д.); снижению физической активности.
Следует подчеркнуть, что при выявлении латентного дефицита железа (общая железосвязывающая способность > 58,0 мкмоль/л, ферритин сыворотки крови Диагностические критерии железодефицитной анемии:
- преобладающее снижение концентрации гемоглобина (Hb), количество эритроцитов может быть нормальным и уменьшается только при значительном дефиците Hb.;
- уменьшение цветового показателя менее 0,8;
- микроцитоз эритроцитов;
- снижение уровня Fe в сыворотке крови (норма 0,7–1,7 мг/л или 12,5–30,4 мкмоль/л);
- уменьшение содержания сывороточного ферритина, который характеризует депонированный (тканевой фонд Fe) [менее 50 мкг/л – у детей до года; менее 15 мкг/л – у детей старше 3 лет].
По степени тяжести анемия подразделяется на легкую – Hb 90–110 г/л; среднюю – Hb 70–89 г/л; тяжелую – Hb менее 70 г/л.
Лечение железодефицитной анемии
Основные принципы терапии железодефицитных анемий были сформулированы в 1981 г. Л.И. Идельсоном.
- Возместить дефицит железа без лекарственных железосодержащих препаратов невозможно.
- Терапия железодефицитных состояний должна проводиться преимущественно препаратами железа для перорального приема.
- Терапия железодефицитной анемии не должна прекращаться после нормализации уровня гемоглобина.
- Гемотрансфузии при железодефицитной анемии должны проводиться только по жизненным показаниям.
Сегодня принципы лечения железодефицитной анемии выглядят следующим образом.
- Выбор места лечения (амбулаторно, в стационаре).
- Путь введения препарата железа.
- Индивидуальный подбор препарата и схема приема (циркадные ритмы).
- Половинная доза препарата в первые дни лечения.
- Контроль лечения: лабораторный (ретикулоцитарный криз), клинический.
- Достаточная продолжительность курса: 3–6 мес – основное лечение + 1–2 мес – поддерживающее.
- Устранение причины анемии.
Один из основополагающих принципов педиатрии «здоровая девочка – здоровая женщина – здоровая мать – здоровый ребенок». Необходимо соблюдение адекватного питания женщинами фертильного возраста и компенсация препаратами железа повышенных его потерь. Распространенность дефицита Fe у беременных в России: дефицит железа – 29%; железодефицитная анемия – 19,2% (1-й триместр – 5,9%; 2-й – 15,0%; 3-й – 21,5%).
В лечении железодефицитных состояний и анемии ведущую роль играет пероральный прием железосодержащих препаратов. Это объясняется следующими положениями.
- Пероральный прием препаратов железа повышает уровень гемоглобина только на 2–4 дня позже, чем при парентеральном введении.
- Пероральный прием крайне редко, в отличие от парентерального, приводит к побочным эффектам.
- Пероральный прием при ошибочной трактовке анемии как железодефицитной не приводит к развитию гемосидероза.
В настоящее время существует большой выбор железосодержащих препаратов и для врача, особенно молодого, важно «не заблудиться в железном лесу», поэтому для лечения этих состояний так важен выбор быстродействующего и обладающего хорошей переносимостью препарата (рисунок). У детей предпочтение отдается пероральным (по способу введения), двухвалентным препаратам железа в виде органической соли, с высокой биодоступностью и имеющим хорошую переносимость, низкую частоту нежелательных проявлений и высокую эффективность. В последние годы среди препаратов железа все большее внимание педиатров привлекает препарат Тотема® (Laboratoire INNOTECH INTERNATIONAL, Франция). Н.И.Стуклов приводит ретроспективный мета-анализ 30 исследований о применении препарата Тотема®, включающих 1077 пациентов, и дает высокую оценку его эффективности и хорошей переносимости [5]. Тотема® содержит органическую соль двухвалентного железа, медь и глюконат марганца, что дает возможность быстро восстановить нормальный уровень гемоглобина и депо железа при хорошей переносимости. Жидкая форма препарата позволяет ему распределяться по слизистой кишечника, облегчая всасывание, что, в конечном итоге, позволяет снизить эффективную профилактическую дозу железа по сравнению с другими препаратами железа. Тотему можно назначать женщинам во время беременности и вскармливания грудью и детям старше трех месяцев.
Рисунок. Препараты железа (по Стуклову Н.И., Семеновой Е.Н. [4]).
При латентном дефиците железа для оценки толерантности желудочно-кишечного тракта к препарату Тотема® ребенок в течение 3 дней получает его 1 раз в день в дозе 1,0 мг/кг [6]. Препарат дается между кормлениями, при хорошей переносимости доза увеличивается до терапевтической (2,5 мг/кг/сут). Суточная доза делится на 3 приема. Препарат дается между кормлениями. Срок лечения — 2 мес.
В случае железодефицитной анемии для оценки толерантности желудочно-кишечного тракта к препарату ребенок в течение 3 дней получает препарат Тотема® 1 раз в день в дозе 1,0 мг/кг между кормлениями, при хорошей переносимости доза увеличивается до терапевтической (5,0 мг/кг/сут). Суточная доза делится на 3 приема. Препарат дается между кормлениями. При нормализации уровня гемоглобина (обычно через 2–3 нед) доза снижается до поддерживающей (2,5 мг/кг/сут). Длительность приема Тотема® 3 мес.
Проведено лечение железодефицитной анемии в амбулаторных условиях у 15 детей в возрасте от 3 до 7 лет (мальчики – 9, девочки – 6) препаратом Тотема®. У детей исследуемой группы не было хронических заболеваний, пороков развития. Анемия легкой степени отмечена у 86,7%, средней степени тяжести – у 13,3% детей. Нормализация уровня гемоглобина у детей с анемией легкой степени тяжести произошла к 9-му дню, анемии средней степени тяжести – к 15-му дню.
Из побочных действий только у одного ребенка (6,7%) отмечены легкие, непродолжительные диспепсические проявления. Они не потребовали отмены препарата. На 5-й дней ребенку был назначен пробиотик Аципол®.
Лечение у всех пациентов успешно завершено.
Профилактика железодефицитных состояний в различные возрастные этапы.
Пренатальная профилактика железодефицитных состояний:
- сбалансированное питание беременной женщины с дополнительным использованием специализированных продуктов или витаминно-минеральных комплексов;
- здоровый образ жизни (отказ от вредных привычек), прогулки, занятия физкультурой;
- контроль гемоглобина крови беременной женщины;
- санация очагов хронической инфекции;
- обследование на наличие бактериальных и вирусных инфекций (по показаниям);
Постнатальная профилактика железодефицитных состояний:
- поддержка и поощрение грудного вскармливания;
- сбалансированное питание кормящей матери, обеспечивающее физиологические потребности ее и ребенка в нутриентах (в том числе железе) за счет дополнительного введения специализированных продуктов или витаминно-минеральных комплексов;
- своевременное назначение продуктов прикорма промышленного производства, обогащенных железом (не позднее 6 мес).
ЛИТЕРАТУРА
1. WHO Global Database on Anaemia Geneva, World Health Organization, 2008.
2. WHO Global Database on Iron Deficiency and Anaemia, Micronutrient Deficiency Information System. Geneva, World Health Organization. 2005.
3. Эрман МВ. Лекции по педиатрии. СПб.: «Издательство ФОЛИАНТ», 2001.
4. Стуклов НИ, Семенова ЕН. Лечение железодефицитной анемии. Что важнее, эффективность или переносимость? Существует ли оптимальное решение? Журнал международной медицины. 2013;1(2):47-55.
5. Стуклов НИ. Мета-анализ данных переносимости питьевой формы глюконата железа (II), меди и марганца (препарат Тотема) при лечении железо-дефицитной анемии у детей и взрослых. Земский врач. 2012;15(4):11-9.
6. Квезерели–Коладзе АН, Мтварелидзе ЗГ. Применение препарата Тотема при лечении железодефицитной анемии у детей раннего возраста. Современная педиатрия. 2010;4(32):35-8.
References
1. WHO Global Database on Anaemia Geneva, World Health Organization, 2008.
2. WHO Global Database on Iron Deficiency and Anaemia, Micronutrient Deficiency Information System. Geneva, World Health Organization. 2005.
3. Erman MV. Lektsii po pediatrii. Saint Petersburg: «FOLIANT» Publ., 2001. (In Russian).
4. Stuklov NI, Semenova YeN. Lecheniye zhelezodefitsitnoy anemii. Chto vazhneye, effektivnost ili perenosimost? Sushchestvuyet li optimalnoye resheniye? Zhurnal mezhdunarodnoy meditsiny. 2013;1(2):47-55. (In Russian).
5. Stuklov NI. Meta-analiz dannykh perenosimosti pityevoy formy glyukonata zheleza (II), medi i margantsa (preparat Totema) pri lechenii zhelezo-defitsitnoy anemii u detey i vzroslykh. Zemskiy vrach. 2012;15(4):11-9. (In Russian).
6. Kvezereli–Koladze AN, Mtvarelidze ZG. Primeneniye preparata Totema pri lechenii zhelezodefitsitnoy anemii u detey rannego vozrasta. Sovremennaya pediatriya. 2010;4(32):35-8. (In Russian).
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)


