Наследственно обусловленный гемолиз эритроцитов характерен для следующих анемий
Эритроцитопатии. Наиболее часто встречается – наследственный семейный сфероцитоз (микросфероцитоз, болезнь Минковского – Шоффара, белковозависимая мембранопатия).
Заболевание наследуется аутосомно-доминантным путем.
В основе его развития лежит дефект структуры мембраны эритроцитов, что приводит к изменению их формы с дискоидной на сферическую. Такие эритроциты не деформируются и при прохождении через узкие капилляры теряют часть мембранного вещества, уменьшаются в размерах, разрушаются. Их мембрана становится высоко проницаемой для ионов натрия и воды. На удаление натрия расходуется больше энергии (глюкозы, АТФ), чем в норме. В крови, где глюкозы достаточно, натриевый насос обеспечивает выведение избытка натрия. В межсинусовых пространствах селезёнки, где содержание глюкозы снижено, натрий не выводится, что приводит к осмотическому гемолизу эритроцитов. Основными клиническими проявлениями заболевания являются периодические гемолитические кризы, анемия, желтуха, спленомегалия, уробилинемия, уробилинурия, повышение температуры, трофические язвы голени в результате микротромбоза.
При этом содержание Нb и эритроцитов в крови уменьшается, развивается нормохромия, микросфероцитоз, ретикулоцитоз (10 % и более), снижается осмотическая резистентность эритроцитов. Во время гемолитических кризов наблюдается нейтрофильный лейкоцитоз.
К наследственно-обусловленным эритроцитопатиям (мембранопатиям) относятся также овалоцитоз (эллиптоцитоз), стоматоцитоз, акантоцитоз и другие ГА, получившие свое название от присущей им характерной формы эритроцитов (см. выше).
Ферментопатии (энзимопатии) объединяют группу ГА, которые проявляются недостаточностью активности ферментов эритроцитов, участвующих в процессе их энергетического обеспечения. В странах, прилегающих к Средиземному морю, Латинской Америки, Африки, Азии часто встречается анемия, вызванная дефицитом активности глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ) эритроцитов. Существуют две основные мутантные формы данного фермента. Одна из них (форма В) распространена среди европейцев, другая (форма А) – среди негритянского населения Африки. Заболевание передается по кодоминантному типу, сцеплено с Х-хромосомой. Ген, отвечающий за продуцирование Г-6-АДГ эритроцитов, располагается в Х-хромосоме рядом с геном цветного зрения и геном гемофилии. Лица, страдающие дефицитом Г-6-ФДГ эритроцитов, как и лица с серповидноклеточной анемией, реже погибают от тропической малярии, что обусловливает преимущественное распространение этой патологии в «малярийных» регионах. Для болезни характерно раннее проявление, нередко в период новорожденности. Она может сочетаться с гемофилией и дальтонизмом и клинически проявляется главным образом у мужчин. У женщин яркая клиника возможна только в случае наличия у них гомозиготности по данному гену.
При недостаточной активности Г-6-ФДГ в эритроцитах нарушается аэробное окисление глюкозы, что ослабляет процессы образования восстановленного НАДФ и восстановления глютатиона, необходимого для защиты Нb и мембраны эритроцитов от окислителей, в том числе и лекарственных веществ. При приеме обычных лечебных доз лекарств – окислителей (противомалярийных препаратов, сульфаниламидов, производных салициловой кислоты и др.) происходит окисление Нb, гем исчезает из его молекулы, выпадают в осадок цепи глобина в виде телец Гейнца.
Эритроциты освобождаются от них в селезёнке. При этом утрачивается часть их мембранного вещества, в результате чего они подвергаются гемолизу, развивается гемолитический криз, прекращающийся после того, как все эритроциты с дефицитом Г-6-ФДГ разрушаются (феномен «самоограничения» гемолиза). Аналогичная картина наблюдается также при приеме с пищей конских бобов (фавизм – «багдадская весенняя лихорадка», распространена в Ираке в период цветения бобовых растений), иногда при вирусных инфекциях, гиповитаминозах Р, С, Е, отравлениях анилином, бензолом, фенилгидразином, в результате приема с пищей в больших количествах голубики, черники, вдыхания пыльцы трав, деревьев и т.д. (болезнь встречается в Беларуси).
Для гемолитических кризов характерны: высокая температура, головная боль, адинамия, гемоглобинурия, желтуха, гепатомегалия. Эти явления обусловливаются освобождающимися при повреждении эритроцитов медиаторами воспаления, в том числе и пирогенными цитокинами.
В картине крови отмечаются: Нb – 20-40 г/л, эритроциты до 1х1012/л, ретикулоцитоз, эритроциты с тельцами Гейнца, анизоцитоз, пойкилоцитоз, дегмациты, шизоциты, базофильная пунктация эритроцитов, нормобластоз, нейтрофильный лейкоцитоз со сдвигом влево (до миелоцитов).
Гемоглобинопатии (гемоглобинозы) возникают в результате наследственных нарушений синтеза глобина. Они могут быть качественные, обусловленные изменением первичной структуры Нb (серповидноклеточная анемия), и количественные, обусловленные нарушением скорости процесса синтеза одной из цепей глобина (талассемии). Большинство гемоглобинопатий наследуется аутосомно-доминантно. Данная патология встречаются главным образом в странах жаркого климата: в Центральной Африке, Азии, на Кубе. В некоторых районах Центральной Африки носительство гена серповидноклеточной анемии достигает 40-45 %. Гомозиготное носительство дает высокую детскую смертность.
Серповидноклеточная анемия (гемоглобинопатия S, дрепаноцитоз) – наиболее частая форма патологии, связанная с аномалией структуры Нb. Распространена она во многих тропических районах Африки, где малярия носит эндемический характер. Возникает эта патология, когда в b — цепи Нb глютаминовая аминокислота заменяется на валин, что ведет к изменению физико-химических свойств молекулы гемоглобина (HbS). В восстановленном состоянии растворимость НbS резко снижается, молекулы агрегируют, и в результате образуется гель и кристаллы. Появляющиеся при этом полимеры представляют собой длинные нити, группирующиеся в так называемые тактоиды. Последние изменяют форму эритроцита, в результате чего формируются серповидные эритроциты (дрепаноциты), которые легко подвергаются гемолизу. В дрепаноцитах погибают малярийные плазмодии. Причина их гибели – снижение концентрации калия, возникающее в эритроците в состоянии дезоксигенации НbS, обусловленного повреждением плазматической мембраны и физическим повреждением паразитов агрегатами Нb.
Клинически заболевание проявляется в том случае, если содержание НbS в эритроцитах превышает 45 % или менее того, но при попадании больного в условия сниженного парциального давления кислорода (высокогорье, высотный полет и т.п.). При этом периодически возникают гемолитические, апластические, полиурические, никтурические, острые болевые, окклюзионные кризы. Их провоцируют гипоксия и ацидоз любого происхождения. Болевые приступы связаны с агрегацией дрепаноцитов в кровеносном русле, формированием микроэмболов, микротромбозом сосудов с развитием инфарктов различных органов, инсультов, «грудного синдрома» (окклюзия ветвей легочной артерии), ишемией и отслойкой сетчатки. Хроническая гипоксия и нарушение текучести крови приводят к гиперфункции миокарда и перегрузочной сердечной недостаточности. У больных отмечается вторичный иммунодефицит, повышенная восприимчивость к инфекциям, особенно в детском возрасте.
Для картины крови данного заболевания характерны анемия со значительным снижением числа эритроцитов и Нb, гипо- или нормохромия, анизоцитоз, пойкилоцитоз, базофильная пунктация эритроцитов, наличие дрепаноцитов, ретикулоцитоз, иногда нормобластоз, во время гемолитического криза – нейтрофильный лейкоцитоз со сдвигом влево, тромбоцитоз.
Талассемии (болезнь Кули, средиземноморская анемия) объединяют группу наследственных анемий, при которых наличие мутантного гена приводит к торможению синтеза цепей глобина, дефициту НbА.
Различают a- и b-талассемию. Чаще встречается b-талассемия, при которой отсутствует или уменьшен синтез b-цепей глобина. В этом случае уменьшается количество НbА, в состав которого входят по две a- и b-цепи, а содержание НbА2 (по две a- и g-цепи) и НbF (по две a- и Ay — цепи) возрастает. Избыточно синтезирующиеся a-цепи образуют нестабильный Нb, возникают его преципитаты, содержащие их эритроциты удаляются клетками макрофагально-фагоцитарной системы. При этом повреждается мембрана эритроцитов, лишние a-цепи взаимодействуя с SH-группами этой мембраны, увеличивают ее проницаемость, что также способствует повышеннию гемолиза эритроцитов. Нарушается синтез гема и метаболизм железа.
У гомозигот развивается тяжелая гемолитическая анемия (большая талассемия, болезнь Кули), приводящая к высокой детской смертности на 1-м или 5-8-м году жизни. Характерен «монголоидный» тип лица, бледность и желтушность кожных покровов, язвы на нижних конечностях, спленомегалия, отставание в росте и развитии; рентгенологически у больных выявляется череп «ежика» (игольчатый периост теменных и лобных костей).
Гетерозиготы по генам талассемии отличаются повышенной устойчивостью к малярии (эритроциты с сокращенным сроком жизни ранее подвергаются фагоцитозу, при котором плазмодий гибнет). Эта форма b-талассемии протекает значительно легче, чем другие формы.
При нарушении синтеза a-цепей возникает a-талассемия. Гомозиготное носительство приводит к внутриутробной гибели плода, гетерозиготное – к гемолитической анемии различной тяжести.
В картине крови отмечаются гипохромная анемия (ЦП = 0,5 – 0,4), анизоцитоз, микроцитоз, пойкилоцитоз, гипохромия, большое количество мишеневидных эритроцитов (тороцитов), базофильная пунктуация эритроцитов; ретикулоцитоз (5-10 %), умеренный нейтрофильный лейкоцитоз со сдвигом влево, повышение уровеня сывороточного железа. Существует двойное гетерозиготное носительство аномальных алельных (структурных) и неалельных (структурных и регуляторных) генов, которое приводит к тяжелой гемолитической анемии. Например, аномальный НbЕ и b-талассемия, НbS/b-талассемия, НbН/a-талассемия и др. Близкородственные браки среди людей с высоким уровнем носительства аномальных гемоглобинов могут привести к увеличению числа гомозигот и двойных гетерозигот.
Распространение гемоглобинозов совпадает с так называемыми малярийными поясами Земли. Оказалось, что носители HbS и больные талассемией либо не болеют тропической малярией, либо переносят ее в легкой форме. Устойчивость больных гемоглобинозами к малярии объясняется тем, что возбудители ее являются внутриклеточными (внутриэритроцитарными) паразитами. Они потребляют большое количество кислорода, провоцируя тем самым ускоренный гемолиз эритроцитов, в процессе которого и сами погибают. Поскольку бессимптомное носительство HbS или малые формы талассемии не наносят организму серьезный вред, можно говорить о том, что одна менее тяжелая патология (легкие формы гемоглобинозов) становится защитным фактором по отношению к другому более тяжелому заболеванию (малярия).
Приобретенные гемолитические анемии возникают при появлении аутоантител к собственным эритроцитам организма (аутоиммунные); воздействии изоиммунных антител (переливание несовместимой крови, гемолитическая болезнь новорожденных); лекарственных веществ (сульфаниламиды и пр.); механическом повреждении эритроцитов (протезирование клапанов сердца, маршевая гемоглобинурия и пр.); вирусных инфекциях, действии химических и физических факторов (соли свинца, яды змей, ожоги, ультрафиолетовое облучение и пр.).
Гемолиз эритроцитов при данной форме анемии обусловливается метаболическими и структурными повреждениями их мембран, последующим повышением осмомолярности внутриклеточного содержимого, снижением способности эритроцитов к деформациям в синусах селезёнки, что способствует их разрушению.
В картине крови в первые часы развития анемии отмечается кратковременная «ложная» гиперхромия, затем развиваются нормохромная или гипохромная анемия, ретикулоцитоз, полихроматофилия, лейкоцитоз, увеличение в крови содержания непрямого билирубина.
- Наследственные гемолитические анемии, обусловленные нарушением активности ферментов эритроцитов
- ВРОЖДЕННЫЕ ГЕМОЛИТИЧЕСКИЕ АНЕМИИ, ОБУСЛОВЛЕННЫЕ ГЕНЕТИЧЕСКИМИ (НАСЛЕДСТВЕННО-СЕМЕЙНЫМИ) ФАКТОРАМИ
- ОСТРЫЕ ГЕМОЛИТИЧЕСКИЕ АНЕМИИ, ОБУСЛОВЛЕННЫЕ ЭКЗОГЕННЫМИ ГЕМОЛИТИЧЕСКИМИ ФАКТОРАМИ
- НАСЛЕДСТВЕННЫЕ ГЕМОЛИТИЧЕСКИЕ АНЕМИИ
- ГЕМОЛИТИЧЕСКИЕ АНЕМИИ, ОБУСЛОВЛЕННЫЕ НАРУШЕНИЕМ СИНТЕЗА ГЕМОГЛОБИНА
- ГЕМОЛИТИЧЕСКИЕ АНЕМИИ, ОБУСЛОВЛЕННЫЕ ХИМИЧЕСКИМИ, БИОЛОГИЧЕСКИМИ И ФИЗИЧЕСКИМИ ФАКТОРАМИ
- Наследственные гемолитические анемии, связанные с нарушением мембраны эритроцитов (мембранопатии)
- Наследственные гемолитические анемии.
- Наследственные гемолитические анемии, связанные с нарушением структуры или синтеза гемоглобина (гемоглобинопатии)
- Наследственные гемолитические анемии
- ПРИОБРЕТЕННЫЕ ГЕМОЛИТИЧЕСКИЕ АНЕМИИ
- ГЕМОЛИТИЧЕСКИЕ АНЕМИИ
- Гемолитические анемии
- ГЕМОЛИТИЧЕСКИЕ АНЕМИИ
- Приобретенные гемолитические анемии
- ГЕМОЛИТИЧЕСКИЕ АНЕМИИ У ДЕТЕЙ
- Гемолитические анемии (ГА)
- Гемолитические анемии
- ИММУННЫЕ ГЕМОЛИТИЧЕСКИЕ АНЕМИИ

Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для данной группы заболеваний типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
Общие сведения
Гемолитическая анемия (ГА) — малокровие, обусловленное нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Данная группа анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных когортах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. Патология характеризуется укорочением жизненного цикла эритроцитов и их распадом (гемолизом) раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).
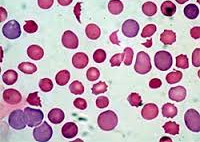
Гемолитическая анемия
Причины
Этиопатогенетическую основу наследственных гемолитических синдромов составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфофункциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды, среди которых:
- Аутоиммунные процессы. Образование антител, агглютинирующих эритроциты, возможно при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии). Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода.
- Токсическое действие на эритроциты. В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Вызывать разрушение клеток крови может прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков).
- Механическое повреждение эритроцитов. Гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.
Патогенез
Центральным звеном патогенеза ГА является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. При аутоиммунном механизме анемии происходит образование антиэритроцитарных АТ (тепловых, холодовых), которые вызывают ферментативный лизис мембраны эритроцитов. Токсические вещества, являясь сильнейшими окислителями, разрушают эритроцит за счет развития метаболических, функциональных и морфологических изменений оболочки и стромы красных кровяных телец. Механические факторы оказывают прямое воздействие на клеточную мембрану. Под влиянием этих механизмов из эритроцитов выходят ионы калия и фосфора, а внутрь поступают ионы натрия. Клетка разбухает, при критическом увеличении ее объема наступает гемолиз. Распад эритроцитов сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
Классификация
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные. Наследственные ГА включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии — анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные ГА подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные) – обусловлены воздействием антител
- токсические – анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- механические — анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Симптомы
Наследственные мембранопатии, ферментопении и гемоглобинопатии
Наиболее распространенной формой данной группы анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке. Манифестация микросфероцитарной ГА возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом — обтурационная желтуха. При микросфероцитозе во всех случаях увеличена селезенка, а у половины пациентов – еще и печень. Кроме наследственной микросфероцитарной анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Энзимопенические анемии связаны с недостатком определенных ферментов эритроцитов (чаще — Г-6-ФД, глутатион-зависимых ферментов, пируваткиназы и др). Гемолитическая анемия может впервые заявлять о себе после перенесенного интеркуррентного заболевания или приема медикаментов (салицилатов, сульфаниламидов, нитрофуранов). Обычно заболевание имеет ровное течение; типична «бледная желтуха», умеренная гепатоспленомегалия, сердечные шумы. В тяжелых случаях развивается ярко выраженная картина гемолитического криза (слабость, рвота, одышка, сердцебиение, коллаптоидное состояние). В связи с внутрисосудистым гемолизом эритроцитов и выделением гемосидерина с мочой последняя приобретает темный (иногда черный) цвет. Особенностям клинического течения гемоглобинопатий — талассемии и серповидно-клеточной анемии посвящены самостоятельные обзоры.
Приобретенные гемолитические анемии
Среди различных приобретенных вариантов чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер. Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка. При некоторых формах аутоиммунных анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия. Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Осложнения
Каждый вид ГА имеет свои специфические осложнения: например, ЖКБ – при микросфероцитозе, печеночная недостаточность – при токсических формах и т.д. К числу общих осложнений относятся гемолитические кризы, которые могут провоцироваться инфекциями, стрессами, родами у женщин. При остром массивном гемолизе возможно развитие гемолитической комы, характеризующейся коллапсом, спутанным сознанием, олигурией, усилением желтухи. Угрозу жизни больного несут ДВС-синдром, инфаркт селезенки или спонтанный разрыв органа. Неотложной медицинской помощи требуют острая сердечно-сосудистая и почечная недостаточность.
Диагностика
Определение формы ГА на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки. Лабораторный диагностический комплекс включает:
- Исследование крови. Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. При аутоиммунных анемиях большое диагностическое значение имеет положительная проба Кумбса.
- Анализы мочи и кала. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина.
- Миелограмму. Для цитологического подтверждения выполняется стернальная пункция. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, порфирии, гемобластозы. Пациента консультируют гастроэнтеролог, клинический фармаколог, инфекционист и другие специалисты.
Лечение
Различные формы ГА имеют свои особенности и подходы к лечению. При всех вариантах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной анемии выполняется спленэктомия. Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов.
Прогноз и профилактика
Течение и исход зависят от вида анемии, тяжести протекания кризов, полноты патогенетической терапии. При многих приобретенных вариантах устранение причин и полноценное лечение приводит к полному выздоровлению. Излечения врожденных анемий добиться нельзя, однако возможно достижение длительной ремиссии. При развитии почечной недостаточности и других фатальных осложнений прогноз неблагоприятен. Предупредить развитие ГА позволяет профилактика острых инфекционных заболеваний, интоксикаций, отравлений. Запрещается бесконтрольное самостоятельное использование лекарственных препаратов. Необходимо тщательная подготовка пациентов к гемотрансфузиям, вакцинации с проведением всего комплекса необходимых обследований.


