Нарушение обмена железа железодефицитная анемия гемохроматоз реферат
Нарушение обмена железа
Избыток
Существует аутосомно-рецессивное заболевание гемохроматоз, связанное с нарушением гепсидиновой регуляции и избыточностью всасывания железа в кишечнике. В результате железо накапливается в органах и тканях: печени, поджелудочной железе, миокарде, селезёнке, коже, эндокринных железах и др. Общее содержание железа в организме достигает 20-60 г при норме 2-4 г. Постепенно развиваются цирроз печени, кардиомиопатии, сахарный диабет 1 типа, артрит.
Приобретенный избыток железа возникает при гемолитических анемиях и избыточной задержке железа в макрофагах, нарушении мобилизации железа из депо, при избыточной парентеральной терапии железодефицитных состояний. Накапливающийся ферритин преобразуется в гемосидерин, в результате резко снижается использование железа. Такое состояние называется гемосидероз.
К образованию гемосидерина приводит перенасыщение ферритина железом, деградация его белковой части и полимеризация молекул. Провоцирующим повреждение фактором является способность железа инициировать образование активных кислородных радикалов.
Избыточное потребление препаратов железа per os не приводит к интоксикации, так как возможности транспорта металла из кишечника ограничены саморегуляцией энтероцитов и свойствами транспортных систем. Избыток железа задерживается в эпителии кишечника и выводится со слущивающимися клетками.
Дефицит
При недостаточности железа в организме (железодефицит) мобилизация резервов происходит в следующем порядке:
- Сначала используется железо из депо (ферритин),
- Затем в клетках (кроме эритроидных) снижается количество гемопротеинов до жизнеспособного минимума,
- Далее истощаются запасы сывороточного железа (холотрансферрин),
- В последнюю очередь страдает синтез гемоглобина.
Таким образом, железодефицитная анемия является проявлением крайнего дефицита железа и нормальная концентрация гемоглобина крови не должна быть критерием обеспеченности организма железом!
Причины дефицита железа
Причинами нехватки железа являются
- недостаток его в пище (несбалансированное вегетарианство),
- заболевания ЖКТ со снижением всасывания (гипоацидные гастриты и энтериты),
- потери железа с кровью при менструальных, кишечных или иных кровотечениях,
- у новорожденных и грудных детей недостаток железа связан в первую очередь с недополучением его при внутриутробном развитии,
- в связи с ускоренным ростом в первый год жизни (физиологическая анемия).
Симптомы
Недостаточный синтез цитохромов, железосодержащих белков и нарушение доставки кислорода к тканям (при снижении содержания гемоглобина) вызывает ряд специфических и неспецифических симптомов:
- ухудшение внимания и памяти у детей и взрослых,
- иногда детская гиперактивность,
- уплощение, волнистость и ломкость ногтей, появление исчерченности, белых пятен и полосок на ногтях,
- выпадающий и секущийся волос,
- поражение эпителия, проявляющееся в сухости и трещинах кожи рук и ног,
- неинфекционный ларингофаринготрахеит (гиперемия, покраснение и охриплость), что дезориентирует врача,
- мышечная слабость:
– общая утомляемость,
– недостаточное сокращение сфинктеров мочевого пузыря, при этом характерным признаком является выделение капель мочи при резком кашле, смехе, чихании,
– недостаточное сокращение сфинктеров пищевода, что позволяет забрасываться соляной кислоте в пищевод и вызывать изжогу.
- атрофический м анацидный гастрит – может быть как причиной, так и следствием железодефицита, половина больных гастритом имеет недостаток железа,
- обострение ишемической болезни сердца и других сердечно-сосудистых заболеваний, так как усиливает гипоэнергетическое состояние клеток (снижение содержания цитохромов дыхательной цепи в миокардиоцитах),
- извращение обонятельных предпочтений – нравится запах краски, бензина, выхлопных газов, резины, мочи,
- извращение вкусовых предпочтений – больные едят мел, штукатурку, уголь, песок, мясной фарш, лед.
По данным ВОЗ железодефицитное состояние имеется у трети населения планеты.
В России частота железодефицитной анемии приближается к показателю стран третьего мира. Железодефицитной анемией и скрытыми формами дефицита железа страдает 50-80% населения России.
У женщин детородного возраста основные потери железа вызывают менструальные кровотечения. Известно, что за цикл около 20% женщин теряет 20 мл крови, 70% – 40-60 мл крови, 5% – 100 мл, 5% – 200 мл крови. Учитывая, что в 1 мл крови находится около 0,7 мг железа, потери железа составляют от 14 мг до 140 мг.
Из-за физиологических ежемесячных кровопотерь и вынашивания детей более чем у 51% женщин детородного возраста во всем мире обнаруживается нехватка железа вплоть до отсутствия его запасов.
Во время беременности мать отдает ребенку 300-500 мг железа, особенно активно это происходит на 28-32 неделях, когда ребенку требуется по 22 мг в неделю. Дефицит железа в III триместре беременности обнаруживается почти у 90% женщин и сохраняется после родов и лактации у 55% из них.
При лактации потери железа у матери составляют 11-12 мг/сут.
У мужчин и пожилых женщин основной причиной железодефицитных состояний являются кровопотери через ЖКТ.
В
орг-ме 3-4г Fe,
из них2,5г находится в составе гем-на
эритроцитов,20%-в мышцах, 15% в печени и
селезенке. Ф-ии:1.
Транспорт и депонирование О2
кровью и тканями (гемоглобин, миоглобин).
2 участвует в тканевом дыхании и
энергетическом обмене, являясь составной
частью цитохромов в ЦПЭ.3. входит в
структуру цитохрома Р-450, участвуя в
р-ях микросомального ок-ия. 4. Явл-ся
компонентом каталаз и пероксидаз-
ферментов антиоксидантной защиты.
Стабильна форма железа-Fe3+.Транспорт
и депонирование
Fe
в тканях осущ-ют белки ферритин,
гемоидерин, в плазме- трансферрин.
Трансферрин—
гликопротеин плазмы крови, содержится
в печени, немного в лимф. ткани, яичках,
молочных железах. Белковая часть-
β-глобулин, имеет 2 центра связывания
3-ех валентного Fе.
Обеспечивает создание нетоксического
пула Fe.
Каждая молекула трансферрина 10 раз
взаимодействует с поверхностью
эритробласта, передавая Fe.
Ферритин-
является депо Fe
в ткани, содержится в печени, селезенке,
костном мозге. Быстро мобилизирует Fe,
в зависимости от потребности. У здорового
чел-ка концентрация ферритина соотв.
кол-ву депонированного Fe
в орг-ме. Гемосидерин-
двойная молекула ферритина. Депонирует
Fe
при избытке Fe
сверх уровня, кот.может депонироваться
ферритином. Откладывается в печени,
селезенке, костном мозге. Обмен.
Железо, освобождающееся из гема, при
распаде эритр-ов, используется повторно.
Однако часть Fe
теряется орг-ом с желчью. Это компенсируется
поступлением Fe
с пищей. Суточное потребление Fe
-10-20мг, в кишечнике всасывается небольшая
часть(1мг в сутки), это про исходит с
участием белка сходного с ферритином.
Затем Fe
поступает на трансферрин крови, кот.
передает его трансферрину разных
органов. В соединении с белками Fe
находится в 3-ех валентном состоянии,
но при переходе с одного белка на
др.валентность меняется Fe3+,
Fe2+,
Fe3+.
Железодефицитная
анемия—
связана либо с дефицитом Fe
в орг-ме, либо с недостаточностью
фермента, включающего Fe
в структуру предшественника гема (при
беременности, кровопотери, ухудшение
всасывания и т.д.). Сопровождается
трофическими расстройствами из-за
ухудшения ф-ий железосодержащих тканевых
дыхательных ферментов, нарушением
образования гем-на, развитием гипохромной
анемии. Гемосидероз—
синдром перегрузки Fe-ом,
отложение его в виде гемосидерина в
пренхиматозных органах, сопровождающееся
их функц-ыми расстройствами. Гемохроматоз-
генетически детерминированное
заболевание, сопровождающееся накоплением
гемосидерина в паренх. органах. Встречается
чаще у мужчин 45-60 лет. Последствия- цирроз
печени, сахарный диабет.
102. Белки и ферменты крови. Белки «острой фазы». Физиологически активные пептиды (кининовая система). Определение белков и ферментов крови с целью диагностики.
Общий
белок
плазмы крови- 60-80г/л. Выделяют
5 фракций:
1.альбумины(52-65%)
синт-ся в печени. Ф-ии-транспортная,
определяют онкотич. давление, используются
как источник аминокислот для глюконеогенеза.
Пример-транскортин, ретинолсвязывающий
белок. 2. α
1-глобулины(2,5-5,6%).
3. α
2-глобулины(7-13%).
4.β-глобулины(9-13%).
5.γ-глобулины(15-22%)-иммуноглобулины.
Белки-переносчики-
трансферрин, трансп-ий железо,
церулоплазмин, трансп-ий медь.
Белки
острой фазы-группа
белков сыворотки крови, активность
кот.повышается при повреждении
ткани(воспалении). Индукция синтеза
этих белков включает продукцию лимфокинов
(интерлейкинов), кот.в печени дают начало
синтезу спецефич. белков , поступающих
в очаг воспаления. Ф-ии:1.остановка
кровотечения. 2. Ингибирование
протеинкиназ.3. предотвращение
аутоиммуноагрессии.4. отчистка очагов
повреждения.5. участие в регенерации.
Белки острой фазы:1.α1антитрипсин-
ингибирует протеолитические ферменты,
ограничивая деструкцию ткани.
2.гаптоглобин- белок-компенсатор,
связывает белки, метаболиты, токсины в
очаге повреждения, отчищая его.
3.С-реактивный белок- активатор сист-мы
комплемента, обнаруживается при
патологическом состоянии. 4.интерферон-
противовирусный белок, блокирует синтез
белков в вирусе. 5.фибриноген-активирует
свертывающую систему и способствует
регенерации ткани.
Ферменты
крови- секреторные(
секрет-ся в печени и поступают в кровь-
свертыв. и антисвертыв. сист.крови),
экскреорные- показатель холестаза-щелочная
фосфотаза, индикаторные- маркеры цитолиза
(инфаркт миокарда-АСТ, креатинфосфокиназа
КФК, ЛДГ-1; гепатит- АЛТ>АСТ; панкреатит-
амилаза, липаза).
Кининовая
сист-ма –
опред-ое соотн. низкомолек-ых
пептидов(брадикинин, каллидн) и ферментов
их синтеза и расщепления(калликреин,
уропепсин, кининазы). Ф-ии: 1. Регуляция
местного и общего кровообращ., т.к.обладает
мощным гипотензивным действием на
уровне капилляров. 2.регуляция тонуса
гладкой мускулатуры (бронхов). 3.регуляция
проницаемости сосуд.стенки. Кининовая
сист-ма: α2-глобулин→кининогены→брадикинин-9аминок-т(коллекреин
плазмы), коллидин-11аминок-т(коллекреин
печени).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Обмен железа: всасывание, транспорт кровью, депонирование. Нарушение обмена железа: железодефицитная анемия, гемохроматоз.
В пище железо в основном находится в окисленном состоянии (Fe3+) и входит в состав белков или солей органических кислот. Освобождению железа из солей органических кислот способствует кислая среда желудочного сока. Наибольшее количество железа всасывается в двенадцатиперстной кишке. Аскорбиновая кислота, содержащаяся в пище, восстанавливает железо и улучшает его всасывание, так как в клетки слизистой оболочки кишечника поступает только Fe2+. В суточном количестве пищи обычно содержится 15 — 20 мг железа, а всасывается только около 10% этого количества. Организм взрослого человека теряет около 1 мг железа в сутки. Количество железа, которое всасывается в клетки слизистой оболочки кишечника, как правило, превышает потребности организма. Поступление железа из энтероцитов в кровь зависит от скорости синтеза в них белка апоферритина. Апоферритин «улавливает» железо в энтероцитах и превращается в ферритин, который остаётся в энтероцитах. Таким способом снижается поступление железа в капилляры крови из клеток кишечника. Когда потребность в железе невелика, скорость синтеза апоферритина. Постоянное слущивание клеток слизистой оболочки в просвет кишечника освобождает организм от излишков железа. При недостатке железа в организме апоферритин в энтероцитах почти не синтезируется. Железо, поступающее из энтероцитов в кровь, транспортирует белок плазмы крови трансферрин.

Транспорт железа в плазме крови и его поступление в клетки. В плазме крови железо транспортирует белок трансферрин. Трансферрин — гликопротеин, который синтезируется в печени и связывает только окисленное железо (Fe3+). Поступающее в кровь железо окисляет фермент ферроксидаза, известный как медьсодержащий белок плазмы крови церулоплазмин. Одна молекула трансферрина может связать один или два иона Fe3+, но одновременно с анионом СО32- с образованием комплекса трансферрин-2 (Fe3+-CO32-). В норме трансферрин крови насыщен железом приблизительно на 33%. Трансферрин взаимодействует со специфическими мембранными рецепторами клеток. В результате этого взаимодействия в цитозоле клетки образуется комплекс Са2+-кальмодулин-ПКС, который фосфорилирует рецептор трансферри-на и вызывает образование эндосомы. АТФ-зависимый протонный насос, находящийся в мембране эндосомы, создаёт кислую среду внутри эндосомы. В кислой среде эндосомы железо освобождается из трансферрина. После этого комплекс рецептор — апотрансферрин возвращается на поверхность плазматической мембраны клетки. При нейтральном значении рН внеклеточной жидкости апотрансферрин изменяет свою конформацию, отделяется от рецептора, выходит в плазму крови и становится способным вновь связывать ионы железа и включаться в новый цикл его транспорта в клетку. Железо в клетке используется для синтеза железосодержащих белков или депонируется в белке ферригине. Ферритин — олигомерный белок с молекулярной массой 500 кД. Он состоит из тяжёлых (21 кД) и лёгких (19 кД) полипептидных цепей, составляющих 24 протомера. Разный набор прогомеров в олигомере ферритина определяет образование нескольких изоформ этого белка в разных тканях. Ферритин представляет собой полую сферу, внутри которой может содержаться цо 4500 ионов трёхвалентного железа, но обычно содержится менее 3000. Тяжёлые цепи ферритина окисляют Fe2+ в Fe3+, Железо в виде гидроксидфосфата находится в центре сферы, оболочка которой образована белковой частью молекулы. Оно поступает внутрь и освобождается наружу через каналы, пронизывающие белковую оболочку апоферритина, но железо может откладываться и в белковой части молекулы ферритина. Ферритин содержится почти во всех тканях, но в наибольшем количестве в печени, селезёнке и костном мозге. Незначительная часть ферритина экскретируется из тканей з плазму крови. Поскольку поступление ферритина в кровь пропорционально его содержанию в тканях, то концентрация ферритина в крови — важный диагностический показатель запасов железа в организме при железодефидитной анемии.
Нарушения метаболизма железа. Железодефицитная анемия может наблюдаться при повторяющихся кровотечениях, беременности, частых родах, язвах и опухолях ЖКТ, после операций на ЖКТ. При железодефицитной анемии уменьшается размер эритроцитов и их пигментация (гипохромные эритроциты малых размеров). В эритроцитах уменьшается содержание гемоглобина, понижается насыщение железом трансферрина, а в тканях и плазме крови снижается концентрация ферритина. Причина этих изменений — недостаток железа в организме, вследствие чего снижается синтез гема и ферритина в неэритроидных тканях и гемоглобина в эритроидных клетках.
Гемохроматоз. Когда количество железа в клетках превышает объём ферритинового депо, железо откладывается в белковой части молекулы ферритина. В результате образования таких аморфных тложений избыточного железа ферритии превращается в гемосидерин. Гемосидерин плохо растворим в воде и содержит до 37% железа Накопление гранул гемосидерина в печени, поджелудочной железе, селезёнке и печени приводит к повреждению этих органов — гемохроматозу. Гемохроматоз может быть обусловлен наследственным увеличением всасывания железа в кишечнике, при этом содержание железа в организме больных может достигать 100 г. Это заболевание наследуется по аутосомнорецессивному типу, причём около 0,5% европеоидов гомозиготны по гену гемохроматоза. Накопленш гемосидерина в поджелудочной железе приводит к разрушению р-клеток островков Лангерханса и, как следствие этого, к сахарному диабету. Отложение гемосидерина в гепатоцитах вызывает цирроз печени, а в миокардиоцитах — сердечную недостаточность. Больных наследственным гемохроматозом лечат регулярными кровопусканиями, еженедельно или один раз в месяц в зависимости от тяжести состояния больного. К гемохроматозу могут привести частые переливания крови, в этих случаях больных лечат препаратами, связывающими железо.
Николаев
стр. 491-493
Гемосидероз
— избыточное отложение гемосидерина
в тканях организма. Возникает при
усиленном распаде эритроцитов, нарушении
утилизации этого пигмента в процессе
эритроцитопоэза, усиленном всасывании
его в кишечнике, при нарушении обмена
железосодержащих пигментов.В организме
взрослого человека содержится 4—5 г
железа,
в основном в составе гемопротеидов и
соединений резервного железа —
ферритина и гемосидерина, являющихся
белковыми комплексами. Основной
представитель гемопротеидов —
гемоглобин клеток эритроидного ряда.
При избытке железа в организме гемосидерин
накапливается в тканях, что сопровождается
повреждением лизосом.
Гемохроматоз
(пигментный цирроз, бронзовый диабет)
— HLA-ассоциированное
полисистемное заболевание, наследуемое
по аутосомно-рецессивному типу,
обусловленное генетическим дефектом,
который приводит к повышенному всасыванию
железа в желудочно-кишечном тракте и с
избыточным накоплением железа в
организме, что проявляется поражением
печени, поджелудочной железы, сердца,
кожи, суставов, гипофиза.
Транспорт
железа в плазме крови и его поступление
в клетки
В
плазме крови железо транспортирует
белок трансферрин. Трансферрин —
гликопротеин, который синтезируется в
печени и связывает только окисленное
железо (Fe3+). Поступающее в кровь железо
окисляет фермент ферроксидаза, известный
как медьсодержащий белок плазмы крови
церулоплазмин. Одна молекула трансферрина
может связать один или два иона Fe3+, но
одновременно с анионом СО32- с
образованием комплекса трансферрин-2
(Fe3+-CO32-). В норме трансферрин крови насыщен
железом приблизительно на 33%.
Трансферрин
взаимодействует со специфическими
мембранными рецепторами клеток. В
результате этого взаимодействия в
цитозоле клетки образуется комплекс
Са2+-кальмодулин-ПКС, который фосфорилирует
рецептор трансферри-на и вызывает
образование эндосомы. АТФ-зависимый
протонный насос, находящийся в мембране
эндосомы, создаёт кислую среду внутри
эндосомы. В кислой среде эндосомы железо
освобождается из трансферрина. После
этого комплекс рецептор — апотрансферрин
возвращается на поверхность плазматической
мембраны клетки. При нейтральном значении
рН внеклеточной жидкости апотрансферрин
изменяет свою конформацию, отделяется
от рецептора, выходит в плазму крови и
становится способным вновь связывать
ионы железа и включаться в новый цикл
его транспорта в клетку. Железо в клетке
используется для синтеза железосодержащих
белков или депонируется в белке ферригине.
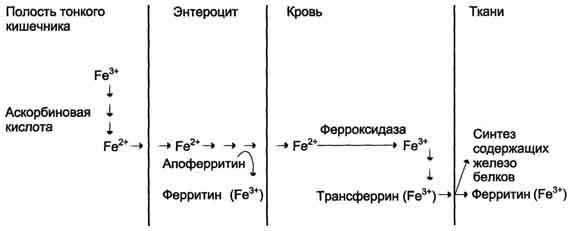
Рис.
13-7. Поступление экзогенного железа в
ткани. В
полости кишечника железо освобождается
из белков и солей органических кислот
пищи. Усвоению железа способствует
аскорбиновая кислота, восстанавливающая
железо. В клетках слизистой оболочки
кишечника избыток поступившего железа
соединяется с белком апоферритином с
образованием ферритина, при этом ферритин
окисляет Fe2+ в Fe3+. Поступление железа
из клеток слизистой оболочки кишечника
в кровь сопровождается окислением
железа ферментом сыворотки крови
ферроксидазой. В крови Fe3+ транспортирует
белок сыворотки крови трансферрин. В
тканях Fe2+ используется для синтеза
железосодержащих белков или депонируется
в ферритине.
Ферритин
— олигомерный белок с молекулярной
массой 500 кД. Он состоит из тяжёлых (21
кД) и лёгких (19 кД) полипептидных цепей,
составляющих 24 протомера. Разный набор
прогомеров в олигомере ферритина
определяет образование нескольких
изоформ этого белка в разных тканях.
Ферритин представляет собой полую
сферу, внутри которой может содержаться
цо 4500 ионов трёхвалентного железа, но
обычно содержится менее 3000. Тяжёлые
цепи ферритина окисляют Fe2+ в Fe3+,
Железо в виде гидроксидфосфата находится
в центре сферы, оболочка которой
образована белковой частью молекулы.
Оно поступает внутрь и освобождается
наружу через каналы, пронизывающие
белковую оболочку апоферритина, но
железо может откладываться и в белковой
части молекулы ферритина. Ферритин
содержится почти во всех тканях, но в
наибольшем количестве в печени, селезёнке
и костном мозге. Незначительная часть
ферритинаэкскретируется из тканей з
плазму крови. Поскольку поступление
ферэитина в кровь пропорционально его
содержанию в тканях, то концентрация
ферритина в крови — важный диагностический
показатель запасов железа в организме
при железодефидитной анемии. Метаболизм
железа в организме представлен на рис.
13-8.
В.
Регуляция поступления железа в клетки
Содержание
железа в клетках определяется соотношением
скоростей его поступления, использования
и депонирования и контролируется двумя
молекулярными механизмами. Скорость
поступления железа в неэритроидные
слетки зависит от количества
белков-рецепторов трансферрина в их
мембране. Избыток железа в клетках
депонирует ферритин. Синтез шоферритина
и рецепторов трансферринарегулируется
а уровне трансляции этих белков и зависит
от содержания железа в клетке.
На
нетранслируемом 3′-конце мРНК рецептора
трансферрина и на нетранслируемом
5′-конце мРНКапоферритина имеются
шпилечные петли — железочувствительные
элементы IRE (рис. 13-9 и 13-10). Причём мРНК
рецептора трансферрина имеет 5 петель,
а мРНКапоферритина — только 1.
Эти
участки мРНК могут взаимодействовать
с регуляторным IRE-связывающим белком.
При низких концентрациях железа в клетке
IRE-связывающий белок соединяется с IRE
мРНКапоферритина и препятствует
присоединению белковых факторов
инициации трансляции (рис. 13-9, А). В
результате этого снижаются скорость
трансляции апоферритина и его содержание
в клетке. Вместе с тем при низких
концентрациях железа в клетке
IRE-связывающий белок связывается с
железочувствительным элементом мРНК
рецептора трансферрина и предотвращает
её разрушение ферментом РНК-азой (рис.
13-10, А). Это вызывает увеличение количества
рецепторов трансферрина и ускорение
поступления железа в клетки.
При
повышении содержания железа в клетке
в результате его взаимодействия с
IRE-связывающим белком происходит
окисление SH-групп активного центра
этого белка и снижение сродства к
железочувствительным элементам мРНК.
Это приводит к двум последствиям:
во-первых,
ускоряется трансляция апоферритина
(рис. 13-9, Б);во-вторых,
IRE-связывающий белок освобождает
шпилечные петли мРНК рецептора
трансферрина, и она разрушается ферментом
РНК-азой, в результате снижается скорость
синтеза рецепторов трансферрина (рис.
13-10, Б). Ускорение синтеза апоферритина
и торможение синтеза рецепторов
трансферрина вызывают снижение
содержания железа в клетке.
В
целом эти механизмы регулируют содержание
железа в клетках и его использование
для синтеза железосодержащих белков.
ОБМЕН
ЖЕЛЕЗА
В
гемсодержащих белках железо находится
в составе гема. В негемовых железосодержащих
белках железо непосредственно связывается
с белком. К таким белкам относят
трансферрин, ферритин, окислительные
ферменты рибонук-леотидредуктазу и
ксантиноксидазу, железофлавопротеины
NADH-дегидрогеназа и сукцинат-дегидрогеназа.
В
организме взрослого человека содержится
3 — 4 г железа, из которых только около
3,5 мг находится в плазме крови. Гемоглобин
имеет примерно 68% железа всего организма,
ферритин — 27%, миоглобин — 4%, трансферрин
— 0,1%, На долю всех содержащих железо
ферментов приходится всего 0,6% железа,
имеющегося в организме. Источниками
железа при биосинтезе железосодержащих
белков служат железо пищи и железо,
освобождающееся при постоянном распаде
эритроцитов в клетках печени и селезёнки.
В
нейтральной или щелочной среде железо
находится в окисленном состоянии — Fe3+,
образуя крупные, легко агрегирующие
комплексы с ОН-, другими анионами и
водой. При низких значениях рН железо
восстанавливается и легко диссоциирует.
Процесс восстановления и окисления
железа обеспечивает его перераспределение
между макромолекулами в организме. Ионы
железа обладают высоким сродством ко
многим соединениям и образуют с ними
хелатные комплексы, изменяя свойства
и функции этих соединений, поэтому
транспорт и депонирование железа в
организме осуществляют особые белки.
В клетках железо депонирует белок
ферритин, в крови его транспортирует
белок трансферрин.
А.
Всасывание железа в кишечнике
В
пище железо в основном находится в
окисленном состоянии (Fe3+) и входит в
состав белков или солей органических
кислот. Освобождению железа из солей
органических кислот способствует кислая
среда желудочного сока. Наибольшее
количество железа всасывается в
двенадцатиперстной кишке. Аскорбиновая
кислота, содержащаяся в пище, восстанавливает
железо и улучшает его всасывание, так
как в клетки слизистой оболочки кишечника
поступает только Fe2+. В суточном количестве
пищи обычно содержится 15 — 20 мг железа,
а всасывается только около 10% этого
количества. Организм взрослого человека
теряет около 1 мг железа в сутки.
Количество
железа, которое всасывается в клетки
слизистой оболочки кишечника, как
правило, превышает потребности организма.
Поступление железа из энтероцитов в
кровь зависит от скорости синтеза в них
белка апоферритина. Апоферритин
«улавливает» железо в энтероцитах
и превращается в ферритин, который
остаётся в энтероцитах. Таким способом
снижается поступление железа в капилляры
крови из клеток кишечника. Когда
потребность в железе невелика, скорость
синтеза апоферритина повышается (см.
ниже «Регуляция поступления железа
в клетки»). Постоянное слущивание
клеток слизистой оболочки в просвет
кишечника освобождает организм от
излишков железа. При недостатке железа
в организме апоферритин в энтероцитах
почти не синтезируется.елезо, поступающее
из энтероцитов в кровь, транспортирует
белок плазмы крови трансферрин (рис.
13-7).
Нарушения
метаболизма железа
Железодефицитная
анемия может наблюдаться при повторяющихся
кровотечениях, беременности, частых
родах, язвах и опухолях ЖКТ, после
операций на ЖКТ. При железодефицитной
анемии уменьшается размер эритроцитов
и их пигментация (гипохромные эритроциты
малых размеров). В эритроцитах уменьшается
содержание гемоглобина, понижается
насыщение железом трансферрина, а в
тканях и плазме крови снижается
концентрация ферритина. Причина этих
изменений — недостаток железа в организме,
вследствие чего снижается синтез гема
и ферритина в неэритроидных тканях и
гемоглобина в эритроидных клетках.
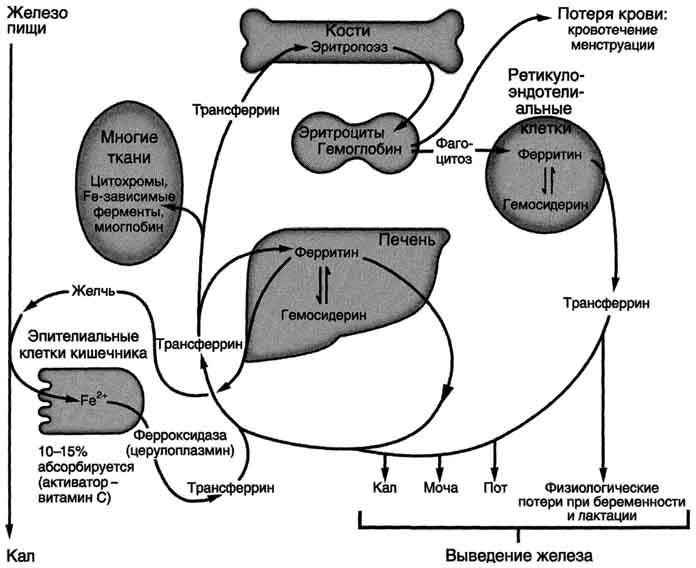
Рис.
13-8. Метаболизм железа в организме.
Соседние файлы в папке экз
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

