Нафтизин при бронхиальной астме
В.Н. Солопов, И.В. Луничкина
ПАТОГЕНЕТИЧЕСКИЕ ВАРИАНТЫ ОБСТРУКТИВНОГО СИНДРОМА У БОЛЬНЫХ БРОНХИАЛЬНОЙ АСТМОЙ
Медицинский кооператив «Пульмонолог»
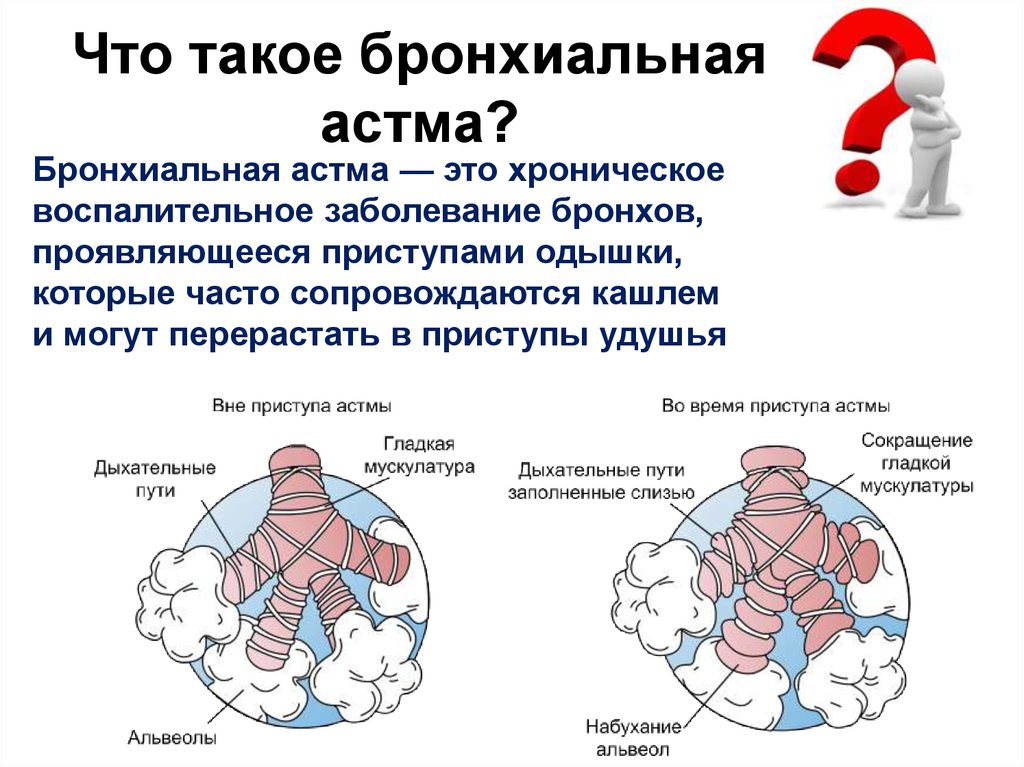
Современная диагностика и лечение бронхиальной астмы (БА) основаны на выделении основных форм ее — иммунологической и неиммунологической, а также нескольких патогенетических вариантов: инфекционного, аутоиммунного, дисгормонального, пищевого, нервно-психического и пр. [6, 7]. Для практических врачей такое выделение форм дает возможность более дифференцировано и индивидуально подходить к выбору терапии. Клиницисты и исследователи отмечают, что сама по себе болезнь не является статичной, застывшей, она претерпевает определенную эволюцию — от относительно благополучного дебюта до трагического финала. Характер клинических проявлений и индивидуальные особенности, определяющие тот или иной патогенетический вариант, непрерывно меняются. Проявившись, например, в дебюте как атопическая, астма по мере развития часто трансформируется в смешанную форму, при которой аллергия уже не имеет определяющего значения, а на первое место выходит инфекционно-воспалительный компонент. По мере прогрессирования может присоединиться непереносимость пищевых продуктов, лекарственных препаратов и т. д., что приводит к существенному изменению и характера, и течения заболевания. Недостаточно эффективная терапия, прогрессирование астмы и ее осложнения приводят к необратимой обструкции просвета бронхов [9] и ситуации, при которой первоначальный этнологический фактор полностью утрачивает какое-либо значение.
Известно, что в основе механизмов обструкции при этом заболевании лежит спазм мускулатуры бронхов, воспалительный отек их слизистой оболочки и обтурация просвета дыхательных путей слизью вследствие нарушения экспекторации [5, 6]. Поскольку значимость перечисленных механизмов в каждом конкретном случае может быть различна [1], с нашей точки зрения, целесообразно подходить к терапии бронхиальной астмы с учетом выраженности одного из трех обратимых компонентов обструкции. Определение диагностических критериев и выделение патогенетических вариантов обструктивного синдрома при различных формах БА и явились целью данного сообщения.
МАТЕРИАЛ И МЕТОДЫ
Нами проанализированы истории болезни, а также обследованы в период ; обострения заболевания 75 больных (35 больных мужского и 40 — женского пола в возрасте от 15 до 60 лет) с достоверно установленным диагнозом БА, им проведено рентгенологическое, аллергологическое, иммунологическое обследование, а также исследование крови и мокроты. Атопическая форма заболевания диагностирована у 12 пациентов (у 5 — сенсибилизация к пыльцевым аллергенам, у 6 — к домашней пыли, у 1 — к домашней пыли и плесени Aspergilla negro). У 6 пациентов выявлена непереносимость нестероидных противовоспалительных средств и полипоз носа, т. е. аспириновая астма. У 8 обследованных причиной астмы явилась пищевая аллергия и у 46 — инфекция. У 23 больных астма была смешанной формы: сенсибилизация к аллергенам домашней пыли, наряду с клиническими и лабораторными признаками рецидивирующего инфекционно-воспалительного процесса; очагами хронической инфекции являлись хронический тонзиллит, хронический гайморит. Контрольную труппу составили 40 здоровых обследованных в возрасте от 21 года до 50 лет, не куривших, не подвергавшихся воздействию профессиональных вредностей, без заболеваний органов дыхания. Программа обследования включала применение клинических и инструментальных методов. Клиническое обследование проводили по общепринятой схеме. При этом основное внимание уделяли оценке выраженности клинических симптомов бронхиальной обструкции: 1) приступам затрудненного дыхания и удушья, 2) одышке, 3) кашлю и отделению мокроты.
Инструментальное обследование включало изучение функции внешнего дыхания (ФВД) с проведением фармакологических спирометрических проб и определение времени эвакуации бронхиального содержимого (время экспекторации). Исследование ФВД и фармакологические пробы проводили на автоматическом спироанализаторе. Определяли следующие показатели: ОФВ1 — объем форсированного выдоха за 1-ю секунду, П75, П50 и П25 — поток при объеме 75, 50 и 25% и форсированной жизненной емкости легких (ФЖЕЛ), отражающие проходимость соответственно на уровне крупных, средних и мелких бронхов. Для проведения фармакологических проб использовали: селективный (бета-2-агонист — беротек, холинолитик — атровент и неселективный симпатомиметик — адреналин. Схема проведения фармакологических проб отличалась от обычной, принятой в клинической практике. Основное отличие заключалось в последовательности проведения проб вначале с беротеком, затем с адреналином и далее с атровентом. Фармакологическое тестирование проводили в течение 2 дней.
1-й день: исходное исследование ФВД, ингаляция 0,4 мг (2 дозы) беротека, повторное исследование ФВД через 20 мин, ингаляция 0,5 мг (0,5 мл 0,1% раствора) адреналина, повторное исследование ФВД через 10 мин. Адреналин вводили с помощью ингалятора АИИП-1 в режиме распыления с подачей аэрозоля на вдохе. Идея такой последовательности проведения проб заключалась в том, что применение адреналина непосредственно после беротека, снимающего спазм бронхиальной мускулатуры, позволяет селективно оценить его противоотёчное действие.
2-й день: исходное исследование ФВД, ингаляция 0,04 мг (2 дозы) атровента, повторное исследование ФДВ через 30 мин. За 8-12 ч до начала исследования больные прекращали прием бронхолитических препаратов (симпатомиметики, холинолитики, теофиллин).
Результаты фармакологического тестирования оценивали по тому, насколько эффективно ингалируемый препарат приближал показатели ФВД к должным величинам. Это позволяет более объективно оценить степень обратимости бронхиальной обструкции [8]. При проведении фармакологического тестирования возник и другой вопрос: какова величина прироста показателей ФВД, достоверно свидетельствующая о нарушении бронхиальной проходимости? С этой целью проведены фармакологические пробы со всеми препаратами у обследованных контрольной группы. При этом прирост показателей ФВД после ингаляции максимальной дозы бронхолитиков составил в среднем: ОФВ1 — 3,0±0,59%, П75 — 5,74±1,7%, П50 — 4,4±2,6%, П25 — 4,7±1,8%. Прирост отдельных показателей у некоторых из обследуемых достигал 10%. Поэтому мы решили считать достоверными результаты в тех случаях, когда прирост показателей ФВД превышал 10%.
Время экспекторации определяли по выведению с мокротой гемосодержащих веществ после их ингаляции в дыхательные пути [5]. В контрольной группе индикатор определяли в бронхиальном содержимом через 18, 24, 30 и 36 ч (в каждый из указанных промежутков времени — у 10 обследованных) после его введения. Бронхиальное содержимое получали после ингаляции 10 мл гипертонического раствора (15% КаСl и 1% NaНСО3). У всех обследованных контрольной группы через 36 ч индикатор в бронхиальном содержимом не определялся, что позволило в качестве верхней границы нормы принять время 30 ч.
Таким образом, программа исследования была ориентирована на объективную количественную оценку всех 3 компонентов бронхиальной обструкции: спазма, воспалительного отека и нарушения экспекторации.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
По характеру и клиническим особенностям основных проявлений бронхиальной обструкции все обследуемые были разделены на 3 группы. 1-ю группу (21 больной) составили 5 пациентов с атопической (аллергия к пыльце трав и деревьев) и 16 — с инфекционной формами заболевания. Клиническая картина бронхиальной обструкции проявлялась у этих больных пароксизмально возникающими приступами удушья, хорошо купирующимися селективными симпатомиметиками (беротек, сальбутамол) и препаратами теофиллина. Одышка отмечалась только в момент возникновения приступов удушья. Кашель появлялся преимущественно после приступа и сопровождался отделением мокроты, обычно слизистого характера. Количество откашливаемой мокроты было незначительным: от отдельных плевков до 10-30 мл/сут. Затруднения в ее отхождении больные отмечали только в момент приступа.
Во 2-ю группу (30 пациентов) вошли больные с атонической (аллергия на домашнюю пыль), инфекционной формами заболевания, а также все пациенты с аспириновой астмой и пищевой аллергией. В клинической картине обструктивного синдрома у них превалировали одышка и кашель. Приступы удушья и затрудненного дыхания начинались с выраженной одышки и кашля. Часто они провоцировались и усугублялись кашлем. Кашель, особенно в период обострения заболевания, был мучительным и непродуктивным. Кашель и приступы удушья часто возникали под влиянием различных внешних воздействий: форсированного дыхания (у 7), холодного воздуха (у 2), тумана, запаха и ингаляции аэрозолей (у 20), т. с. у этих пациентов была особенно выражена так называемая гиперреактивность бронхиального дерева. Характер приступов удушья у них отличался от подобных приступов у больных 1-й группы: пароксизмально возникающее тяжелое удушье не купировалось бронхоспазмолитиками.
Таблица 1. Результаты фармакологических проб с беротеком и адреналином
(Х±m)
| Группа больных | Препарат | Прирост показателей ФВД, % от должных | |||
| ОФВ1 | П75 | П50 | П25 | ||
| 1-ая | Беротек Адреналин | 18,6±2,40 4,2±0,78 | 26,8±1,74 5,2±0,96 | 28,4±2,23 4,8±0,64 | 24,6±1,98 4,6±1,01 |
| 2-ая | Беротек Адреналин | 9,6±1,52 20,9±1,76 | 8,81±1,36 19,4±2,12 | 7,1±1,41 20,7±3,16 | 8,4±1,56 20,1±3,25 |
| 3-ая | Беротек Адреналин | 6,7±1,42 4,8±1,61 | 5,9±0,87 3,6±1,21 | 2,4±1,12 3,4±1,72 | 3,7±0,71 3,9±0,97 |
Преобладающее большинство пациентов 2-й группы (23 больных) за время своего заболевания (от 2 до 5 лет) находились в состоянии астматического статуса 1 или более раз. Все пациенты получали кортикостероиды, 20 из них пероралыю; 11 больных в связи с постоянным приемом кортикостероидов ранее были отнесены к группе гормонзависимых. В отличие от больных 1-й группы затруднения дыхания у них лучше купировались неселективными симпатомиметиками: эфедрином, адреналином и средствами, содержащими их (теофедрином, бронхолитином). В обострении заболевания, при появлении тяжелых приступов удушья, только повышение дозы кортикостероидов давало эффект. Количество мокроты, обычно скудное (25-30 мл/сут), значительно увеличивалось (100-150 мл/сут) после выхода из тяжелых приступов или астматического состояния.
В 3-ю группу (24 больных) вошли больные с инфекционной и смешанной формами заболевания. В отличие от больных предыдущих групп, у них отмечались большая длительность заболевания (10-15 лет и более), а также значительные морфологические изменения в легких: выраженная эмфизема, диффузный пневмосклероз, обнаруживаемые физическими и инструментальными методами исследования. У 10 из них выявлялись признаки периферического цианоза. Клинические проявления бронхиальной обструкции у этих пациентов характеризовались своими особенностями. Так, несмотря на систематически проводимую терапию симпатомиметиками, препаратами теофиллина и кортикостероидами, все пациенты жаловались на постоянное затруднение дыхания, периодически переходящее в тяжелое удушье с выраженной одышкой и кашлем, и прогрессирующее ухудшение состояния при частых (до 8 раз в год) обострениях. Постоянный кашель у них в отличие от пациентов 2-й группы всегда сопровождался отделением мокроты, характер которой чаще всего был слизисто-гнойным, количество ее составляло 50-200 мл/сут. Увеличение дозы кортикостероидов при обострении заболевания существенно не улучшало состояния пациентов. Облегчение они отмечали лишь после санационной бронхоскопии или отхождения большого количества мокроты.
Различными были и результаты фармакологического тестирования. В 1-й группе показатели ФВД значительно возрастали непосредственно после ингаляции беротека, во 2-й — эти показатели после ингаляции беротека изменялись незначительно, а последующая ингаляция адреналина эффективно восстанавливала бронхиальную проходимость. В 3-й группе отсутствовала достоверная положительная динамика при ингаляции обоих фармакологических агентов (табл. 1).
Таблица 2. Результаты фармакологических проб с атровентом
(Х±m)
| Группа больных | Прирост показателей ФВД, % от должных | |||
| ОФВ1 | П75 | П50 | П25 | |
| 1-ая | 16,4±1,86 | 18,1±2,21 | 14,5±2,04 | 12,8±1,72 |
| 2-ая | 8,4±1,38 | 7,6±1,42 | 6,5±2,01 | 6,7±1,80 |
| 3-ая | 5,2±0,96 | 4,6±1,01 | 3,9±1,04 | 2,1±0,46 |
Дополнительное фармакологическое тестирование с холинолитиком атровентом выявило также малую эффективность. Этого бронхоспазмолитика именно во 2-й и 3-й группах (табл.2).
Время экспекторации составило в 1-3-й группе соответственно 30,1±2,01; 44,0±2,04 и 56,2±2,48 ч.
Как видно из представленных результатов, низкая эффективность беротека наблюдалась у больных с выраженными нарушениями бронхиального очищения и обтурации просвета бронхов скопившимся секретом (3-я группа), что было показано нами и ранее [4]. Во 2-й группе отсутствие эффекта от ингаляции селективного бета-2-адреномиметика беротека, вероятно, обусловлено преобладанием в обструкции отека слизистой оболочки, как это было выявлено у больных с пищевой бронхиальной астмой [3]. Именно альфа-стимулирующее действие адреналина, снимающее отек слизистой оболочки у больных 2-й группы, обусловливает его более высокую по сравнению с беротеком эффективность. Это объясняет тот факт, что в некоторых случаях по эффективности купирования приступов удушья неселективные симпатомиметики, в частности адреналин и эфедрин, не уступают селективным бета-2-агонистам [3, 10], а в ряде тяжелых ситуаций являются единственно приемлемыми. Клиницистами давно подмечено, что иногда своевременное подкожное введение адреналина купирует тяжелый приступ удушья, даже если бета-2-агонисты были совершенно неэффективны. Как известно, применение неселективных симпатомиметиков ограничено вследствие их выраженного
бета-1-кардиостимулирующего действия. Поэтому в таких случаях предпочтительным оказалось бы применение селективных противоотечных альфа-стимуляторов — нафтизина, галазолина и других с бета-2-агонистами и холинолитиками. Например: беротек + нафтизин, сальбутамол + галазолин, атровент + нафтизин и т.д. Казалось бы, это противоречит данным литературы о бронхоконстриктивном действии альфа-стимулирующих агентов, в частности мезатона, норадреналина и др. [2, 7, 11], Статистическая обработка наших данных нивелировала индивидуальные различия изменений показателей ФВД после ингаляции адреналина. Однако детальный анализ выявил у 8 обследованных на фоне значительного прироста бронхиальной проходимости поело ингаляции беротека отчетливое снижение показателей ФВД на последующую пробу с адреналином — на 9-12% по отношению к должным величинам (ОФВ1 — с 6,2±3,4%, П75 — 6,6±2,2%, П50 — 5,4±2,01%, П25 — 7,6±2,9%). Отсюда становится понятной кажущаяся противоречивость данных по этому вопросу: в случаях, когда отек слизистой оболочки является преобладающим фактором в развитии обструкции, ингаляция препаратов с альфа-стимулирующим действием улучшает бронхиальную проходимость, ибо выраженный прирост показателей ФВД после купирования отека нивелирует незначительную альфа-стимулированную бронхоконстрикцию. Если же отечный компонент незначителен, бронхоконстрикторное действие альфа-стимуляторов отчетливое. Таким образом, детальный клинический анализ симптомов, последовательное проведение фармакологических проб с селективными бета-2-агонистами, с препаратами альфа-стимулирующего действия и оценка времени экспекторации позволяют выделить 3 основных патогенетических варианта обструктивного синдрома у больных БА: бронхоспастический, воспалительно-отечный и обтурационный. Это позволяет осуществлять дифференцированное назначение 3 основных групп препаратов: бронхоспазмолитиков, противовоспалительных и отхаркивающих :средств, а также составлять индивидуальные программы ингаляционной терапии.
ЛИТЕРАТУРА
1. Замотаев И.П. и др.//Сов. мед. — 1977. — № 12. — с. 19-23.
2. Рябова К.Г. и др. // Эпидемиология и диагностика неспецифических заболеваний легких. — Саратов, 1988. — с. 161.
3. Сокуренко С.И. Клинико-функциональные особенности нутритивной бронхиальной астмы: Автореф. дис. … канд. мед. наук. — М., 1987.
4. Солопов В.Н. Мукоцилиарный транспорт у больных обструктивными заболеваниями легких: Автореф. дис. … канд. мед. Наук. М., 1987.
5. Солопов В.Н. Луничкина И.В. // Клин. мед. — 1989. — № 7, — с. 49-52.
6. Федосеев Г.В. // Руководство по пульмонологии. — Л., 1984. — с. 282-308.
7. Чучалин А.Г. Бронхиальная астма. М., 1985.
8. Brown R.D. Grattan C.// Lancet. — 1988. — Vol. 1. — P. 586-587.
9. Finucane K.F. et al// Med J. Aust. — 1985. — Vol. 142, N 11. — P. 602-604.
«Клиническая медицина» 1990, №6, с. 77-81
Общие характеристики. Состав:
Действующее вещество: naphazoline;
1 мл препарата содержит нафазолина нитрата (нафтизин) 0,5 мг (0,05 % раствор) или 1 мг (0,1 % раствор);
вспомогательные вещества: кислота борная, вода для инъекций или вода очищенная.
Фармакологические свойства:
Нафтизин оказывает выраженное сосудосуживающее действие на периферические сосуды благодаря воздействию на альфа-адренорецепторы. При нанесении на слизистые оболочки уменьшает отек, гиперемию, экссудацию, что способствует облегчению носового дыхания при ринитах. Нафазолин способствует открытию и расширению выводящих протоков придаточных пазух носа и евстахиевых труб, что улучшает отток секрета и препятствует осаждению бактерий.
При местном применении нафазолин полностью всасывается.
Терапевтическое действие наступает в течение 5 минут и длится 4-6 часов при интраназальном применени.
Показания к применению:
Острый ринит, воспаление придаточных пазух носа, евстахеит, воспаление среднего уха.
Для уменьшения отёка при диагностических и лечебных процедурах.
Важно! Ознакомься с лечением Ринита, Среднего отита, Евстахиита (Тубоотита), Острого ринита
Способ применения и дозы:
Нафтизин закапывают в каждый носовой ход, запрокинув голову немного назад и отклонив ее вправо при закапывании в левую ноздрю и влево — при закапывании в правую ноздрю.
С лечебной целью. Взрослым и детям в возрасте от 15 лет — по 1-3 капли раствора 0,1 % в каждый носовой ход. Детям в возрасте от 2 до 6 лет применяют раствор 0,05 % — по 1 капле, детям в возрасте от 6 до 15 лет — по 2 капле в каждый носовой ход.
Нафтизин применяют 2–3 раза в день, но не чаще чем через 4-6 часов.
Нафтизин нельзя применять больше 1 недели взрослым и больше 3 дней — детям.
Повторно Нафтизин можно применять лишь через 7-14 дней.
В случае кровотечения использовать тампоны, смоченные 0,05 % раствором препарата.
С диагностической целью — после очищения носовой полости в каждый носовой ход закапывают по 3-4 капли 0,05 % раствора или вводят на 1-2 мин тампон, смоченный в 0,05 % растворе.
Особенности применения:
Применение в период беременности или кормления грудью. Применение возможно только по назначению врача, который определит соотношение пользы для матери/риска для плода (ребенка).
Способность влиять на скорость реакции при управлении автотранспортом или работе с другими механизмами. При применении в терапевтических дозах не влияет на способность управлять транспортными средствами и работать с другими механизмами.
Дети. Нафтизин 0,05 % нельзя применять детям в возрасте до 2 лет.
Детям в возрасте от 2 до 15 лет можно применять Нафтизин 0,05 %.
Побочные действия:
При соблюдении рекомендованных доз Нафтизин обычно хорошо переносится. В редких случаях возникают побочные явления.
Местные действия препарата:
ощущение жжения и сухости в полости носа, реактивная гиперемия; при длительном применении – отёк слизистой оболочки носа; аллергические реакции, крайне редко – отек Квинке.
При применении больше 1 недели может вызывать привыкание к препарату.
Длительное применение может вызвать атрофический ринит.
Системное действие препарата:
со стороны нервной системы: слабость, тремор, тошнота, головная боль, раздражительность, повышенная потливость;
со стороны сердечно-сосудистой системы: в отдельных случаях у предрасположенных пациентов – повышение артериального давления, тахикардия, аритмия.
Эти побочные эффекты возникают преимущественно после передозировки препарата.
Взаимодействие с другими лекарственными средствами:
Нафтизин снижает терапевтическую активность гипотензивных средств, назначаемых перорально, замедляет всасывание анестетиков.
При комбинированном применении с ингибиторами МАО (ниаламид, бефол) и трициклическими антидепрессантами или на протяжении нескольких дней после их отмены существует риск резкого повышения артериального давления.
Неселективные ингибиторы обратного захвата моноаминов усиливают сосудосуживающий эффект препарата Нафтизин.
Противопоказания:
Повышенная чувствительность к компонентам препарата;
сухое воспаление слизистой оболочки носа;
детский возраст до 2 лет; Нафтизин 0,1 % раствор противопоказан детям в возрасте до 15 лет.
Надлежащие меры безопасности при применении.
Длительное применение препарата может привести к хронической заложенности носа и атрофии слизистой оболочки.
Следует очень осторожно применять препарат людям с тяжёлыми заболеваниями сердечно-сосудистой системы (артериальная гипертензия, ишемическая болезнь сердца), больным сахарным диабетом, при гипертиреозе, феохромоцитоме, бронхиальной астме. Осторожность необходима при одновременном применении ингибиторов МАО и других препаратов, что потенциально могут повысить артериальное давление; при применении анестетиков, которые повышают чувствительность миокарда к симпатомиметикам (например, галотан).
Передозировка:
Передозировка или случайное проглатывание препарата может проявиться симптомами системного действия препарата: повышение артериального давления, тахикардия, головная боль, тремор, раздражительность, повышенная потливость, ощущение сердцебиения, нарушение сознания. Могут возникать — цианоз, тошнота, остановка сердца, отек легких, психические нарушения, повышение температуры тела. Угнетающее действие на центральную нервную систему проявляется такими симптомами: сонливость, брадикардия, снижение температуры тела, шоковое состояние, апноэ, кома.
При случайной передозировке следует прекратить применение препарата и немедленно обратиться к врачу.
Лечение симптоматическое.
Условия хранения:
Срок годности. 3 года. После вскрытия флакона срок годности препарата — 28 суток. Не применять препарат после окончания срока годности, указанного на упаковке.
Флаконы полиэтиленовые и флаконы полиэтиленовые с контролем вскрытия. Хранить в оригинальной упаковке, защищенном от света месте при температуре от 15 ºС до 25 ºС.
Флаконы стеклянные. Хранить в защищенном от света месте при температуре не выше 25 ºС. Хранить в недоступном для детей месте.
Условия отпуска:
Без рецепта
Упаковка:
По 10 мл во флаконе полиэтиленовом, во флаконе полиэтиленовом с контролем вскрытия или во флаконе стеклянном, вложенном в пачку.
Опубликовано: 29 окт 2018