Микроангиопатическая гемолитическая анемия это
Термин «микроангиопатическая
гемолитическая анемия» (МАГА), предложенный
Симмерсом в 1952 году, используется для
обозначения гемолитического синдрома,
в основе которого лежит фрагментация
эритроцитов во время их циркуляции по
измененным мелким сосудам.
Наиболее часто МАГА наблюдается
иммунокомпетентной патологии и синдроме
диссеминированного внутрисосудистого
свертывания (ДВС), обусловливающих
развитие:
гемолитико-уремического синдрома;
тромботической тромбоцитопенической
пурпуры;синдрома острой дефибринации при
преждевременной отслойке плаценты,
эмболии околоплодными водами и других
заболеваниях.
Этиология и патогенез.
Поражение мелких сосудов (в основном
артериол) при иммунокомплексной патологии
и ДВС состоит в нарушении целостности
сосудистого эндотелия и внутрисосудистом
отложении фибрина. Эритроциты, проходя
через небольшие отверстия между нитями
фибрина или контактируя с отростками
клеток поврежденного эндотелия,
травмируются, в результате чего они
распадаются на отдельные фрагменты
(шистоциты) или теряют часть оболочки,
принимая форму микросфероцитов.
Интенсивность фрагментации эритроцитов
зависит от распространенности
микроангиопатии и скорости тока
эритроцитов через пораженные сосуды.
Последняя во многом определяется
величиной артериального давления,
которое при многих заболеваниях,
сопровождающихся иммунокомплексной
патологией и синдромом ДВС, оказывается
повышенным.
Клиника.
Течение МАГА во многом зависит от
основного заболевания.
При гемолитико-уремическом синдроме,
наблюдающемся в основном у детей после
инфекционных заболеваний и вакцинаций,
симптомы гемолитической анемии (слабость,
повышенная утомляемость, бледность и
желтушность кожных покровов) сочетаются
с признаками быстро нарастающей почечной
недостаточности (отсутствие аппетита,
рвота, боли в поясничной области, олигурия
и анурия).
При тромботической тромбоцитопенической
пурпуре, которая чаще встречается в
возрасте 30-40 лет и характеризуется более
распространенными сосудистыми
поражениями, в клинической картине
преобладает геморрагический синдром,
являющийся следствием глубокой
тромбоцитопении, и неврологические
нарушения: потеря сознания, делирий,
афазия, атаксия и др.
При острой дефибринации, развивающейся
при сепсисе, преждевременной отслойке
плаценты, эмболии околоплодными водами
и некоторой другой акушерской патологии,
в клинике доминируют профузные
кровотечения, обусловленные полной
потерей способности крови к свертыванию.
Поскольку гемолиз при МАГА, сопровождающей
эти состояния происходит в основном
внутрисосудистого, селезенка и печень,
как правило, не увеличены.
Лабораторные данные.
Выраженность анемии при МАГА зависит
от распространенности сосудистых
поражений. При просмотре мазка крови
обращает на себя внимание присутствие
большого количества фрагментов
эритроцитов (шистоцитоз). Отмечается
также микросфероцитоз, наличие
нормобластов, полихромазия и умеренный
ретикулоцитоз. Число лейкоцитов увеличено
за счет нейтрофилов. В большинстве
случаев наблюдается тромбоцитопения
вследствие потребления кровяных
пластинок в процессе ДВС.
Наиболее выраженная тромбоцитопения
наблюдается при тромботической
тромбоцитопенической пурпуре и острой
дефибринации.
Проба Кумбса отрицательная, продолжительность
жизни эритроцитов укорочена.
В костном мозге – эритроидная гиперплазия
и некоторое увеличение числа мегакариоцитов
за счет молодых форм.
Увеличение уровня свободного гемоглобина
сыворотки, низкая концентрация
гаптоглобина и умеренная гипербилирубинемия
свидетельствуют о внутрисосудистом
характере гемолиза.
При развитии почечной недостаточности
в плазме повышается содержание остаточного
азота, азота, мочевины и креатинина. При
острой дефибринации наблюдается
удлинение протромбинового и тромбинового
времени, снижение концентрации факторов
V,VIII,
фибриногена и повышение содержания
продуктов деградации фибрина (ПДФ).
При хроническом ДВС, который наблюдается
при гемолитико-уремическом синдроме и
тромботической тромбоцитопенической
пурпуре, концентрация в крови свертывающих
факторов, включая фибриноген, может
быть нормальной или даже повышенной.
Однако, содержание ПДФ, как правило,
увеличено, а уровень антитромбина IIIснижен.
Диагностика.
В диагностике МАГА ведущее значение
имеет обнаружение шистоцитоза в мазках
крови и признаков ДВС: прогрессирующей
тромбоцитопении, фибриногенопении,
повышенного содержания ПДФ, наличия
активированных факторов X,XIIи снижения уровня
антитромбинаIII.
Лечение.
Лечение МАГА включает:
Терапию основного заболевания, вызвавшего
развитие ДВС,Терапию ДВС с помощью гепарина в дозе
25-30 ед/кг/ч, переливаний плазмы (источник
антитромбина III), альбумина,
реополиглюкина и введения
антифибринолитических препаратов
(контрикал, трасилол и др.),Обменные переливания крови и плазмаферез,
При значительной анемизации –
заместительные гемотрансфузии.
Прогноз.
Прогноз при МАГА целиком зависит от
основного заболевания. Так, если при
гемолитико-уремическом синдроме погибают
5% больных, то при тромботической
тромбоцитопенической пурпуре смертность
в первые три месяца достигает 80%, а менее
10% больных живут более одного года.
ПРИЛОЖЕНИЕ I.
Нормальные гематологические показатели
здорового человека.
Показатель | Пол | Пределы нормальных | Единицы измерения |
Гемоглобин (Hb) | Мужчины | 133-177 | г/л |
Женщины | 117-157 | ||
Эритроциты (RBC) | Мужчины | 4,6-6,5 | х1012/л |
Женщины | 3,8-5,8 | ||
Гематокрит (HCT) | Мужчины | 0,4-0,54 | % |
Женщины | 0,37-0,49 | ||
Средний объем | 80-100 | фл* | |
Среднее содержание | 27-32 | пг* | |
Средняя концентрация | 310-370 | г/л | |
Ретикулоциты | 2-10 | ‰ | |
Лейкоциты (WBC) | 4,0-8,0 | х109/л | |
| 1-6 | % | |
0,04-0,3 | х109/л | ||
| 45-70 | % | |
2,0-5,5 | х109/л | ||
| 20-45 | % | |
1,5-4,0 | х109/л | ||
| 2-9 | % | |
0,08-0,60 | х109/л | ||
| 1-6 | % | |
0,04-0,4 | х109/л | ||
| <1 | % | |
<0,1 | х109/л | ||
Тромбоциты (PLT) | 150-400 | х109/л | |
Сывороточное железо | мужчины | 9-28 | ммоль/л |
женщины | 7-26 | ||
Общая железосвязывающая | 45-70 | мкмоль/л | |
Ферритин сыворотки | мужчины | ||
женщины | |||
Шиллинг-тест | >10% дозы, выделенной | ||
Фолаты сыворотки | 2,5-20,0 | мкг/л | |
Фолаты эритроцитов | 160,0-640,0 | мкг/л | |
Скорость оседания | < 10 мм в течение | мм/ч | |
Масса циркулирующих | мужчины | 25-35 | мл/кг |
женщины | 20-30 | мл/кг | |
Объем плазмы | 40-50 | мл/кг | |
Период полураспада | 25-30 дней | ||
Гемоглобин А2 | 1,5-3,2 | % общего Hb | |
Гемоглобин F | 0,5-0,8 | % общего Hb | |
*Примечание: пг – пикограмм (10-12г) фл – фентолитр | |||
Оглавление.
Глава |
Эритропоэз. |
Гемоглобин. |
Железо, |
Иммунология |
Морфофизиология |
Глава |
Глава |
Апластические |
Миелодиспластический |
Хроническая |
Мегалобластные |
Глава |
Мембранопатии. |
Наследственные мембранопатии. |
Пароксизмальная ночная гемоглобинурия |
Энзимопатии. |
Гемолитическая анемия вследствие |
Гемоглобинопатии. |
Качественные (структурные) |
Серповидно-клеточная анемия |
Гемоглобинопатия С |
Гемоглобинопатия SC |
Гемоглобинопатия D |
Гемоглобинопатия E |
Количественные гемоглобинопатии. |
β-талассемии. |
α-талассемии. |
H-гемоглобинопатия. |
Аутоиммунные |
АИГА с неполными тепловыми агглютининами. |
АИГА с полными холодовыми агглютининами. |
АИГА с двухфазными гемолизинами |
Глава |
Приложение. |
в соответствующих главах учебного
пособия приводятся подробные классификации
анемий этих типов.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
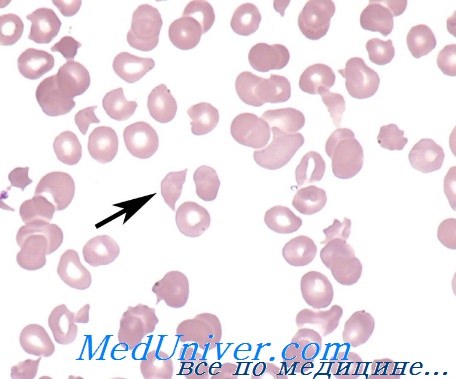
Микроангиопатическая гемолитическая анемия — история изучения, причиныМикроангиопатическая гемолитическая анемия (МГА) относится к группе приобретенных гемолитических анемий по внеэритоцитным причинам, точнее — к подгруппе механических гемолитических анемий. Микроангиопатическая гемолитическая анемия представляет собой частную форму гемолитической анемии, характеризующуся наличием раздробленных эритроцитов («шлемообразные », треугольные, зубчатые, микросфероциты) на мазках крови и признаками внутрисосудистого расплавления крови. Часто тромбоцитопения и расстройство свертывания (Brain) сопровождают микроангиопатическую гемолитическую анемию. Подобно иным видам анемии, микроангиопатическая гемолитическая анемия не составляет самостоятельную единицу, а лишь синдром, развивающийся при ином заболевании или синдроме. Болезни, при которых была описана микроангиопатическая гемолитическая анемия носят общий характер — патологическое изменение небольших сосудов, артериол и капилляров (микроаигиопатия). В 1891 г. Ehrlich впервые отметил наличие раздробленных эритроцитов («шистоциты») на мазке страдающего анемией. В 1949 Schwartz и Motto описали присутствие 0,1—0,5% «надрезанных» («burr cells») эритроцитов в мазках крови больных уремией, раком желудка и пептической геморрагической язвой. В 1954 г. Monroe и Strauss сообщили о выявлении раздробленных эритроцитов на срезах отдельных кровеносных сосудов больного, погибшего от тромботической тромбогемолитической пурпуры. Они выдвинули гипотезу, по которой раздробление эритроцитов якобы происходит в ненормальных кровеносных сосудах. В 1962 Brain, Dacie и Hourihane впервые использовали термин «микроангионатическая гемолитическая анемия». В период с 1962 по 1972 гг. Brain и Dacie, в сотрудничестве с другими исследователями, поставили эксперимент микроангиопатической гемолитической анемии на животных, изучили механизм дробления эритроцитов в пробирке, описали процесс внутрисосудистого свертывания у страдающих микроангиопатической гемолитической анемией, реакцию на лечение гепарином и сочетание микроангиопатической гемолитической анемии с метастатическим раком. Понятие микроангиопатической гемолитической анемии общепринято и подтверждено другими авторами. С 1961 г. в литературе был опубликован ряд сообщений о гемолитической анемии, в условиях которой, после хирургического вмешательства на сердце по поводу клапанопластики, протезирования синтетическими клапанами и исправления внутрисердечных дефектов. Гемолитическая анемия с дроблением эритроцитов описана у больных, страдающих тяжелой недостаточностью клапанов (в частности сужение аорты) и коарктацией аорты.
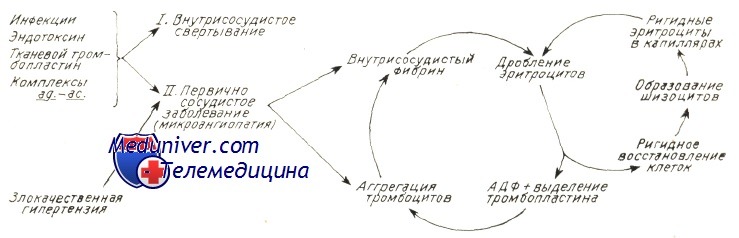
Причины (этиология) микроангиопатической гемолитической анемииМикроангиопатическая гемолитическая анемия описана в сочетании с рядом иных заболеваний. Наличие процесса расплавления крови с последующим дроблением эритроцитов предполагает следующие патогенетические механизмы: В патологии человека микроангиопатическая гемолитическая анемия описана в сочетании с сосудистыми заболеваниями, обусловленными обоими механизмами. В случае первичного сосудистого нарушения или вызванного процессом внутрисосудистого свертывания тромбы фибрина и тромбоциты частично закупоривают просвет мелких сосудов. Волоски фибрина действуют на движущиеся эритроциты подобно «гильотине » и тем самым обусловливают их дробление. Те фрагменты эритроцитов, у которых поверхностная оболочка меньше соответствующего объема, быстро захватываются макрофагами селезенки. Другие же, у которых отношение площадь/ объем превышает норму (за счет перехода гемоглобина в плазму или в результате дробления) подвергаются процессу рубцевания («повторному запечатыванию») оболочки и остаются в кровообращении, представляя собой «ключ» к постановке диагноза основного заболевания. В результате этого процесса рубцевания оболочки появляются жесткие эритроциты — сфероциты, «шлемообразные» эритроциты, которые подвергаются повторному дроблению при переходе через капилляры. Дробление эритроцитов сопровождается выделением АДФ и фосфолипидного прокоагулянта, что снова ведет к аггрегации тромбоцитов и отложению фибрина в мелких сосудах, тем самым усиливая процесс внутрисосудистого свертывания. На рисунке приводится модель патогенеза микроангиопатической гемолитической анемии. Необходимо отметить, что не у всех больных с рассеянным внутрисосудистым свертыванием наблюдается микроангиопатическая гемолитическая анемия. Для ее развития важно, чтобы фибрин удержался в кровообращении достаточный период времени. Сохранение запасов фибрина в мелких сосудах зависит от ритма дефибринизации, клиренса макрофаговой системы и местного фибринолиза.
Болезни, сопутствующие микроангиопатической гемолитической анемии (МГА)1. Тромбогемолитическая тромботическая пурпура (РТТ) 2. Уремический гемолитический синдром При микроангиопатической гемолитической анемии, встречающейся в заболеваниях метастазом рака, эритроциты разрушаются механическим путем в малых сосудах, измененных: — Также рекомендуем «Диагностика микроангиопатической гемолитической анемии — дифференциация» Оглавление темы «Гемолитические анемии»:
|
Приобретенные гемолитические анемии развиваются у большинства больных при внутрисосудистом гемолизе нормальных эритроцитов, обусловленном антителами и токсинами, гиперактивностью клеток ретикулоэндотелиальной системы, естественными или механическими препятствиями кровотоку.
Иммунные гемолитические анемии
Иммунный гемолиз у взрослых обычно вызван IgG- и IgM-аутоантителами к антигенам собственных эритроцитов. При остром начале аутоиммунных гемолитических анемий у больных появляются слабость, одышка, сердцебиение, боли в сердце и в пояснице, повышается температура, развивается интенсивная желтуха. При хроническом течении заболевания выявляют общую слабость, желтуху, увеличение селезенки, иногда и печени.
Анемия носит нормохромный характер. В крови обнаруживают макроцитоз и микросфероцитоз, возможно появление нормобластов. СОЭ увеличена.
Основной метод диагностики аутоиммунных гемолитических анемий — проба Кумбса, при которой антитела к иммуноглобулинам (особенно IgG) или компонентам комплемента (СЗ) агглютинируют эритроциты больного (прямая проба Кумбса).
В некоторых случаях необходимо выявить антитела в сыворотке больного. Для этого сначала инкубируют сыворотку больного с нормальными эритроцитами, а затем выявляют антитела на них с помощью антиглобулиновой сыворотки (анти-IgG) — непрямая проба Кумбса.
В редких случаях на поверхности эритроцитов не обнаруживают ни IgG, ни комплемент (иммунная гемолитическая анемия с отрицательной пробой Кумбса).
Аутоиммунная гемолитическая анемия с тепловыми антителами
Аутоиммунная гемолитическая анемия с тепловыми антителами чаще развивается у взрослых, особенно у женщин. Тепловые антитела относятся к IgG, реагирующим с белковыми антигенами эритроцитов при температуре тела. Эта анемия бывает идиопатической и лекарственной и наблюдается как осложнение гемобластозов (хронического лимфолейкоза, лимфогранулематоза, лимфомы), коллагенозов, особенно СКВ, СПИДа.
Клиника заболевания проявляется слабостью, желтухой, спленомегалией. При выраженном гемолизе у больных появляются лихорадка, обмороки, боли в грудной клетке и гемоглобинурия.
Лабораторные данные характерны для внесосудистого гемолиза. Выявляется анемия со снижением уровня гемоглобин до 60–90 г/л, содержание ретикулоцитов повышается до 15—30%. Прямая проба Кумбса положительна более чем в 98% случаев, обнаруживают IgG в сочетании с СЗ или без него. Уровень гемоглобина снижен. В мазке периферической крови обнаруживается микросфероцитоз.
Легкий гемолиз не требует лечения. При гемолитической анемии средней тяжести и тяжелой — лечение в первую очередь направлено на причину заболевания. Для быстрого прекращения гемолиза используют нормальный иммуноглобулин G 0,5–1,0 г/кг/сут в/в в течение 5 сут.
Против самого гемолиза назначают глюкокортикоиды (например, преднизолон 1 мг/кг/сут внутрь) до нормализации уровня гемоглобина в течение 1—2 недель. После этого дозу преднизолона снижают до 20 мг/сут, затем в течение нескольких месяцев продолжают снижать и отменяют полностью. Положительный результат достигается у 80% больных, но у половины из них заболевание рецидивирует.
При неэффективности или непереносимости глюкокортикоидов показана спленэктомия, которая дает положительный результат у 60% больных.
В отсутствии эффекта от глюкокортикоидов и спленэктомии назначают иммунодепрессанты — азатиоприн (125 мг/сут) или циклофосфамид (100 мг/сут) в сочетании с преднизолоном или без него. Эффективность этого лечения составляет 40—50%.
При тяжелом гемолизе и выраженной анемии проводят гемотрансфузию. Так как тепловые антитела реагируют со всеми эритроцитами, обычный подбор совместимой крови неприменим. Предварительно следует адсорбировать антитела, присутствующие в сыворотке больного, с помощью его же эритроцитов, с поверхности которых удалены антитела. После этого сыворотка исследуется на наличие аллоантител к антигенам донорских эритроцитов. Подобранные эритроциты медленно переливают больным под тщательным наблюдением за возможным возникновением гемолитической реакции.
Аутоиммунная гемолитическая анемия с холодовыми антителами
Эта анемия характеризуется наличием аутоантител, реагирующих при температуре ниже 37 °С. Существует идиопатическая форма болезни, составляющая около половины всех случаев, и приобретенная, связанная с инфекциями (микоплазменными пневмониями и инфекционным мононуклеозом) и лимфопролиферативными состояниями.
Основным симптомом болезни является повышенная чувствительность к холоду (общему переохлаждению или приему холодной пищи или напитков), проявляющаяся посинением и побелением пальцев рук и ног, ушей, кончика носа.
Характерны расстройства периферического кровообращения (синдром Рейно, тромбофлебиты, тромбозы, иногда холодовая крапивница), возникающие в результате внутри- и внесосудистого гемолиза, приводящего к образованию внутрисосудистых конгломератов из агглютинированных эритроцитов и окклюзии сосудов микроциркуляторного русла.
Анемия обычно нормохромная или гиперхромная. В крови выявляют ретикулоцитоз, нормальное количество лейкоцитов и тромбоцитов, высокий титр холодовых агглютининов, обычно антител класса IgM и СЗ. Прямая проба Кумбса выявляет только СЗ. Нередко обнаруживают агглютинацию эритроцитов in vitro при комнатной температуре, исчезающую при подогревании.
Пароксизмальная холодовая гемоглобинурия
Заболевание в настоящее время редкое, бывает как идиопатическим, так и вызванным вирусными инфекциями (корью или эпидемическим паротитом у детей) или третичным сифилисом. В патогенезе основное значение имеет образование двухфазных гемолизинов Доната–Ландштейнера.
Клинические проявления развиваются после пребывания на холоде. Во время приступа возникают озноб и лихорадка, боли в спине, ногах и животе, головная боль и общее недомогание, гемоглобинемия и гемоглобинурия.
Диагноз ставят после обнаружения холодовых Ig-антител в двухфазной пробе на гемолиз. Прямая проба Кумбса либо отрицательная, либо выявляет СЗ на поверхности эритроцитов.
Главное в лечении аутоиммунных гемолитических анемий с холодовыми аутоантителами — предупреждение возможности переохлаждения. При хроническом течении заболевания используют преднизолон и иммунодепрессанты (азатиоприн, циклофосфамид). Спленэктомия обычно неэффективна.
Аутоиммунная лекарственная гемолитическая анемия
Лекарственные средства, вызывающие иммунную гемолитическую анемию, по патогенетическому механизму действия делятся на три группы.
К первой группе относятся препараты, вызывающие заболевание, клинические признаки которого аналогичны признакам аутоиммунной гемолитической анемии с тепловыми антителами. У большинства больных причиной заболевания является метилдофа. При приеме этого препарата в дозе 2 г/сут у 20% больных отмечается положительная проба Кумбса. У 1% больных развивается гемолитическая анемия, в крови выявляют микросфероцитоз. На эритроцитах обнаруживают IgG. Гемолиз ослабевает через несколько недель после прекращения приема метилдофы.
Ко второй группе относятся препараты, которые адсорбируются на поверхности эритроцитов, выполняют роль гаптенов и стимулируют образование антител к комплексу лекарственное средство — эритроцит. Такими препаратами являются пенициллин и другие близкие по структуре антибиотики. Гемолиз развивается при назначении препарата в высоких дозах (10 млн ед/сут и более), но обычно бывает умеренно выраженным и после отмены препарата быстро прекращается. Проба Кумбса при гемолизе бывает положительной.
В третью группу включены лекарственные препараты (хинидин, сульфаниламиды, производные сульфанилмочевины, феницитин и др.), вызывающие образование специфических антител комплекса IgM. Взаимодействие антител с лекарственными препаратами приводит к образованию иммунных комплексов, оседающих на поверхности эритроцитов.
Прямая проба Кумбса бывает положительной только по отношению к СЗ. Непрямая проба Кумбса положительная только в присутствии лекарственного препарата. Гемолиз чаще бывает внутрисосудистым и быстро проходит после отмены лекарственных средств.
Механическая гемолитическая анемия
Механические повреждения эритроцитов, приводящие к развитию гемолитической анемии, возникают:
- при прохождении эритроцитов по мелким сосудам над костными выступами, где подвергаются сдавлению извне (маршевая гемоглобинурия);
- при преодолении градиента давления на протезах клапанов сердца и сосудов;
- при прохождении по мелким сосудам с измененными стенками (микроангиопатическая гемолитическая анемия).
Маршевая гемоглобинурия возникает после длительной ходьбы или бега, занятий каратэ или тяжелой атлетикой и проявляется гемоглобинемией и гемоглобинурией.
Гемолитическая анемия у больных с протезированными клапанами сердца и сосудов обусловлена внутрисосудистыми разрушениями эритроцитов. Гемолиз развивается примерно у 10% больных с протезированным аортальным клапаном (стеллитовые клапаны) или его дисфункцией (околоклапанная регургитация). Биопротезы (свиные клапаны) и искусственные митральные клапаны редко вызывают значительный гемолиз. Механический гемолиз обнаруживают у больных с аортобедренными шунтами.
Гемоглобин снижается до 60–70 г/л, появляются ретикулоцитоз, шизоциты (обломки эритроцитов), снижается содержание гемоглобина, возникают гемоглобинемия и гемоглобинурия.
Лечение направлено на уменьшение дефицита железа, назначаемого внутрь, и ограничение физической нагрузки, что снижает интенсивность гемолиза.
Микроангиопатическая гемолитическая анемия
Является вариантом механического внутрисосудистого гемолиза. Заболевание возникает при тромботической тромбоцитопенической пурпуре и гемолитико-уремическом синдроме, синдроме диссеминированного внутрисосудистого свертывания, патологии сосудистой стенки (гипертонических кризах, васкулитах, эклампсии, диссеминированных злокачественных опухолях).
В патогенезе этой анемии основное значение имеет отложение нитей фибрина на стенках артериол, проходя через переплетения которых эритроциты разрушаются. В крови выявляются фрагментарные эритроциты (шизоциты и шлемовидные клетки) и тромбоцитопения. Анемия обычно резко выражена, уровень гемоглобина снижается до 40–60 г/л.
Проводят лечение основного заболевания, назначают глюкокортикоиды, свежезамороженную плазму, плазмаферез и гемодиализ.