Механизмы развития анемии железодефицитной
Различают острую и хроническую
постгеморрагическую анемии.
Острая постгеморрагическая анемия
Возникает в результате острой массивной
потери крови в объеме от 5 мл/кг массы
тела и выше (травма, хирургическое
вмешательство, желудочные, маточные,
кишечные кровотечения, разрыв фаллопиевых
труб, нарушение гемостаза и др.). Сразу
после потери крови вследствие уменьшения
ее массы появляется общеанемические
признаки — тахикардия, одышка, бледность
кожных покровов и слизистых оболочек,
падение АД. Содержание эритроцитов и
гемоглобина снижается равномерно
(нормоцитемическая гиповолемия),
развивается нормохромная анемия.
Изменения периферической крови носят
стадийный характер. На 2–3-е сутки после
кровотечения в кровь поступает тканевая
жидкость, масса ее восстанавливается
(гидремическая фаза), а количество
эритроцитов и гемоглобина снижается,
падает гематокрит, но в связи с выходом
эритроцитов из депо цветовой показатель
сохраняется в норме (нормохромная
анемия), развивается лейкопения (утрата
лейкоцитов во время кровотечения,
гемодиллюция), тромбоцитопения (утрата
тромбоцитов при потере крови, потребление
при образовании тромба). Наблюдается
умеренный анизоцитоз и пойкилоцитоз
эритроцитов. Возникшая гипоксия ведет
к повышению уровня эритропоэтина и на
4–5-е сутки после кровотечения активируется
функция костного мозга (костномозговая
фаза компенсации) появляются регенеративные
формы эритроцитов — полихроматофилы,
единичные нормобласты (полихроматофильные,
оксифильные), ретикулоцитоз. Анемия
приобретает гипохромный характер, т.
к. ускоренная регенерация опережает
созревание эритроцитов из-за возникшего
дефицита железа. Развивается нейтрофильный
лейкоцитоз со сдвигом влево по
регенеративному типу.
Данные нарушения обусловлены уменьшением
объема циркулирующей крови и гипоксией.
В ответ на кровопотерю включаются
механизмы компенсации, направленные
на восстановление утерянного объема
крови и на борьбу с анемическим состоянием
(гипоксией).
Хроническая постгеморрагическая анемия
Развивается в результате длительно
повторяющихся небольших кровотечений.
Является вариантом железодефицитных
анемий, патогенез и проявления обусловлены
нарастающим дефицитом железа.
Железодефицитная анемия
Железо — один из важнейших микроэлементов,
входящих в состав организма человека.
Взрослому человеку требуется 15–18 мг/сут
железа, из которых всасывается 2–2,5 мг.
При этом биодоступность содержащегося
в пище гемового железа существенно
выше, чем негемового. Основные депо
железа: печень (гепатоциты и макрофаги),
костный мозг, селезёнка, мышцы. Если
метаболизм железа нормален, 30–40 %
нормобластов костного мозга содержат
гранулы ферритина (сидеробласты).
Отсутствие сидеробластов характерно
для железодефицита. Избыток гранул в
сидеробласте служит признаком переполнения
организма железом (гемосидероз) или
неспособности утилизировать его
(сидеробластная анемия). На рис. 2
представлена схема метаболизма железа.
Дефицит железа в организме существует
в двух формах, представляющих собой две
последовательные стадии одного процесса:
латентный (тканевый) дефицит железа
(ЛДЖ) и собственно железодефицитная
анемия (ЖДА).
ЖДА составляет около 80–90 % всех случаев
анемий и является одной из самых
распространенных ее форм. Женщины
страдают данным заболеванием чаще, чем
мужчины, поскольку запасы железа у
последних значительно превышают (на
100–200 %) таковые у женщин. Явный и скрытый
дефицит железа отмечается почти у 60 %
женщин земного шара. Железодефицитные
анемии встречаются во всех возрастных
группах. Различают «истинные» ЖДА —
при абсолютном дефиците железа и «ложные»
— при нарушении включения железа в
гемм, в отсутствие первичного истинного
железодефицита.
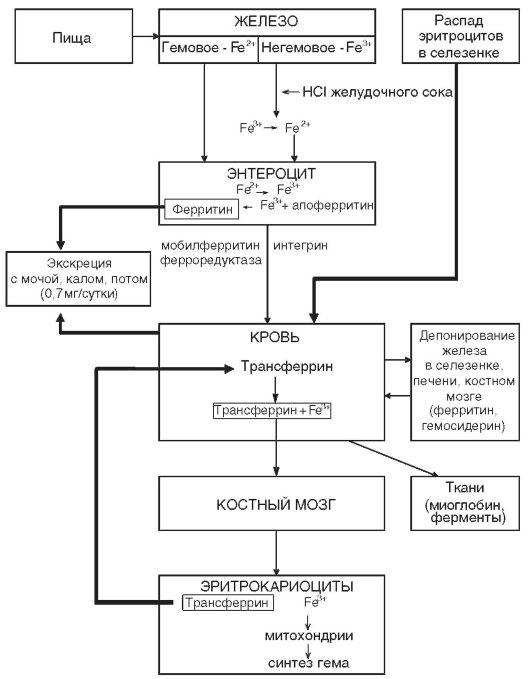
Рисунок 2 – Схема метаболизма
железа в организме
Этиология
По патогенетическому принципу с учетом
основных этиологических причин
железодефицитные анемии делят на пять
основных подгрупп (Л.И. Идельсон): 1)
связанные с повышенной потерей железа;
2) связанные с недостаточным исходным
уровнем железа; 3) связанные с повышенным
расходованием железа; 4) связанные с
нарушением всасывания железа и
недостаточным поступлением его с пищей
(алиментарные); 5) связанные с нарушением
транспорта железа.
Таблица 3.Причины и механизмы
развития железодефицитных состояний
Группы | Характеристика | Патогенез |
Особенные периоды | Дети недоношенные Дети первых лет | Недостаточный |
Интенсивный рост Беременность Лактация | Повышенное | |
Патологические | Хроническая При При Из Из При Припатологии | Повышенная потеря |
Патологические | Патология ЖКТ: Резекция желудка Гипосекреция Хронический Дисбактериозы; Глистные инвазии | Нарушение |
Наследственная Приобретённая | Нарушение | |
Алкоголизм | Комбинация Недостаточное | |
Нарушение | Нерациональное Голодание; Вегетарианская Искусственное | Недостаточное |
Избыточные | Повышенное |
Нередко действуют комбинации указанных
факторов, вызывающих отрицательный
баланс железа. Примером ЖДА, развивающейся
вследствие комплексного влияния
нескольких факторов, является хлороз
(от греч. «хлорос» — бледно-зеленый, или
«бледная немочь»). Название связано со
специфическим цветом лица таких больных.
При ЖДА уменьшается содержание железа
в плазме крови, костном мозге и в тканевых
депо.
Патогенез.
Основным звеном патогенеза заболевания
является снижение содержания железа в
депо, сыворотке крови и костном мозгу.
В результате нарушается синтез
гемоглобина, возникают гипохромная
анемия и трофические расстройства в
тканях, признаками которых являются:
сухость и вялость кожи, ломкость ногтей,
выпадение волос, атрофия слизистой
оболочки языка, повышенное разрушение
зубов, дисфагия, извращение вкуса,
мышечная слабость и др.. В патогенезе
клинических проявлений болезни имеет
значение: нарушение активности
железосодержащих ферментов в тканях
организма (цитохром С, цитохромоксидаза,
сукцинатдегидрогеназа, пероксидаза,
митохондриальная моноаминооксидаза,
α-глицерофосфатоксидаза) и недостаточное
снабжение тканей кислородом. Признаки
гипоксии тканей появляются лишь при
значительной выраженности малокровия,
когда наступает истощение компенсаторных
механизмов, обеспечивающих на ранних
этапах развития дефицита железа
нормализацию отдачи кислорода из
гемоглобина тканям.
Клиническая картинаскладывается
из двух основных синдромов: общеанемического
и сидеропенического.
Общеанемический синдром проявляется
симптомами, характерными для всех видов
анемии: бледность, общая слабость,
быстрая утомляемость, обмороки, одышка,
тахикардия, систолический шум.Сидеропенический синдром характеризуется
рядом трофических нарушений. Отмечаются:
сухость и трещины кожи, преждевременные
морщины, ломкость ногтей, койлонихия
(катлонихия) — ложкообразные ногти,
ангулярный стоматит, атрофия слизистых
оболочек рта, пищевода, желудка,
дыхательных путей. Нарушается иммунитет,
что приводит к хронизации инфекций,
частым ОРЗ; развивается мышечная
слабость, слабость физиологических
сфинктеров. Может возникнуть извращение
вкуса (поедание несъедобных продуктов
— мела, бумаги и др.), пристрастие к
необычным запахам (ацетон, бензин,
краска). Нарушается память, концентрация
внимания. При дефиците железа резко
усиливается абсорбция свинца, и у детей
на этом фоне развивается необратимая
задержка интеллектуального развития.
Нарушение проницаемости мелких сосудов
ведет к отекам лица. Иногда возникает
«сидеропенический субфебрилитет».
Картина крови.Основным признаком
железодефицитной анемии является
гипохромия со снижением цветового
показателя ниже 0,8 и, соответственно,
уменьшением содержания гемоглобина
ниже 110 г/л. Количество эритроцитов, как
правило, остается на исходном уровне,
но в ряде случаев может оказаться
сниженным до 2,0-1,5×1012/л вследствие
нарушения процессов пролиферации клеток
эритроидного ряда в костном мозгу и
усиления неэффективного эритропоэза
(в норме разрушение эритронормобластов
в костном мозгу не превышает 10-15%).
Ретикулоциты в норме или незначительно
увеличены, при прогрессировании ЖДА их
количество снижается. Важным морфологическим
признаком железодефицитных анемий
является анизоцитоз эритроцитов с
преобладанием микроцитов.
Нередко развивается нейтропения (в
результате уменьшения содержания
железосодержащих ферментов в лейкоцитах).
СОЭ в норме или незначительно увеличена.
Уровень тромбоцитов может быть
незначительно повышен (на фоне
кровотечений).
Исследование костного мозга.В КМ
определяется нормобластическая
гиперплазия с нарушением гемоглобинизации
(преобладание базофильных и
полихроматофильных нормобластов при
снижении оксифильных), снижение индекса
созревания нормобластов, снижение
количества сидеробластов вплоть до
полного их отсутствия. Миелоидный и
мегакариоцитарный ростки не изменены.
Биохимический анализ крови – основной
диагностический критерий при ЖДА,
включающий набор тестов, при помощи
которых подтверждается факт дефицита
железа в организме:
снижение уровня сывороточного железа,
снижение уровня сывороточного ферритина,
снижение степени насыщения трансферрина
железом,увеличение содержания трансферрина в
сыворотке,повышение общей и латентной
железосвязывающей способности сыворотки,увеличение содержания растворимых
рецепторов к трансферритину в сыворотке,повышение свободного протопорфирина
IX в эритроцитах.
Количество железа в сыворотке крови
при выраженной ЖДА падает до 5,4–1,8
мкмоль/л при норме 12,5–30,4 мкмоль/л
(мужчины; у женщин этот показатель на
10–15% ниже. Под общей железосвязывающей
способностью сыворотки понимается
количество железа, которое может
связаться с трансферрином (в норме
54,0–72,0 мкмоль/л). В норме одна треть
трансферрина насыщена железом, а две
трети — свободны. Об уровне депонированного
железа можно судить по содержанию железа
в суточной моче после однократного
введения больному 500 мг десферала
(продукт метаболизма актиномицетов,
избирательно выводящий ион железа из
организма). В норме этот показатель
соответствует 0,6–1,3 мг железа, а при
железодефицитной анемии снижается до
0,2 мг в сутки и менее.
Сывороточный ферритин— очень точный
индикатор резервных запасов железа. Он
содержит примерно 15-20% общего запаса
железа в организме взрослого человека.
Определяется почти во всех тканях,
особенно высока его концентрация и
синтетическая способность в печени,
селезенке и костном мозге. Белок в
свободном от железа виде называется
апоферритином. Ферритин состоит из
белковой оболочки, которая окружает
ядро трехвалентного железа в виде
комплексов окиси и фосфата железа.
Каждая молекула апоферритина может
сорбировать до 5000 атомов железа, однако
большинство молекул ферритина содержат
от 1000 до 3000 атомов железа.
Анемии, ассоциированные с заболеваниями
внутренних органов, включают анемии
при эндокринных заболеваниях, заболеваниях
печени и почек.
К числу анемий при эндокринных
заболеванияхотносятся анемии при
заболеваниях щитовидной и паращитовидных
желез, надпочечников, половых желез,
гипопитуитаризме и др., в основе патогенеза
которых лежит депрессия эритропоэза
при дефиците или, напротив, гиперсекреции
ряда гормонов. В частности, такие гормоны,
как тироксин, кортизол, тестостерон в
очень высоких концентрациях вызывают
угнетение пролиферативной активности
эритроидных прекурсоров. В случае
сгущения крови в результате дегидратации
(при надпочечниковой недостаточности,
гипотиреозе) диагностика анемии может
быть затруднена.
К анемиям при заболеваниях печени
относятся анемии, возникающие при
диффузных поражениях органа (циррозе,
хроническом гепатите, гемохроматозе и
др.).
Патогенез анемии при заболеваниях
печени отличается многообразием
патогенетических факторов, что
определяется особенностями патогенеза
основного заболевания. Выделяют следующие
механизмы развития анемии:
угнетение процессов кроветворения в
костном мозгу вследствие прямого
токсического влияния на клетки-предшественницы
гемопоэза алкоголя (при алкогольном
поражении печени) и эндогенных токсинов
(при нарушениях обезвреживающей и
клиренсной функции печени), при нарушениях
метаболизма железа и депонирования
витамина В12и фолиевой кислоты
в пораженной печени;укорочение продолжительности жизни
эритроцитов в результате прямого
повреждающего действия токсических
продуктов экзогенного (алкоголь) и
эндогенного (при эндотоксемии)
происхождения, гиперспленизма, при
нарушениях внутриклеточного метаболизма
эритроцитов (например, в связи с дефицитом
в клетках НАДФ+) и их способности
к деформации (вследствие патологии
клеточной мембраны при изменениях
фракционного состава фосфолипидов,
снижении содержания сиаловых кислот);кровотечения из расширенных вен
желудочно-кишечного тракта (при циррозе
печени), носовые, геморроидальные и
иной локализации (при формирующейся
недостаточности синтеза факторов
свертывания крови вследствие нарушений
белкового обмена).
В подавляющем большинстве случаев при
заболеваниях печени регистрируется
нормохромная нормоцитарная анемия, при
присоединяющемся дефиците железа —
микроцитарная нормоили гипохромная,
при недостаточности витамина В12и фолиевой кислоты, метастазах рака
желудка в печень — макроцитарная анемия
нормо- или гиперхромного типа.
Анемии при заболеваниях почекмогут
выявляться у больных острым
гломерулонефритом, интерстициальным
нефритом, хронической почечной
недостаточностью. Патогенез анемии при
заболеваниях почек определяется
снижением продукции эритропоэтина
клетками юкстагломерулярного аппарата,
депрессией кроветворения в костном
мозгу (в результате нарушения
пролиферативной активности эритроидных
клеток, торможения процессов синтеза
гема) и сокращением срока жизни эритроцитов
(до 40-50 дней) при действии токсических
продуктов азотистого обмена.
Контрольные вопросы по теме:
Охарактеризуйте типовые формы изменений
общего объема циркулирующей крови.Какова этиология олигоцитемических и
полицитемических гиповолемий?Какова этиология олигоцитемических и
полицитемических гиперволемий?Укажите общие механизмы формирования
компенсаторно-приспособительных
механизмов при кровопотере.Каков механизм формирования экстренных
защитно-приспособительных реакций
организма при кровопотерях?Каков механизм формирования долговременных
защитно-приспособительных реакций
организма при кровопотерях?Дайте определение понятию анемия,
каковы принципы классификации?Назовите основные фонды железа в
организме?Перечислите лабораторные показатели,
характеризующие состояние красной
крови при острой кровопотере?Перечислите лабораторные показатели,
характеризующие состояние красной
крови при хронической кровопотере?Какие Вы знаете анемии, ассоциированные
с заболеваниями внутренних органов,
какие особенности для них характерны?
Темы реферативных сообщений:
Этиологи и патогенез ювенильного
хлороза (у девочек в пубертатный период)
при ЖДА
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Железодефицитная анемия – синдром, обусловленный недостаточностью железа и приводящий к нарушению гемоглобинопоэза и тканевой гипоксии. Клинические проявления представлены общей слабостью, сонливостью, пониженной умственной работоспособностью и физической выносливостью, шумом в ушах, головокружениями, обморочными состояниями, одышкой при нагрузке, сердцебиением, бледностью. Гипохромная анемия подтверждается лабораторными данными: исследованием клинического анализа крови, показателей сывороточного железа, ОЖСС и ферритина. Терапия включает лечебную диету, прием препаратов железа, в некоторых случаях – трансфузию эритроцитарной массы.
Общие сведения
Железодефицитная (микроцитарная, гипохромная) анемия – анемия, обусловленная нехваткой железа, необходимого для нормального синтеза гемоглобина. Её распространенность в популяции зависит от половозрастных и климатогеографических факторов. По обобщенным сведениям, гипохромной анемией страдает около 50% детей раннего возраста, 15% женщин репродуктивного возраста и около 2% мужчин. Скрытый тканевой железодефицит выявляется практически у каждого третьего жителя планеты. На долю микроцитарной анемии в гематологии приходится 80–90% всех анемий. Поскольку железодефицит может развиваться при самых различных патологических состояниях, данная проблема актуальна для многих клинических дисциплин: педиатрии, гинекологии, гастроэнтерологии и др.
Железодефицитная анемия
Причины
Ежесуточно с потом, калом, мочой, слущенными клетками кожи теряется около 1 мг железа и примерно столько же (2-2,5 мг) поступает в организм с пищей. Дисбаланс между потребностями организма в железе и его поступлением извне или потерями способствует развитию железодефицитной анемии. Железодефицит может возникать как при физиологических условиях, так и в результате ряда патологических состояний и быть обусловлен как эндогенными механизмами, так и внешними воздействиями:
Кровопотери
Чаще всего анемия вызывается хронической потерей крови: обильными менструациями, дисфункциональными маточными кровотечениями; желудочно-кишечными кровотечениями из эрозий слизистой желудка и кишечника, гастродуоденальных язв, геморроидальных узлов, анальных трещин и др. Скрытая, но регулярная кровопотеря отмечается при гельминтозах, гемосидерозе легких, экссудативном диатезе у детей и др.
Особую группу составляют лица с болезнями крови — геморрагическими диатезами (гемофилией, болезнью Виллебранда), гемоглобинурией. Возможно развитие постгеморрагической анемии, вызванной одномоментным, но массивным кровотечением при травмах и операциях. Гипохромная анемия может возникать вследствие ятрогенных причин — у доноров, часто сдающих кровь; пациентов с ХПН, находящихся на гемодиализе.
Нарушение поступления, всасывания и транспорта железа
К факторам алиментарного порядка относятся анорексия, вегетарианство и следование диетам с ограничением мясных продуктов, плохое питание; у детей — искусственное вскармливание, позднее введение прикорма. Снижение абсорбции железа характерно для кишечных инфекций, гипоацидного гастрита, хронического энтерита, синдрома мальабсорбции, состояния после резекции желудка или тонкой кишки, гастрэктомии. Значительно реже железодефицитная анемия развивается вследствие нарушения транспортировки железа из депо при недостаточной белково-синтетической функции печени – гипотрансферринемиях и гипопротеинемиях (гепатитах, циррозе печени).
Повышенное расходование железа
Ежедневная потребность в микроэлементе зависит от пола и возраста. Наиболее высока необходимость в железе у недоношенных, детей раннего возраста и подростков (в связи с высокими темпами развития и роста), женщин репродуктивного периода (в связи с ежемесячными менструальными потерями), беременных (в связи с формированием и ростом плода), кормящих мам (в связи с расходом в составе молока). Именно эти категории являются наиболее уязвимыми в отношении развития железодефицитной анемии. Кроме того, повышение потребности и расхода железа в организме наблюдается при инфекционных и опухолевых заболеваниях.
Патогенез
По своей роли в обеспечении нормального функционирования всех биологических систем железо является важнейшим элементом. От уровня железа зависит поступление кислорода к клеткам, протекание окислительно-восстановительных процессов, антиоксидантная защита, функционирование иммунной и нервной систем и пр. В среднем содержание железа в организме находится на уровне 3-4 г. Более 60% железа (>2 г) входит в состав гемоглобина, 9% — в состав миоглобина, 1% — в состав ферментов (гемовых и негемовых). Остальное железо в виде ферритина и гемосидерина находится в тканевом депо – главным образом, в печени, мышцах, костном мозге, селезенке, почках, легких, сердце. Примерно 30 мг железа непрерывно циркулирует в плазме, будучи частично связанным основным железосвязывающим белком плазмы – трансферрином.
При развитии отрицательного баланса железа мобилизуются и расходуются запасы микроэлемента, содержащиеся в тканевых депо. На первых порах этого бывает достаточно для поддержания адекватного уровня Hb, Ht, сывороточного железа. По мере истощения тканевых резервов компенсаторно увеличивается эритроидная активность костного мозга. При полном истощении эндогенного тканевого железа его концентрация начинает снижаться в крови, нарушается морфология эритроцитов, уменьшается синтез гема в гемоглобине и железосодержащих ферментов. Страдает кислородтранспортная функция крови, что сопровождается тканевой гипоксией и дистрофическими процессами во внутренних органах (атрофический гастрит, миокардиодистрофия и др.).
Классификация
Железодефицитная анемия возникает не сразу. Вначале развивается предлатентный железодефицит, характеризующийся истощением только запасов депонированного железа при сохранности транспортного и гемоглобинового пула. На этапе латентного дефицита отмечается уменьшение транспортного железа, содержащегося в плазме крови. Собственно гипохромная анемия развивается при уменьшении всех уровней метаболических запасов железа – депонированного, транспортного и эритроцитарного. В соответствии с этиологией различают анемии: постгеморрагические, алиментарные, связанные с повышенным расходом, исходным дефицитом, недостаточностью резорбции и нарушением транспорта железа. По степени выраженности железодефицитные анемии подразделяются на:
- Легкие (Нb 120-90 г/л). Протекают без клинических проявлений или с их минимальной выраженностью.
- Среднетяжелые (Нb 90-70 г/л). Сопровождаются циркуляторно-гипоксическим, сидеропеническим, гематологическим синдромами умеренной степени выраженности.
- Тяжелые (Нb
Симптомы
Циркуляторно-гипоксический синдром обусловлен нарушением синтеза гемоглобина, транспорта кислорода и развитием гипоксии в тканях. Это находит свое выражение в ощущении постоянной слабости, повышенной утомляемости, сонливости. Пациентов преследует шум в ушах, мелькание «мушек» перед глазами, головокружения, переходящие в обмороки. Характерны жалобы на сердцебиение, одышку, возникающую при физической нагрузке, повышенную чувствительность к низким температурам. Циркуляторно-гипоксические нарушения могут усугублять течение сопутствующей ИБС, хронической сердечной недостаточности.
Развитие сидеропенического синдрома связано с недостаточностью тканевых железосодержащих ферментов (каталазы, пероксидазы, цитохромов и др.). Этим объясняется возникновение трофических изменений кожных покровов и слизистых оболочек. Чаще всего они проявляются сухостью кожи; исчерченностью, ломкостью и деформацией ногтей; повышенным выпадением волос. Со стороны слизистых оболочек типичны атрофические изменения, что сопровождается явлениями глоссита, ангулярного стоматита, дисфагии, атрофического гастрита. Может возникать пристрастие к резким запахам (бензина, ацетона), искажение вкуса (желание есть глину, мел, зубной порошок и пр.). Признаками сидеропении также служат парестезии, мышечная слабость, диспепсические и дизурические расстройства. Астеновегетативные нарушения проявляются раздражительностью, эмоциональной неустойчивостью, снижением умственной работоспособности и памяти.
Осложнения
Поскольку в условиях железодефицита IgA теряет свою активность, больные становятся подвержены частой заболеваемости ОРВИ, кишечными инфекциями. Пациентов преследует хроническая усталость, упадок сил, снижение памяти и концентрации внимания. Длительное течение железодефицитной анемии может привести к развитию миокардиодистрофии, распознаваемой по инверсии зубцов Т на ЭКГ. При крайне тяжелом железодефиците развивается анемическая прекома (сонливость, одышка, резкая бледность кожи с цианотичным оттенком, тахикардия, галлюцинации), а затем – кома с потерей сознания и отсутствием рефлексов. При массивной стремительной кровопотере возникает гиповолемический шок.
Диагностика
На наличие железодефицитной анемии может указывать внешний вид больного: бледная, с алебастровым оттенком кожа, пастозность лица, голеней и стоп, отечные «мешки» под глазами. При аускультации сердца обнаруживается тахикардия, глухость тонов, негромкий систолический шум, иногда – аритмия. С целью подтверждения анемии и определения ее причин проводится лабораторное обследование.
- Лабораторные тесты. В пользу железодефицитного характера анемии свидетельствует снижение гемоглобина, гипохромия, микро- и пойкилоцитоз в общем анализе крови. При оценке биохимических показателей отмечается снижение уровня сывороточного железа и концентрации ферритина (60 мкмоль/л), уменьшение насыщения трансферрина железом (
- Инструментальные методики. Для установления причины хронической кровопотери должно быть проведено эндоскопическое обследование ЖКТ (ЭГДС, колоноскопия,), рентгенодиагностика (ирригоскопия, рентгенография желудка). Обследование органов репродуктивной системы у женщин включает УЗИ малого таза, осмотр на кресле, по показаниям — гистероскопию с РДВ.
- Исследование пунктата костного мозга. Микроскопия мазка (миелограмма) показывает значительное снижение количества сидеробластов, характерное для гипохромной анемии. Дифференциальная диагностика направлена на исключение других видов железодефицитных состояний — сидеробластной анемии, талассемии.
Лечение
К основным принципам терапии железодефицитной анемии относятся устранение этиологических факторов, коррекция рациона питания, восполнение железодефицита в организме. Этиотропное лечение назначается и проводится специалистами гастроэнтерологами, гинекологами, проктологами и др.; патогенетическое – гематологами. При железодефицитных состояниях показано полноценное питание с обязательным включением в рацион продуктов, содержащих гемовое железо (телятины, говядины, баранины, мяса кролика, печени, языка). Следует помнить, что усилению ферросорбции в ЖКТ способствуют аскорбиновая, лимонная, янтарная кислота. Ингибируют всасывание железа оксалаты и полифенолы (кофе, чай, соевый протеин, молоко, шоколад), кальций, пищевые волокна и др. вещества.
Вместе с тем, даже сбалансированная диета не в состоянии устранить уже развившийся недостаток железа, поэтому больным с гипохромной анемией показана заместительная терапия ферропрепаратами. Препараты железа назначаются курсом не менее 1,5-2-х месяцев, а после нормализации уровня Hb проводится поддерживающая терапия в течение 4-6 недель половинной дозой препарата. Для фармакологической коррекции анемии используются препараты двухвалентного и трехвалентного железа. При наличии витальных показаний прибегают к гемотрансфузионной терапии.
Прогноз и профилактика
В большинстве случаев гипохромная анемия подается успешной коррекции. Однако при неустраненной причине железодефицит может рецидивировать и прогрессировать. Железодефицитная анемия у детей раннего и младшего возраста может вызывать задержку психомоторного и интеллектуального развития (ЗПР). В целях профилактики железодефицита необходим ежегодный контроль параметров клинического анализа крови, полноценное питание с достаточным содержанием железа, своевременная ликвидация источников кровопотери в организме. Следует учитывать, что лучше всего усваивается железо, содержащееся в мясе и печени в форме гема; негемовое железо из растительной пищи практически не усваивается – в этом случае оно сначала должно восстановиться до гемового при участии аскорбиновой кислоты. Лицам групп риска может быть показан профилактический прием железосодержащих препаратов по назначению специалиста.


