Механизм тромбообразования при атеросклерозе
В развитии взглядов на патогенез острых коронарных синдромов (ОКС) сделан новый акцент на тромбообразовании как на переломном (решающем) механизме перехода от хронического атеросклероза к его острому течению. Понимание механизмов тромбоза коронарной артерии (КА) существенно прогрессирует.
Сейчас уже ясно, что физическое разрушение атеросклеротической бляшки (АБ) обычно сопровождается острым тромбозом. Появление большинства коронарных тромбов провоцируется разрывами атеросклеротической бляшки (АБ), обусловленными несколькими механизмами.
Первый механизм, объясняющий почти 60% случаев ОИМ, заключается в трещине фиброзной покрышки АБ. Другой механизм — поверхностная эрозия интимы, что объясняет до 25% всех ОИМ среди тщательно отобранных наблюдений, поступивших от экспертов, анализировавших причины внезапной сердечной смерти (ВСС). Поверхностная эрозия в качестве механизма ВСС чаще фигурирует у женщин, чем у мужчин.
а) Разрыв атеросклеротической бляшки и тромбоз. Разрыв фиброзной покрышки АБ отражает, видимо, дисбаланс между силами воздействия на покрышку и силой напряжения самой фиброзной покрышки. Биомеханическая устойчивость к разрыву фиброзной покрышки обеспечивается в основном интерстициальными формами коллагена. Следовательно, процессы метаболизма коллагена участвуют в регуляции предрасположенности атеросклеротической бляшки (АБ) к разрыву. Факторы, угнетающие синтез коллагена в ГМК, снижают способность этих клеток восстанавливать и сохранять фиброзную покрышку атеросклеротической бляшки (АБ).
Например, продуцируемый Т-клетками цитокин IFNγ является мощным ингибитором синтеза коллагена в ГМК. В то же время, как уже отмечалось, некоторые медиаторы, высвобождаемые из тромбоцитарных гранул в процессе их активации, усиливают синтез коллагена в ГМК, укрепляя тем самым фиброзную структуру АБ. К таким медиаторам относятся TGFβ и PDGF.
Помимо снижения в ГМК синтеза коллагена de novo, повышенный катаболизм макромолекул внеклеточного матрикса, которые входят в состав фиброзной покрышки бляшки, также вносит вклад в ослабление этой структуры и повышает риск разрыва, а следовательно, и образования тромба. Те же самые деградирующие ферменты, которые, как полагают, участвуют в миграции ГМК и ремоделировании артерий, могут ослаблять и фиброзную покрышку.
В прогрессирующей атероме человека макрофаги в избытке экспрессируют металлопротеиназы и обладающие эластолитическим действием катепсины, которые способны разрушать коллаген и эластин внеклеточного матрикса артерий. Таким образом, натяжение фиброзной покрышки АБ подвержено динамической регуляции, при которой воспалительная реакция интимы сопряжена с молекулярными детерминантами стабильности АБ и, следовательно, с осложнениями атеромы в виде тромбообразова-ния. Истончение фиброзной покрышки в результате сниженного синтеза коллагена и повышенной его деградации объясняет, почему АБ, которые разорвались и привели к развитию фатального ИМ, имеют согласно патологоанатомическим исследованиям характерную тонкую фиброзную покрышку.
Другой особенностью такой атеросклеротической бляшки (АБ), называемой уязвимой, является относительный дефицит ГМК. Как объяснялось ранее, медиаторы воспаления — как растворимые, так и ассоциированные с поверхностью Т-лимфоцитов — способны вызывать апоптоз ГМК. «Выпадение» ГМК из участков локального воспаления в АБ вносит, вероятно, определенный вклад в относительный дефицит ГМК в тех местах, где происходит разрыв АБ.
Поскольку эти клетки служат источником вновь синтезированного коллагена, необходимого для восстановления и сохранения фиброзной покрышки, при дефиците ГМК она ослабляется, а склонность АБ к разрыву, соответственно, возрастает.
Выраженное скопление макрофагов и большой липидный пул являются третьей микроанатомической особенностью уязвимой АБ. С точки зрения строгой биомеханики большой липидный пул способен концентрировать на себе биомеханические силы, направленные на «плечи» АБ — обычные зоны разрыва фиброзной покрышки. С точки зрения метаболизма активированные макрофаги, характерные для ядра АБ, продуцируют цитокины и деградирующие матрикс ферменты, которые, в свою очередь, как полагают, регулируют метаболизм матрикса и апоптоз ГМК. Находящиеся в состоянии апоптоза макрофаги, как и ГМК, вырабатывают тканевый фактор — потенциальный инициатор капиллярного тромбоза после спонтанного или ятрогенного разрыва АБ. Успехи липидснижающей терапии в уменьшении частоты возникновения ОИМ или НС у пациентов с высоким риском могут быть результатом снижения накопления липидов, уменьшения воспаления и тромбогенности АБ. Результаты недавно выполненных на животных исследований, а также данные мониторинга периферических маркеров воспаления у людей подтверждают эту концепцию.
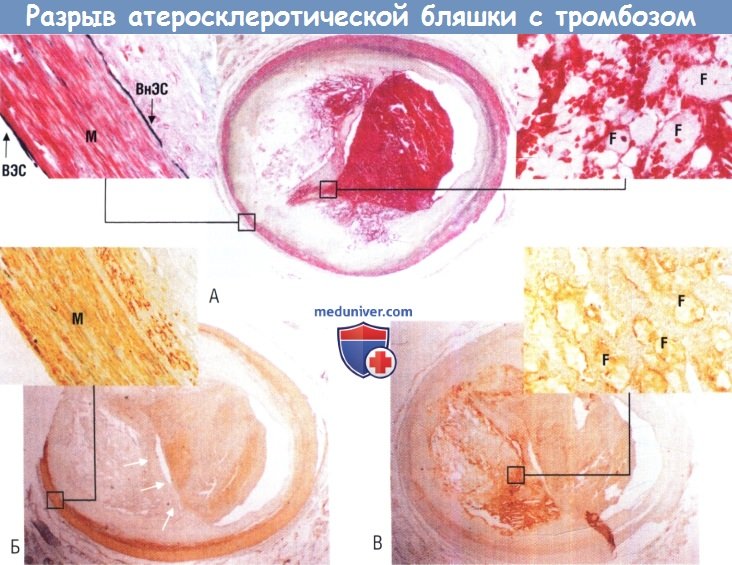
Пример разрыва бляшки, ставшего причиной фатального тромбоза.
(А) Окрашивание по Movat. (Б) Иммуноокрашивание с помощью HHF-35, при котором визуализируются ГМК.
Видно незначительное количество ГМК в фиброзной покрышке (стрелки) в противоположность их изобилию в среднем слое (вставка).
(В) Окрашивание макрофагов (CD68) позволяет видеть скопление воспалительных клеток вблизи фиброзной покрышки (вставка).
F — пенистая клетка; ВнЭС — внутренний эластический слой; ВЭС — внешний эластический слой; М — медиа.
б) Тромбоз, вызванный поверхностным изъязвлением бляшки. В следующей статье будет обсуждена патофизиология разрыва фиброзной покрышки атеросклеротической бляшки (АБ). Ясности в вопросах поверхностного изъязвления намного меньше. При экспериментальном атеросклерозе, вызванном у обезьян, зоны отсутствия эндотелия и отложения тромбоцитов появляются в более сформированных атеросклеротических бляшек (АБ).
Оказалось, что у человека поверхностные эрозии являются вероятной причиной случаев фатального ОИМ у женщин и лиц с гипертриглицеридемией и СД. Однако молекулярные механизмы, лежащие в основе этого явления, остаются нераскрытыми. Апоптоз ЭК может вносить определенный вклад в десквамацию эндотелия в зонах поверхностного изъязвления. Аналогично этому ММП, включая некоторые желатиназы, специализирующиеся на деградации нефибриллярного коллагена, расположенного в базальной мембране (например, коллаген IV типа), также могут разрушать участки соединения ЭК с подлежащей базальной мембраной и ускорять их десквамацию.
В большинстве случаев разрывы атеросклеротической бляшки (АБ) не приводят к клинически выраженным коронарным событиям. При тщательном патологоанатомическом изучении препаратов сердца, полученных от внезапно умерших по некардиальной причине лиц, в АБ на удивление часто находили очаговые (фокальные) разрывы с ограниченным числом пристеночных тромбов.
Более того, при исследовании извлеченных и сразу же зафиксированных сердец от пациентов, страдавших выраженным атеросклерозом с хроническим стабильным течением и перенесших процедуру трансплантации сердца в связи с ишемической кардиомиопатией (КМП), были получены аналогичные данные, свидетельствующие о бессимптомных разрывах АБ. У обезьян с экспериментальным атеросклерозом было показано, что пристеночные тромбы могут усугубить изъязвление АБ, не вызывая сужение артерии.
Отсюда следует, что повторные циклы, включающие разрыв атеросклеротической бляшки (АБ), тромбообразование in situ и заживление (рубцевание), вносят, вероятно, определенный вклад в прогрессирование атеросклеротического поражения и рост АБ. Подобные эпизоды тромбообразования и рубцевания представляют собой один из типов «кризиса» в процессе развития АБ, который вызывает всплеск пролиферации и миграции ГМК и синтеза в них матрикса. Синтез коллагена в ГМК, как отмечено ранее, стимулируют TGFβ и PDGF, высвобождаемые из тромбоцитарных гранул. В роли мощного стимулятора пролиферации ГМК выступает тромбин, образующийся в зоне пристеночного тромбоза.
Последняя стадия атеросклеротического процесса («перегоревшая» фиброзная и кальцифицированная атерома) представляет собой конечный этап развития исходно перегруженной липидами и уязвимой бляшки, превратившейся в фиброзное и практически бесклеточное образование в ответ на повреждение, опосредуемого продуктами тромбообразования.
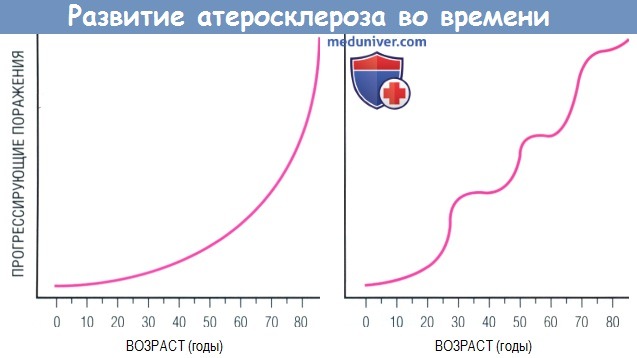
Развитие атеросклероза во времени.
Согласно традиционному взгляду, формирование атеромы с течением лет происходит прогрессивно по нарастающей (слева).
Современный взгляд предлагает альтернативную модель: не монотонная эволюция поражения в зависимости от времени, а скорее ее поэтапное развитие (справа).
Согласно последней модели, в процессе развития атеросклеротического поражения относительно спокойные периоды могут сменяться «кризисами».
Вслед за таким «кризисом» возможен разрыв бляшки с интрамуральным тромбозом, ее рубцевание, сопровождающееся всплеском пролиферации ГМК и отложением матрикса.
Аналогичное развитие событий может быть спровоцировано кровоизлиянием внутри бляшки, вызванным разрывом хрупких микрососудов.
Такие эпизоды обычно клинически не проявляются. Внесосудистые события, например случайная инфекция, сопровождающаяся системной цитокинемией или эндотоксинемией,
способны вызвать «эхо» на уровне артериальной стенки, индуцируя цикл локальной экспрессии генов цитокинов с помощью «профессиональных» воспалительных лейкоцитов, присутствующих в зоне поражения.
Представленная справа модель эпизодического прогрессирования бляшки больше соответствует данным ангиографии у человека, чем кривая слева.
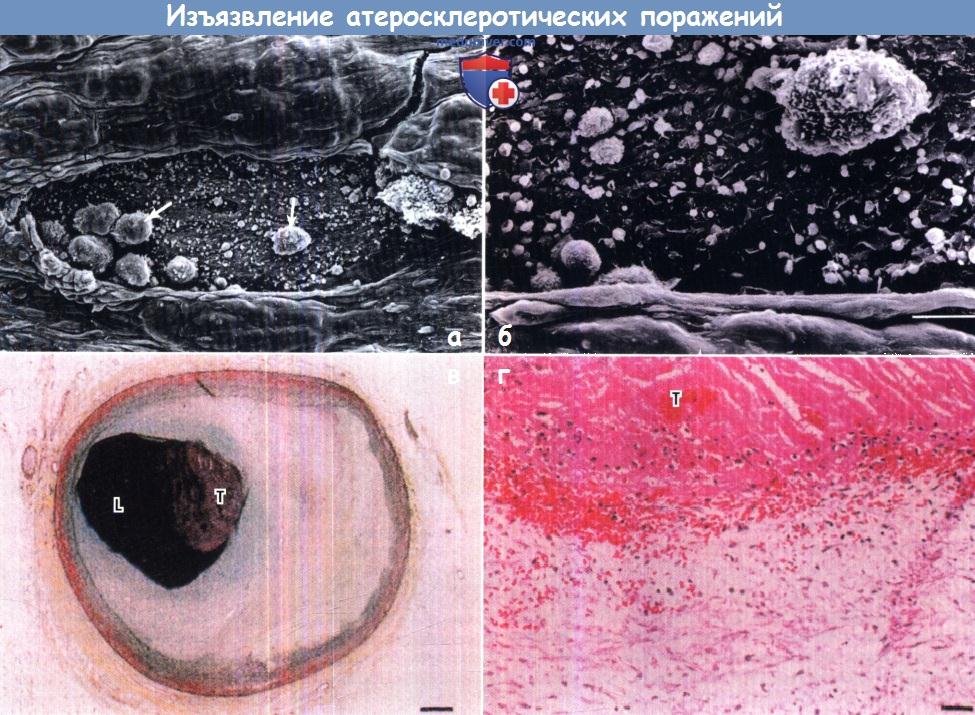
Изображение поверхностного изъязвления экспериментальных атеросклеротических поражений, полученное с помощью сканирующей электронной микроскопии.
Прогрессирующие атеросклеротические бляшки стимулируют тромбообразование за счет поверхностного изъязвления эндотелиального слоя и контакта крови
и тромбоцитов с содержащей коллаген субэндотелиальной базальной мембраной, а также активацию тромбоцитов и тромбообразование.
(А) При низком разрешении видна трещина в эндотелии. Лейкоциты (стрелки) прилипли к субэндотелию, который начинает покрываться слоем тромбоцитов.
(Б) При высоком разрешении на участке, выбранном из центра (А), видны лейкоциты и тромбоциты, прилипшие к субэндотелию.
(В) Гистологический срез через коронарную артерию с тромбом, образовавшимся в результате поверхностного изъязвления (фото низкого разрешения).
(Г) Гистологический срез через коронарную артерию с тромбом, образовавшимся в результате поверхностного изъязвления (фото высокого разрешения).
L — просвет сосуда; Т — тромб.
— Читать «Воспаление атеросклеротической бляшки при атеросклерозе как причина осложнений»
Оглавление темы «Атеросклероз и его осложнения»:
- Роль иммунитета в развитии атеросклероза
- Миграция и пролиферация гладкомышечных клеток при атеросклерозе
- Механизм гибели гладкомышечных клеток при атеросклерозе
- Внеклеточный матрикс артерии при атеросклерозе
- Рост сосудов в атеросклеротической бляшке — ангиогенез
- Отложение кальция в атеросклеротической бляшке — минерализация, кальцификация
- Сужение артерии (стеноз) как осложнение атеросклероза
- Тромбоз артерии как осложнение атеросклероза
- Воспаление атеросклеротической бляшки при атеросклерозе как причина осложнений
- Аневризмы артерий как осложнение атеросклероза
В большинстве случаев летальных исходов при атеросклерозе обнаруживают тромбы в тех или иных сосудистых областях. При тщательном изучении состояния сосудов 350 больных, умерших от атеросклероза и гипертонической болезни, у 85% обнаружил тромбы. В большинстве случаев тромб в коронарных сосудах формируется на фоне выраженных атеросклеротических изменений. Лишь в незначительном количестве случаев тромб может образоваться в неизмененных сосудах сердца.
Клинико-анатомические исследования последних лет, особенно в связи с внедрением контрастных методов изучения сосудов, позволили выявить значительную частоту тромбоза и при атеросклерозе почечной артерии. Как показали эти исследования, значительный процент почечных гипертоний связан именно с этим видом патологии почечных сосудов. Обнаружили тромбоз почечной артерии у 4% больных, оперированных по поводу поражения главных почечных артерий и гипертонии.
Чем же объяснить частоту тромбоза при атеросклерозе? Длительное время причиной подобной частоты считали нарушение поверхности сосудистой стенки, появление атеросклеротических бляшек, на которых оседают и распадаются форменные элементы крови, давая начало тромбу.
Экспериментальные, клинические и патоморфологические наблюдения доказали сложность механизмов возникновения тромбоза, который предстал как результат комплекса функционально-биохимических нарушений, связанных с состоянием всего организма, в том числе и с центральной нервной системой. Было подчеркнуто значение функционального фактора, фактора спазма сосуда. В то же время известно, что атеросклероз характеризуется изменением реактивности организма, склонностью к функциональным расстройствам, И этот факт имеет, вероятно, большое значение в развитии тромбоза в ранних стадиях атеросклероза, когда еще может и не быть больших изменений стенки сосуда, но налицо, значительные функциональные расстройства. Отсюда становится понятным один из механизмов нередкого возникновения тромбоза в ранних стадиях атеросклероза.
Тромбоз при атеросклерозе связан и с теми биохимическими нарушениями, которые характерны для этого процесса. Работы прежних лет, посвященные биохимической сущности патологического тромбообразования, касались в основном роли коагулянтов в возникновении тромбоза. В ряде работ было изучено содержание коагулянтов главным образом при атеросклеротическом поражении коронарных сосудов, которое сопровождается увеличением содержания некоторых факторов свертывания крови: тромбина, V и VII факторов, тромбопластической активности крови, антигемофилического глобулина.
В процессе тромбообразования большое значение придавали содержанию протромбина в крови. Его увеличение рассматривается как показатель предтромботического состояния.
Нередко высокие показатели протромбина в крови были единственным симптомом «болезни» и, как правило, даже при вполне удовлетворительном состоянии больного вызывали тревогу; больному назначали антикоагулянты, часто постельный или полупостельный режим. В то же время в эксперименте удается увеличить содержание протромбина крови до 180% без появления тромбов в сосудистом русле. Вместе с тем клинические наблюдения указывают на возможность возникновения тромбозов при низком уровне протромбина крови, даже на фоне вполне достаточных для терапии показателей при применении антикоагулянтов.
Свертывание крови может нормально протекать при содержании 10% протромбина, 35% Ас-глобулина и 50% Кристмас-фактора.
Основываясь на подобных наблюдениях, в настоящее время большинство патофизиологов и клиницистов не придает большого значения в возникновении тромбоза уровню протромбина крови. То же можно сказать и о некоторых других факторах свертывания крови, например о факторе VII, повышение содержания которого, играет известную роль в развитии тромбоза. Гораздо большее значение в патогенезе тромбоза придается повышению тромбопластической активности крови.
Работы последних лет все больше и больше убеждают, что стенка сосуда не является просто механическим фактором, отграничивающим сосудистое русло, или фактором, обеспечивающим метаболизм но системе кровь — орган и обратно. В стенке сосуда вырабатывается ряд ферментов, участвующих в различных обменных процессах, в том числе и в коагуляции крови. Тромбопластической активностью обладают отдельные слои сосудистой стенки, причем внутренний слой больше, чем средний. У больных атеросклерозом, тромбопластическая активность сосудов больше, чем у здоровых людей. Отложение липидов в стенке сосуда увеличивает тромбопластическую активность тканей, повышает возможность отложения фибрина в этой области.
Сообщается об увеличении содержания в крови больных атеросклерозом антигемофилического глобулина, способствующего превращению протромбина в тромбин и тем самым активирующего систему свертывания крови. Исследуя в Институте терапии АМН содержание антигемофилического глобулина у 62 больных атеросклерозом, обнаружили его повышение во всех стадиях болезни. Так, если у здоровых людей содержание антигемофилического глобулина, колебалось от 100 до 146% в зависимости от возраста, то при атеросклерозе оно повышалось до 294—364%- Считается увеличение антигемофилического глобулина наряду с повышением содержания фибриногена важным фактором в развитии тромбоза при атеросклерозе. Таким образом, полученные данные указывают на активацию системы свертывания крови при атеросклерозе, причем активность свертывающей системы наиболее выражена в далеко зашедших стадиях болезни. Все это подтверждает, что с развитием атеросклероза происходит увеличение содержания в крови коагулянтов.
Казалось бы, ясно, что увеличение содержания коагулянтов, с одной стороны, наличие значительных изменений стенки сосуда—с другой, являются теми факторами, которые обусловливают частоту тромбоза при атеросклерозе. Однако тромбоз не может возникнуть, каково бы ни было увеличение содержания свертывающих факторов, если оно будет компенсировано защитным увеличением антикоагулирующих и фибринолитических веществ. Вот почему изучение состояния противосвертывающих механизмов при атеросклерозе представляет интерес пе только с. точки зрения характера их изменений при этом процессе, но и с точки зрения значения нарушений для возникновения тромбоза. По мере развития экспериментального атеросклероза не только снижается содержание в крови гепарина и уровень фибринолитическои активности, но и уменьшаются возможности их компенсаторного повышения при искусственном увеличении содержания в крови тромбина.
Клинические наблюдения подтверждают угнетение противосвертывающих механизмов при атеросклерозе: уменьшение в крови содержания гепарина и фибринолитическои активности. Исследуя содержание гепарина и уровень фибринолитическои активности у 100 больных с ранними проявлениями атеросклероза (I стадия по классификации А. Л. Мясникова) и у 100 больных со значительными атеросклеротическими изменениями (III стадия), мы обнаружили выраженную депрессию антикоагулирующих и фибринолитических свойств в III стадии болезни. Так, если в 1 стадии заболевания снижение содержания гепарина крови наблюдалось лишь у 22 больных и угнетение фибринолизина у 30, то в 111 стадии уже у 72 больных были низкие показатели гепарина, а у 83 оказалась резко сниженной фибринолитическая активность крови.
Интересно, отметить, что в ранней стадии болезни в известном проценте случаев встречалось повышение содержания гепарина в крови и увеличение фибринолитической активности. Подобное повышение мы склонны рассматривать как компенсаторный, защитный механизм. Компенсаторные возможности в ранних стадиях атеросклероза могут быть еще велики, и они соответственно реагируют на возникновение спазма сосудов и изменения в системе свертывания крови, что характерно для этой стадии болезни.
Создается впечатление, что при угрозе возникновения тромбоза у больных атеросклерозом происходит истощение компенсаторных возможностей повышать антикоагулируюпще и фибринолитические свойства крови. Особенно отчетливо это проявляется при изучении содержания гепарина крови на высоте приступа стенокардии. Оказалось, что у больных ранними стадиями атеросклероза на высоте приступа стенокардии наблюдается значительно более высокое повышение содержания гепарина, чем у больных с тяжелыми формами заболевания, перенесшими в прошлом инфаркт миокарда. Показательно уменьшение компенсаторных возможностей и при воспроизведении стресса у животных. При воспроизведении повторных стрессов в эксперименте происходит постепенное истощение противосвертывающих возможностей организма.
Почему же происходит угнетение антикоагулирующих и фибринолитических свойств крови? Прежде всего необходимо указать, что как содержание гепарина и гепариноидов, так и фибринолитическая активность крови зависит от состояния сосудистой стенки, ибо их выработка связана с ретикуло-эндотелием. С развитием атеросклероза происходят не только морфологические изменения стенки сосуда, но нарушаются обменные процессы, выработка ферментов.
Оказалось, что развитие атеросклероза сопровождается гипоплазией и уменьшением числа гепариноцитов, в результате чего уменьшается содержание гепарина в крови.
Мукополисахариды, содержащиеся в стенке сосуда, обладают выраженными антикоатулянтными свойствами. Развитие же атеросклероза сопровождается значительными изменениями муко-полисахаридов в стенке сосудов- Возможно, что это приводит к уменьшению антикоагулирующих свойств той или иной области стенки сосуда.
Таким образом, одной из важнейших причин нарушения противосвертывающих механизмов при атеросклерозе является уменьшение выработки сосудистой стенкой противосвертывающих компонентов крови. И, наконец, уменьшение противосвертывающих возможностей при атеросклерозе связано с увеличением содержания ингибиторов, антикоагулирующих и фибринолитических компонентов крови.
В настоящее время выделен в чистом виде антифибринолизин, относящийся к альбуминовой фракции белков.
С целью выяснения состояния ингибиторпых свойств крови в отношении гепарина и фибринолизина у больных атеросклерозом антигепариновые и антифибринолизиновые свойства были изучены 30 больных с ранними проявлениями атеросклероза (I стадия) и 30 больных с выраженными атеросклеротическими изменениями (III стадия). При этом наблюдалось четкое увеличение антифибринолитических и антигепариновых свойств крови у больных с выраженными атеросклеротическими изменениями. Если у больных с I стадией коронарного атеросклероза антигепариновая активность была повышена незначительно (образование сгустка происходило в среднем через 2 минуты 44 секунды при норме 3 минуты 30 секунд при определении по методу Поллера), то у больных с III стадией атеросклероза, перенесших в прошлом инфаркт миокарда, это увеличение было уже значительным (образование сгустка осуществлялось в среднем за 1 минуту 18 секунд).
Такая же закономерность выявлена и в отношении антифибринолитических свойств крови.
Если у больных с ранними проявлениями коронарного атеросклероза антифибринолитическая активность крови была у большинства такой же, как и у здоровых людей (у 25 больных из 30 обследованных), то у больных с выраженными атеросклеротическими изменениями наблюдалось значительное увеличение антифибринолитических свойств крови. У всех 30 обследованных больных антифибринолитическая активность была значительно выше нормы (время лизиса сгустка во всех случаях было более 260 секунд при исследовании по методу Сандберг при норме 200 секунд). В депрессии противосвертывающих механизмов при атеросклерозе важную роль играет увеличение антифибринолитических и антигепариновых свойств крови. Выясняется еще один патогенетический механизм, обусловливающий частоту тромбоза при атеросклерозе, — увеличение антигепариновой активности тромбоцитов и тканей. Причины такого увеличения еще неясны и требуют дальнейших исследований.
Известно, что при атеросклерозе не только изменяется содержание факторов свертывания крови, но и свойства тромбоцитов. Придают значение нарушению нормальной функции тромбоцитов, изменению их электропотенциала как фактору, способствующему развитию тромбоза при атеросклерозе. Уменьшение продолжительности жизни тромбоцитов, их распад способствуют увеличению содержания в крови протромбокиназы, тромбопластической активности. В свою очередь изменение электропотенциала увеличивает слипчивость тромбоцитов, их распад.
Несомненно, что при прочих равных условиях местное увеличение тромбопластической активности сосудистой стенки в области бляшки и отложения липидов, местное уменьшение фибринолиза и другие изменения могут способствовать возникновению тромбоза.
Несмотря на то что в последние годы усиленно изучается взаимоотношение липидного обмена и тромбообразующих свойств крови, мы еще не знаем достаточно четко взаимозависимость этих двух процессов. Несомненно, как упоминалось выше, что липиды оказывают влияние на состояние некоторых компонентов свертывающей и противосвертывающей системы крови и могут тем самым усиливать тромбообразующие свойства крови. Однако в этом процессе еще очень много неясного.
Так, например, находят четкую закономерную связь уровня гепарина в крови и содержания β-липопротеинов, тогда как другие не обнаруживают подобной зависимости, а некоторые сообщают об изменении содержания холестерина крови при введении гепарина.
Задача состоит не просто в изучении взаимосвязи общих нарушений липидного обмена и тромбообразования, а в исследовании роли отдельных фракций липидного обмена, различных жирных кислот в изменении свертывающих и противосвертывающих возможностей. Увеличение содержания гепарина в крови, отражаясь на состоянии фактора просветления, нормализует липидный обмен, уменьшает гиперхолестеринемию. Параллельное снижение содержания свободного гепарина крови и уменьшение активности липопротеиновой липазы наблюдаются при самых ранних признаках атеросклероза, даже в его доклинической стадии. Вместе с тем увеличение триглицеридов, которым в настоящее время придают большое значение в патогенезе атеросклероза, повышает тромбопластическую активность и уменьшает протромбиновое время. Нейтральные жиры, холестерин способствуют снижению содержания гепарина в крови и уменьшению фибринолитической активности крови.
Нарушение липидного обмена, являющееся одним из решающих звеньев в патогенезе атеросклероза, отражается и на состоянии тромбообразующих свойств крови, в частности угнетает противосвертывающие механизмы крови.
Тесная связь атеросклероза и тромбоза позволила выдвинуть положение, что не только атеросклероз способствует тромбообразованию за счет морфологических функционально-биохимических изменений, но и тромбообразование оказывает влияние на развитие атеросклероза.
Нельзя полностью отвергать значения состояния коагулирующих свойств крови для развития атеросклероза. Последние наблюдения позволяют утверждать, что увеличение наклонности к тромбообразованию способствует возникновению и развитию атеросклероза.
Обсуждение патогенеза тромбоза при атеросклерозе показывает всю сложность этого процесса. Слишком просто было бы представить частоту его возникновения при атеросклерозе нарушением поверхности сосудистой стенки, появлением шероховатых поверхностей.
Клиническая картина тромбозов при атеросклерозе определяется в основном нарушением кровообращения, которое возникает в органах в связи с образованием в питающей его артерии тромба.
Характер клинической картины при тромбозах зависит, кроме того, от двух важных факторов: сопровождающих тромбоз нейрорефлекторных реакций, выражающихся, в частности, спазмом сосудов, и степени развития, коллатералей. Нейрорефлекторные факторы в большей степени, чем механические, объясняют ряд признаков остро возникающих тромбозов и эмболии сосудов различных сосудистых областей (боль, бледность, общие шоковые явления).
Значение этих факторов различно в зависимости от локализации тромба и характера сосудистой сети. Известно, что хорошее развитие коллатералей в мышце сердца может способствовать значительному ограничению зоны некроза при возникновении коронарного тромбоза. Применение сосудорасширяющих, спазмолитических препаратов при тромбозе артерий голени улучшает течение патологического процесса, уменьшает выраженность многих клинических проявлений болезни, а в некоторых случаях способствует восстановлению кровообращения в ноге. Следует подчеркнуть, что при тромбозах может возникать но только спазм сосудов той области, где формируется тромб, но в связи с рефлекторными реакциями и в сосудах других областей. Примером может служить спазм коронарных сосудов при тромбозе легочной артерии.
Тромбоз при атеросклерозе часто бывает вторичным, связанным с эмболией. Источником эмболов при этом служат обычно пристеночные тромбы в области бляшек, особенно при язвенном атеросклерозе аорты, пристеночные тромбы в полости сердца в связи с перенесенными инфарктами миокарда. Эмболия сопровождается, как правило, формированием тромба. Здесь играют роль и местные изменения, возникающие на фоне общих нарушений тромбообразующих свойств крови при атеросклерозе, и спазм сосудов, более выраженный и более характерный при эмболиях. Возникая вследствие раздражения нервных окончаний в растянутой стенке артерии, спазм сосуда может значительно отягощать клиническую картину заболевания. Вот почему следует думать об эмболии с последующим тромбозом в случаях с более острым, тяжелым началом, со значительными общими явлениями (внезапная резкая боль с выраженной ишемией, шоковые явления), тогда как для тромбоза более характерно постепенное начало болезни. Важное значение имеют указание на перенесенный инфаркт миокарда и выраженность атеросклеротического процесса, заставляющая предполагать наличие язвенного атеросклероза.
Следует указать, что подобная дифференциация относительна и не может служить точным критерием отличия эмболии с тромбозом от чистого тромбоза. Эта градация с практической точки зрения не имеет большого значения, так как поведение врача у постели больного с тромбоэмболией не будет отличаться от поведения у больного с тромбозом. Клиническая картина тромбоэмболии и тромбозов при атеросклерозе крайне разнообразна и зависит от того, какие сосуды поражаются. Нет, например, ничего общего между симптоматической гипертонией, связанной с ишемией почки, и гангреной ноги в связи с нарушением питания в ней. Однако и в том, и в другом случае причина может быть одна — закупорка артерии тромбом. Вот почему мы считаем целесообразным рассмотрение клинической картины тромбозов и тромбоэмболии при атеросклерозе в зависимости от их локализации.