Механизм образования тромба при атеросклерозе
Атеросклероз
является полиэтиологическим заболеванием, в возникновении которого играют роль многочисленные факторы риска.
Патогенез атеросклероза сложен. По современным представлениям в основе возникновения атеросклероза лежит взаимодействие многих патогенетических факторов, ведущее в конечном счете к образованию фиброзной бляшки (неосложненной и осложненной).
Различают три основные стадии формирования атеросклеротической бляшки (атерогенез):
- Образование липидных пятен и полосок (стадия липоидоза).
- Образование фиброзной бляшки (стадия липосклероза).
- Формирование осложненной атеросклеротической бляшки.
Начальная стадия характеризуется появлением в интиме артерий пятен и полосок, содержащих липиды.
- Образование липидных пятен и полосок
Липидные пятна представляют собой небольших размеров (до 1,0-1,5 мм) участки на поверхности аорты и крупных артерий, которые имеют желтоватый цвет. Липидные пятна состоят, главным образом, из пенистых клеток, содержащих большое количество липидов и Т-лимфоцитов. В меньшем количестве в них присутствуют также макрофаги и гладкомышечные клетки. Со временем липидные пятна увеличиваются в размерах, сливаются друг с другом и образуют так называемые липидные полоски, слегка возвышающиеся надо поверхностью эндотелия. Они также состоят из макрофагов, лимфоцитов, гладкомышечных и пенистых клеток, содержащих липиды. На этой стадии развития атеросклероза
холестерин
расположен преимущественно внутриклеточно и лишь небольшое его количество находится вне клеток.
Липидные пятна и полоски образуются в результате отложения липидов в интиме артерий. Первым звеном этого процесса является повреждение эндотелия и возникновение эндотелиальной дисфункции, сопровождающееся повышением проницаемости этого барьера.
Причинами первоначального повреждения эндотелия могут служить несколько факторов:
- Механическое воздействие на эндотелий турбулентного потока крови, особенно в местах разветвления артерий.
- Артериальная гипертензия, увеличивающая напряжение сдвига.
- Увеличение в крови атерогенных фракций
ЛПНП
и
липопротеина (а)
, особенно их модифицированных форм, образующихся в результате перекисного окисления липидов или их гликозилирования (при сахарном диабете) и обладающие выраженным цитотоксическим действием.
- Повышение активности симпато-адреналовой и ренин-ангиотензиновой систем, сопровождающееся цитотоксическим действием катехоламинов и ангиотензина II на сосудистый эндотелий.
- Хроническая гипоксия и гипоксемия любого происхождения.
- Курение.
- Повышение у в крови содержания
гомоцистеина
, например, при дефиците витамина В
6
, В
12
и
фолиевой кислоты
.
- Вирусная и хламидийная инфекция, сопровождающаяся развитием хронического воспаления в стенке артерии.
В результате повреждения эндотелия формируется эндотелиальная дисфункция, проявляющаяся снижением продукции вазодилатирующих факторов (простациклин, окись азота и др.) и увеличением образования вазоконстрикторных веществ (эндотелинов, АII, тромбоксана А2 и др.), еще больше повреждающих эндотелий и повышающих его проницаемость. Модифицированные
ЛПНП
и
липопротеин (а)
и некоторые клеточные элементы крови (моноциты, лимфоциты) проникают в интиму артерий и подвергаются окислению или гликозилированию (модификации), что способствует еще большему повреждению эндотелия и облегчает миграцию из кровотока в интиму артерий этих клеточных элементов.
Моноциты, проникшие в интиму, трансформируются в макрофаги, которые с помощью так называемых скэвеннджер-рецепторов («рецепторов-мусорщиков») поглощают модифицированные
ЛПНП
и накапливают свободный и этерифицированный
холестерин
. Перегруженные липидами макрофаги превращаются в пенистые клетки. Макрофаги, перегруженные модифицированными ЛПНП, а также тромбоциты, проникающие в интиму артерий из крови, секретируют факторы роста и митогены, воздействующие на гладкомышечные клетки, расположенные в средней оболочке артерий. Под действием факторов роста и митогенов гладкомышечные клетки мигрируют в интиму и начинают пролиферировать. Находясь в интиме, они захватывают и накапливают модифицированные ЛПНП, также превращаясь в своеобразные пенистые клетки. Кроме того, гладкомышечные клетки приобретают способность сами продуцировать элементы соединительной ткани (коллаген, эластин, и гликозамингликаны), которые в дальнейшем используются для построения фиброзного каркаса атеросклеротической бляшки. Со временем пенистые клетки подвергаются апоптозу. В результате липиды попадают во внеклеточное пространство.
Липидные пятна появляются в артериях с раннего детства. В возрасте 10 лет липидные пятна занимают около 10% поверхности аорты, а к 25 годам — от 30 до 50% поверхности. В венечных артериях сердца липоидоз встречается с 10-15 лет, а в артериях мозга — к 35-45 годам.
- Образование фиброзных бляшек
По мере прогрессирования патологического процесса в участках отложения липидов разрастается молодая соединительная ткань, что ведет к образованию фиброзных бляшек, в центре которых формируется так называемое липидное ядро. Этому способствует увеличение количества липидов, высвобождающихся в результате гибели (апоптоза) гладкомышечных клеток, макрофагов и пенистых клеток, перегруженных липидами. Экстрацеллюлярно расположенные липиды пропитывают интиму, образуя липидное ядро, которое представляет собой скопление атероматозных масс (липидно-белкового детрита). Вокруг липидного ядра возникает зона соединительной ткани, которая на начальном этапе богата клеточными элементами (макрофагами, пенистыми и гладкомышечными клетками, Т-лимфоцитами), коллагеном и эластическими волокнами.
Одновременно происходит васкуляризация очага атеросклеротического поражения. Вновь образующиеся сосуды отличаются повышенной проницаемостью и склонностью к образованию микротромбов и разрывам сосудистой стенки. По мере созревания соединительной ткани количество клеточных элементов уменьшается, а коллагеновые волокна утолщаются, формируя соединительнотканный каркас атеросклеротической бляшки, который отделяет липидное ядро от просвета сосуда («покрышка»). Формируется типичная фиброзная бляшка, выступающая в просвет сосуда и нарушающая кровоток в нем.
Клиническое и прогностическое значение сформировавшейся атеросклеротической бляшки во многом зависит именно от структуры ее фиброзной покрышки и размеров липидного ядра. В некоторых случаях (в том числе на относительно ранних стадиях формирования бляшки) ее липидное ядро хорошо выражено, а соединительнотканная капсула сравнительно тонкая и может легко повреждаться под действием высокого артериального давления, ускорения кровотока в артерии и других факторов. Такие мягкие и эластичные бляшки иногда называют «желтыми бляшками». Они, как правило, мало суживают просвет сосуда, но ассоциируются с высоким риском возникновения повреждений и разрывов фиброзной капсулы, то есть с формированием так называемой «осложненной» атеросклеротической бляшки.
В других случаях (обычно на более поздних стадиях) фиброзная покрышка хорошо выражена, плотная и меньше подвержена повреждению и разрывам. Такие бляшки называют «белыми». Они нередко значительно выступают в просвет артерии и вызывают гемодинамически значимое ее сужение, которое в некоторых случаях может осложняться возникновением пристеночного тромба.
Первые две стадии атерогенеза завершаются образованием неосложненной атеросклеротической бляшки. Прогрессирование атероматозного процесса приводит к формированию «осложненной» атеросклеротической бляшки, вследствие чего образуется пристеночный тромб, который может приводить к внезапному и резкому ограничению кровотока в артерии.
- Формирование «осложненной» бляшки
Прогрессирование атероматозного процесса приводит к формированию «осложненной» атеросклеротической бляшки. Эта стадия атероматоза характеризуется значительным увеличением липидного ядра (до 30% и более от общего объема бляшки), возникновением кровоизлияний в бляшку, истончением ее фиброзной капсулы и разрушением покрышки с образованием трещин, разрывов и атероматозных язв. Выпадающий при этом в просвет сосудов детрит может стать источником эмболии, а сама атероматозная язва служить основой для образования тромбов. Завершающей стадией атеросклероза является атерокальциноз, отложение солей кальция в атероматозных массы, межуточное вещество и фиброзную ткань.
На рисунке схематично представлены все три стадии формирования атеросклеротической бляшки.
Главным следствием формирования «осложненной» атеросклеротической бляшки является образование пристеночного тромба, который внезапно и резко ограничивает кровоток в артерии. В большинстве случаев именно в этот период возникают клинические проявления обострения заболевания, соответствующие локализации атеросклеротической бляшки (нестабильная стенокардия, инфаркт миокарда, ишемический инсульт и т.п.).
Таким образом, наиболее значимыми осложнениями атеросклеротического процесса являются:
- Гемодинамически значимое сужение просвета артерии за счет выступающей в просвет артерии атеросклеротической бляшки.
- Разрушение фиброзной капсулы, ее изъязвление, что способствует агрегации тромбоцитов и возникновению пристеночного тромба.
- Разрыв фиброзной капсулы атеросклеротической бляшки и выпадение в просвет сосуда содержимого липидного ядра детрита, который может стать источником эмболии и ли формирования пристеночного тромба.
- Кровоизлияние в бляшку из вновь образованных микрососудов, что также способствует разрыву покрышки и формированию тромба на поверхности атеросклеротической бляшки и т.д..
- Отложение солей кальция в атероматозные массы, межуточное вещество и фиброзную ткань, что существенно увеличивает плотность атеросклеротической бляшки.
- Стабильные и нестабильные атеросклеротические бляшки
Атеросклеротические бляшки могут быть стабильными и нестабильными.
Стабильность бляшки зависит от ее строения, размеров и конфигурации. Стабильные бляшки статичны или характеризуются медленным ростом в течение многих лет. Стабильные бляшки богаты коллагеном; нестабильные — липидами.
Тонкая фиброзная капсула атеросклеротической бляшки (между стрелками) отделяет мягкое липидное ядро от просвета сосуда.
Тонкая фиброзная капсула, инфильтрированная макрофагами (пенистыми клетками), покрывающая липидное ядро бляшки, способна к разрыву. Если на поверхности такой капсулы имеются эритроциты, вероятность ее разрыва очень высока.
Нестабильные бляшки легко подвергаются эрозии, разрывам, приводя к острым тромбозам, окклюзиям и инфарктам еще до развития стенозов сосудов.
Тонкая, инфильтрированная пенистыми клетками капсула бляшки (между стрелками) в состоянии разрыва.
D — разрыв (обозначен стрелками) тонкой, инфильтрированной пенистыми клетками капсулы бляшки, пристеночный тромбоз в месте разрыва.
Клинические признаки атеросклероза появляются при прогрессирующем сужении просвета артерии в результате разрастания стабильной атеросклеротической бляшки, когда дефициту кровотока составляет 50-70%. В этом случае развиваются:
- Cтабильная стенокардия.
- Перемежающаяся хромота.
- Мезентериальная стенокардия и другие проявления атеросклероза.
На рисунке схематично представлен механизм формирования нестабильной бляшки.
Разрыв нестабильной атеросклеротической бляшки и оголение эндотелия ведут к образованию тромба, который полностью или частично препятствует кровотоку в пораженной артерии. При этом диагностируются:
- Нестабильная стенокардия.
- Инфаркты миокарда.
- Транзиторные ишемические атаки.
- Инсульты.
Атероматозная эмболия возникает спонтанно:
- Как осложнение хирургических операций на аорте.
- При проведении ангиографии, тромболитической терапии у пациентов с диффузным или прогрессирующим атеросклерозом.
(1).jpg)
На серии изображений, полученных в ходе микроскопии представлено атеросклеротическое поражение коронарных артерий, которое привело к их полной окклюзии:
- А — степень выраженности стеноза 90%.
- В, С — небольшие каналы реканализации в капиллярах.
- D — воспалительный процесс в адвентициальном слое сосуда.
- Е -разрастание капилляров в адвентициальной оболочке сосудов.
В развитии взглядов на патогенез острых коронарных синдромов (ОКС) сделан новый акцент на тромбообразовании как на переломном (решающем) механизме перехода от хронического атеросклероза к его острому течению. Понимание механизмов тромбоза коронарной артерии (КА) существенно прогрессирует.
Сейчас уже ясно, что физическое разрушение атеросклеротической бляшки (АБ) обычно сопровождается острым тромбозом. Появление большинства коронарных тромбов провоцируется разрывами атеросклеротической бляшки (АБ), обусловленными несколькими механизмами.
Первый механизм, объясняющий почти 60% случаев ОИМ, заключается в трещине фиброзной покрышки АБ. Другой механизм — поверхностная эрозия интимы, что объясняет до 25% всех ОИМ среди тщательно отобранных наблюдений, поступивших от экспертов, анализировавших причины внезапной сердечной смерти (ВСС). Поверхностная эрозия в качестве механизма ВСС чаще фигурирует у женщин, чем у мужчин.
а) Разрыв атеросклеротической бляшки и тромбоз. Разрыв фиброзной покрышки АБ отражает, видимо, дисбаланс между силами воздействия на покрышку и силой напряжения самой фиброзной покрышки. Биомеханическая устойчивость к разрыву фиброзной покрышки обеспечивается в основном интерстициальными формами коллагена. Следовательно, процессы метаболизма коллагена участвуют в регуляции предрасположенности атеросклеротической бляшки (АБ) к разрыву. Факторы, угнетающие синтез коллагена в ГМК, снижают способность этих клеток восстанавливать и сохранять фиброзную покрышку атеросклеротической бляшки (АБ).
Например, продуцируемый Т-клетками цитокин IFNγ является мощным ингибитором синтеза коллагена в ГМК. В то же время, как уже отмечалось, некоторые медиаторы, высвобождаемые из тромбоцитарных гранул в процессе их активации, усиливают синтез коллагена в ГМК, укрепляя тем самым фиброзную структуру АБ. К таким медиаторам относятся TGFβ и PDGF.
Помимо снижения в ГМК синтеза коллагена de novo, повышенный катаболизм макромолекул внеклеточного матрикса, которые входят в состав фиброзной покрышки бляшки, также вносит вклад в ослабление этой структуры и повышает риск разрыва, а следовательно, и образования тромба. Те же самые деградирующие ферменты, которые, как полагают, участвуют в миграции ГМК и ремоделировании артерий, могут ослаблять и фиброзную покрышку.
В прогрессирующей атероме человека макрофаги в избытке экспрессируют металлопротеиназы и обладающие эластолитическим действием катепсины, которые способны разрушать коллаген и эластин внеклеточного матрикса артерий. Таким образом, натяжение фиброзной покрышки АБ подвержено динамической регуляции, при которой воспалительная реакция интимы сопряжена с молекулярными детерминантами стабильности АБ и, следовательно, с осложнениями атеромы в виде тромбообразова-ния. Истончение фиброзной покрышки в результате сниженного синтеза коллагена и повышенной его деградации объясняет, почему АБ, которые разорвались и привели к развитию фатального ИМ, имеют согласно патологоанатомическим исследованиям характерную тонкую фиброзную покрышку.
Другой особенностью такой атеросклеротической бляшки (АБ), называемой уязвимой, является относительный дефицит ГМК. Как объяснялось ранее, медиаторы воспаления — как растворимые, так и ассоциированные с поверхностью Т-лимфоцитов — способны вызывать апоптоз ГМК. «Выпадение» ГМК из участков локального воспаления в АБ вносит, вероятно, определенный вклад в относительный дефицит ГМК в тех местах, где происходит разрыв АБ.
Поскольку эти клетки служат источником вновь синтезированного коллагена, необходимого для восстановления и сохранения фиброзной покрышки, при дефиците ГМК она ослабляется, а склонность АБ к разрыву, соответственно, возрастает.
Выраженное скопление макрофагов и большой липидный пул являются третьей микроанатомической особенностью уязвимой АБ. С точки зрения строгой биомеханики большой липидный пул способен концентрировать на себе биомеханические силы, направленные на «плечи» АБ — обычные зоны разрыва фиброзной покрышки. С точки зрения метаболизма активированные макрофаги, характерные для ядра АБ, продуцируют цитокины и деградирующие матрикс ферменты, которые, в свою очередь, как полагают, регулируют метаболизм матрикса и апоптоз ГМК. Находящиеся в состоянии апоптоза макрофаги, как и ГМК, вырабатывают тканевый фактор — потенциальный инициатор капиллярного тромбоза после спонтанного или ятрогенного разрыва АБ. Успехи липидснижающей терапии в уменьшении частоты возникновения ОИМ или НС у пациентов с высоким риском могут быть результатом снижения накопления липидов, уменьшения воспаления и тромбогенности АБ. Результаты недавно выполненных на животных исследований, а также данные мониторинга периферических маркеров воспаления у людей подтверждают эту концепцию.
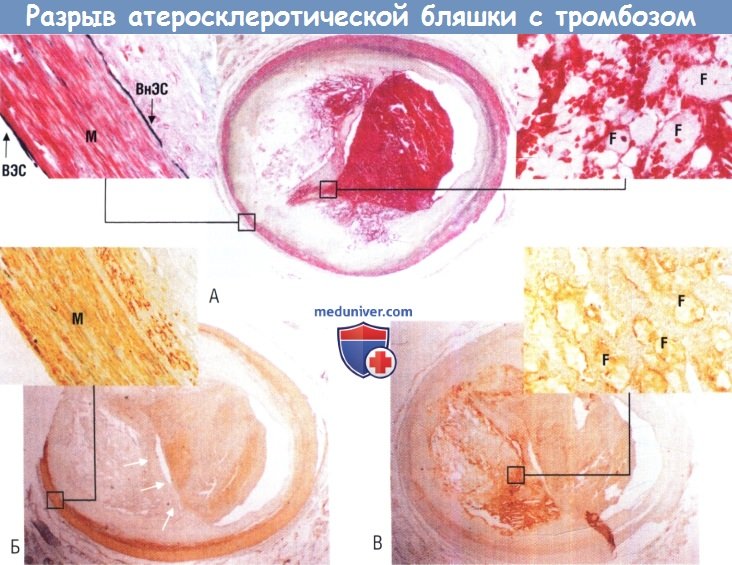
Пример разрыва бляшки, ставшего причиной фатального тромбоза.
(А) Окрашивание по Movat. (Б) Иммуноокрашивание с помощью HHF-35, при котором визуализируются ГМК.
Видно незначительное количество ГМК в фиброзной покрышке (стрелки) в противоположность их изобилию в среднем слое (вставка).
(В) Окрашивание макрофагов (CD68) позволяет видеть скопление воспалительных клеток вблизи фиброзной покрышки (вставка).
F — пенистая клетка; ВнЭС — внутренний эластический слой; ВЭС — внешний эластический слой; М — медиа.
б) Тромбоз, вызванный поверхностным изъязвлением бляшки. В следующей статье будет обсуждена патофизиология разрыва фиброзной покрышки атеросклеротической бляшки (АБ). Ясности в вопросах поверхностного изъязвления намного меньше. При экспериментальном атеросклерозе, вызванном у обезьян, зоны отсутствия эндотелия и отложения тромбоцитов появляются в более сформированных атеросклеротических бляшек (АБ).
Оказалось, что у человека поверхностные эрозии являются вероятной причиной случаев фатального ОИМ у женщин и лиц с гипертриглицеридемией и СД. Однако молекулярные механизмы, лежащие в основе этого явления, остаются нераскрытыми. Апоптоз ЭК может вносить определенный вклад в десквамацию эндотелия в зонах поверхностного изъязвления. Аналогично этому ММП, включая некоторые желатиназы, специализирующиеся на деградации нефибриллярного коллагена, расположенного в базальной мембране (например, коллаген IV типа), также могут разрушать участки соединения ЭК с подлежащей базальной мембраной и ускорять их десквамацию.
В большинстве случаев разрывы атеросклеротической бляшки (АБ) не приводят к клинически выраженным коронарным событиям. При тщательном патологоанатомическом изучении препаратов сердца, полученных от внезапно умерших по некардиальной причине лиц, в АБ на удивление часто находили очаговые (фокальные) разрывы с ограниченным числом пристеночных тромбов.
Более того, при исследовании извлеченных и сразу же зафиксированных сердец от пациентов, страдавших выраженным атеросклерозом с хроническим стабильным течением и перенесших процедуру трансплантации сердца в связи с ишемической кардиомиопатией (КМП), были получены аналогичные данные, свидетельствующие о бессимптомных разрывах АБ. У обезьян с экспериментальным атеросклерозом было показано, что пристеночные тромбы могут усугубить изъязвление АБ, не вызывая сужение артерии.
Отсюда следует, что повторные циклы, включающие разрыв атеросклеротической бляшки (АБ), тромбообразование in situ и заживление (рубцевание), вносят, вероятно, определенный вклад в прогрессирование атеросклеротического поражения и рост АБ. Подобные эпизоды тромбообразования и рубцевания представляют собой один из типов «кризиса» в процессе развития АБ, который вызывает всплеск пролиферации и миграции ГМК и синтеза в них матрикса. Синтез коллагена в ГМК, как отмечено ранее, стимулируют TGFβ и PDGF, высвобождаемые из тромбоцитарных гранул. В роли мощного стимулятора пролиферации ГМК выступает тромбин, образующийся в зоне пристеночного тромбоза.
Последняя стадия атеросклеротического процесса («перегоревшая» фиброзная и кальцифицированная атерома) представляет собой конечный этап развития исходно перегруженной липидами и уязвимой бляшки, превратившейся в фиброзное и практически бесклеточное образование в ответ на повреждение, опосредуемого продуктами тромбообразования.
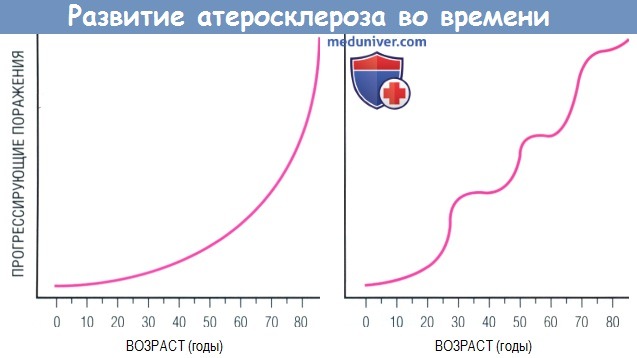
Развитие атеросклероза во времени.
Согласно традиционному взгляду, формирование атеромы с течением лет происходит прогрессивно по нарастающей (слева).
Современный взгляд предлагает альтернативную модель: не монотонная эволюция поражения в зависимости от времени, а скорее ее поэтапное развитие (справа).
Согласно последней модели, в процессе развития атеросклеротического поражения относительно спокойные периоды могут сменяться «кризисами».
Вслед за таким «кризисом» возможен разрыв бляшки с интрамуральным тромбозом, ее рубцевание, сопровождающееся всплеском пролиферации ГМК и отложением матрикса.
Аналогичное развитие событий может быть спровоцировано кровоизлиянием внутри бляшки, вызванным разрывом хрупких микрососудов.
Такие эпизоды обычно клинически не проявляются. Внесосудистые события, например случайная инфекция, сопровождающаяся системной цитокинемией или эндотоксинемией,
способны вызвать «эхо» на уровне артериальной стенки, индуцируя цикл локальной экспрессии генов цитокинов с помощью «профессиональных» воспалительных лейкоцитов, присутствующих в зоне поражения.
Представленная справа модель эпизодического прогрессирования бляшки больше соответствует данным ангиографии у человека, чем кривая слева.
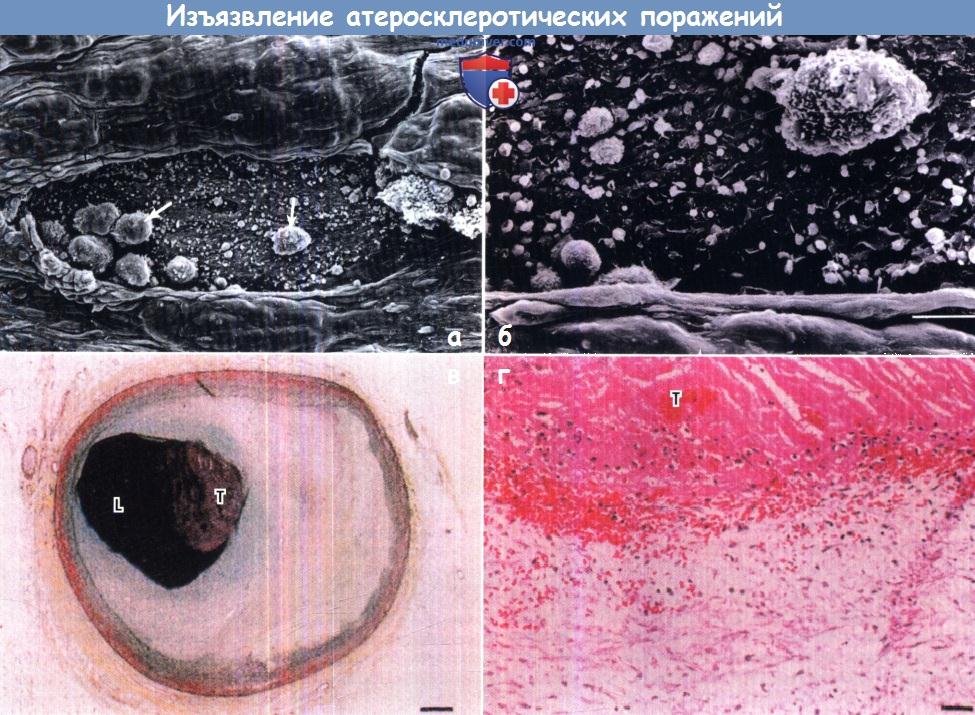
Изображение поверхностного изъязвления экспериментальных атеросклеротических поражений, полученное с помощью сканирующей электронной микроскопии.
Прогрессирующие атеросклеротические бляшки стимулируют тромбообразование за счет поверхностного изъязвления эндотелиального слоя и контакта крови
и тромбоцитов с содержащей коллаген субэндотелиальной базальной мембраной, а также активацию тромбоцитов и тромбообразование.
(А) При низком разрешении видна трещина в эндотелии. Лейкоциты (стрелки) прилипли к субэндотелию, который начинает покрываться слоем тромбоцитов.
(Б) При высоком разрешении на участке, выбранном из центра (А), видны лейкоциты и тромбоциты, прилипшие к субэндотелию.
(В) Гистологический срез через коронарную артерию с тромбом, образовавшимся в результате поверхностного изъязвления (фото низкого разрешения).
(Г) Гистологический срез через коронарную артерию с тромбом, образовавшимся в результате поверхностного изъязвления (фото высокого разрешения).
L — просвет сосуда; Т — тромб.
— Читать «Воспаление атеросклеротической бляшки при атеросклерозе как причина осложнений»
Оглавление темы «Атеросклероз и его осложнения»:
- Роль иммунитета в развитии атеросклероза
- Миграция и пролиферация гладкомышечных клеток при атеросклерозе
- Механизм гибели гладкомышечных клеток при атеросклерозе
- Внеклеточный матрикс артерии при атеросклерозе
- Рост сосудов в атеросклеротической бляшке — ангиогенез
- Отложение кальция в атеросклеротической бляшке — минерализация, кальцификация
- Сужение артерии (стеноз) как осложнение атеросклероза
- Тромбоз артерии как осложнение атеросклероза
- Воспаление атеросклеротической бляшки при атеросклерозе как причина осложнений
- Аневризмы артерий как осложнение атеросклероза











