Мдс рефрактерная анемия мкб 10
Рубрика МКБ-10: D46.4
МКБ-10 / C00-D48 КЛАСС II Новообразования / D37-D48 Новообразования неопределенного или неизвестного характера / D46 Миелодиспластические синдромы
Определение и общие сведения[править]
Для миелодиспластических синдромов (МДС) характерны неэффективный гемопоэз в более чем одной его линиях, диспластические изменения в клетках костного мозга, цитопения периферической крови и клональные цитогенетические нарушения. С начала ХХ в. к МДС применяли термины: «дремлющий лейкоз», «малопроцентный лейкоз», «сидероахрестическая анемия» и др. — и рассматривали как непосредственный предлейкоз.
Классификация
В 1982 г. ФАБ-группой была предложена классификация МДС, предусматривающая пять вариантов заболевания:
— рефрактерная анемия;
— рефрактерная анемия с кольцевидными сидеробластами;
— рефрактерная анемия с избытком бластов;
— рефрактерная анемия с избытком бластов в стадии трансформации в острый лейкоз;
— хронический миеломоноцитарный лейкоз.
Эта схема основана на данных анализов периферической крови и миелограм-мы и предусматривает наличие не более 5% бластов в крови и не более 30% — в миелограмме. Особое внимание в ней уделено диспластическим изменениям в клетках разных линий гемопоэза. В эритроидном ряду они проявляются наличием дву- и многоядерных эритробластов, клеток мегалобластоидного вида, ринг-сидеробластов, сидерофагов, а также отложениями внеклеточного гемосидерина, что указывает и на нарушение обмена железа. В гранулоцитарной линии клеток выявляют аномалию лейкоцитов Пельгера: гипосегментацию их ядер и иногда небольшой сдвиг в сторону незрелых форм. О дисплазии клеток мегакариоци-тарного ростка можно судить по появлению микрогенераций мегакариоцитов и клеток с гипосегментированным ядром.
МДС впервые были введены в классификацию ВОЗ в 2001 г. По сравнению с ФАБ-классификацией, в ней изменилось разделение МДС на варианты и уменьшено допустимое число бластов в периферической крови (менее 5%) и костном мозге (до 20%). В новой схеме не отражен хронический миеломоноцитарный лейкоз, сочетающий в себе морфологические особенности МДС и миелопролифератив-ного заболевания, хотя ряд исследователей вместо него выделяют форму МДС/
МПЗ.
Согласно модифицированной схеме ВОЗ различают следующие варианты первичных МДС:
— рефрактерная анемия;
— рефрактерная анемия с кольцевидными сидеробластами;
— рефрактерная цитопения с мультилинейной дисплазией;
— рефрактерная анемия с избытком бластов;
— МДС, ассоциированный с изолированной делецией хромосомы 5 (del 5q);
— МДС неклассифицируемый.
Первичными МДС, в отличие от вторичных, называют заболевания, причина которых после тщательного обследования больного не была установлена. Вторичные МДС и так называемые вторичные лейкозы, развивающиеся после
химио- и лучевой терапии по поводу опухолей различной природы, составляют 10-15% первичных МДС и не входят в приведенную классификацию.
Этиология и патогенез[править]
Этиология МДС до конца не изучена; его возникновение многие исследователи связывают с неблагоприятными экологическими факторами, повышенной радиацией, воздействием ряда химических веществ и пр.
Патогенез
МДС — заболевание пациентов преимущественно старшего возраста, дети и молодые люди поражаются значительно реже. В числе механизмов возникновения МДС называют цитогенетические изменения. Уже на этапе первоначальной диагностики у 40-60% больных выявляют хромосомные аберрации, наиболее частые из которых — делеция и моносомия хромосом 5 и 7, а также изменения в хромосомах 8, 12, 17, 18 и 20. Наиболее изучен прогностически неблагоприятный 5q-синдром, при котором миелоидные (CD34+, CD38-) и про-В-лимфоидные (CD34+, CD19+) клетки-предшественницы неустойчивы к апоптозу и не способны поддерживать лимфомиелоидную пролиферацию. Часто отмечают также мутации в коротком плече хромосомы 17 (17p) c вовлечением 53p. МДС относят к клональным заболеваниям, что подтверждает обнаружение однотипных хромосомных нарушений в стволовых клетках и элементах миелоидного и лимфоидного ряда, а также мутации гена NRAS в гранулоцитах, моноцитах и лимфоцитах обоих фенотипов. О клональном поражении стволовых и клеток-предшественниц свидетельствует и возможность трансформации МДС в ОМЛ или бифенотипический острый лейкоз. Особенностью МДС являются разнообразие хромосомных аберраций и их сочетания. Клональность МДС легла в основу классификации ВОЗ. Большинство исследователей расценивают МДС как предлейкоз, однако в ряде наблюдений не было зафиксировано трансформации его в острый лейкоз даже при длительном течении болезни. Этот феномен объясняют как генетической нестабильностью стволовых клеток, что теоретически возможно, так и различными изменениями в некоторых онкогенах и факторах роста, нарушениями колониеобразования и др. В патогенезе МДС рассматривают и нарушения межклеточных и клеточно-матриксных взаимодействий в кроветворной ткани. В моноцитарно-миелоидных клетках-предшественницах увеличена экспрессия СЭФР и его мембранного рецептора РСЭФР-1, с чем связывают повышенную васкуляризацию кроветворной ткани, свойственную, в частности, ОМЛ, а также экспрессия фактора роста фибро-бластов, что объясняет фиброзное поражение стромы. При всех вариантах МДС в CD34-положительных клетках обнаруживают высокую экспрессию гена Bcl-2, повышенный уровень Fas и его лигандов в эритроидной линии клеток, другие изменения в семействе Bcl-2 белков, а также увеличенный уровень циклина D1 и дефицит ростовых факторов. Дисбаланс экспрессии указанных белков определяет уровень пролиферации и степень дифференцировки клеток при МДС.
Клинические проявления[править]
Основные клинические симптомы МДС — цитопения периферической крови (одно-, двух или трехростковая) и анемический синдром, не поддающийся медикаментозной коррекции и выявляемый у 80% больных. Анемия обычно носит макроцитарный характер. Примерно в половине случаев отмечают нейтропению, иногда — в сочетании с увеличенным числом моноцитов. У 25% больных снижено число тромбоцитов, функциональные нарушения в которых связаны с изменениями количества и размеров гранул. У некоторых пациентов наблюдают артралгии, незначительное увеличение селезенки. С лейкопенией и тромбоцитопенией при МДС связывают инфекционные и геморрагические осложнения, нередко определяющие танатогенез.
Рефрактерная анемия неуточненная: Диагностика[править]
Данные исследований трепанобиопсий при МДС требуют тщательного сопоставления их с результатами лабораторных анализов. Диагноз «МДС» верен при различной, чаще повышенной клеточности кроветворной ткани, наличии диспла-стических изменений в клетках двух или трех линий гемопоэза, так называемых воспалительных участков огрубения в строме (лимфоидная или лимфоплазмоклеточная очаговая пролиферация). Нарушения обмена железа обнаруживают при сидероахрестической форме МДС. Подтверждение любого варианта МДС требует исследования трепанобиоптата костного мозга в динамике, особенно в случаях изменений в клетках гранулоцитарной линии, а также после проведенного лечения, которое может включать и трансплантацию костного мозга или стволовых клеток.
Дифференциальный диагноз[править]
Рефрактерная анемия неуточненная: Лечение[править]
В настоящее время нет данных, что циторедуктивная терапия полезна для пациентов с РАКС-Т (рефрактерная анемия с кольцевыми сидеробластами, ассоциированная с выраженным тромбоцитозом); более того, назначение гидроксикарбамида может приводить к нарастанию анемии. Показана эффективность леналидомида у единичных пациентов с JAK2V617F с достижением независимости от трансфузий и полной молекулярной ремиссии. Необходимы новые клинические исследования пациентов с РАКС-Т.
Профилактика[править]
Прочее[править]
Источники (ссылки)[править]
«Патологическая анатомия [Электронный ресурс] : национальное руководство / гл. ред. М.А. Пальцев, Л.В. Кактурский, О.В. Зайратьянц — М. : ГЭОТАР-Медиа, 2014. — (Серия «Национальные руководства»).» — https://www.rosmedlib.ru/book/ISBN9785970431542.html
Гематология [Электронный ресурс] : национальное руководство / под ред. О.А. Рукавицына — М. : ГЭОТАР-Медиа, 2015. — https://www.rosmedlib.ru/book/ISBN9785970433270.html
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
Связанные заболевания и их лечение
Национальные рекомендации по лечению
Стандарты мед. помощи
Содержание
- Описание
- Симптомы
- Диагностика
- Дифференциальная диагностика
- Причины
- Прогноз
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Миелодиспластический синдром.
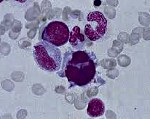
Миелодиспластический синдром
Описание
Миелодиспластический синдром (МДС) — группа гетерогенных клональных заболеваний, характеризующаяся наличием цитопении в периферической крови, дисплазии в костном мозге и риском трансформации в острый лейкоз.
МДС сегодня является одной из самых сложных проблем гематологии. Лишь недавно лечение МДС вышло за рамки поддерживающей терапии, проводившейся с целью облегчения симптомов.
МДС — это патология старшей возрастной группы. 80 % случаев МДС приходится на лица старше 60 лет. МДС в детском возрасте встречается крайне редко. В европейских странах среди лиц 50-69 лет регистрируется 40 новых случаев МДС на 1 млн населения, а среди лиц 70 лет и старше — 150 новых случаев на 1 млн населения. Заболеваемость МДС в РФ в среднем составляет 3-4 случая на 100 тыс. Населения в год и увеличивается с возрастом.
Симптомы
МДС отличает отсутствие типичной клинической картины. Симптоматику МДС составляют последствия дисмиелопоэза, то есть цитопении: анемия, нейтропения и тромбоцитопения (анемия Hb меньше 110 г/л, нейтрофилы меньше 1,800 на 1 микролитр крови; гематокрит меньше 36 % эритроцитов в общем объёме крови в организме; тромбоциты меньше 100,000 на 1 микролитр крови).
Наиболее часто МДС манифестирует цитопениями, главным образом анемией.
Одышка. Тромбоцитоз. Увеличение лимфоузлов.
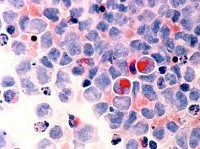
Миелодиспластический синдром
Диагностика
Диагностика МДС базируется исключительно на лабораторно-инструментальных методах, из которых ключевыми являются полный клинический анализ периферической крови, некоторые биохимические исследования и морфологический анализ аспиратов и биоптатов костного мозга.
Дифференциальная диагностика
Необходимо дифференцировать МДС от железа или B12- дефицитной анемии, постгеморрагической анемии, анемии при хронических заболеваниях и онкологии или связанной с хронической почечной недостаточностью, а также апластической анемией, пароксизмальной ночной гемоглобинурией. У 10 % пациентов имеются признаки инфекции, а у несколько меньшей доли пациентов болезнь проявляется кровотечениями.
Дифференциальная диагностика МДС также затруднена в силу множества состояний, имеющих общие с МДС клинико-лабораторные проявления.
Причины
Первичный (идиоптический) тип — 80-90 % случаев, вторичный(вследствие предшествующей химиотерапии и факторов) — 10-20 %. Большинство (80 %) случаев МДС являются первичными — идиопатическими или de novo (лат. — вновь появившийся, новый).
Вторичный МДС является значительно более неблагоприятным и резистентным к лечению типом МДС, обладающим заведомо более худшим прогнозом в сравнении с первичным МДС. 10-20 % случаев МДС возникают вследствие предшествующей химиотерапии по поводу других новообразований. К препаратам, обладающим доказанной способностью повреждать геном с последующим развитием МДС, относятся алкилирующие агенты (циклофосфан), ингибиторы, топоизомеразы — противоопухолевые агенты растительного происхождения (топотекан, иринотекан и ), антрациклины (доксорубицин) и подофиллотоксины (этопозид). К МДС также могут приводить радиотерапия и контакт с токсическими материалами.
Факторы риска, первичный МДС:
• Контакт с токсинами (бензин, органические растворители, пестициды).
• Радиация.
• Курение.
• Врожденные и наследственные заболевания.
• Пожилой возраст.
Факторы риска, вторичный МДС:
Предшествующая химиотерапия онкологического заболевания или после ТКМ.
Прогноз
Прогноз: 5-летняя выживаемость при МДС не превышает 60 %. Трансформация в острый лейкоз ~30 % случаев.
Лечение
Не все пациенты с МДС нуждаются в терапии. Пациенты без анемического, геморрагического синдрома, инфекционных осложнений могут наблюдаться и не получать лечения (тактика «watch and wait»).
Выбор терапевтической тактики во многом определятся возрастом пациента, соматическим статусом, степенью риска по шкале IPSS, WPSS, наличием совместимого донора.
Можно выделить следующие направления терапии МДС:
• Сопроводительная терапия включает в себя переливание различных гемокомпонентов (эритроцитарной массы, тромбоконцентрата), терапию эритропоэтином, тромбопоэтином. У больных часто получающих гемотрансфузии развивается перегрузка организма железом. Железо обладает токсическим действием на различные ткани и органы, в первую очередь сердце, печень, поэтому такие пациенты должны получать препараты, связывающие железо — хелаторы (десферал, эксиджад).
• Иммуносупрессивная терапия наиболее эффективна у пациентов с гипоклеточным костным мозгом, нормальным кариотипом и наличием HLA-DR15. Леналидомид, обладающий иммуномодулирующим и антиангиогенным действием, показал свою эффективность у трети пациентов с рефрактерной анемией (согласно критериям ВОЗ) и низким риском (по IPSS), а также у больных с 5q- синдромом. Эффективность лечения в данном случае весьма высока; 95 % больных достигают цитогенетической ремиссии.
• Аллогенная трансплантация гемопоэтических стволовых клеток от совместимых доноров является методом выбора у пациентов с миелодиспластическим синдромом.
Пациентам с МДС моложе 65 лет, с хорошим соматическим статусом, при наличии HLA-совместимого донора показано проведение аллогенной трансплантации костного мозга, так как трансплантация является потенциально радикальным методом лечения МДС.
• Химиотерапия.
• Цитарабин, низкие дозы. Широко используются в России, да и во всей Европе, для лечения пациентов с МДС и ОМЛ, которым не подходит терапия методом ТКМ или применение интенсивной химиотерапии.
Мнения исследователей относительно целесообразности использования низкоинтенсивной терапии расходятся. Bowen D считает, что нет оснований рекомендовать её рутинное использование при МДС: было выполнено 3 рандомизированных крупных исследования (141 пац. ), которые показали, что применение низких доз цитарабина не увеличивает продолжительность жизни пациентов с МДС. Вместе с тем, в более позднем исследовании у пациентов с ОМЛ и МДС высокого риска было показано, что продолжительность жизни у больных, у которых применялся LDAC более, чем в 1 цикле, выше, чем при поддерживающей терапии.
Таким образом, необходимость в низкоинтенсивной терапии с доказанной эффективностью и лучшей переносимостью, чем LDAC, которая будет способствовать увеличению выживаемости пациентов с МДС высокого риска, остается актуальной.
• Высокодозная химиотерапия используется у больных с РАИБ с гипер- и нормоклеточным костным, при трансформации в ОМЛ. Пятилетняя выживаемость составляет около 18 %.
• Гипометилирующие препараты.
Новые многообещающие терапевтические подходы, широко обсуждающиеся в последнее время, по поводу которых проводятся многочисленные клинические исследования, возникли в результате глубокого изучения биологии МДС. Среди них следует отметить ингибиторы метилирования ДНК (5-азацитидин, децитабин) и иммуномодулятор — леналидомид. 5-азацитидин обладает двойным механизмом действия. Он встраивается не только в молекулу ДНК, но и в молекулу РНК. В процессе метилирования ДНК гипометилирующие агенты ковалентно связываются с ДНК-метилтрансферазой, что приводит к реактивации генов, после чего восстанавливается дифференцировка гемопоэтических клеток-предшественников и нормальное кроветворение. Азацитидин, встраиваясь в РНК молекулу, тем самым понижает её количество в клетках, что приводит к цитостатическому эффекту вне зависимости от клеточной фазы. На основании результатов исследования 3 фазы AZA-001 — международное, мультицентровое, контролируемое, в параллельных группах, в котором пациенты МДС высокого риска/ОМЛ (ВОЗ критерии) сравнивались со стандартным лечением (сопроводительная терапия, интенсивная химиотерапия, низкие дозы цитарабина), азацитидин был зарегистрирован, в том числе и в РФ, для лечения этих больных. Было показано, что азацитидин в 2,5 раза увеличивает общую выживаемость.
Основные медуслуги по стандартам лечения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Связанные заболевания и их лечение
Описания заболеваний
Национальные рекомендации по лечению
Стандарты мед. помощи
Содержание
- Синонимы диагноза
- Описание
- Симптомы
- Диагностика
- Дифференциальная диагностика
- Причины
- Прогноз
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
D46 Миелодиспластические синдромы.

D46 Миелодиспластические синдромы
Синонимы диагноза
Миелодиспластические синдромы, миелодисплазия, мдс, миелодиспластический синдром, синдром дисплазии костного мозга.
Описание
Миелодиспластический синдром (МДС) — группа гетерогенных клональных заболеваний, характеризующаяся наличием цитопении в периферической крови, дисплазии в костном мозге и риском трансформации в острый лейкоз.
МДС сегодня является одной из самых сложных проблем гематологии. Лишь недавно лечение МДС вышло за рамки поддерживающей терапии, проводившейся с целью облегчения симптомов.
МДС — это патология старшей возрастной группы. 80 % случаев МДС приходится на лица старше 60 лет. МДС в детском возрасте встречается крайне редко. В европейских странах среди лиц 50-69 лет регистрируется 40 новых случаев МДС на 1 млн населения, а среди лиц 70 лет и старше — 150 новых случаев на 1 млн населения. Заболеваемость МДС в РФ в среднем составляет 3-4 случая на 100 тыс. Населения в год и увеличивается с возрастом.

D46 Миелодиспластические синдромы
Симптомы
МДС отличает отсутствие типичной клинической картины. Симптоматику МДС составляют последствия дисмиелопоэза, то есть цитопении: анемия, нейтропения и тромбоцитопения (анемия Hb меньше 110 г/л, нейтрофилы меньше 1,800 на 1 микролитр крови; гематокрит меньше 36 % эритроцитов в общем объёме крови в организме; тромбоциты меньше 100,000 на 1 микролитр крови).
Наиболее часто МДС манифестирует цитопениями, главным образом анемией.
Диагностика
Диагностика МДС базируется исключительно на лабораторно-инструментальных методах, из которых ключевыми являются полный клинический анализ периферической крови, некоторые биохимические исследования и морфологический анализ аспиратов и биоптатов костного мозга.
Дифференциальная диагностика
Необходимо дифференцировать МДС от железа или B12- дефицитной анемии, постгеморрагической анемии, анемии при хронических заболеваниях и онкологии или связанной с хронической почечной недостаточностью, а также апластической анемией, пароксизмальной ночной гемоглобинурией. У 10 % пациентов имеются признаки инфекции, а у несколько меньшей доли пациентов болезнь проявляется кровотечениями.
Дифференциальная диагностика МДС также затруднена в силу множества состояний, имеющих общие с МДС клинико-лабораторные проявления.
Причины
Первичный (идиоптический) тип — 80-90 % случаев, вторичный(вследствие предшествующей химиотерапии и факторов) — 10-20 %. Большинство (80 %) случаев МДС являются первичными — идиопатическими или de novo (лат. — вновь появившийся, новый).
Вторичный МДС является значительно более неблагоприятным и резистентным к лечению типом МДС, обладающим заведомо более худшим прогнозом в сравнении с первичным МДС. 10-20 % случаев МДС возникают вследствие предшествующей химиотерапии по поводу других новообразований. К препаратам, обладающим доказанной способностью повреждать геном с последующим развитием МДС, относятся алкилирующие агенты (циклофосфан), ингибиторы, топоизомеразы — противоопухолевые агенты растительного происхождения (топотекан, иринотекан и ), антрациклины (доксорубицин) и подофиллотоксины (этопозид). К МДС также могут приводить радиотерапия и контакт с токсическими материалами.
Факторы риска, первичный МДС:
* Контакт с токсинами (бензин, органические растворители, пестициды).
* Радиация.
* Курение.
* Врожденные и наследственные заболевания.
* Пожилой возраст.
Факторы риска, вторичный МДС:
Предшествующая химиотерапия онкологического заболевания или после ТКМ.
Прогноз
Прогноз: 5-летняя выживаемость при МДС не превышает 60 %. Трансформация в острый лейкоз ~30 % случаев.
Лечение
Не все пациенты с МДС нуждаются в терапии. Пациенты без анемического, геморрагического синдрома, инфекционных осложнений могут наблюдаться и не получать лечения (тактика «watch and wait»).
Выбор терапевтической тактики во многом определятся возрастом пациента, соматическим статусом, степенью риска по шкале IPSS, WPSS, наличием совместимого донора.
Можно выделить следующие направления терапии МДС:
* Сопроводительная терапия включает в себя переливание различных гемокомпонентов (эритроцитарной массы, тромбоконцентрата), терапию эритропоэтином, тромбопоэтином. У больных часто получающих гемотрансфузии развивается перегрузка организма железом. Железо обладает токсическим действием на различные ткани и органы, в первую очередь сердце, печень, поэтому такие пациенты должны получать препараты, связывающие железо — хелаторы (десферал, эксиджад).
* Иммуносупрессивная терапия наиболее эффективна у пациентов с гипоклеточным костным мозгом, нормальным кариотипом и наличием HLA-DR15. Леналидомид, обладающий иммуномодулирующим и антиангиогенным действием, показал свою эффективность у трети пациентов с рефрактерной анемией (согласно критериям ВОЗ) и низким риском (по IPSS), а также у больных с 5q- синдромом. Эффективность лечения в данном случае весьма высока; 95 % больных достигают цитогенетической ремиссии.
* Аллогенная трансплантация гемопоэтических стволовых клеток от совместимых доноров является методом выбора у пациентов с миелодиспластическим синдромом.
Пациентам с МДС моложе 65 лет, с хорошим соматическим статусом, при наличии HLA-совместимого донора показано проведение аллогенной трансплантации костного мозга, так как трансплантация является потенциально радикальным методом лечения МДС.
* Химиотерапия.
* Цитарабин, низкие дозы. Широко используются в России, да и во всей Европе, для лечения пациентов с МДС и ОМЛ, которым не подходит терапия методом ТКМ или применение интенсивной химиотерапии.
Мнения исследователей относительно целесообразности использования низкоинтенсивной терапии расходятся. Bowen D считает, что нет оснований рекомендовать её рутинное использование при МДС: было выполнено 3 рандомизированных крупных исследования (141 пац. ), которые показали, что применение низких доз цитарабина не увеличивает продолжительность жизни пациентов с МДС. Вместе с тем, в более позднем исследовании у пациентов с ОМЛ и МДС высокого риска было показано, что продолжительность жизни у больных, у которых применялся LDAC более, чем в 1 цикле, выше, чем при поддерживающей терапии.
Таким образом, необходимость в низкоинтенсивной терапии с доказанной эффективностью и лучшей переносимостью, чем LDAC, которая будет способствовать увеличению выживаемости пациентов с МДС высокого риска, остается актуальной.
* Высокодозная химиотерапия используется у больных с РАИБ с гипер- и нормоклеточным костным, при трансформации в ОМЛ. Пятилетняя выживаемость составляет около 18 %.
* Гипометилирующие препараты.
Новые многообещающие терапевтические подходы, широко обсуждающиеся в последнее время, по поводу которых проводятся многочисленные клинические исследования, возникли в результате глубокого изучения биологии МДС. Среди них следует отметить ингибиторы метилирования ДНК (5-азацитидин, децитабин) и иммуномодулятор — леналидомид. 5-азацитидин обладает двойным механизмом действия. Он встраивается не только в молекулу ДНК, но и в молекулу РНК. В процессе метилирования ДНК гипометилирующие агенты ковалентно связываются с ДНК-метилтрансферазой, что приводит к реактивации генов, после чего восстанавливается дифференцировка гемопоэтических клеток-предшественников и нормальное кроветворение. Азацитидин, встраиваясь в РНК молекулу, тем самым понижает её количество в клетках, что приводит к цитостатическому эффекту вне зависимости от клеточной фазы. На основании результатов исследования 3 фазы AZA-001 — международное, мультицентровое, контролируемое, в параллельных группах, в котором пациенты МДС высокого риска/ОМЛ (ВОЗ критерии) сравнивались со стандартным лечением (сопроводительная терапия, интенсивная химиотерапия, низкие дозы цитарабина), азацитидин был зарегистрирован, в том числе и в РФ, для лечения этих больных. Было показано, что азацитидин в 2,5 раза увеличивает общую выживаемость.
Основные медуслуги по стандартам лечения | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


