Лимфоузлы при апластической анемии
Апластическая (гипопластическая) анемия – тяжелое заболевание крови, которое часто может приводить к летальному исходу. Несмотря на серьезность патологии, в последнее время были разработаны методы лечения апластической анемии, которые увеличили количество выживших пациентов.
Механизм развития анемии
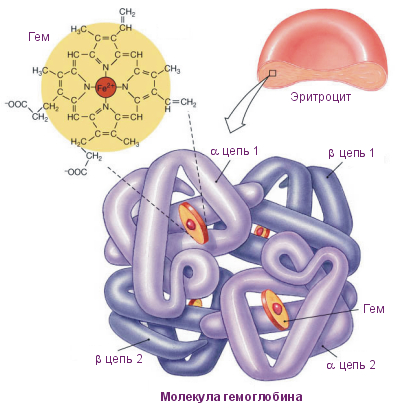
Анемия – синдром, характеризующийся резким уменьшением количества гемоглобина в крови. Как известно, благодаря гемоглобину происходит перенос кислорода от легким к тканям. Гемоглобин, в свою очередь, входит в состав красных кровяных телец – эритроцитов, синтезирующихся в костном мозге из гемопоэтических стволовых клеток.
При апластической анемии костный мозг прекращает производство новых эритроцитов или резко снижает их выработку. Связано это с уменьшением количества гемопоэтических стволовых клеток или с нарушением их функциональности.
Обычно снижается выработка не только эритроцитов, но и иммунных клеток – лейкоцитов, а также тромбоцитов, отвечающих за свертывание крови. Возникает состояние, которое называется пангемоцитопенией. Таким образом, при апластической анемии прекращается или серьезно снижается выработка всех основных клеток крови, что представляет серьезную угрозу для жизни. Ведь эритроциты живут в крови всего три месяца, тромбоциты – 1-2 недели, а лейкоциты – не больше дня.
Эпидемиология
Апластическая анемия – редкое заболевание. В среднем заболевает 1 человек из 500 тысяч в год. Анемия может поразить человека в любом возрасте. Но основная часть заболевших – дети и молодые люди (от 10 до 25 лет) или пожилые люди старше 60 лет. Женщины и мужчины болеют с одинаковой частотой.
Разновидности
Апластическая анемия подразделяется на врожденную (появившуюся с рождения) и приобретенную. Если причины апластической анемии неизвестны, то речь идет об идиопатической анемии. Такая ситуация наблюдается у половины больных. Иногда останавливается только синтез новых эритроцитов, а другие клетки крови синтезируются в прежнем объеме. Этот тип заболевания называется парциальной гипопластической анемией.
Одной из разновидностей врожденной апластической анемии является анемия Фанкони. Она проявляется уже в детском возрасте и обусловлена генетическими отклонениями. Кроме анемии, у детей с такими отклонениями наблюдаются недоразвитость конечностей, микроцефалия, небольшой рост, нарушения слуха и другие дефекты развития. Другие врожденные апластические анемии – анемия Эстрена-Дамешека и анемия Даймонда-Блекфена.
В зависимости от длительности течения анемия делится на острую (до 1 месяца), подострую (1-6 месяцев) и хроническую (более 6 месяцев) формы.
Пара слов о приобретенной апластической анемии
Эта апластическая анемия встречается чаще, чем врожденная. От этой страшной болезни не застрахован никто. Причем часто причины ее появления не удается установить. В других случаях причиной приобретенной анемии могут быть отравления токсинами, облучение.
Не исключено, что за возникновением приобретенной апластической анемии стоят аутоиммунные процессы. Например, вирусная инфекция приводит к тому, что иммунные клетки атакуют вместо вирусов клетки костного мозга, В результате происходит угнетение функций этого органа. Некоторые исследования возлагают ответственность за этот процесс на T-лимфоциты, которые производят цитокины (фактор некроза опухоли и гамма-интерфероны), угнетающие кроветворение.
Причины возникновения
Не всегда удается установить причину возникновения болезни, то есть, она имеет идиопатический характер. Иногда апластическая анемия имеет наследственные механизмы развития. Однако часто анемия возникает у здоровых людей под воздействием следующих факторов:
- отравления токсинами (бензол и другие ароматические углеводороды, соединения мышьяка, пестициды и инсектициды, соли тяжелых металлов);
- радиационное облучение;
- прием лекарств (антибиотики, анальгин, препараты золота, НПВП, хлорпромазин, метотрексат);
- химиотерапия и лучевая терапия;
- вирусные инфекции (заражение цитомегаловирусом, вирусом Эпштейна-Барра и ВИЧ, грипп, парагрипп, корь, краснуха, корь, свинка, вирусные гепатиты А, В, С, D);
- злоупотребление алкоголем;
- аутоиммунные заболевания;
- туберкулез.
Механизмы, которые вызывают повреждение костного мозга при взаимодействии с химикатами и лекарственными препаратами, пока что неясны. Иногда, возможно, они оказывают прямое токсическое воздействие, а в других случаях – косвенное, через аутоиммунные реакции.
Часто возникает апластическая анемия и после вирусных гепатитов. Обычно это явление наблюдается спустя полгода после острого периода гепатита. Это, возможно, связано с тем, что репликация вируса иногда происходит в клетках, вырабатываемых в костном мозге. В результате запускается аутоиммунный процесс, поражающий этот орган.
Иногда после ликвидации провоцирующего фактора функции костного мозга восстанавливаются (например, после отмены препарата). Однако чаще такого не происходит.
Из лекарственных препаратов наибольшую опасность представляют антибиотик хлорамфеникол (Левомицетин) и сильнодействующее средство, принадлежащее к классу НПВП – фенилбутазон (Бутадион). Апластическая анемия возникает у одного из 20000 человек, принимающих хлорамфеникол и у одного из 40000, принимающих фенилбутазон. Прием этих препаратов увеличивает вероятность заболевания апластической анемией в 10 раз. Чаще всего анемия, вызванная этими препаратами, наблюдается у детей 3-7 лет. Поэтому во многих странах хлорамфеникол и фенилбутазон применяются системно только при отсутствии альтернатив.
В некоторых случаях возникновение гипопластической анемии было обусловлено многократным приемом или передозировкой препаратов. Такие препараты, как метотрексат, циклофосфан вызывают зависимое от дозы угнетение костного мозга, которое быстро проходит после их отмены. В других случаях достаточно однократного использования препарата в дозе, не превышающей терапевтическую. Возможно, здесь играют роль генетические дефекты клеток костного мозга, негативное влияние других препаратов. Существует и другая теория – сенсибилизация организма малыми дозами антибиотиков или НПВП, попадающих в организм с молоком (от получавших данные лекарственные препараты коров).
Симптомы
Симптомы апластической анемии связаны с недостатком трех основных компонентов крови – эритроцитов, лейкоцитов и тромбоцитов. Недостаток эритроцитов приводит к гипоксии тканей, недостаток лейкоцитов – к снижению иммунитета, недостаток тромбоцитов – к появлению кровотечений, которые трудно остановить.
Основные анемические симптомы болезни:
- слабость,
- вялость,
- сонливость или бессонница,
- постоянная усталость,
- шум или звон в ушах,
- обмороки,
- головокружение,
- «мушки» перед глазами,
- боли в области сердца,
- раздражительность,
- одышка при незначительной нагрузке или в покое,
- бледность или желтушность кожи,
- плохой аппетит,
- тахикардия,
- головные боли,
- гипотония,
- нарушения внимания и памяти.
Геморрагические проявления болезни:
- повышенная кровоточивость десен;
- частые носовые кровотечения;
- точечные кровоизлияния;
- гематомы на коже, появляющиеся спонтанно или после небольшого физического воздействия;
- обильные менструации и маточные кровотечения у женщин;
- кровь в моче;
- неостанавливаемые кровотечения при ранениях;
- желудочно-кишечные кровотечения;
- внутриглазные кровотечения.
Проявления синдрома лейкоцитопении:
- повышенная подверженность инфекционным болезням (особенно инфекциям верхних дыхательных путей и полости рта);
- инфекционные болезни имеют тенденцию к более тяжелому протеканию и развитию осложнений;
- инфекционные воспаления на коже, фурункулез;
- стоматиты;
- беспричинное повышение температуры тела;
- очаги инфекции во внутренних органах (пневмонии, циститы).
Иногда наблюдается увеличение печени и селезенки, хотя в целом для апластической анемии это явление нехарактерно.
При анализе крови выявляется снижение всех основных клеток крови (лейкоцитов, эритроцитов и тромбоцитов). Однако у разных больных отдельные элементы крови снижены не в одинаковой степени. Абсолютное количество лимфоцитов обычно не снижено или незначительно снижено, а относительно других клеток крови даже повышено. Цветовой показатель обычно равен единице. СОЭ резко повышена (до 40-60 мм/ч). Гистологическое исследование костного мозга показывает увеличение в нем доли жировой ткани (до 90%).
Возможные осложнения:
- сепсис,
- бактериальный эндокардит,
- сердечная и почечная недостаточность.
Также апластическая анемия негативно влияет на работу почек, печени, ЖКТ.
Прогноз
Прогноз болезни обычно серьезный. Апластическая анемия может развиваться очень быстро, в течение нескольких месяцев приводя к смерти пациента. Непосредственной причиной смерти чаще всего бывают кровоизлияния во внутренние органы, реже – тяжелые инфекционные болезни и анемическая кома. В других случаях может наблюдаться ремиссия, которая часто сменяется очередным обострением.
Чем моложе пациент, тем благоприятнее для него прогноз. Кроме того, прогноз зависит от степени угнетения функций косвенного мозга, и от того, насколько хорошо апластическая анемия поддается лечению. При правильном лечении ремиссия достигается у половины больных. При тяжелой форме анемии и проведении только симптоматической терапии вероятность прожить год для больного составляет всего 10%. При пересадке костного мозга пятилетняя выживаемость составляет 80%.
Диагностика анемии
При появлении симптомов, характерных для апластической анемии, необходимо обратиться к терапевту. Однако лечение анемии осуществляется гематологом. Кроме того, при осложнениях понадобятся консультации других врачей – инфекциониста, отоларинголога, гинеколога, стоматолога.
Гипопластическую анемию необходимо дифференцировать от других болезней крови, прежде всего, от мегалобластных анемий, миелодиспластического синдрома, острого лейкоза. Для определения апластической анемии часто бывает достаточно общего анализа крови, который показывает дефицит ее основных компонентов. Для оценки состояния костного мозга делается его биопсия. С этой целью из грудинной кости забирается образец и исследуется под микроскопом. При апластической анемии количество кровяных клеток в костном мозге снижено, а часть мозга оказывается заполненной заместительной жировой тканью.
При аускультации определяются шумы в сердце, а тона сердца приглушены.
Лечение
Лечение апластической анемии – непростое дело, которое не всегда завершается успехом. При лечении используются в основном терапевтические методы, реже – хирургические.
Лечение нередко проводится в стационаре, где больным создаются условия, предохраняющие их от инфицирования патогенной микрофлорой.
Основные направления лечения анемии:
- этиологическое,
- патогенетическое,
- симптоматическое.
Если известен конкретный фактор, вызвавший заболевание (прием лекарств, контакт с токсинами, радиотерапия), то иногда для выздоровления достаточно избавиться от его воздействия.
При гипопластической анемии назначаются следующие типы препаратов:
- глюкокортикостероиды (метилпреднизолон),
- андрогены,
- анаболические стероиды,
- иммуносупрессоры,
- стимуляторы костного мозга,
- гемостатики (при выраженном геморрагическом синдроме).
Препараты из класса андрогенов и анаболических стероидов стимулируют кроветворение. Однако они требуют длительного приема – в течение месяцев или даже лет. Побочные эффекты андрогенов – дисфункции печени и маскулинизация у женщин.
Препараты-иммуносупрессоры подавляют иммунитет. Они применяются в том случае, если известно, что анемия вызвана аутоиммунными процессами, и при отсутствии эффекта от других групп препаратов. Из этой группы препаратов часто используются Циклоспорин А, антитимоцитарный глобулин. Лечение иммуносупрессорами, однако, имеет один серьезный недостаток – увеличение вероятности развития инфекций. Иммуносупрессоры больше подходят для терапии анемии легкой и средней тяжести.
Глюкокортикостероиды также продемонстрировали свою эффективность при болезни. Они используются при анемии аутоиммунной этиологии. Однако их всегда назначают в сочетании с иммунносупрессорами или анаболиками.
Стимуляторы костного мозга – очень дорогие препараты, что обусловлено сложностью их получения. К этой категории относятся:
- сарграмостим,
- филграстим,
- пэгфилграстим,
- эпоэтин-альфа.
Эти препараты часто применяют совместно с иммуносупрессорами.
Больные анемией чаще подвержены инфекционным заболеваниям. Даже простое ОРЗ может стать для пациента фатальным. Поэтому больным для терапии и профилактики таких осложнений могут назначаться антибиотики, противовирусные и противогрибковые средства. Для профилактики инфекций используются промывания полости рта антисептическими составами.
Другой способ терапии болезни – переливание эритроцитарной или тромбоцитарной массы.
Показания к переливанию:
- выраженный анемический синдром,
- гипоксия мозга,
- гемодинамические нарушения.
При этом необходимо стремиться к тому, чтобы уровень гемоглобина был бы не ниже 80 г/л. Однако эти методы дают только временный эффект. Кроме того, при помощи переливаний крови невозможно заместить лейкоциты, поскольку продолжительность их жизни слишком мала. При переливании крови необходимо учитывать и то, что она содержит железо. Частые переливания эритроцитарной массы приводят к накоплению железа в организме. Поэтому необходимы препараты, ускоряющие вывод железа.
Чаще всего к смерти больных анемией приводят кровоизлияния. Чтобы их избежать, больному запрещаются физические нагрузки, прием НПВП и ацетилсалициловой кислоты. Женщинам для предотвращения кровотечений во время месячных показаны препараты – ингибиторы овуляции.
При анемии необходимо как можно чаще отдыхать, избегать перенапряжений. Для защиты от инфекций требуется усилить меры личной гигиены, избегать контактов с зараженными людьми.
Хирургические методы при гипопластической анемии используется редко. В некоторых случаях помогает удаление селезенки – органа, где разрушаются эритроциты.
Трансплантация костного мозга
Этот метод заключается в заборе гемопоэтических стволовых клеток донора и добавлении их в кровь к пациенту. В дальнейшем они мигрируют в костный мозг и начинают функционировать вместо стволовых клеток хозяина.
Этот способ наиболее эффективен, и доля ремиссий после пересадки костного мозга наивысшая (75-90%). Чем моложе донор и реципиент, тем выше вероятность успеха.
Для пересадки необходимо выбрать донора, чьи ткани были совместимы бы с тканями больного анемией по генетическим показателям. Лучше всего для этой цели использовать костный мозг однояйцевого близнеца. Меньше подходит донорский материал от обычных братьев и сестер. Если совместимость отсутствует, может произойти отторжение трансплантата.
Чтобы этого не произошло, больному анемией предварительно назначают препараты – иммуносупрессоры. Также перед трансплантацией костного мозга необходимо уничтожить остатки старого костного мозга при помощи облучения. После операции больному также назначается препараты-иммуносупрессоры.
Иногда после трансплантации возможно возвращение пациента к нормальной жизни. Однако не исключены и рецидивы заболевания. В среднем время между пересадкой и рецидивом составляет 5 лет. Недостаток трансплантации – высокая цена процедуры.
 Клетки организма погружены в жидкую среду, откуда черпают все, что требуется для пластических и энергетических реакций, и куда выделяют конечные и промежуточные метаболиты. Циркуляция крови, лимфы обеспечивает гуморальную интеграцию организменных систем.
Клетки организма погружены в жидкую среду, откуда черпают все, что требуется для пластических и энергетических реакций, и куда выделяют конечные и промежуточные метаболиты. Циркуляция крови, лимфы обеспечивает гуморальную интеграцию организменных систем.
Содержание
- Анемия
- Миеломная болезнь
- Лейкоз
- Геморрагический диатез
- Лимфаденит
- Лимфаденопатия
- Лимфогранулематоз
Кровь — сбалансированная (в норме) полидисперсная система. Основными ее компонентами являются клеточные элементы (около 46% объема): эритроциты, лейкоциты, тромбоциты; электролиты; органические осмолиты (в основном белковой природы); вода. Физический, химический, клеточный состав крови и лимфы отражает происходящие в органах и тканях процессы и влияет на них.
Анемия
Снижение концентрации гемоглобина (анемия) может быть следствием заболевания крови либо симптомом других патологий. Причина анемического синдрома — снижение способности крови транспортировать кислород и углекислый газ.
Эти газы диффундируют через мембрану эритроцитов, реагируя с гемоглобином. Направление диффузии определяется парциальным давлением газов в легочных альвеолах и тканях организма.
Основые симптомы
Мишенью патологии при анемии становятся как сами эритроциты, так и содержащийся в них гемоглобин. Поскольку анемический синдром имеет неспецифический характер, для адекватного лечения необходимо выяснить причину симптоматики:
- бледный цвет кожных покровов, визуально доступных слизистых;
- дизорексия;
- тиннитус;
- мушки перед глазами;
- утомляемость;
- неустойчивость настроения, раздражительность;
- снижение когнитивных функций;
- головокружения;
- синкопе;
- диспноэ;
- физикальные изменения со стороны сердца (расширение границ, приглушенность тонов, тахикардия, систолический шум).
В большинстве случаев источник этих симптомов — железодефицитная анемия — одно из самых массовых заболеваний человечества, развивающаяся при геморрагиях, нарушениях всасывания железа в пищеварительном тракте, недостаточности получения железа с пищей.

При анемии происходит снижение способности крови транспортировать кислород и углекислый газ
Дефициту железа присуща сидеропеническая симптоматика: глоссит; истончение и вогнутость ногтей; дисфагия; слабость мышц; атрофический гастрит; извращение вкуса; трещины в углу рта.
Причины разных видов анемии
Более редкие варианты анемий могут быть обусловлены:
- Нарушением метаболизма порфирина (например, при отравлении свинцом, недостатке витамина B6, генетических аномалиях).
- Наследственным или приобретенным нарушением транскрипции ДНК в мегалобластах (например, при дефицитах витаминов B12, B9).
- Гемолизом из-за дефектов мембраны (сфероцитоз, эллиптоцитоз, стоматоцитоз, пиропойкилоцитоз, акантоцитоз); снижения активности внутриэритроцитарных энзимов; аутоиммунных реакций; дефицита витамина Е.
- Нарушением синтеза и структуры белковой части гемоглобина из-за хромосомных дефектов (талассемии, гемоглобинопатии). Например, при серповидно-клеточной анемии генная мутация приводит к синтезу патологического гемоглобина с дефектами растворимости.
- Механическим травмированием эритроцитов (при протезировании сосудов, сердечных клапанов).
- Угнетением кроветворения в костном мозге (апластическая анемия).
Клиническая картина так же вариабельна, как и виды анемий. Это же относится и к спектру терапевтических мероприятий: от диетотерапии до пересадки костного мозга.
Миеломная болезнь
Злокачественное лимфопролиферативное поражение В-лимфоцитов (лимфома) составляет около 10% онкологических заболеваний крови и развивается вследствие:
- Воздействия ионизирующей радиации. Повышенная частота лимфом наблюдается у жителей Японии, выживших после ядерной бомбардировки.
- Мутагенного эффекта химических веществ: асбеста, производных бензола, инсектицидов.
- Истощения иммунитета при длительных хронических воспалениях.
- Генетической предрасположенности. Патология более вероятна, если заболели близкие родственники.
Симптомокомплекс (лихорадка, истощение, потливость) развивается по мере роста лимфомы с поражением тканей внутренних органов. У подавляющего большинства больных (до 90%) ведущим признаком являются оссалгии.

Миеломная болезнь — злокачественное лимфопролиферативное поражение В-лимфоцитов
Наблюдаются деформации костей, опухания, спонтанные переломы, миалгии, гепато- и спленомегалия, амилоидоз, иммунодефицит, анемия, сенсорная нейропатия. Летальный исход при лимфоме чаще всего наступает вследствие почечной недостаточности.
Характерную картину деструктивно-остеопоротического процесса («симптом пробойника», «рыбьи позвонки») дает рентгенологический анализ. Верификация диагноза делается методами цитологического и гистологического исследования, которые обнаруживают миеломную пролиферацию; иммуноферментным определением патологических иммуноглобулинов.
Лечение миелоидной болезни проводится методами химиотерапии, лучевой терапии. Патологические белки удаляются плазмаферезом. Спектр симптоматической терапии направлен на коррекцию метаболизма кальция, своевременное лечение и профилактику инфекций и анемии.
Лейкоз
Опухоли гемопоэтической ткани (лейкоз, лейкемия, рак крови) с нерегулируемым размножением и нарушением дифференцировки ростка белой крови выделены как отдельное заболевание в XIX веке. У детей в большинстве случаев поражается лимфоидный росток кроветворения; у взрослых — миелоидный.

Механизм формирования на клеточном уровне миелодиного и лимфоидного лейкоза
Утрата контроля над пролиферативным циклом связана с хромосомными (транслокации) и генными (мутации) нарушениями.
Симптоматика развивается из-за накопления опухолевой массы, заполнения бластами печени, кожи, мозговых оболочек, лимфоузлов и других органов и тканей.
Дебют лейкемии сопровождается общим недомоганием, вялостью, бледностью, анемическим синдромом. Костный мозг, переполненный бластами, дает о себе знать артралгиями. Также характерны общемозговые и очаговые проявления (цефалгия, рвота, жажда, полиурия, судороги, парезы, диссомнии, зрительные расстройства), болевой синдром со стороны печени; поражение периферической нервной системы (радикулопатия).
Увеличение органов, накапливающих бласты, приводит к симптоматике сдавления, диспноэ. У больного поражаются десны (язвенно-некротический стоматит), кожа (лейкемиды). Иммунодефициты и эндогенные интоксикации, вызваны угнетением гемопоэза, язвенно-некротическими поражениями с присоединением инфекций.
Дефицит синтеза факторов свертывания крови при поражении печени проявляется в геморрагиях (петехии, спонтанные кровотечения). До 20% больных умирают вследствие геморрагий. Диагноз ставится на основании данных цитологического, цитохимического, иммунологического анализа, который демонстрирует отклонения в содержании форменных элементов крови, увеличение количества бластов.
Современные методы лучевой и химиотерапии, трансплантация костного мозга позволяют надеяться на хороший прогноз. С возрастом шансы благоприятного исхода уменьшаются.
Геморрагический диатез
Клинические картины этой группы заболеваний включают сложно останавливаемые кровотечения, кровоизлияния. У больных появляются беспричинные синяки; симптом «шкуры леопарда»; эритроматозная сыпь, подверженная некрозам; макулопапулы, петехии.

На фото проявления геморрагического диатеза
Помимо кожных проявлений наблюдается абдоминальный, суставной, почечный синдромы.
Нарушения системы гемостаза (геморрагические диатезы) могут быть обусловлены:
- заболеваниями сосудов (васкулит; эндотелиоз; авитаминозы С, К; телеангиоэктазия);
- тромбоцитопенией, тромбоцитопатией;
- наследственными и приобретенными дефицитами факторов свертывания крови, гемофилиями;
- действием антикоагулянтов.
Терапевтические мероприятия определяются этиологией и патогенезом геморрагического синдрома. Например, это может быть использование трансфузионной терапии, концентратов факторов свертывания крови, криопреципитата (при гемофилиях); иммуноглобулиновой терапии, стероидов, спленэктомии, цитостатиков (при тромбоцитопении иммунного генеза); диетотерапии (при авитаминозах).
Лимфаденит
Воспаление ткани лимфатических узлов обычно является следствием бактериальной активности. Основная задача лимфоузлов, в которых сконцентрированы лимфоциты и фагоциты — создавать барьер транспортировке инфекционных агентов.

При лимфадените происходит воспаление ткани лимфатических узлов
Симптомы воспаления лимфоузлов включают:
- Цефалгию, слабость, повышение температуры.
- Признаки нагноения: болезненность и гиперемия в зоне узла, снижение подвижности (спаивание) узлов. Гнойный лимфаденит сопровождается лихорадкой, ознобом, тахикардией.
Лимфаденит сопровождается увеличением лимфоузлов, которое определяется пальпацией. Однако само по себе увеличение узла может свидетельствовать и о том, что узел является «трудоголиком», активно очищая кровь после инфекций или на их фоне. Терапия лимфаденита направлена на устранение причины, его вызвавшей (инфекции). Значительно пораженные лимфоузлы приходится удалять.
Лимфаденопатия
Лимфаденопатия (увеличение лимфоузлов) — не самостоятельная нозологическая форма, а синдром, который может появиться вследствие:
- инфекции;
- опухоли;
- приема лекарственных препаратов (антигипертензивных, противосудорожных, антибиотических);
- аутоиммунных процессов.
Диагностические мероприятия включают выявление специфических антител, полимеразную цепную реакцию, серологические методы, биопсию лимфоузла, инструментальные исследования (УЗИ, компьютерная томография с контрастированием, МРТ).

На фото лимфаденопатия — увеличение лимфатических узлов
Выявить причину помогает и локализация увеличенного узла. Например, инфекции кожи головы, краснуха сопровождаются увеличением затылочных узлов. Увеличение узлов в зоне ключицы может свидетельствовать о новообразованиях (метастазы; лимфомы в грудной клетке или животе).
Паховые, подколенные узлы увеличиваются при грибковых инфекциях, травмах нижних конечностей. При лимфаденопатии распространена практика приема антибиотиков. Однако этот подход эффективен только при бактериальной природе синдрома.
Лимфогранулематоз
Опухолевая патология лимфатической системы с развитием патологической ткани (гранулемы) в лимфоузлах была описана А.Л. Ходжкиным в 1832 году. Первым признаком заболевания является увеличение лимфоузлов (обычно шейных).

Лимфогранулематоз — опухолевая патология лимфатической системы
Далее патологический процесс распространяется на другие внутренние органы (в 30% случаев основной мишенью является селезенка), обуславливая клиническую симптоматику:
- повышение температуры;
- потливость (в ночное время);
- снижение массы тела;
- боли в костях;
- неврологические расстройства;
- симптомы сдавления: асфиксия, желтуха, непроходимость кишечника;
- иммунный дефект (подверженность инфекциям).
Летальный исход обусловлен дыхательной, сердечной, почечной, печеночной недостаточностью, расстройством белкового обмена.
Методами лечения являются лучевая и химиотерапия. При рецидивирующем локальном лимфогрануломатозе, доступном хирургическому вмешательству, делается экстирпация лимфоузлов.
Лимфосаркома
Мутагены могут вызвать злокачественные изменения в лимфоцитах, расположенных в лимфоузлах, нарушив процессы их пролиферации и дифференцировки. В результате лимфоузлы и другие органы заполняются опухолевыми массами.
Первый симптом — увеличение лимфоузлов в зоне шеи, подмышек, гортани, крестца. Наблюдаются потеря аппетита, ночная потливость, спленомегалия.
Для диагностики делается анализ биоптата лимфоузлов, кожи, легких, печени и других органов, где может локализоваться опухоль. Основными методами лечения являются лучевая и химиотерапия, пересадка костного мозга, спленэктомия.