Лабораторная диагностика анемий клинические рекомендации
В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
В настоящей публикации на основании данных литературы и анализа собственных наблюдений представлены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий, а также принципы их лечения у детей. Установлено, что основной формой дефицитных анемий (ДА) в педиатрической популяции является анемия, обусловленная недостаточным содержанием в организме железа. При этом особо подчеркивается, что железодефицитная анемия (ЖДА) не только наиболее распространенная ДА, но и самое частое гематологическое заболевание у детей [1–3]. С учетом того, что другие типы анемий (в т. ч. развивающиеся при дефиците таких витаминов, как фолиевая кислота и В12) хуже известны врачам-педиатрам, их верификация, как правило, запаздывает, т. к. они ошибочно принимаются за ЖДА. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма и ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения дифференциальной диагностики и лечения анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Дифференциальная диагностика ДА у детей
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).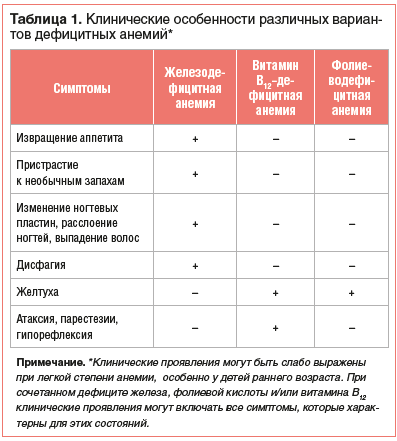
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).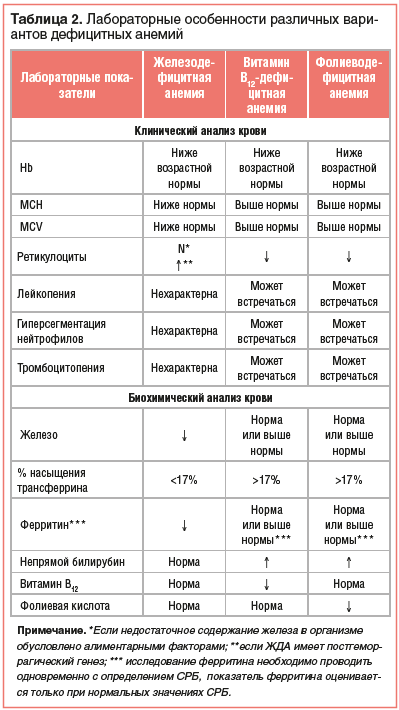
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Лечение ДА у детей
Корректная трактовка клинико-анамнестических данных и результатов лабораторного обследования позволяет верифицировать причину ДА и своевременно назначить адекватную терапию. Принципиально важным при этом является положение о том, что компенсировать дефицитные состояния невозможно только за счет нормализации рациона питания. Основная роль в купировании дефицита железа, фолиевой кислоты и витамина В12 принадлежит заместительной фармакотерапии [1–7]. При этом для лечения ЖДА используются солевые препараты железа или препараты на основе железа гидроксид полимальтозата. Суточная доза препаратов зависит от массы тела и возраста ребенка, расчет при этом проводится по элементарному железу. Так, для солевых препаратов железа, назначаемых внутрь, используются следующие дозы (расчет по элементарному железу!): для детей до 3 лет — 3 мг/кг/сут, для детей старше 3 лет — 45–60 мг/сут, для подростков —
до 120 мг/сут. При использовании пероральных форм железа гидроксид полимальтозата рекомендованные дозы составляют 5 мг/кг/сут (расчет по элементарному железу!). Продолжительность терапии препаратами железа зависит от степени тяжести ЖДА. При легкой ЖДА курс лечения составляет 3 мес., при среднетяжелой форме — 4,5 мес., при тяжелой — до 6 мес. [3].
В случае диагностики фолиеводефицитной анемии заместительная терапия проводится препаратами фолиевой кислоты. Рекомендовано использовать следующие суточные дозы фолиевой кислоты: для детей до 1 года — 0,25–0,5 мг/сут, для детей старше 1 года — 1,0 мг/сут. При синдроме мальабсорбции доза может быть повышена до 5–15 мг фолиевой кислоты в сутки. Терапия проводится в указанных дозах ежедневно на протяжении 4–6 нед. Через 7 дней от начала лечения необходимо выполнить клинический анализ крови с обязательным подсчетом ретикулоцитов (рис. 1). Повышение уровня ретикулоцитов на фоне приема фолиевой кислоты указывает на правильно установленный диагноз и является обоснованием для продолжения терапии. Купирование анемии достигается через 4–6 нед. от начала лечения [6].
Для лечения витамин В12-дефицитной анемии используют препараты цианокобаламина для парентерального введения. При этом рекомендовано придерживаться следующего режима дозирования: для детей до 1 года — 5 мкг/кг/сут, для детей старше 1 года — 100 мкг/сут, для подростков — 200 мкг/сут. Препарат вводится внутримышечно 1 р./сут ежедневно. На 7–10-й день терапии проводят клинический анализ. Выявление ретикулоцитоза позволяет сделать вывод об эффективности проводимого лечения. Терапию следует продолжить в том же режиме дозирования еще в течение 3–4 нед. В дальнейшем, при достижении нормализации уровня гемоглобина, переходят на поддерживающее лечение: цианокобаламин вводят в терапевтической дозе 1 раз в 7 дней в течение 2 мес., а затем 1 раз в 14 дней в течение 6 мес. (рис. 2). Учитывая, что дефицит витамина В12, как правило, редко обусловлен алиментарными факторами, одновременно проводят поиск причин данного патологического состояния (болезнь Крона, целиакия, инвазия широким лентецом, наследственные нарушения всасывания и/или транспортировки витамина В12 и др.) [7]. В тех случаях, когда имеют место полидефицитные состояния с развитием анемического синдрома, оправданно комбинированное заместительное лечение. Чаще всего у детей встречается сочетанный дефицит железа и фолиевой кислоты, что требует одновременного назначения препаратов железа и фолиевой кислоты.
Заключение
Таким образом, выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. Своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка. Авторы выражают надежду, что информация, представленная в настоящей публикации, будет полезна практикующим врачам-педиатрам.
Железодефицитная анемия (ЖДА) представляет собой клинико–гематологический синдром, возникающий при развитии дефицита железа вследствие различных патологических (физиологических) процессов и характеризующийся снижением уровня гемоглобина (в меньшей степени эритроцитов) наряду с клиническими признаками анемии и сидеропении.
Клинические рекомендации ведения больных ЖДА включают: – выявление причины ЖДА и при необходимости – ее коррекция; – обучение больных ЖДА; – принятие решения о назначении лекарственных препаратов железа (ПЖ); – выбор лекарственного ПЖ; – путь введения ПЖ (внутрь или парентерально); – длительность лечения и необходимость поддерживающей терапии; – контроль переносимости ПЖ и коррекция при плохой переносимости; – оценку эффективности и выявление причин отсутствия или недостаточного эффекта; – коррекцию выявленных причин неэффективности.
Выявление причины ЖДА и возможности ее коррекции
После верификации железодефицитного характера анемии, т.е. синдрома ЖДА, необходимо выявление причины, лежащей в основе данного варианта анемического синдрома (нозологическая диагностика). Для клинициста этот этап является не менее важным и вместе с тем наиболее трудным и ответственным, поскольку в основе имеющейся ЖДА могут лежать потенциально курабельные заболевания. Наличие в МКБ–10 рубрики «Железодефицитная анемия неуточненная» оставляет для врача «лазейку» в случаях отсутствия явной причины анемии, «освобождая» его от тщательности и углубления диагностического поиска на этапе нозологической диагностики. Следует особо подчеркнуть роль врача–интерниста на этапах синдромной и нозологической диагностики, поскольку подавляющее большинство больных ЖДА (независимо от конкретной причины) обращаются прежде всего, как и многие другие пациенты, к терапевту, а не к гематологу или другому специалисту. При выявлении причины ЖДА лечение должно быть направлено на устранение этой причины (по возможности) или коррекцию имеющихся нарушений – лечение эрозивно–язвенных процессов в желудке, оперативные лечения при опухолях ЖКТ, миоме матки, лечение энтеритов, коррекция алиментарной недостаточностии т.д.
Обучение больных
Существенным компонентом ведения больных ЖДА является повышение их образовательного уровня в отношении данной патологии, создание мотивации к лечению, вовлечение пациентов в контроль за своим состоянием и лабораторными показателями. Необходимо разъяснение сущности ЖДА, причин ее возникновения, реальных возможностей коррекции дефицита железа и нормализации уровня гемоглобина. Особое значение имеют обучающие программы у беременных женщин с наличием ЖДА и пациенток, страдающих меноррагиями. У беременных должна создаваться мотивация необходимости коррекции дефицита железа с целью предотвращения недостатка железа у плода. Больные должны быть осведомлены о возможных побочных эффектах при лечении лекарственными препаратами железа, необходимости соблюдения врачебных назначений, в том числе и регулярности приема ПЖ. Следует обязательно указать на недопустимость попыток коррекции дефицита железа с помощью различных пищевых продуктов, а также на строгие показания к назначению инъекционных форм ПЖ.
Принятие решения о назначении лекарственных препаратов железа
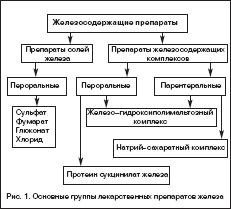
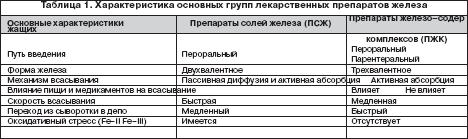
Всем больным ЖДА показана патогенетическая терапия препаратами железа. Следует подчеркнуть ошибочность мнения о возможности коррекции дефицита железа с помощью пищевых продуктов с высоким содержанием железа, что является одним из мифов в представлениях о ведении больных ЖДА. Об этом должны быть осведомлены больные, что следует считать важным образовательным компонентом ведения данной категории пациентов. Разумеется, пища должна быть богата продуктами, содержащими железо. Однако следует иметь в виду неодинаковую степень всасываемости железа из различных продуктов. Так например, железо, содержащееся в мясе в виде гема, всасывается на 40–50%, в то время как из растительных продуктов, овощей, фруктов всасывается всего 3–5% содержащегося в них железа. Поэтому средством выбора для коррекции дефицита железа и уровня гемоглобина у больных ЖДА являются лекарственные препараты железа. На фармацевтическом рынке России в настоящее время имеется большой арсенал ПЖ в различных лекарственных формах, с неодинаковым содержанием в них железа, наличием дополнительных компонентов, влияющих на биодоступность железа, различной стоимостью (рис. 1). Из ПСЖ железо всасывается в двухвалентной форме, в последующем превращается в трехвалетное, которое связывается с трансферрином и используется для построения молекулы гемоглобина. В ПЖК железо находится в трехвалентной форме и всасывается как бы в готовом виде. В ПЖК, в частности, в гидрооксиполимальтозном комплексе, связано как в физиологическом состоянии в молекуле ферритина. Существуют различия в механизмах всасывания железа из ПСЖ и ПЖК. Всасывание железа из ПСЖ происходит главным образом в виде пассивной диффузии согласно градиенту концентрации и в меньшей степени активно, в то время как абсорбция железа из ПЖК является активным процессом в виде конкурентного обмена. Это ведет к различному уровню железа в сыворотке, объему распределения, константам элиминации после абсорбции. Всасывание железа из ПЖК и нарастание его концентрации в сыворотке происходит медленно, но оно быстро поступает в запасы. При применении ПСЖ могут возникать нарушения окислительных процессов (оксидативные повреждения) вследствие превращения ионов двухвалентного железа в трехвалентное, которое соединяется с трансферрином и включается в молекулу гемоглобина. При окислении образуются свободные радикалы, которые вызывают клеточные повреждения, такие как перекисное окисление липидов, нарушение структуры мембранных и клеточных белков, повреждение клеточной ДНК и РНК. ПЖК в отличие от ПСЖ не вызывают «оксидативного стресса», поскольку ионы железа не меняют свою валентность в процессе всасывания (табл. 1). Для лучшей абсорбции ПСЖ рекомендуется принимать за час до еды т.е. на пустой желудок, что может вызывать нарушения со стороны желудка, кишечника и другие побочные эффекты. Современные технологии производства препаратов железа позволяют производить ПСЖ с замедленным высвобождением железа в тонком кишечнике, что уменьшает токсическое воздействие ионов железа на слизистую желудка. Частота побочных эффектов при лечении ПЖК меньше по сравнении с ПСЖ, что обеспечивает лучший комплайенс больных ЖДА. ПСЖ взаимодействуют с некоторыми пищевыми продуктами (танин, фитаты, соли кальция) и медикаментами (пленкообразующие препараты, тетрациклины, препараты кальция), снижающими биодоступность железа. В связи с этим ПСЖ не следует принимать одновременно с указанными пищевыми продуктами и лекарственными препаратами. В то же время пища и медикаменты не оказывают влияния на всасывание железа из ПЖК. Темпы прироста показателей гемоглобина при применении ПСЖ и ПЖК примерно одинаковые.
Путь введения препаратов железа
В большинстве случаев для коррекции дефицита железа при отсутствии специальных показаний ПЖ следует назначать внутрь. Путь введения ПЖ у больных ЖДА определяется конкретной клинической ситуацией, в частности, состоянием кишечного всасывания и переносимостью пероральных ПЖ.
Основными показаниями для парентерального введения ПЖ являются: – патологии кишечника с нарушением всасывания (различные энтериты, синдром недостаточности всасывания); – резекция тонкой кишки; – резекция желудка по Бильрот II с формированием «слепой петли»; – эрозивно–язвенные процессы в желудке (обострение язвенной болезни и др.); – непереносимость ПЖ для приема внутрь. Многие врачи обосновывают назначение парентеральных ПЖ выраженностью анемического синдрома в расчете на якобы больший их эффект, что также не имеет достаточных оснований и не подтверждается клинической практикой. Темпы прироста уровня гемоглобина при назначении ПЖ внутрь и парентерально оказались приблизительно одинаковыми, в связи с чем предпочтение ПЖ в инъекционных формах при необходимости более быстрой нормализации содержания гемоглобина (например, при подготовке к оперативному вмешательству) следует считать неоправданным. ПЖ для парентерального введения могут назначаться при плохой переносимости пероральных ПЖ, однако большинство современных ПСЖ и ПЖК переносятся сравнительно удовлетворительно. В связи с этим принятие решения о назначении парентерального ПЖ должно осуществляться только после ряда «врачебных маневров» (снижение дозы ПЖ, прием вместе с пищей, смена ПЖ для приема внутрь и т.д.).
Выбор лекарственного препарата железа
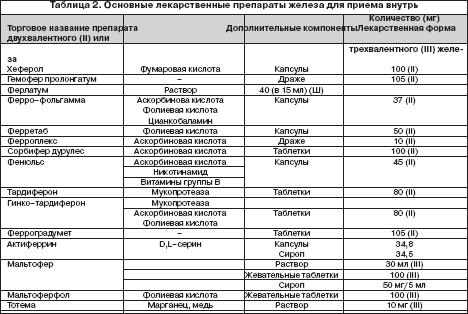
Выбор ПЖ и оптимального режима его дозирования должен определяться количеством и биодоступностью содержащегося в нем железа, переносимостью, стоимостью. При этом необходимо иметь в виду, что адекватный прирост показателей гемоглобина у больных ЖДА может быть обеспечен поступлением в организм от 30 до 100 мг элементарного железа . Учитывая, что при развитии ЖДА всасывание железа увеличивается по сравнению с нормой и составляет 25–30% (при нормальных запасах железа – всего 3–7%), необходимо назначать от 100 до 300 мг элементарного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. С учетом этого при выборе ПЖ следует ориентироваться не на содержание в нем общего количества соединения железа, а на количество элементарного железа. Например, при назначении препаратов сульфата железа с низким содержанием элементарного железа (менее 100 мг) количество принимаемых таблеток должно быть от 3 и выше (в зависимости от содержания железа в каждой таблетке), в то время как препараты сульфата, фумарата или гидроксиполимальтозного комплекса железа с содержанием 100 мг элементарного железа можно принимать в количестве 1–2 таблеток в сутки. Основные ПСЖ представлены сульфатом железа, глюконатом, хлоридом, фумаратом, глицин сульфатом. Наибольшей степенью абсорбции обладают препараты сульфата железа, а наименьшей – глицин сульфата. Многие из ПСЖ содержат вещества, например, аскорбиновую кислоту, усиливающие всасывание железа и улучшающие биодоступность препарата, а также витамины (фолиевую кислоту, цианкобаламин). Среди ПЖК на отечественно рынке имеются гидроксиполимальтозный комплекс, железо–сорбитоловый комплекс, протеин сукцинилат железа, железо–сахарозный комплекс. К новым высокоэффективным и безопасным препаратам железа относятся препараты, представляющие собой неионные соединения железа на основе гидроксиполимальтозного комплекса (ГПК) трехвалентного железа. Структура комплекса состоит из многоядерных центров гидроксида Fe (III), окруженных нековалентно связанными молекулами полимальтозы. Комплекс имеет большой молекулярный вес, что затрудняет его диффузию через мембрану слизистой кишечника. Химическая структура комплекса максимально приближена к структуре естественных соединений железа с ферритином. Абсорбция железа в виде ГПК имеет принципиально иную схему по сравнению с его ионными соединениями и обеспечивается поступлением Fe (III) из кишечника в кровь путем активного всасывания. Неионная структура комплекса обеспечивает его стабильность и перенос железа с помощью транспортного белка, что предотвращает в организме свободную диффузию ионов железа, т.е. прооксидантные реакции. Данные по безопасности, полученные во время клинических исследований препарата железа на основе гидроксида Fe (III) с полимальтозой, свидетельствуют о более низкой частоте побочных эффектов по сравнению с солевыми препаратами железа. Для лучшей переносимости ПСЖ следует принимать во время еды, хотя следует иметь в виду, что всасывание железа лучше при приеме лекарственных препаратов перед едой. Всасываниежелеза может уменьшаться под влиянием содержащихся в некоторых пищевых продуктах веществ – фитинов (рис, соя), фосфатов (рыба, морепродукты), танина (чай, кофе). Многие больные склонны запивать лекарства чаем, что в случаях приема ПЖ в виде солей недопустимо, поскольку образуются плохо растворимые комплексы с низкой их абсорбцией в кишечнике. Кроме того, всасывание железа из ПЖ в виде солей ухудшается при одновременном приеме ряда медикаментов (тетрациклины, антациды, соли магния). С учетом этого следует рекомендовать прием препаратов солей железа в различное время с другими вышеуказанными медикаментами. Препараты ПЖК, в частности, гидроксиполимальтозный комплекс лишены подобных недостатков, поскольку пищевые продукты и медикаменты не оказывают влияние на всасываемость железа (в виде трехвалентной формы) из железосодержащих комплексов. В таблице 2 представлены основные зарегистрированные в России лекарственные ПСЖ и ПЖК для приема внутрь.
Оценка эффективности лечения
В случаях назначения ПЖ в достаточной дозе на 7–10–й день от начала лечения наблюдается повышение количества ретикулоцитов. Достоверное повышение уровня гемоглобина отмечается через 3–4 нед. от начала лечения. Нормализация показателей гемоглобина обычно происходит в сроки 4–9 нед. Иногда наблюдается резкое скачкообразное повышение гемоглобина. Эти индивидуальные колебания могут быть обусловлены, с одной стороны, выраженностью ЖДА, степенью истощения запасов железа, а с другой – эффективностью назначенного ПЖ (количество содержащегося железа, биодоступность и др.). Имеет также значение некомплаентность больных (нерегулярность приема ПЖ, побочные эффекты).
Длительность лечения и поддерживающая терапия
Оптимальная тактика ведения больных ЖДА предполагает насыщающую и поддерживающую терапию ПЖ. Длительность насыщающей терапии зависит от темпов прироста и сроков нормализации показателей гемоглобина, составляя в среднем 4–6 недель. Поддерживающая терапия показана в тех ситуациях, когда причина дефицита железа сохраняется (меноррагии, беременность) или в силу различных ситуаций является трудноустранимой (патология кишечника, носовые и другие кровотечения при геморрагических диатезах). Женщинам, страдающим ЖДА на фоне меноррагий, после нормализации показателей гемоглобина рекомендуется поддерживающая терапия ПЖ в течение 5–7 дней после очередной менструации. Больным надо разъяснять необходимость поддерживающего лечения в связи с продолжающимися избыточными потерями железа. Беременные с ЖДА должны получать ПЖ до конца беременности в целях обеспечения адекватной потребности плода в железе.
Переносимость препаратов железа
Среди побочных эффектов на фоне применения ПЖ внутрь наиболее часто возникают тошнота, анорексия, металлический вкус во рту, запоры, реже – поносы. Развитие запоров обусловлено, по всей вероятности, связыванием в кишечнике сероводорода, являющегося одним из стимулов кишечной перистальтики. В большинстве случаев современные ПЖ вызывают незначительные побочные явления, не требующие их отмены и перехода на парентеральный путь введения. Диспептические расстройства могут уменьшаться при приеме препаратов после еды или уменьшения суточной дозы препарата. Чаще побочные эффекты регистрируютсяпри приеме ПСЖ, в то время как препараты ПЖК (гидроксиполимальтозный комплекс) переносятся лучше и имеют в связи с этим определенные преимущества. В случаях сохраняющейся плохой переносимости пероральных ПЖ показано назначение ПЖ парентерально (внутримышечно или внутривенно). На фоне лечения парентеральными ПЖ, особенно для внутривенного введения, могут возникать аллергические реакции в виде крапивницы, лихорадка, флебиты, анафилактический шок. Кроме того, при внутримышечном введении ПЖ возможно потемнение кожи в местах инъекций, инфильтраты, абсцессы. Если ПЖ для парентерального введения назначают больным гипохромной анемией, не связанной с дефицитом железа, имеется повышенный риск возникновения тяжелых нарушений из–за «перегрузки» железом различных органов и тканей (печень, поджелудочная железа и др.) с развитием гемосидероза.
Причины неэффективности лечения препаратами железа
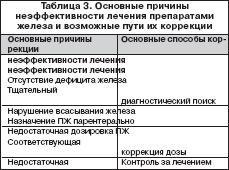
В случае отсутствия или недостаточного эффекта от лечения ПЖ следует выяснить причину с целью возможности ее коррекции. Возможные причины неэффективности лечения ПЖ и способы их коррекции представлены в таблице 3. Необходима убежденность в правильной трактовке всех клинико–лабораторных признаков и в достоверности синдрома ЖДА. Причиной отсутствия или недостаточной эффективности ПЖ может быть недостаточная суточная доза железа, что обычно связано с назначением ПЖ с низким содержанием в нем железа и малым количеством принимаемых таблеток. Так, например, при лечении препаратом, в котором содержится всего лишь 10 мг двухвалентного железа, число принимаемых таблеток должно быть не менее 10 в сутки. Такой режим дозирования неудобен для больных, чем и объясняется, вероятнее всего, невыполнение ими врачебного назначения. С учетом вышесказанного для обеспечения комплаентности следует назначать ПЖ с высоким содержанием железа (не менее 100 мг). Препараты с низким содержанием железа целесообразно использовать в педиатрической практике. Одной из причин неэффективности ПЖ при назначении внутрь может быть нарушение всасывания железа, в частности, у больных с невыявленной или недооцененной кишечной патологией. В этих случаях показано назначение парентеральных ПЖ. В ряде случаев вследствие улучшения самочувствия больные начинают нерегулярно принимать ПЖ или вообще прекращают лечение. В результате показатели гемоглобина не достигают нормальных значений и ЖДА при этом остается фактически недолеченной. С учетом этого длительность насыщающей терапии ПЖ должна определяться сроками достижения нормального уровня гемоглобина, что требует постоянного лабораторного мониторинга. Ряд больных не всегда выполняют назначение врача (регулярность приема ПЖ, достаточная продолжительность и т.д.). В некоторых случаях это может быть обусловлено развитиемпобочных эффектов от ПЖ и самостоятельным прекращением лечения. Поэтому необходим контроль за лечением, эффективностью, переносимостью ПЖ со стороны врача, среднего медперсонала, родственников больных. Отсутствие эффекта от ПЖ может быть связано с неустраненными причинами ЖДА, среди которых клинически наиболее значимыми являются скрытые кровопотери из желудочно–кишечного тракта, чаще из кишечника (невыявленная опухоль!). С учетом этого в подобных ситуациях при исключении других возможных причин неэффективности ПЖ необходимо тщательное эндоскопическое исследование кишечника (в ряде случаев – повторное). Таким образом, у больных ЖДА наряду с устранением причины обязательна патогенетическая терапия ПЖ (ПСЖ и ПЖК), которые должны назначаться преимущественно внутрь. Тактика лечения ПЖ предусматривает выбор пути введения ПЖ с учетом клинической ситуации, оптимального ПЖ с достаточным содержанием в нем железа, оценку эффективности и переносимости препарата, длительность насыщающей и обоснованность поддерживающей терапии. Своевременная верификация синдрома ЖДА и выявление ее причины, адекватная патогенетическая терапия с назначением ПЖ с оптимальными фармакокинетическими свойствами, клинической эффективностью, переносимостью позволяет корригировать анемический синдром и обеспечивать достаточный уровень качества жизни у данной категории пациентов.