Клинические рекомендации анемии мегалобластные 2015г
Мегалобластные анемии — группа анемий, общим признаком которых является наличие метал областного костномозгового кроветворения, т. е. появление в костном мозге эритрокариоцитов со структурными ядрами, сохраняющими эти черты на поздних стадиях дифференцировки эритроидного ростка.
Мегалобластное кроветворение возникает в результате нарушения синтеза нуклеиновых кислот, а, следовательно, ДНК и РНК, что приводит к неэффективному гемопоэзу.
Поскольку синтез нуклеиновых кислот касается всех гемопоэтических клеток, мегалобластные анемии характеризуются не только анемией, но и лейкоцитопенией и тромбоцитопенией.
Мегалобластные анемии по цитометрическим характеристикам являются макроцитарными и гаперхромными. Причины для возникновения мегалобластных анемий: дефицит витамина В12 или фолиевой кислоты.
ВИТАМИН В12-ДЕФИЦИТНАЯ АНЕМИЯ
В12ДА — это заболевание, обусловленное истощением запасов витамина В12 в организме, что влечет за собой нарушение синтеза ДНК в клетках. Основными проявлениями заболевания являются резкое нарушение гемопоэза с развитием гиперхромной (макроцитарной) анемии, нейтропении, тромбоцитопении и нарушение функции нервной системы.
По МКБ-10 D51 Витамин В12-дефицитная анемия.
Классификация В12ДА: врожденные и приобретенные.
Эпидемиология. Приобретенная В12ДА — распространенное заболевание, частота 1500 на 1 млн населения.
Болеют преимущественно лица старшей возрастной группы.
Соотношение женщин и мужчин составляет 10:7.
Этиология. Дефицит витамина В12 в организме может развиться при нарушении всасывания; нарушении поступления; конкурентного поглощения; нарушения транспорта.
Наиболее частая причина развития дефицита витамина В12 — нарушение его всасывания из-за атрофии слизистой оболочки желудка, вследствие которой нарушается секреция внутреннего фактора, соляной кислоты, пепсина.
Другая причина — изменение нормальной функции рецепторов к внутреннему фактору, расположенных в слизистой оболочке тонкой кишки (при тяжелых энтеритах, глутеновой энтеролатии, при обширных резекциях тонкой кишки).
Поражение ПЖс длительным уменьшением секреции протеолитических ферментов приводит к нарушению диссоциации комплекса витамин В12—R-протеин, что препятствует образованию комплекса с внутренним фактором и нарушает всасывание витамина B12. Еще одна причина дефицита витамина В12 — его конкурентное поглощение при дифиллоботриозе или кишечной микрофлорой в слепых петлях кишки после резекции кишечника.
У части пациентов В12ДА развивается на фоне аутоиммунных заболеваний вследствие появления аутоантител к париетальным клеткам слизистой желудка, секретирующим внутренний фактор, или аутоантител к самому внутреннему фактору, в этих случаях нередко имеет место сочетание В12ДА с другими аутоиммунными заболеваниями.
У небольшого числа больных наблюдается дефицит витамина В!2 вследствие наследственного снижения количества транскобаламина И. Развитие В12ДА вследствие исключения продуктов питания с высоким содержанием витамина (мясо, яйца, молочные продукты) наблюдается у вегетарианцев спустя 3—5 лет.
Патогенез. Витамин В12 является ко-фактором, необходимым для образования тетрагидрофолиевой кислоты из фолиевой кислоты.
Активная тетрагидрофолиевая кислота участвует в синтезе пуриновых и пиримидиновых оснований нуклеиновых кислот, т.е. синтезе ДНК.
Дефицит витамина В12 приводит к нарушению синтеза ДНК, что лежит в основе изменения нормального гемопоэза.
Изменение гемопоэза затрагивает все клеточные линии. В клетках блокируется синтез ДНК, что приводит к нарушению процесса деления клеточного ядра и преждевременной гибели гемопоэтических предшественников в костном мозге (неэффективный гемопоэз).
Наиболее яркие морфологические изменения отмечаются в клетках эритроидного ростка.
Вторая реакция, зависящая от участия витамина В12, не влияет на кроветворение и представляет собой одну из реакций метаболизма жирных кислот.
Это реакция превращения метилмалонового кофермента А в сукцинил-кофермент А.
Реакция протекает при участии дезоксиаденозилкобаламина.
При дефиците витамина В12 нормальный ход реакции нарушается, что приводит к накоплению метилмалоновой кислоты.
Метилмалоновая кислота является токсичным продуктом.
С ее избыточным накоплением связывают развитие неврологической симптоматики у больных сВ12ДА — Витамин В12 участвует также в процессах синтеза жирных кислот и миелина.
При дефиците витамина В|2 нарушается синтез миелина и происходит демиелинизация периферических нервных волокон, проявляющаяся клиническими признаками фуникулярного миелоза.
Клиническая картина.
Анемический синдром: слабость, повышенная утомляемость, плохая переносимость душных помещений, ощущение сердцебиения, коллаптоидные состояния. У четверти больных с В12ДА имеются жалобы на боли во рту или языке, связанные с развитием глоссита.
Поражение нервной системы — фуникулярный миелоз: нарушение чувствительности, ощущение ползания мурашек, онемения конечностей, ваты или подушки под ногами, легкие болевые ощущения в кончиках пальцев.
При обследовании: бледность кожи и слизистых оболочек, сочетающаяся с их легкой желтушностью. Желтушность обусловлена повышением содержания непрямого билирубина вследствие ускоренной гибели эритрокариоцитов в костном мозге и повышенного разрушения крупных эритроцитов (макроцитов) в селезенке.
Проявления геморрагического диатеза — экхимозы и петехии у пациентов с выраженной тромбоцитопенией. На языке обнаруживаются участки воспаления, афты, атрофия и сглаженность сосочков.
Язык имеет малиновую окраску.
Незначительное увеличение селезенки, которая пальпируется на 1-2 см ниже края реберной дуги.
У большей части больных с В12ДА при ФГДС выявляются признаки атрофического гастрита.
Диагностика.
I этап — первичное представление о наличии у больного анемии формируется на основании жалоб, характерных для анемического синдрома, а появление симптомов фуникулярного миелоза (см. выше) позволяет предположить наличие дефицита витамина В12 — I этап обследования больного любой анемией, в том числе мегалобластной, — констатация самой анемии, что достигается с помощью клинического анализа крови.
В пользу мегалобластной анемии, помимо снижения количества НЬ и эритроцитов, будут свидетельствовать такие признаки, как повышение цветового показателя выше 1,0 (гиперхромная анемия), большие размеры эритроцитов (макроцитарная анемия), количество ретикулоцитов — в пределах нормы (реже — ретикулоцитопения), тенденция к лейкопении (чаще — нейтропения) итромбоцитопении (нередко — значительная).
В гемограмме — правый сдвиг, гиперсегментированные (5 сегментов) нейтрофилы (специфический признак дефицита витамина В12 и фолиевой кислоты).
В эритроцитах обнаруживают остатки ядра, получившие названия тельца Жоли и кольца Кебота.
При биохимическом исследовании крови может быть обнаружено увеличение содержания билирубина за счет непрямой фракции.
II этап — стернальная пункция и исследование костного мозга.
III этап — установление этиологического фактора мегалобластной анемии, т.е. проведение дифференциального диагноза между В12ДА и фолиеводефицитной анемией, а также выявление причины возникновения анемии.
Диагноз В12ДА подтверждается при уменьшении содержания витамина В12 в сыворотке крови и появлении метилмалоновой кислоты в моче.
Для выяснения причины возникновения В12ДА учитываются данные анамнеза, проводятся исследование кала на обнаружение яиц глистов, главным образом, широкого лентеца, рентгенологические и эндоскопические исследования ЖКТ (признаки атрофического гастрита, ахлоргидрия, опухоли желудка) и некоторые специальные методы исследования. Объем проводимых исследований определяется конкретной клинической ситуацией.
Патоморфология костного мозга.
Характерно мегалобластное кроветворение. В пунктате костного мозга находят раздраженный красный росток (соотношение между миелоидным и эритроидным ростками 1:3 вместо 3:1, как в норме), большое количество мегалобластов, отсутствие оксифильных форм, поэтому костный мозг выглядит базофильным («синий костный мозг»).
Дифференциальная диагностика.
Дифференциальный диагноз между В12ДА и фолиеводефицитной анемией проводится на основании отсутствия клинических признаков фуникулярного миелоза и метилмалоновой ацидурии при фолиеводефицитной анемии, определения содержания витамина В12 и фолиевой кислоты в сыворотке крови.
Дифференциальный диагноз с апластической анемией, миелодиспластическим синдромом проводят на основании цитологического и гистологического исследований костного мозга.
Дифференциальный диагноз с гемолитическими анемиями основывается на определении количества ретикулоцитов, выраженности лабораторных и клинических признаков гемолиза и морфологии костного мозга.
Лечение.
Если установлена конкретная причина дефицита витамина В12, обязательно проводится этиотропное лечение.
Имеются в виду дегельминтизация, хирургическое удаление опухоли желудка, лечение заболеваний кишечника, в частности коррекция дисбактериоза и т.д.
Патогенетическое лечение заключается в назначении парентерального введения витамина В12 (цианкобаламина).
В зависимости от исходных показателей красной крови его назначают по 200—500 мкг ежедневно до начала гематологической ремиссии, а затем дозу можно уменьшить или вводить препарат через день.
Первым признаком ремиссии является резкое повышение количества ретикулоцитов — ретикулоцитарный криз.
В дальнейшем постепенно нормализуется количество эритроцитов и гемоглобина, снижается величина цветового показателя.
По достижении нормализации гемограммы больным назначается витамин В12 в поддерживающих дозах по 100-200 мкг 2—4 раза в мес.
Больным анемией Аддисона-Бирмера вводить витамин В12 следует пожизненно.
При симптомах фуникулярного миелоза дозы витамина B12 увеличиваются до 800—1000 мкг ежедневно и уменьшаются при исчезновении не только гематологических, но и неврологических признаков заболевания.
Рекомендации ВОЗ по лечению В12ДА следующие:
Цианкоболамин
Без фуникулярного миелоза
1000 мкг 1 раз в сут в/м х 1 нед
1000 мкт 2 раза в нед в/м х 1 нед
1000 мкг 1 раз в нед в/м х 4 нед
1000 мкг 1 раз в мес в/м пожизненно
С фуникулярным миелозом
1000 мкг 1 раз в сут в/м х 1 нед
1000 мкг 2 раза в нед в/м х 1 нед
1000 мкг 1 раз в нед в/м х 4 нед
1000 мкг 2 раза в мес в/м х 6 мес
1000 мкг 1 раз в мес в/м пожизненно.
Цианкоболамин можно применять как в/м, так и в/в в виде капельных инфузий.
Гемотрансфузии назначаются только при пре- или коматозном состоянии, переливается эритроцитарная масса по 250-300 мл.
Иногда приходится назначать на короткий период ГКС в связи с тем, что у части больных в патогенезе анемии участвуют аутоиммунные механизмы.
Прогноз.
При лечении препаратами витамина B12 неврологическая симптоматика регрессирует медленнее других симптомов, остаточные явления могут сохраняться в течение 6-8 мес после курса терапии.
Профилактика.
Первичная профилактика развития дефицита витамина В12 заключается в предотвращении нарушения его поступления или его конкурентного поглощения.
Это позволяет предотвратить развитие заболевания или избежать наступления рецидивов после завершения курса лечения.
У больных с резецированным желудком необходимо проводить профилактическое лечение препаратами витамина В12.
Назначают цианкобаламин по 400 мкг по одной инъекции в месяц или один раз в год проводят курс из 12 инъекций ежедневно.
Аналогичную профилактическую терапию необходимо проводить у больных с атрофическим гастритом для предотвращения развития анемии и у больных, уже получивших курс лечения по поводу В12ДА.
Следует обратить внимание на то, что при невозможности устранения причины дефицита витамина В12 больные нуждаются в заместительной терапии на протяжении всей жизни.
ФОЛИЕВОДЕФИЦИТНАЯ АНЕМИЯ
В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
В настоящей публикации на основании данных литературы и анализа собственных наблюдений представлены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий, а также принципы их лечения у детей. Установлено, что основной формой дефицитных анемий (ДА) в педиатрической популяции является анемия, обусловленная недостаточным содержанием в организме железа. При этом особо подчеркивается, что железодефицитная анемия (ЖДА) не только наиболее распространенная ДА, но и самое частое гематологическое заболевание у детей [1–3]. С учетом того, что другие типы анемий (в т. ч. развивающиеся при дефиците таких витаминов, как фолиевая кислота и В12) хуже известны врачам-педиатрам, их верификация, как правило, запаздывает, т. к. они ошибочно принимаются за ЖДА. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма и ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения дифференциальной диагностики и лечения анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Дифференциальная диагностика ДА у детей
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).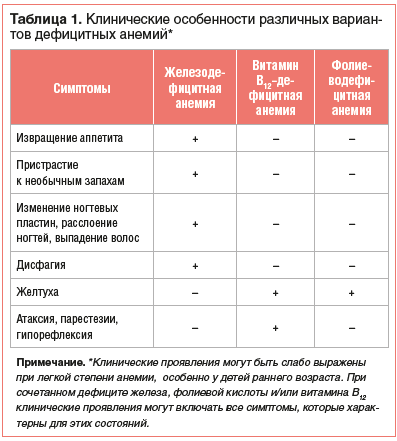
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).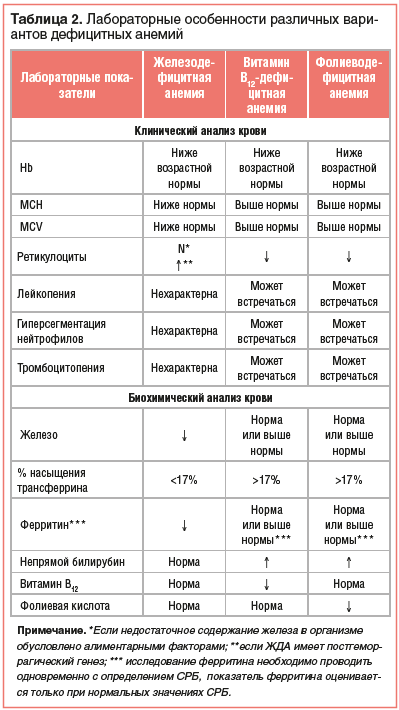
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Лечение ДА у детей
Корректная трактовка клинико-анамнестических данных и результатов лабораторного обследования позволяет верифицировать причину ДА и своевременно назначить адекватную терапию. Принципиально важным при этом является положение о том, что компенсировать дефицитные состояния невозможно только за счет нормализации рациона питания. Основная роль в купировании дефицита железа, фолиевой кислоты и витамина В12 принадлежит заместительной фармакотерапии [1–7]. При этом для лечения ЖДА используются солевые препараты железа или препараты на основе железа гидроксид полимальтозата. Суточная доза препаратов зависит от массы тела и возраста ребенка, расчет при этом проводится по элементарному железу. Так, для солевых препаратов железа, назначаемых внутрь, используются следующие дозы (расчет по элементарному железу!): для детей до 3 лет — 3 мг/кг/сут, для детей старше 3 лет — 45–60 мг/сут, для подростков —
до 120 мг/сут. При использовании пероральных форм железа гидроксид полимальтозата рекомендованные дозы составляют 5 мг/кг/сут (расчет по элементарному железу!). Продолжительность терапии препаратами железа зависит от степени тяжести ЖДА. При легкой ЖДА курс лечения составляет 3 мес., при среднетяжелой форме — 4,5 мес., при тяжелой — до 6 мес. [3].
В случае диагностики фолиеводефицитной анемии заместительная терапия проводится препаратами фолиевой кислоты. Рекомендовано использовать следующие суточные дозы фолиевой кислоты: для детей до 1 года — 0,25–0,5 мг/сут, для детей старше 1 года — 1,0 мг/сут. При синдроме мальабсорбции доза может быть повышена до 5–15 мг фолиевой кислоты в сутки. Терапия проводится в указанных дозах ежедневно на протяжении 4–6 нед. Через 7 дней от начала лечения необходимо выполнить клинический анализ крови с обязательным подсчетом ретикулоцитов (рис. 1). Повышение уровня ретикулоцитов на фоне приема фолиевой кислоты указывает на правильно установленный диагноз и является обоснованием для продолжения терапии. Купирование анемии достигается через 4–6 нед. от начала лечения [6].
Для лечения витамин В12-дефицитной анемии используют препараты цианокобаламина для парентерального введения. При этом рекомендовано придерживаться следующего режима дозирования: для детей до 1 года — 5 мкг/кг/сут, для детей старше 1 года — 100 мкг/сут, для подростков — 200 мкг/сут. Препарат вводится внутримышечно 1 р./сут ежедневно. На 7–10-й день терапии проводят клинический анализ. Выявление ретикулоцитоза позволяет сделать вывод об эффективности проводимого лечения. Терапию следует продолжить в том же режиме дозирования еще в течение 3–4 нед. В дальнейшем, при достижении нормализации уровня гемоглобина, переходят на поддерживающее лечение: цианокобаламин вводят в терапевтической дозе 1 раз в 7 дней в течение 2 мес., а затем 1 раз в 14 дней в течение 6 мес. (рис. 2). Учитывая, что дефицит витамина В12, как правило, редко обусловлен алиментарными факторами, одновременно проводят поиск причин данного патологического состояния (болезнь Крона, целиакия, инвазия широким лентецом, наследственные нарушения всасывания и/или транспортировки витамина В12 и др.) [7]. В тех случаях, когда имеют место полидефицитные состояния с развитием анемического синдрома, оправданно комбинированное заместительное лечение. Чаще всего у детей встречается сочетанный дефицит железа и фолиевой кислоты, что требует одновременного назначения препаратов железа и фолиевой кислоты.
Заключение
Таким образом, выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. Своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка. Авторы выражают надежду, что информация, представленная в настоящей публикации, будет полезна практикующим врачам-педиатрам.


