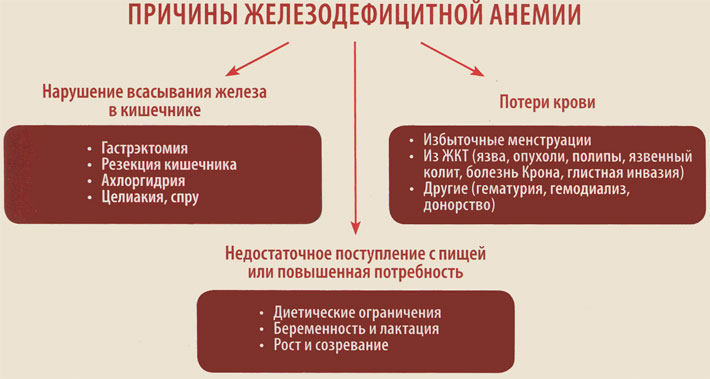
К механизмам развития анемии при гемобластозах относят
Анемия
—
клинико-гематологический синдром,
характеризующийся уменьшением
содержания гемоглобина в единице объема
крови, чаще при одновременном
уменьшении количества эритроцитов, что
приводит к развитию кислородного
голодания тканей.
Принято
считать анемией снижение уровня
гемоглобина ниже 130 г/л и количества
эритроцитов ниже 4* 12/л у мужчин и ниже
120 г/л и 3,5* 10/л у
женщин
ГЕМОБЛАСТОЗАМИ
называют
группу опухолей, возникших из
кроветворных
клеток. Они подразделяются на две группы:
лейкозы
—
опухоль, исходящая из родоначальных
(стволовых) кроветворных
клеток с первичным поражением костного
мозга.гематосаркомы
—
внекостномозговые
первоначально локальные опухоли
(преимущественно
в лимфатических узлах) с возможной их
генерацией в кроветворные
органы, включая костный мозг.
Несколько
реже других гемобластозов встречаются
лимфоцитомы (лимфомы)
—
опухоли, состоящие из зрелых лимфоцитов
или образованные разрастаниями,
идентичными лимфатическому узлу, но
мало или совсем не поражающие костный
мозг. Лимфомы
разделяют на лимфогранулематоз (болезнь
Ходжкина, ходжкинская лимфома) и
неходжкинские лимфомы (недифференцированные,
высоко- и малодифференцированные,
лимфомы Беркитта, грибовидный микоз и
др.).
Лейкозы
делятся на острые и хронические. В основу
классификации лейкозов положена степень
зрелости и морфологическая характеристика
опухолевых клеток, составляющих субстрат
того или иного лейкоза в костном мозге.
К
острым
лейкозам относят
опухолевые заболевания системы
крови, основным
субстратом которых являются бластные
клетки: миелобласты,
лимфобласты, монобласты, эритробласты,
промиелоцитарные и недифференцируемые
бласты. Вариант острого лейкоза определяют
цитохимически
по наличию или отсутствию в бластах
пероксидазы, липидов, гликогена, кислых
мукополисахаридов, неспецифической
эстеразы, фосфатаз и
др.
В
соответствии с этим острые лейкозы
подразделяют на: лимфобластный,
миелобластный, промиелоцитарный,
миеломонобластный, монобластный,
эритромиелоз, мегакариобластный,
плазмобластный, недифференцированный,
малопроцентарный (количество бластов
в костном мозге
не более 15-20%) как вариант миелодиспластического
синдрома
(МДС).
К
хроническим относят
лейкозы, при которых основная
опухолевая масса костного
мозга и крови состоит из созревающих
или зрелых клеток (лимфоцитов
—
при
хроническом лимфолейкозе, миелоцитов,
юных,
палочкоядерных
и сегментоядерных —
при
хроническом миелолейкозе, эритроцитов
— при эритремии, плазмоцитов — при
миеломе). В соответствии с этим
выделяют: хронический миелолейкоз,
доброкачественный сублейкемический
миелоидный лейкоз (миелофиброз,
остеомиелосклероз), эритремию,
хронический моноцитарный лейкоз,
хронический лимфолейкоз, миеломную
болезнь,макроглобулинемию Вальденстрема.
Анемический
синдром при гемобластозах.
Анемический
синдром при гемобластозах является
закономерным явлением и
проявлением основного заболевания.
Наиболее часто в
общеклинической и гематологической
практике встречаются следующие варианты
гемобластозов:
Острый лимфобластный
лейкозОстрый нелимфобластный
лейкозХронический
миелоидный лейкозХронический
лимфолейкозЛимфогранулематоз
Неходжкинские
лимфомыМиелодиспластический
синдромИдиопатический
миелофиброзМножественная
миеломаМакроглобулинемия
Вальденстрема
Анемический
синдром может носить как первичный, так
и вторичный
(ятрогенный)
характер.
В
развитии анемического синдрома при
гемобластозах играют роль
различные
механизмы, в зависимости от формы и
стадии болезни.
Уменьшение
числа эритроцитов в периферической
крови при гемобластозах
обусловлено
следующими механизмами в чистом виде
или их
комбинациями:
поражение
эритроцитарного ростка костного мозга,
вытеснение, замещение
его патологической тканью следовательно,
недостаточной продукцией
эритроцитов;повышенным
разрушением эритроцитов, в том числе
и при проведении терапии
гемобластозов;потерями
значительных количеств эритроцитов
вследствие кровопотери при
выраженном геморрагическом синдроме.
Развитию
анемии могут способствовать нарушение
продукции эндогенного эритропоэтина,
укорочение продолжительности жизни
эритроцитов, дефицит железа
в следствии повышенной кровоточивости
при синдроме
гипервязкости. Анемия может усугубляться
гемодилюцией, обусловленной увеличением
объема плазмы у больных с высоким уровнем
парапротеина. Во
всех случаях анемия приводит к развитию
гипоксии с соответствующими клиническими
проявлениями.
Клиника
анемического синдрома при гемобластозах.
Основной симптом
анемии — слабость и быстрая утомляемость.
Также может наблюдаться:
Бледность
Сердцебиение
Одышка или чувство
нехватки воздухаБоли в области
сердцаГоловокружение
Головные боли
Похолодание
пальцев
Легкая,
а иногда и средняя степень тяжести
анемии может оставаться бессимптомной
и обнаруживаться только при анализе
крови. Однако с увеличением степени
снижения гемоглобина признаки и симптомы
анемии проявляются.
Отличительными
особенностями анемий при гемобластозах
являются выраженный эритронормобластоз
и лейкемоидная картина крови, в некоторых
случаях может развиться панцитопения.
Возможные
варианты анемии при наиболее часто
встречающихся гемобластозах:
Для
острого промиелоцитарного лейкоза
характерно развитие тяжелого ДВС-синдрома
с появлением геморрагии, внутрисосудистого
гемолиза. У некоторых больных с острым
лейкозом большее значение в анемизации
получает геморрагический синдром,
связанный с глубокой тромбоцитопенией.
Миелодиспластический
синдром —
заболевание, при котором анемия долгое
время является ведущим клиническим
проявлением. Как правило, носит
нормохромный характер. У лиц пожилого
возраста может наблюдаться сочетание
миелоидной дисплазии с дефицитом
витамина В-12.
При
хроническом миелоидном лейкозе
анемия так же носит нормохромный
характер, однако, развивается, как
правило, в исходе заболевания -бластном
кризе.
Иммунный
гемолиз более свойственен лимфопролиферативным
опухолям (хронический
лимфолейкоз, неходжкинские лимфомы) и
может носить весьма выраженный характер.
Множественная
миелома —
у 60-70% больных при первичном обращении
выявляется
анемия, как правило, нормоцитарная,
нормохромная. При
болезни Вальденстрема анемический
синдром развивается медленно (иногда
в течение нескольких лет). Ведущую роль
в его генезе играет лей
кемическое подавление эритропоэза,
гемолиз (аутоиммунная гемолитическая
анемия с неполными тепловыми агглютининами
регистрируется
в 5% случаев), железодефицитная анемия
в момент постановки
диагноза отмечается у 25% пациентов с
болезнью Вальденстрема. Ее
патогенез изучен недостаточно. Наиболее
вероятной причиной считается нарушение
всасывания железа в тонком кишечнике.
Как и при множественной миеломе, анемия
может усугубляться гемодилюцией,
обусловленной увеличением объема плазмы
у больных с высоким уровнем парапротеина.
Больные
с гемобластозами, не имеющие поражения
костного мозга, часто имеют
легкую или умеренную нормохромную
нормоцитарную анемию, этиология
которой включает много факторов. У этих
пациентов обычно снижен уровень
сывороточного железа и общей
железосвязывающей способности
сыворотки, повышен ферритин, что
свидетельствует о блокаде в
переносе железа из запасов в эритроидные
предшественники. Кроме того, у некоторых
больных (миелодиспластический синдром,
остеомиелофиброз) обнаружен
сниженный ответ на эритропоэтин. Уровень
эритропоэтина может быть
выше нормы, но значительно ниже
соответствующего данной степени анемии.
Диагностика
гемобластозов.
Клинические
симптомы лейкозов: анемический,
гиперпластический, гемморагический,
интоксикационный, инфекционный,
язвенно-некротический при острых
лейкозах наблюдаются следующие изменения:
1)
Периферическая
кровь.
Анемия
нормохромная нормоцитарная,
ретикулоцитопения, тромбоцитопения,
изменение общего количества лейкоцитов
(увеличение или
норма), появление бластов в периферической
крови(бластный криз -более
10% бластов в периферической крови),
уменьшение количества зрелых нейтрофилов
(нейтропения), феномен «провала»(
отсутствие промежуточных форм
между бластами и зрелыми гранулоцитами),
увеличение СОЭ, уменьшение
эозинофилов и базофилов
2) миелограмма
Количество
бластов 30% и более, выраженная редукция
эритроидного, гранулоцитарного,
мегакариоцитарного ростков
3) трепанобиопсия
крыла подвздошной кости с гистологическим
исследованием
— бласты.
4) цитохимическое
исследование, иммунологические и
цитогенетические методы —
изменения, характерные для конкретного
варианта острого лейкоза
5)
общий анализ мочи —
изменения неспецифичны, протеинурия,
микрогематурия, возможна цилиндрурия.
При
хронических лейкозах:
1.
Периферическая кровь:
Анемия
нормохромная, нормоцитарная, нейтрофильный
лейкоцитоз с появлением
молодых форм (промиелоцитов, миелоцитов,
метамиелоцитов), базофильно-эозинофильная
ассоциация, чаще увеличение количества
тромбоцитов,
лимфопения (при ХМЛ) либо резкое увеличение
лимфоцитов более
10*10/л и более, увеличение СОЭ.
2.
Миелограмма — гиперклеточный костный
мозг, представлены все элементы с
наличием переходных форм в большом
количестве 3)
цитогенетический анализ, иммунофенотипирование
Маркером
ХМЛ является филадельфийская хромосома
Диагностика
множественной миеломы
1)
клиническая триада Калера — боли в
костях, опухоли, переломы;
2)
белок Бенс-Джонса в моче;
остеолитические
очаги на рентгенограмме;периферическая
кровь: плазматические клетки, анемия,
увеличение СОЭ;протеинограмма:
М-градиент, сывороточный парапротеин
IgG
более 35 г/л, IgA
более 20 г/л; .миелограмма:
плазматических клеток более 30%.
Лечение анемического
синдрома при гемобластозах:
Прежде
всего, это лечение самого гемобластоза.
Одним из критериев достижения ремиссии
является нормализация уровня гемоглобина.Следует
ли больным гемобластозами, получающими
химиотерапию,
назначать эритропоэтин? Однозначного
ответа на этот вопрос нет.
К безусловным плюсам применения
эритропоэтина можно отнести возможность
уменьшения количества трансфузий
эритроцитов. Доказана эффективность
эритропоэтина у больных с почечной
недостаточностью, некоторых
групп с миелодиспластическим синдромом,
остеомиелофиброзом.Нарушение
синтеза ДНК (метотрексат, мелфалан,
пуринетол, антагонисты ииримидинов,
гидроксимочевина) приводит к дефициту
витамина В12 и фолиевой
кислоты. При применении этих препаратов
ожидается увеличение среднего
объема эритроцита.В
большинстве же остальных случаев,
лечение анемического синдрома при
гемобластозах
сводится к заместительным трансфузиям
эритроцитарной массы.
При
решении вопроса
в
большинстве же остальных случаев,
лечение анемического синдрома при
гемобластозах
сводится к заместительным
трансфузиямэритроцитарной
массы.
При
решении вопроса о назначении трансфузий
больным с хронической
анемией
следует основываться на результатах
оценки тяжести основного
заболевания,
выраженности физиологической адаптации
к анемии, объема
физической
активности, необходимой данному больному.
Гемобластозами
обозначают опухоли, возникающие из
кроветворных клеток. К гемобластозам
относят две разновидности опухолей:
лейкозы и гематосаркомы. Лейкозы
представляют собой опухоли, диффузно
поражающие гемопоэтическую ткань
костного мозга. Долгое время в качестве
синонима термина «лейкоз» использовался
термин «лейкемия» — «белокровие»,
предложенный Р. Вирховым. Сейчас от него
отказались в связи с тем, что к лейкозам
относятся (помимо опухолей, поражающих
лейкопоэтический росток) также
новообразования из эритро- и
мегакариопоэтических ростков кроветворной
ткани. Кроме того, термин «лейкемия»
подразумевает и увеличение числа
лейкоцитов в крови, что при лейкозах
наблюдается не всегда.
Уровень
заболеваемости лейкозами в разных
странах колеблется от 3 до 10 человек на
100 000 населения. При этом мужчины
болеют различными формами лейкоза в
1,5 раза чаще, чем женщины. Максимальный
уровень заболеваемости хроническими
лейкозами отмечается у людей старше
40–50 лет, а острыми — в возрасте до 10–18
лет.
Гематосаркомы
также происходят из кроветворных клеток,
но находятся вне костного мозга. Кроме
того, гематосаркомы, в отличие от
лейкозов, характеризуются местным,
локальным ростом. Их клетки не
распространяются по системе кроветворения
(до этапа метастазирования). Однако
лейкозы и гематосаркомы могут «переходить»
друг в друга: метастазирование лейкозных
клеток за пределы костного мозга (в
лимфоузлы, селезенку, миндалины) приводит
к развитию гематосарком и наоборот —
попадание клеток гематосарком в костный
мозг обусловливает развитие лейкоза.
Этиология
и патогенез гемобластозов. Причинами
гемобластозов, как и других опухолей,
являются канцерогенные агенты химической,
физической и биологической природы.
Одно
из важных условий, способствующих
возникновению гемобластозов, —
«наследственно-генетический» фактор.
Об этом свидетельствуют, в частности:
1) наличие так называемых «лейкозных
семей», 2) частое развитие лейкозов у
людей с патологией хромосом (при трисомии
21-й пары, синдроме Дауна лейкоз бывает
в 18–20 раз чаще), 3) высокая частота
структурных изменений в хромосомах
лейкозных клеток. Другим условием,
способствующим реализации действия
канцерогенных факторов, служит низкая
активность антиканцерогенных механизмов
противоопухолевой резистентности
организма.
Трансформация
нормальных гемопоэтических клеток в
опухолевые является следствием изменения
в геноме, обеспечивающим «переключение»
нормальной генетической программы на
программу формирования опухолевого
атипизма. При этом под действие канцерогена
опухолевой трансформации попадает одна
гемопоэтическая клетка, затем дающая
в процессе пролиферации начало клону
«однотипных» гемобластозных клеток.
Важное условие, способствующее опухолевой
трансформации клеток гемопоэтической
ткани, — это снижение активности
антимутационных механизмов противоопухолевой
защиты (первичный или вторичный
иммунодефицит).
Характеристика
атипизма гемобластозов. В
основе формирования атипизма гемобластозов
лежит процесс опухолевой прогрессии.
Опухолевая прогрессия по своему существу
является механизмом нарастания степени
злокачественности опухолевых клеток.
Повышенная и постоянная изменчивость
свойств опухолей, обусловливая их
гетерогенность, создает условия для
все большей приспособленности их клеток
к условиям среды, включая и возможность
«ускользания» от цитостатической
терапии.
К
числу основных проявлений опухолевой
прогрессии гемобластозов относят
следующие: 1) трансформацию гемобластозов
из моноклоновых в поликлоновые; 2) переход
лейкозов от алейкемической формы к
лейкемической; 3) метастазирование
гематосарком в костный мозг —
«лейкемизация» их; 4) метастазирование
лейкозных клеток во внекостно-мозговую
гемопоэтическую ткань, а также — вне
органов гепоэза; 5) угнетение нормальных
ростков кроветворной ткани с развитием
анемии, тромбоцитопении; 6) снижение
числа относительно дифференцированных
опухолевых клеток и увеличение бластных
их форм;
7) утрату ферментной специфичности
лейкозных клеток; 8) нарастание признаков
клеточного атипизма; 9) формирование
устойчивости к воздействию противоопухолевых
агентов. Процесс опухолевой прогрессии
является основой формирования атипизма
роста, обмена, функции и структуры
гемобластозов.
Атипизм
роста.
В костном мозге при лейкозах обнаруживают
клетки, относящиеся к двум качественно
разным типам гемопоэза: нормальному и
лейкозному. Кроме того, выявляются
признаки патологического «омоложения»
состава гемопоэтических клеток. Это
отражает процесс диффузного увеличения
числа делящихся лейкозных костно-мозговых
клеток, в основном I–III классов,
сопровождающегося нарастанием количества
атипичных бластных и молодых клеток
гемопоэтической ткани.
В
периферической крови происходит
следующий комплекс изменений:
1)
нередко наблюдается лейкемическая
картина крови, характеризующаяся
увеличением количества лейкоцитов
разной степени зрелости: бластных форм
и их предшественников, молодых клеток.
Этому способствует увеличение
проницаемости (в условиях опухолевого
процесса) гистогематического барьера,
который в норме препятствует элиминации
незрелых и бластных клеток из костного
мозга в кровь.
В
зависимости от общего количества
лейкоцитов и наличия бластных клеток
в единице объема крови выделяют четыре
формы лейкоза: лейкемическую, когда
число лейкоцитов больше 50–80109/л
и обнаруживается большое количество
бластных форм лейкозных клеток;
сублейкемическую, когда число лейкоцитов
больше 9109/л,
но меньше 80109/л,
при наличии большого количества бластных
клеток; лейкопеническую, когда число
лейкоцитов ниже нормы и обнаруживаются
единичные бластные лейкозные клетки;
алейкемическую, при которой количество
лейкоцитов в периферической крови
нормально, а также отсутствуют бластные
клетки. В данном случае увеличение
количества атипичных лейкоцитов, их
бластных и молодых форм выявляется в
ткани костного мозга.
2)
для острого миелобластного лейкоза
(очень частая форма) характерно наличие
признака «Hiatus leukaemicus» — лейкемического
«провала». Он характеризуется наличием
в крови, с одной стороны, бластных и
молодых лейкозных клеток (чаще
нейтрофильного ряда), с другой — зрелых
сегментоядерных нейтрофилов и с третьей
— отсутствием одной или нескольких
переходных форм, например, миелоцитов,
промиелоцитов. Причина — торможение
или блок процесса созревания лейкозных
клеток. Это характерное проявление
атипизма дифференцировки опухолевых
клеток вообще;
3)
при хроническом миелолейкозе отсутствует
признак лейкемического «провала», но,
как правило, наблюдается так называемая
«эозинофильно-базофильная ассоциация»,
которая характеризуется одновременным
существенным увеличением количества
базофилов и эозинофилов в периферической
крови. Это следствие того, что образуется
большое количество атипичных бластных
клеток и их предшественников миелоцитарного
«ростка» гемопоэза. Из них созревает
соответственно и большее количество
зрелых форм лейкозных гранулоцитов (в
том числе эозинофилов и базофилов,
которые в норме обнаруживаются в
небольшом количестве);
4)
спутником большинства лейкозов является
анемия. Степень ее интенсивно нарастает
при острых формах лейкозов. При хронических
лейкозах анемия прогрессирует медленно.
Причины
развития анемии:
а) подавление пролиферации клеток
нелейкозного-эритропоэтического
«ростка» гемопоэза лейкозными клетками
(в частности их метаболитами), а также
интенсивным потреблением лейкозными
клетками субстратов обмена веществ; б)
торможение деления нормальных стволовых
клеток, в том числе дифференцирующихся
в эритроциты;
5)
развитие лейкозов часто сопровождается
выраженной тромбоцитопенией. Причины
те же, что и при анемии;
6)
тромбоцитопения и эритропения
обусловливают снижение свертываемости
крови. Мы знаем, что тромбоциты и
эритроциты содержат большинство факторов
свертывания;
7)
геморрагический синдром. Проявляется
частыми кровотечениями, в том числе в
полости тела и полые органы (желудок,
кишечник, мочевой пузырь). Причина —
снижение свертываемости крови, а также
«разрыхление» стенок сосудов в связи
с образованием в них метастазов
(гематосарком). Это биохимический
атипизм, он проявляется в следующем: а)
прекращается синтез в лейкозных клетках
отдельных ферментов или, напротив,
образуются новые, ранее отсутствовавшие
в этих клетках энзимы. Например, нарастание
степени «малигнизации» миелолейкоза
сопровождается утратой опухолевыми
клетками маркерных ферментов: кислой
фосфатазы, миелопероксидазы; б) развиваются
пара- и диспротеинемии. Парапротеинемия
характеризуется появлением в крови
иммуноглобулинов, синтезируемых
атипичными В-лимфоцитами, которые
отличаются от нормальных по биохимическому
составу. Примером могут быть аномальные
моноклоновые иммуноглобулины: свободные
легкие цепи (белок Бенс–Джонса);
«полумолекулы» иммуноглобулинов,
состоящие из отдельных белковых цепей
без дисульфидных связей.
В
основе дис- и парапротеинемий лежит
изменение генетической информации в
атипичных лимфоцитах (экспрессия ранее
«молчавших» или подавление «активированных»
генов).
Структурный
атипизм.
Проявляется, с одной стороны, тканевым
атипизмом — это изменение соотношения
числа клеток (лейкозных) с другими
клетками гемопоэтической ткани, а с
другой — клеточным атипизмом (нарушением
структуры отдельных клеток). Последний
характеризуется увеличением объема
клеток, изменением формы (уродливые
клетки), нарастанием объема ядра,
изменением числа, формы и объема
субклеточных структур.
Главная
причина формирования тканевого и
клеточного атипизма лейкозов — изменения
в геноме, что сопровождается нарушением
синтеза нуклеиновых кислот, белков и
липидов, необходимых для пластических
процессов.
Функциональный
атипизм. Характеризуется
расстройством функций лейкозных клеток:
1)
нарушением функционирования опухолевых
клеток, относящихся к иммунокомпетентной
системе (Т,-В-лимфоциты). Проявляется
снижением фагоцитарной активности
лейкоцитов, нарушением механизмов
реализации клеточного и гуморального
иммунитета. Все это обусловливает
развитие иммунодефицита и, следовательно,
снижение противоинфекционной устойчивости
организма (часто развивается сепсис,
фурункулез, пневмонии);
2)
снижением специфических функций
атипичных эритроцитов и тромбоцитов,
соответственно при эритромиелозе,
мегакариобластном и мегакариоцитарном
лейкозах. Как следствие — развитие
анемии, нарушение гемостаза с формированием
тромбогеморрагического синдрома.
Совокупность
указанных изменений при опухолевом
атипизме лейкозных клеток приводит к
ряду других проявлений, в частности, к
развитию лихорадочных состояний,
наблюдаются они у 60 % пациентов с
лейкозами. Это следствие повышенного
лизиса атипичных лейкоцитов,
сопровождающегося высвобождением из
них интерлейкина-1. Повышение температуры
тела нередко возникает из-за развивающейся
инфекции.
Кроме
того, лейкозы характеризуются нарушением
течения адаптивных процессов и реакций.
Например, воспаление у пациентов с
лейкозами протекает с преобладанием
альтеративных, экссудативных и
язвенно-некротических реакций (следствие
депрессии иммунных механизмов,
гипопротеинемии).