Ишемическая болезнь сердца и анемия
Ишемическая болезнь сердца (ИБС) – патология, в основе которой лежит поражение миокарда, обусловленное недостаточным его кровоснабжением. Атеросклеротическое сужение коронарных артерий является патогенетической основой ИБС, но для развития ишемии миокарда требуется еще дополнительный фактор, ведущий к нарушению баланса пропускной способности коронарных артерий и потребности миокарда в кислороде.
Чаще всего это увеличение работы ЛЖ (тахикардия, повышение систолического АД) или недостаточность коронарного кровотока (тромбообразование в венечных артериях, спазм). Реже как факторы, способствующие развитию или прогрессированию ИБС, рассматриваются снижение перфузионного давления (ДАД) или нарушение кислород-транспортной функции крови и т. д.
Для наглядности приводим выписки из историй болезни пациентов, у которых эти факторы играли роль «запускающего механизма». Мнение о том, что штаны принято носить только мужчинам, а женщины должны быть утонченные и элегантные, отдавая предпочтение юбкам и платьям, в нынешнее время абсолютно не актуально.
Клинический случай 1
Больной Ш., 84 года, был госпитализирован в мае 2013 г. с жалобами на давящие боли за грудиной при небольшой физической нагрузке и в покое.
Более 30 лет регистрируются высокие цифры АД (до 200/120 мм рт. ст.), сахарный диабет 2-го типа.
4 мес. назад перенес острый инфаркт миокарда без зубца Q боковой стенки левого желудочка. При коронарографии: передняя межжелудочковая ветвь (ПМЖВ) левой коронарной артерии (ЛКА) стенозирована в проксимальной трети на 50%, в дистальной трети — последовательные стенозы 30–50%; огибающая артерия (ОА) стенозирована в средней трети на 70%, правая коронарная артерия (ПКА) субокклюзирована в передней трети, окклюзирована в средней трети, дистальная часть слабо контрастируется по меж- и интраартериальным анастомозам. Выполнено стентирование средней трети ОА. Реканализацию ПКА выполнить не удалось.
Обращено внимание на наличие гипохромной анемии легкой степени (гемоглобин -106 г/л). Проведенное обследование возможного источника кровотечения не выявило. Выписан в удовлетворительном состоянии с рекомендацией приема ацетилсалициловой кислоты и клопидогрела, сахароснижающей терапии, препаратов железа.
Дома рекомендованные препараты принимал нерегулярно, врача не посещал.
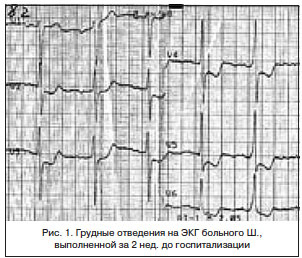
Около 2 мес. назад отметил нарастание слабости. Стали беспокоить редкие приступы загрудинных болей. На ЭКГ от 10.05.13 г.: на фоне синусового ритма с ЧСС 75 уд./мин — выраженная депрессия сегмента ST в отведениях V2-6 (рис. 1). От предложенной госпитализации отказался.
Последние 2 нед. участились приступы загрудинных болей давящего характера, они стали возникать при минимальной физической нагрузке и в покое, сублингвальный прием нитроглицерина оказывал кратковременное действие, появилось чувство нехватки воздуха. Обратился в поликлинику, откуда был доставлен в ЦКБ с диагнозом «ИБС, прогрессирующая стенокардия».
При поступлении: кожные покровы бледные. Отеков нет. ЧД — 18 в 1 мин. Дыхание жесткое. Пульс — 72, АД — 140/70 мм рт. ст. на обеих руках. Систолический шум в точке Боткина и на верхушке, проводящийся в левую подмышечную область.
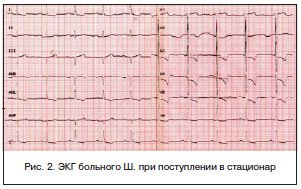
ЭКГ при поступлении (рис. 2): синусовый ритм с ЧСС 59 уд./мин, замедление атриовентрикулярной проводимости (PQ — 0,24 с). Замедление проводимости по левому предсердию и желудочку. Гипертрофия левого желудочка. Нарушение реполяризации в V2-5.
ЭхоКГ: гипертрофия миокарда ЛЖ (ММЛЖ — 240 г). Утолщение межжелудочковой перегородки (МЖП), более выраженное в базальной части (1,6–1,8 см), без признаков обструкции выходного отдела ЛЖ. Толщина ЗСЛЖ — 1,5 см. Сократительная способность миокарда ЛЖ удовлетворительная (ФВ по Тейхольцу — 63%), КСР — 3,6 см, КДР — 5,5 см, ЛП — 5,1 см. Зон нарушенной кинетики не выявлено. Изменение диастолической функции ЛЖ по первому типу.
В экстренном порядке выполнена коронароангиография (КАГ) (рис. 3): ствол ЛКА не изменен. ПМЖВ стенозирована на границе передней и средней третей на 50%, на протяжении дистальной трети — последовательные стенозы 30–60%. 1ДВ — анатомически некрупная, стенозирована в устье на 80%, окклюзирована в средней трети, дистальная часть слабо контрастируется по интерартериальным коллатералям. ВТК стенозирована в устье до 50%. ОВ анатомически крупная, проходима на всем протяжении, ранее имплантированные стенты — без стенотических изменений. ПКА субокклюзирована в передней трети, окклюзирована в средней трети, дистальная часть слабо контрастируется по меж- и интраартериальным анастомозам. Сбалансированный тип коронарного кровоснабжения.
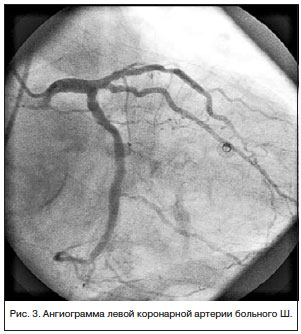
Учитывая отсутствие динамики стенозов-КА по сравнению с КАГ от января 2013 г., чрескожное коронарное вмешательство не проводилось.
В анализе крови: гемоглобин — 61 г/л, эритроциты — 2,30×10*12, ЦП — 0,8, гематокрит — 18,5, лейкоциты — 7,7×10*9.
Кардиоспецифические ферменты (КФК МВ, тропонин Т) находились в пределах референсных значений.
В анализе мочи: удельный вес — 1020, белок — 0,15, лейкоциты — 0–5 в поле зрения, эритроциты — 100–150 в поле зрения.
Дополнительный целенаправленный расспрос позволил выяснить, что на протяжении последних 4 мес. неоднократно были эпизоды выделения темно-красной мочи, иногда длившиеся по несколько дней (макрогематурия?).
Убедительных данных, говорящих об остром очаговом поражении миокарда, на момент госпитализации не получено. Учитывая наличие анемии тяжелой степени, произведена трансфузия отмытых эритроцитов (1150 мл за 2 сут) с положительным эффектом: уровень гемоглобина повысился до 100 г/л, число эритроцитов — до 3,59×10*12, гематокрит — до 29,4.
На ЭКГ через 1 сут после последней гемотранфузии отмечается нормализация конечной части желудочковых комплексов в грудных отведениях (в V4 — зубец Т слабоотрицательный).
Самочувствие пациента значительно улучшилось: в течение последующих 3 сут при расширении двигательного режима до уровня физических нагрузок, соответствующих 3 функциональному классу, боли в грудной клетке не возникали, выраженность одышки существенно уменьшилась, объем нагрузок ограничивался главным образом мышечной утомляемостью. Эпизоды макрогематурии не повторялись. В удовлетворительном состоянии больной переведен для дообследования в урологическое отделение.
Клинический случай 2
Больной К., 50 лет, госпитализирован в стационар в декабре 2014 г. с клиникой прогрессирования стенокардии напряжения, одышки, возникающих при минимальной физической нагрузке, в покое, с нарастанием общей слабости в течение последнего месяца.
В анамнезе: АГ с максимально известными значениями АД 200/100 мм рт. ст. давностью более 15 лет; регулярно принимает антигипертензивные препараты, однако контроль АД нерегулярный. В 2002 г. перенес ОИМ, в этом же году выполнено аортокоронарное шунтирование (АКШ) ПМЖА, ПКА, ОА. В 2009 г. развилась клиника прогрессирующей стенокардии, в связи с чем выполнено стентирование шунта к ОВ ЛКА. В мае 2014 г. — повторный ОИМ задней стенки левого желудочка, проводился системный тромболизис, чрескожное коронарное вмешательство с реканализацией и стентированием АКШ к ОА. После выписки и до настоящей госпитализации — состояние стабильное.
Сопутствующие заболевания: сахарный диабет 2-го типа, мочекаменная болезнь, хронический геморрой, железодефицитная анемия легкой степени регистрируется с 2009 г. (препараты железа не принимал).
При поступлении: кожные покровы бледные, сухие. ЧД — 18 уд./мин. Дыхание жесткое, небольшое количество свистящих хрипов на выдохе. Тоны сердца глухие. ЧСС -76 уд./мин. АД — 150/90 мм рт. ст. на обеих руках.
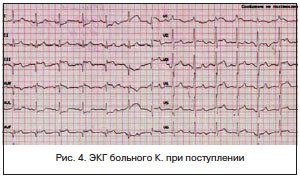
ЭКГ зарегистрирована на фоне болевого приступа (рис. 4): ритм синусовый, ЧСС — 88 уд./мин, смещение сегмента ST вверх от изолинии в отведениях III, aVF, V1. В отведениях I и aVL смещение сегмента ST книзу от изолинии. Зубец Q длительностью 0,04 с во II, III, aVF отведениях.
ЭхоКГ: гипертрофия миокарда ЛЖ (ММЛЖ — 213 г, МЖП — 1,5 см, ЗСЛЖ — 1,2 см). Дилатация левого предсердия (5,3×6,1 см). Нарушение диастолической функции левого желудочка по первому типу. Гипокинез диафрагмального, заднебазального и заднебоковых сегментов. ФВ — 54% по Тейхольцу.
В общем анализе крови: гемоглобин — 70 г/л, эритроциты — 4,29×10*12, гематокрит -23,5, ЦП — 0,48, гипохромия, анизоцитоз, пойкилоцитоз (овалоциты, мишеневидные эритроциты), лейкоциты — 5,9×10*9. Сывороточное железо — 1,9.
Кардиоспецифические ферменты (КФК МВ, тропонин Т) находились в пределах референсных значений.
Таким образом, убедительных данных, свидетельствующих об остром очаговом поражении миокарда, на момент госпитализации не получено. Высказано предположение, что причиной прогрессирования стенокардии являлась тяжелая железодефицитная анемия, вероятнее всего, постгеморрагическая. Проведена трансфузия эритроцитной взвеси 630 мл за первые сутки, начато парентеральное введение препаратов железа.
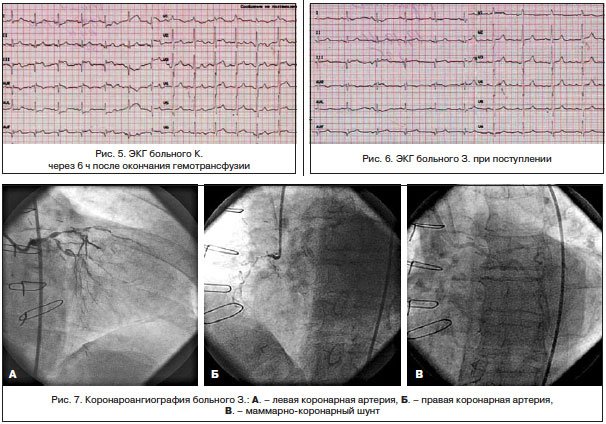
Трансфузионную терапию перенес хорошо. Ангинозные боли не рецидивировали. На ЭКГ, зарегистрированной после гемотрансфузии (рис. 5): ЧСС — 62 уд./мин. Сегмент ST вернулся к изолинии.
В анализе крови спустя 1 сут: уровень гемоглобина возрос до 105 г/л, число эритроцитов — до 5,71×10*12, гематокрит — 38,3, ЦП — 0,55, гипохромия, анизоцитоз сохраняются. Лейкоциты — 8×10*9.
В течение 3 сут пациент находился в ОРИТ, антиангинальной терапии не требовалось, т. к. приступы стенокардии не рецидивировали.
Проводился поиск возможного источника кровопотери, онкопоиск: при колоноскопии выявлен хронический комбинированный геморрой 3 ст. Другой патологии, которая могла бы объяснить наличие анемии, не найдено.
Проводилось постепенное расширение двигательного режима. Физические нагрузки, соответствующие уровню 3 функционального класса, приступов стенокардии и ЭКГ-признаков ишемии миокарда не вызывают.
Через 12 дней в стабильном состоянии пациент выписан для дальнейшего лечения в амбулаторных условиях. Хирургом рекомендовано выполнение в плановом порядке дезартеризации геморроидальных узлов под ультразвуковым контролем.
Клинический случай 3
Больной З., 82 года, госпитализирован в стационар с жалобами на дискомфорт за грудиной, нехватку воздуха, возникающие без четкой связи с физической нагрузкой, длительностью до 4–5 мин, накануне был затяжной приступ длительностью более 1 ч, выраженную слабость, потливость. Настоящее ухудшение состояния отмечает в течение последних 3 дней на фоне появившейся гипотонии.
В течение 2 нед. до госпитализации принимал по поводу дорсалгии нестероидные противовоспалительные препараты (НПВП) (кеторолак). 4 дня назад отметил появление учащенного жидкого стула темной окраски, необычно низкое АД — 80/40 мм рт. ст.
В 1995 г. перенес ОИМ нижней стенки ЛЖ. В этом же году выполнено маммарно-коронарное шунтирование ПМЖА, АКШ ЗБВ ОА и ПКА. В 2003 г. — линейное аортобедренное шунтирование синтетическим протезом слева. Ранний послеоперационный период осложнился развитием повторного ОИМ нижней стенки ЛЖ.
С 2009 г. — пароксизмы мерцательной тахиаритмии.
Постоянно принимает бисопролол — 2,5 мг/сут, периндоприл — 5 мг/сут, аторвастатин — 20 мг/сут, варфарин — 5 мг/сут. Контроль МНО не проводился более года.
При поступлении: кожные покровы и видимые слизистые бледные. Число дыханий — 20 в 1 мин. Дыхание ослабленное, жесткое. Тоны сердца глухие, ритмичные. ЧСС — 76 уд./мин. АД — 110/70 мм рт. ст.
Лабораторные данные: гемоглобин — 91 г/л, эритроциты — 3,93×10*12, гематокрит — 33,0, ЦП — 0,84, лейкоциты — 10,2–10,6×10*9, тромбоциты — 223×10*9, анизоцитоз, анизохромия.
Кардиоспецифические ферменты: КФК — 268 при поступлении, через 10 ч — 319, КФК МВ — 30 при поступлении, через 10 ч — 42, тропонин Т при поступлении — 177, через 10 ч — 538.
Сывороточное железо — 13 мкмоль, белки транспорта железа в границах нормы. Коагулограмма: АЧТВ — нет коагуляции, МНО — нет коагуляции, фибриноген — 3,3 г/л, Д-димер — 1147.
ЭКГ (рис. 6) при поступлении: синусовый ритм, АВ-блокада I ст., рубцовые изменения нижней стенки ЛЖ, смещение сегмента ST во II, III и avF отведениях, высокий R — в V1-2. Архив ЭКГ не предоставлен.
ЭхоКГ: склероз и кальциноз стенок аорты, кольца и створок АК. ММЛЖ — 204 г, толщина МЖП — 1,0 см, ЗСЛЖ — 1,0 см. Дилатация левых отделов сердца (ЛП — 4,5×5,5 см, левый желудочек: КСО — 92, КДО — 171). Относительная недостаточность МК II степени. Гипокинез среднего заднего и заднебокового сегментов ЛЖ. Снижение глобальной сократительной способности миокарда ЛЖ (ФВ по Тейхольцу — 47%). Диастолическая дисфункция левого желудочка первого типа.
С учетом жалоб, анамнеза, лабораторно-инструментальных данных у больного диагностирован повторный ОИМ диафрагмальной и заднебазальной локализации.
Не исключалось состоявшееся желудочно-кишечное кровотечение на фоне приема НПВП и орального антикоагулянта, в связи с чем экстренно выполнена ЭГДС: эндоскопические признаки хронического эзофагита, язва нижней трети пищевода Forrest II C. Острая язва желудка Forrest II B (без признаков продолжающегося кровотечения). Язва привратника Forrest I B (с признаками продолжающегося кровотечения). После эндоскопического инъекционного гемостаза кровотечение остановлено.
Причиной ОИМ, вероятно, явилась гипотония и анемия на фоне желудочно-кишечного кровотечения. Начата консервативная гемостатическая, противоязвенная терапия. От проведения КАГ с возможным чрескожным коронарным вмешательством решено воздержаться до стабилизации состояния.
На фоне лечения цифры АД стабилизировались на уровне 120/85 мм рт. ст., уровень гемоглобина повысился до 110 г/л, возросло число эритроцитов — до 5,71×10*12, гематокрит — 38,3, ЦП — 0,55, лейкоциты — 8×10*9, гипохромия, анизоцитоз сохраняются.
Уровень активности КФК снизился до 113 ед, МВ КФК — до 12,7, тропонина Т — до 225.
ЭГДС через 2 сут: язва нижней трети пищевода Forrest III, острая язва желудка Forrest III, язва привратника Forrest II С (отсутствие признаков кровотечения, появление в области дна фибрина).
На 3-й день пребывания в стационаре возобновились кратковременные приступы сжимающих болей за грудиной (2 приступа: во время приема пищи и при попытке сесть в кровати).
По экстренным показаниям выполнена коронароангиография (рис. 7): ствол ЛКА стенозирован на протяжении передней и средней трети до 70%, субокклюзирован в дистальной трети с переходом на устья ОВ и ПМЖВ; ПМЖВ субокклюзирована в устье, стенозирована в передней трети на 80%, окклюзирована в средней трети, дистальная часть контрастируется по функционирующему маммарно-коронарному шунту. ОВ субокклюзирована в устье, стенозирована в передней трети на 80%; ПКА субокклюзирована на протяжении передней и средней трети, окклюзирована на границе средней и дистальной третей, дистальная часть контрастируется по межартериальным анастомозам.
Правый тип коронарного кровоснабжения.
Маммарно-коронарный шунт из правой маммарной артерии в дистальной трети ПМЖВ проходим. Шунты к ОА и ПКА не визуализируются.
Попытка реканализации стенозированных артерий — без успеха в связи с выраженным кальцинозом.
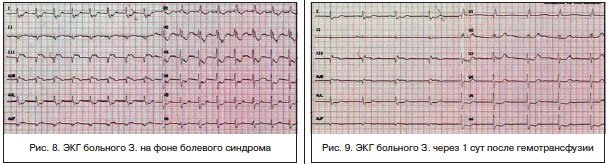
В течение последующих суток — состояние с отрицательной динамикой: в виде учащения кратковременных приступов стенокардии, сопровождающихся выраженными ЭКГ-признаками ишемии миокарда (рис. 8). Отмечено снижение гемоглобина со 110 до 87 г/л, гематокрита — до 26,0.
Кардиоспецифические ферменты в пределах нормальных значений. ЭхоКГ: размер левых отделов сердца прежний, новых участков нарушения движений стенок ЛЖ не выявлено.
Гастроскопия: активное кровотечение из острого дефекта слизистой кардиоэзофагеального перехода (Forrest I). Эндоскопическая остановка кровотечения.
После переливания 600 мл эритроцитной взвеси состояние с положительной динамикой: ангинозные боли и ЭКГ-признаки ишемии миокарда не рецидивируют (рис. 9), восстановление уровня гемоглобина (110 г/л), эритроцитов (3,85×10*12), гематокрита -33,7.
При контрольной ЭГДС через 10 дней положительная динамика — уменьшение в размерах язвенных дефектов без признаков кровотечения.
На фоне терапии ингибиторами протонной помпы, β-блокаторами, клопидогрелом 75 мг/сут показатели красной крови стабильны, двигательный режим расширен и по уровню нагрузок соответствует 3 ФК.
ХМЭКГ: ритм синусовый, ЧСС (за сут/днем/ночью): 78/77/78 уд/мин, максимальная ЧСС — 99 уд/мин, минимальная — 64 уд/мин. Отмечается появление депрессии сегмента ST при увеличении ЧСС свыше 90 уд/мин.
Приведенные случаи демонстрируют возможность проявления коронарной недостаточности на фоне снижения кислород-транспортной способности крови как у пациентов с тяжелым, так и умеренным поражением коронарного русла. Устранение анемии во всех трех случаях способствовало повышению коронарного резерва и стабилизации состояния.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Суворова С.А.
1
Завьялов А.И.
1
Пархонюк Е.В.
1
Шварц Ю.Г.
1
1 ГБОУ ВПО «Саратовский государственный медицинский университет им. В.И. Разумовского Минздравсоцразвития России», Саратов
Исследованы взаимосвязи анемического синдрома у пациентов с ишемической болезнью сердца с хроническими заболеваниями верхних отделов желудочно-кишечного тракта. У стационарных больных с коронарной патологией значимыми факторами, негативно отражающимися на уровне гемоглобина, наряду с женским полом и хронической сердечной недостаточностью является гастроэзофагеальная рефлюксная болезнь. Уровень гемоглобина в крови у пациентов с эндоскопически позитивной ГЭРБ зависел от сочетания ИБС с эрозивной формой эзофагита. Наличие эрозий в пищеводе при этом ассоциировалось с относительным снижением уровня сывороточного железа.
анемия
ишемическая болезнь
Гастроэзофагеальная рефлюксная болезнь
гемоглобин
сывороточное железо
1. Взаимосвязь уровня провоспалительных факторов с выраженностью сердечной недостаточности при ишемической болезни сердца / Ю.Н. Беленков, С.Н. Татенкулова, В.Ю. Мареев и др. // Сердечная недостаточность. –2009. – №3 (53). – С. 137.
2. Козлова И.В. Гастроэзофагеальный рефлюкс и степень эзофагита у больных ишемической болезнью сердца: влияние на показатели реполяризации миокарда и вариабельность сердечного ритма / И.В. Козлова, С.В. Логинов, Ю.Г. Шварц // Клин. мед. – 2004. – № 9.– С. 33–35.
3. Определение значения анемии в прогнозе рецидива острого инфаркта миокарда / Ю.Г. Шварц, Т.Ю. Калюта, Р.Н. Каримов и др. // Кардиоваскулярная терапия и профилактика. – 2006. – №4. – С. 65–69.
4. Ускач Т.М. Клинико-статистический анализ распространенности анемии у пациентов с хронической сердечной недостаточностью / Т.М. Ускач, А.Г. Кочетов, С.Н.Терещенко // Кардиология. – 2011. – № 1. – С. 11–17.
5. ACC/AHA guidelines for the management of patients with unstable angina and non-ST-segment elevation myocardial infarction. A report of the American College of Cardiology / American Heart Association Task Force on Practice Guidelines (Committee on the Management of Patients With Unstable Angina) / E. Braunwald, E.M. Antman, J.W. Beasley, et al. //JACC. – 2000. – № 36. – P. 970–1062.
6. Adlbrecht C. Chronic heart failure leads to an expanded plasma volume and pseudoanaemia, but does not lead to a reduction in the body’s red cell volume / C. Adlbrecht, S. Kommata, M. Hülsmann // Eur. Heart J. –2008. – Vol. 29, №19. – P. 2343–2350.
7. Anaemia as an inflammation-mediated condition during chronic heart failure. Possible role of fibrinogen / S. Morelli, F. Di Girolamo, A. Angelino et al. // Acta Cardiol. – 2008. – Vol. 63, №5. – P. 565–567.
8. Hessel F. Anemia and Mortality in Heart Failure Patients: A Systematic Review and Meta-Analysis / F. Hessel, L. James, D. Kevin // J. Am. Coll. Cardiol. – 2008. – Vol. 52, №10. – P. 818–827.
9. Impact of infectious Burden on extent and Long-Term Prognosis of atherosclerosis / C. Espinola-Klein, H.J. Rupprecht, S. Blankenberg et al. // Circulation. – 2002. – №105. – P. 15–18.
10. Nutritional anemias: report of a WHO scientific group. Geneva World Health Organization 1068 // Published WHO document WHO/MCH/MSM/92.2. – P. 1–100.
Анемический синдром — нередкое явление среди коронарных больных, и в России ее встречаемость, по данным литературы, выше, чем в странах Запада [4]. Установлено существенное значение анемии как фактора риска неблагоприятного прогноза при различных формах ишемической болезни сердца (ИБС), в частности при остром коронарном синдроме и сердечной недостаточности [4, 6].
Различной степени выраженности анемия является нередким спутником хронической сердечной недостаточности (ХСН) [4, 8]. Частота такого сочетания колеблется от 10 до 79 %, в зависимости от возраста и пола больных, тяжести клинических проявлений, а также критериев диагностики анемии [4]. При остром инфаркте миокарда анемия сочетается с [3] повышенным риском развития постинфарктной стенокардии, рецидивированием инфаркта миокарда, неблагоприятным течением кардиогенного шока и развитием более тяжелых проявлений сердечной недостаточности после инфаркта миокарда [3]. Кроме того, анемический синдром считается одним из экстракардиальных механизмов, способствующих проявлению ишемической болезни сердца, в связи с чем считается целесообразным учитывать данный фактор при классификации нестабильной стенокардии [5].
Следует отметить, что анемия у стационарных больных с ишемической болезнью сердца не отражена как проблема ни в одном национальном руководстве. Данные о причинах развития анемического синдрома у коронарных больных немногочисленны и противоречивы. Потенциальными причинами развития анемического синдрома на фоне ИБС, в том числе, являются болезни желудочно-кишечного тракта, но исследованы они в этом контексте недостаточно.
В этой связи была поставлена задача: изучить взаимосвязь хронических заболеваний верхних отделов желудочно-кишечного тракта и анемии у стационарных больных с ишемической болезнью сердца.
Материалы и методы исследования
Исследование выполнено в два этапа. Первоначально были проанализированы истории болезни с результатами обследования 514 пациентов, которые последовательно поступили в кардиологический стационар за 2006-2008 год, по поводу проявлений и осложнений ишемической болезни сердца, средний возраст больных составил 55,6 ± 12 лет, из общего числа обследованных было 229 женщин.
Все пациенты получали консервативную терапию, основанную на рекомендациях ESC и ВНОК, в зависимости от формы заболевания.
Критерии исключения: опасные для жизни нарушения ритма, признаки развития острого или обострения хронического инфекционного заболевания, тяжелая по критериям ВОЗ анемия, сердечная недостаточность в III стадии, злокачественные новообразования, острая фаза или осложненное течение гастроэнтерологических заболеваний, перенесенное обострение подобного заболевания с явным или возможным кровотечением в последние 3 месяца, установленное хроническое заболевание почек, другие опасные для жизни заболевания и состояния, любые кровотечения в течение полугода.
Из общего числа пациентов у 142 в стационаре были выполнены эндоскопия верхних отделов пищеварительного тракта и ультразвуковое исследование органов брюшной полости по назначению лечащего врача. У этой категории больных нами учитывались наличие гастроэзофагеальной рефлюксной болезни (ГЭРБ), хронического эрозивного гастрита, язвенной болезни, хронического панкреатита и калькулезного холецистита, стеатоза печени. В значительном большинстве случаев диагноз подтверждался данными предыдущих инструментальных обследований и клинической картиной.
На втором этапе после предварительного анализа полученных первоначально данных проведено обследование 152 пациентов с ИБС, поступивших в клинику в 2009 году, женщин — 72, средний возраст 59,7 ± 11,1, из которых 78 наряду с ИБС отмечалась эндоскопически позитивная ГЭРБ. При отборе в данную группу, кроме вышеописанных критериев исключения, учитывались дополнительные: острый коронарный синдром, гемодинамически значимые аритмии, язвенная форма эзофагита.
ИБС подтверждалась наличием перенесенного Q-инфаркта миокарда, или типичной клиникой ИБС в совокупности с положительным результатом стресс-тестов и/или в совокупности с подтвержденными ЭКГ, в том числе при мониторировании, эпизодами ишемии миокарда, и/или нарушением локальной сократимости миокарда по данным эхокардиографии. У 68 % больных отмечалась артериальная гипертония, 54 % пациентов перенесли раний инфаркт миокарда, у 65 % — хроническая сердечная недостаточность II и у 10 % — III класса. Группы с наличием и отсутствием ГЭРБ были сопоставимы по тяжести кардиальной патологии, полу и возрасту.
В качестве контрольной группы использовались данные о 73 пациентах с эндоскопически позитивной ГЭРБ, не страдающих ИБС и другой тяжелой кардиальной патологией. Из них 37 женщин, средний возраст 56,2 ± 10,5. Учитывались результаты эндоскопии, в том числе катаральная, либо эрозивная форма ГЭРБ в соответствии с классификацией Savary-Miller [2], гематологические показатели, уровень железа в сыворотке крови. Использовали гематологический анализатор Beckman coulter Act 5 diff — (США) и биохимический анализатор HITACHY-911 (Япония). Анемия определялась по критериям ВОЗ как снижение уровня гемоглобина ниже 120 г/л у женщин и 130 г/л у мужчин [6, 8, 10].
Для статистической обработки применялся однофакторный и многофакторный дисперсионный (MANOVA) анализ, таблицы сопряженности с критериями хи-квадрат и Фишера, непараметрический корреляционный анализ. В качестве меры вариабельности использовалось среднее квадратичное отклонение (SD).
Результаты исследования и их обсуждение
В среднем уровень гемоглобина у наших обследуемых составлял 141,1 ± 5,9 г/л, содержание эритроцитов 4,43 ± 0,46∙1012/л. Среди всех обследуемых анемический синдром встречался в 16 % случаев. Эти показатели оказались более благоприятными, чем были установлены для пациентов с острым коронарным синдромом ранее [8] и у больных с тяжелой ХСН. Различия, очевидно, объясняются разными формами кардиальной патологии, критериями отбора и возрастом в сравниваемых исследованиях. В первой группе инструментально обследованных больных хронические заболевания желудочно-кишечного тракта встречались со следующей частотой: эндоскопически позитивная ГЭРБ — 55 %, язвенная болезнь (рубцовые изменения) — 15 %, холецистит — 20 %, панкреатит — 44 %, эрозивный гастрит 67 %. Эти результаты трудно сопоставить с данными литературы о распространенности указанных заболеваний в различных популяциях, так как обследование наших пациентов проводилось по назначению врача и не имело спланированного характера. Вместе с тем наибольшая частота ГЭРБ соответствует современному представлению об «эпидемии» этой патологии [2].
Многофакторный анализ (MANOVA) показал, что независимыми статистически значимыми (p < 0,05) факторами, связанными с уровнем гемоглобина в крови, являются пол, сердечная недостаточность и наличие ГЭРБ. Другие учитываемые заболевания, в том числе язвенная болезнь, не были значимо связаны с показателями красной крови. Последнее может объясняться нашими критериями исключения. Полученные данные послужили основанием для уточнения взаимосвязи ГЭРБ и анемического синдрома у больных ИБС.
Среди пациентов с ИБС, включенных во второй этап исследования, анемия встречалась несколько чаще, и средний уровень гемоглобина был несколько ниже, чем у больных из первой группы. Возможно, это было связано с большим средним возрастом. Анализ данных второго этапа исследования продемонстрировал, что у больных с сочетанием ИБС и ГЭРБ уровень гемоглобина был несколько (p < 0,1 при однофакторном анализе) ниже, чем у пациентов с ИБС. Подобная же тенденция отмечалась и в отношении уровня эритроцитов: у больных с коронарной патологией содержание в крови эритроцитов было максимальным, с ГЭРБ — «средним», с сочетанной патологией — минимальным. Соответственно анемия в этих группах встречалась у 19, 24 и 28 процентов больных (табл. 1). Эта тенденция не значима статистически, но возможно не случайна, с учетом вышеописанных результатов.
С использованием данных обследования пациентов, страдающих ГЭРБ и сочетанием ГЭРБ и ИБС, был проведен многофакторный анализ «влияния» формы эзофагита и наличия ИБС на изучаемые гематологические характеристики. Значимой зависимости уровня гемоглобина от факта наличия эрозий в пищеводе не установлено. Выявлено значимое независимое негативное «влияние» наличия ИБС на уровень гемоглобина. Кроме того, отчетливое «влияние» на изучаемый показатель оказывало сочетание 2-х факторов, ИБС и формы эзофагита.
Таблица 1
Показатели эритроцитов, гемоглобина крови и встречаемости анемии в зависимости от наличия ИБС и ГЭРБ (М ± SD)
Показатель | Группы пациентов | Значимость р | ||
ИБС | ГЭРБ | ГЭРБ и ИБС | ||
n = 75 | n = 73 | n = 78 | ||
Эритроциты, 1012/ л | 4,38 ± 0,45 | 4,28 ± 0,56 | 4,22 ± 0,46 | < 0,1 |
Гемоглобин, гл | 136,45 ± 12,86 | 134,66 ± 12,10 | 131,52 ± 14,87 | < 0,1 |
Встречаемость анемии, % | 19 | 24 | 28 | > 0,1 |
Из табл. 2 видно, что в целом у пациентов с комбинацией ИБС и ГЭРБ гемоглобин был несколько снижен, еще более низким был этот показатель у больных с сочетанием коронарной болезни сердца и эрозивной формы эзофагита. Среди подобных пациентов анемия встречалась в 35 %. Следует отметить, что среди пациентов с ГЭРБ без ИБС значимой взаимосвязи формы эзофагита и уровня гемоглобина не установлено.
Таблица 2
Показатели эритроцитов, гемоглобина крови и железа сыворотки в зависимости
от наличия ИБС и формы эзофагита при ГЭРБ (М ± SD). Результаты MANOVA
Диагноз | ИБС +ГЭРБ | ГЭРБ | Статистическая значимость «влияния» | ||||
Форма | катаральный | эрозивный | катаральный | эрозивный | формы эзофагита | ИБС | совместно ИБС и форма эзофагита |
Гемоглобин, г/л | 134,19 ± 16,55 | 124,82 ± 0,46 | 133,69 ± 12,19 | 136,14 ± 12,0 | 0,16 | 0,02 | 0,02 |
Железо сыворотки крови | 16,35 ± 5,43 | 11,55 ± 4,09 | 17,52 ± 5,11 | 12,43 ± 6,93 | 0,0001 | 0,41 | 0,90 |
При этом и многофакторный, и однофакторный дисперсионный анализ показателей содержания железа в сыворотке продемонстрировал противоположные закономерности.
Значимую зависимость от формы эзофагита и отсутствие таковой от наличия ИБС, при этом значения этого параметра не выходили за границу нормы [6] и можно говорить лишь об относительном
снижении.
Заключение
Не исключено, что эрозии пищевода способствуют некоторой потере железа, которая чаще всего не так велика, чтобы вызывать явную анемию. Невысокую роль дефицита железа в развитии анемии у наших пациентов подтверждает слабая, хотя и статистически значимая, корреляция между уровнем гемоглобина и сывороточного железа (Kendall Tau = 0,30). Следовательно, негативная взаимосвязь ИБС и уровня гемоглобина, при отсутствии выраженного самостоятельного влияния ГЭРБ, позволяет думать о некой общности патогенеза ИБС, ГЭРБ и анемии у коронарных пациентов. Общим звеном может быть системное воспаление, которое, как известно, является одним из важных механизмов как атеросклеротического процесса [9], так и ГЭРБ, при том, что медиаторы воспаления могут угнетать костный мозг и создавать предпосылки для развития анемии [7]. Найдены подтверждения этому и для кардиальных больных, у которых отмечена негативная взаимосвязь между концентрацией С-реактивного белка и уровнем гемоглобина в крови. Складывается впечатление, что анемия при ИБС поливалентна и воспаление играет не меньшую роль, чем потери железа. Очевидно, что здесь приводится лишь одно из возможных объяснений и анализируются всего два фактора. Полученные данные позволяют говорить лишь о взаимосвязи трех патологических процессов: ИБС, анемии и ГЭРБ, оставляя много вопросов о механизмах данного явления и подчеркивая актуальность исследования в этой области.
Выводы
1. У больных, госпитализированных с ишемической болезнью сердца, значимыми факторами, негативно отражающимися на уровне гемоглобина, наряду с женским полом и хронической сердечной недостаточностью, является гастроэзофагеальная рефлюксная болезнь.
2. При сопоставлении групп пациентов с ИБС, ГЭРБ и сочетанием этих заболеваний наиболее низкие показатели гемоглобина и эритроцитов крови отмечались у больных с сочетанной патологией.
3. Уровень гемоглобина в крови у пациентов с эндоскопически позитивной ГЭРБ зависел от наличия ИБС и сочетания этого заболевания с эрозивной формой эзофагита. Наличие эрозий в пищеводе не обладало самостоятельным «влиянием» на гематологические маркеры анемии, ассоциируясь при этом с относительным снижением уровня сывороточного железа.
Рецензенты:
Олейников В.Э., д.м.н., профессор, зав. кафедрой терапии медицинского института Пензенского государственного университета, г. Пенза;
Лямина Н.П., д.м.н., профессор, зам. директора по научной работе ФГУ «Саратовский НИИ кардиологии Росмедтехнологий», г. Саратов.
Работа поступила в редакцию 10.10.2011.
Библиографическая ссылка
Суворова С.А., Завьялов А.И., Пархонюк Е.В., Шварц Ю.Г. АНЕМИЯ У ПАЦИЕНТОВ С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА И ГАСТРОЭЗОФАГЕАЛЬНАЯ РЕФЛЮКСНАЯ БОЛЕЗНЬ. ЕСТЬ ЛИ ВЗАИМОСВЯЗЬ? // Фундаментальные исследования. – 2011. – № 11-2. – С. 362-365;
URL: https://fundamental-research.ru/ru/article/view?id=29073 (дата обращения: 25.02.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)

