Иммунная гемолитическая анемия патофизиология
1)Иммунные гемолитические анемии.
При иммунных анемиях
гемолиз обусловлен действием антител,
вызывающих повреждение и гибель
эритроцитов. Выделяют следующие основные
группы иммунных гемолитических анемий:
Изоиммуные
гемолитические анемии— антитела
попадают в организм извне. Это наблюдается
при переливании крови, несовместимой
по системе АВО, гемолитической болезни
новорожденных.
Трансиммунные
гемолитические анемии-антитела
попадают в организм плода внутриутробно
от матери, страдающей аутоиммунной
гемолитической анемией. Если эритроциты
матери и ребенка имеют общие антигены,
против которых происходит выработка
антител в организме матери, то и у ребенка
возникает гемолитическая анемия.
Гетероиммунные
гемолитические анемии— происходит
выработка антител против антигена,
фиксированного на поверхности эритроцита.
Таким антигеном могут быть вирусы,
лекарства, разные инфекционные факторы.
Аутоиммунные
гемолитические анемии— антитела
вырабатываются против собственного
неизмененного антигена эритроцитов.
Главным звеном патогенеза служит
развитие аутоаллергической реакции
цитотоксического и цитолитического
типа. Аутоиммунные гемолитические
анемии делятся на несколько видов по
типу имеющихся антител:
Аутоиммунные
гемолитические анемии, вызванные
холодовыми гемагглютининами
При этом типе анемии
вырабатываются антиэритроцитарные
аутоантитела, принадлежащие к классу
IgM, которые максимально
активны при низких температурах
(-40-180С), поэтому данные
антитела носят название холодовых.
Холодовые аутоантитела прочно связываются
с эритроцитами при низких температурах
и фиксируют комплемент. Это приводит к
фагоцитозу эритроцитов и их последующему
внутриклеточному гемолизу.
Аутоиммунные
гемолитические анемии, вызванные
тепловыми гемагглютининами
Антиэритроцитарные
антитела в данном случае относятся к
IgGи активны
при температуре тела (+ 370С).
Аутоантитела данного класса также
фиксируются на эритроцитах и могут
вызывать комплемент-зависимый гемолиз,
но только при высоких титрах аутоантител.
2) Неиммунозависимые гемолитические анемии.
При этих анемиях
первичный гемолиз не обусловлен
действием антител. Среди причин
неиммунозависимых гемолитических
анемий наибольшее значение имеют
следующие:
Механическое повреждение
эритроцитов — при микроангиопатиях, при
протезировании клапанов сердца,
«маршевая» гемолитическая анемия
Токсические –
инфекционные (малярия), лекарственные
(нитрофураны)
Дисэритропоэтические
анемии
Дисэритропоэтические
анемии– анемии вследствие нарушения
эритропоэза и синтеза гемоглобина.
Группа анемий, объединенных одним общим
механизмом развития, который связан с
нарушением или полным прекращением
эритропоэза в результате дефицита
веществ, необходимых для осуществления
нормального кроветворения, носит
названиедефицитных анемий. Сюда
относят дефицит микроэлементов (железо,
медь, кобальт), витаминов
(B12,В6, В2, фолиевая кислота) и белков.
При замещении костномозговой полости
жировой, костной или опухолевой, тканью
(метастазы опухолей в костный мозг,
лейкоз), а также при действии физических
(ионизирующая радиация) и химических
факторов, некоторых микробных токсинов
и лекарственных препаратов развиваются
анемии в результате сокращения плацдарма
кроветворения.
Железодефицитные
анемии.Анемии, обусловленные дефицитом
железа в организме, относятся к числу
наиболее распространенных заболеваний
в мире и составляют 80—95 %всех форм малокровия. Наиболее часто
они встречаются у детей младшего
возраста, девушек-подростков и женщин
детородного возраста.
Этиология.Железодефицитная анемия может быть
обусловлена самыми разнообразными
причинами: недостаточным поступлением
железа с пищей, нарушением всасывания
его в тонком кишечнике, повышенной
потребностью в период роста, беременностью,
лактацией, кровотечениями из различных
органов и др. Однако наиболее частой
причиной железодефицитной анемии
являются кровопотери и в первую очередь
длительные постоянные кровотечения
даже с небольшими потерями крови. В этих
случаях количество теряемого железа
превышает его поступление с пищей.
Дефицит железа в организме развивается
при суточной потере железа в количестве,
превышающем 2мг (рацион
мужчины содержит 18мг
железа, женщины — 12—15мг
железа, из которых всасывается не более1,5мг, при повышенной
потребности организма— не
более 2мг).
По патогенетическому
принципу с учетом основных этиологических
причин железодефицитные анемии делят
на пять основных подгрупп (Л. И. Идельсон):
1)хронические постгеморрагические анемии,
связанные главным образом с маточными
кровотечениями и кровотечениями из
желудочно-кишечного тракта;
2)связанные с недостаточным исходным
уровнем железа (у новорожденных и детей
первых лет жизни);
3)связанные с повышением потребности в
железе (без кровопотери);
4)связанные с нарушением всасывания
железа, и поступлением его с пищей;
5)связанные с нарушением транспорта
железа.
Патогенез. Основным
патогенетическим звеном заболевания
является снижение содержания железа в
сыворотке крови, костном мозге и депо.
В результате нарушается синтез
гемоглобина, возникают гипохромная
анемия и трофические расстройства в
тканях, признаками которых являются:
сухость, вялость кожи, ломкость ногтей,
выпадение волос, атрофия слизистой
оболочки языка, повышенное разрушение
зубов, дисфагия, извращение вкуса,
мышечная слабость и др.
В патогенезе клинических
проявлений болезни в еще большей степени,
чем недостаточное снабжение тканей
кислородом, имеет значение нарушение
активности ряда ферментов тканей
организма (цитохром С, цитохромоксидаза,
сукцинатдегидрогеназа, пероксидаза,
митохондриальная моноаминооксидаза,
альфа-глицерофосфатоксидаза).
Признаки гипоксии
тканей появляются лишь при значительной
выраженности малокровия, когда наступает
истощение компенсаторных механизмов,
обеспечивающих на ранних этапах развития
дефицита железа нормализацию отдачи
кислорода из гемоглобина тканям.
Картина крови.Основным признаком железодефицитной
анемии является гипохромия со снижением
цветового показателя ниже
0,85и соответственно уменьшением
содержания гемоглобина ниже110г/л. Количество эритроцитов, как правило,
остается на исходном уровне, но в ряде
случаев может оказаться сниженным до
2—1,5 •1012/л вследствие нарушения
процессов пролиферации клеток эритроидного
ряда в костном мозге и усиления
неэффективного эритропоэза (в норме
разрушение эритронормобластов в костном
мозге не превышает10—15 %).
Содержание ретикулоцитов
колеблется в пределах нормы, но при
значительной кровопотере бывает
несколько повышенным. Важным морфологическим
признаком железодефицитных анемий
является анизоцитоз эритроцитов с
преобладанием микроцитов.
В костном мозге
отмечается нарушение процессов
гемоглобинезации эритрокариоцитов,
сопровождающееся увеличением количества
базофильных и полихроматофильных
нормобластов при параллельном снижении
числа их оксифильных форм, а также резкое
уменьшение количества сидеробластов
—нормобластов, содержащих единичные
гранулы железа в цитоплазме (в норме до
20—40 %).
В диагностике
железодефицитной анемии решающее
значение имеют показатели обмена железа
(сывороточное железо, железо-связывающая
способность сыворотки, общий запас
железа в организме и др.). Количество
железа в сыворотке крови при выраженной
железодефицитной анемии падает до
5,4—1,8мкмоль/л (40—30мкг %) при норме
12,5—30,4мкмоль/л (70—170мкг %).Резко уменьшается
и железо-связывающая способность
сыворотки (количество железа, которое
может связаться с трансферрином, в норме
составляет 30,6—84,6мкмоль/л
(или 70—470мкг
%).
Содержание ферритина
в сыворотке крови, по результатам
радиоиммунологических методов
исследования, при железодефицитных
анемиях снижается до 9—1,5мкг/л (в норме— 12—300мкг/л). Об уровне депонированного железа
можно судить по содержанию железа в
суточной моче после однократного
введения больному 500мг
десферала (продукт метаболизма
актиномицетов, избирательно выводящий
ион железа из организма). В норме этот
показатель соответствует
0,6—1,3мг железа, а при железодефицитной
анемии снижается до 0,2мг
в сутки и менее.
Железорефрактерные
анемии.При нарушении включения железа
в состав гема —порфириях — наблюдается,
напротив, повышенное содержание железа
в плазме крови, а также в митохондриях
Данная разновидность анемий обусловлена
снижением активности ферментов,
участвующих в синтезе порфиринов.
Большинство порфирий
относятся к наследственным
аутосомно-доминантным нарушениям
синтеза гема. Порфирии проявляются
кожными, неврологическими симптомами
и повышенным содержанием в кале и моче
порфиринов — продуктов промежуточного
синтеза гемоглобина. В крови наблюдается
гипохромная анемия. Также характерно
накопление избытка железа в ткани
печени, надпочечников, поджелудочной
железе и других.
Приобретенные порфирии
чаще всего вызываются интоксикацией
свинцом или дефицитом витамина В6.
В12-дефицитные
и фолиеводефицитные анемии. При
дефиците витамина В12и
фолиевой кислоты имеют место нарушения
образования пиримидиновых или пуриновых
оснований, синтеза ДНК и РНК, развиваются
анемии, характеризующиеся наличием в
костном мозге мегалобластов. Сочетанный
дефицит витамина В12и фолиевой кислоты встречается редко,
чаще наблюдается изолированный дефицит
витамина В12.
Этиология. Дефицит
витамина В12 развивается в результате
нарушения его всасывания при снижении
секреции внутреннего фактора, чаще в
результате атрофии слизистой желудка
либо в результате отсутствия желудка
(агастрические анемии — Агастрические
пернициозные анемии развиваются через
5—7лет после операции тотальной
гастрэктомии). У большинства больных с
дефицитом витамина В12обнаруживаются
антитела, направленные против париетальных
клеток слизистой желудка и внутреннего
фактора Кастла (В 1929г.
Катсл высказал предположение, что в
мясе содержится внешний, а в желудочном
соке внутренний фактор, необходимые
для нормального гемопоэза). В12-и фолиеводефицитные состояния могут
развиваться при инвазии широким лентецом,
поглощающим большое количество витамина
В12,при беременности, нарушении всасывания
витамина В12в
кишечнике, реже при недостатке поступления
с пищей.
Пернициозная анемия
(болезнь Аддисона—Бирмера
— Тяжелое заболевание, ранее
заканчивающееся летальным исходом,
старое название —злокачественное малокровие, предложенное
Бирмером в 1872г.).
Представляет собой одну из форм
заболевания, связанного с дефицитом
витамина В12.Чаще развивается у лиц пожилого возраста.
Различают обычную
форму взрослых и врожденную,
характеризующиеся поражением трех
систем: пищеварительной (воспаление, и
атрофия сосочков языка, гистаминрезистентная
ахилия, связанная с глубокой атрофией
слизистой желудка, в результате чего
железы дна и тела желудка прекращают
выработку внутреннего фактора Кастла
—гастромукопротеина), нервной
(фуникулярный миелоз —дегенерация задних и боковых столбов
спинного мозга, нарушение кожной и
вибрационной чувствительности,
мышечно-суставного чувства, изменение
ахилловых, коленных и других рефлексов),
системы крови (гиперхромная анемия,
переход на мегалобластический тип
кроветворения).
Патогенез. Переход
на мегалобластический тип кроветворения
обусловлен резким снижением активности
В12-зависимых энзимов, участвующих
в метаболизме фолатов (соли фолиевой
кислоты), необходимых для синтеза ДНК.
При этом наблюдается уменьшение
активности метилтрансферазы,
сопровождающееся кумуляцией в клетках
неактивного метилтетрагидрофолата и
снижением синтеза ДНК, что приводит к
нарушению клеточного деления и развитию
мегалобластоза [Алексеев Г. А., 1982].
Нарушение кроветворения
связано с замедлением темпа
мегалобластического эритропоэза в
результате удлинения времени митотического
цикла и сокращения числа митозов: вместо
3митозов, свойственных нормобластическому
эритропоэзу, наблюдается один. Срок
жизни эритроцитов сокращается до
30—40дней (в норме 120дней). Распад мегалобластов, не успевших
превратиться в эритроциты, наряду с их
замедленной дифференциацией приводит
к тому, что процессы кроветворения не
компенсируют процессы кроворазрушения.
Развивается анемия.
Картина крови.В
периферической крови наблюдаются
гиперхромная анемия (цветовой показатель
1,2—1,5),явления пойкилоцитоза с
тенденцией к овалоцитозу, анизоцитоза
с выраженным макроцитозом и мегалоцитозом.
Характерны явления
анизохромии и гиперхромии эритроцитов;
могут обнаруживаться полихроматофильные
и оксифильные мегалобласты (Мегалобласты—клетки мегалобластического кроветворения:
базофильные формы имеют размер
15—25 мкм, базофильную цитоплазму
без включений, круглое, слегка овальное
ядро, расположенное эксцентрично,
хроматин в нем распределен равномерно;
полихроматофильные формы имеют крупное
ядро с нежной сетчатой структурой без
ядрышек; в цитоплазме появляется
гемоглобин; ортохромные формы
—более зрелые клетки, содержащие
гемоглобин. Ядро может сохранять
нежно-петлистое строение или более
грубое вследствие скучивания хроматина
(см. рис. 66, 67)), эритроциты
с тельцами Жолли, кольцами Кабо,
азурофильной зернистостью. Средний
диаметр эритроцитов увеличен до
8,2—9,5мкм, их средний объем превышает
100фл (110—160фл).
Наблюдается умеренная
лейкопения с нейтропенией, встречаются
гиперсегментированные нейтрофилы
(сдвиг вправо), редко —
гигантские формы нейтрофилов.
Количество тромбоцитов уменьшено, часть
их представлена крупными формами
кровяных пластинок. На препаратах
костного мозга обнаруживаются мегалоциты
и мегалобласты, гигантские формы
метамиелоцитоВ12— и (или)
фолиеворефрактерные анемии.Развитие
мегалобластических анемий возможно
также в результате нарушения синтеза
пуриновых или пиримидиновых оснований,
необходимых для синтеза нуклеиновых
кислот.
Причиной данной группы
анемий является обычно рецессивное
наследование нарушения активности
ферментов, необходимых для синтеза
фолиевой, оротовой, адениловой, гуаниловой
и других кислот. В результате этого
нарушаются структура ДНК и заключенная
в ней информация по синтезу полипептидов,
что ведет к трансформации нормобластического
типа эритропоэза в мегалобластический.
Гипо-
и апластические анемии.Гипопластические
анемии —гетерогенная
группа заболеваний, характеризующаяся
уменьшением продукции всех клеток
костного мозга. Патогенез анемии
неизвестен: считается, что имеет место
поражение частично детерминированной
(плюрипотентной) стволовой клетки или
ее микроокружения (В последние годы
появились данные, позволяющие считать,
что некоторые случаи апластической
анемии и лейкоз могут представлять
собой крайние проявления в клиническом
диапазоне одного заболевания [Гейл Р.,
Бутурлани А., 1991]).
Причины апластической
анемии могут быть наследственные (анемия
Фанкони, анемия Блэкфана-Даймонда) и
приобретенные (воздействие бензола и
его производных, ионизирующей радиации;
при туберкулезе, ВИЧ-инфекции, инфекционных
гепатитах, инфекционном мононуклеозе;
воздействии некоторых лекарственных
веществ).
Для апластической
анемии характерны панцитопения,
сочетающаяся со снижением кроветворения
в костном мозге, уменьшение количества
стволовых клеток или потеря ими
способности к пролиферации. Заболевание
чаще начинается постепенно, в крови
наблюдается снижение содержания
гемоглобина (до 30—20г/л),
эритроцитов, ретикулоцитов. Анемия, как
правило, нормохромная, макроцитарная.
Лейкопения сопровождается
абсолютной нейтропенией, относительным
лимфоцитозом. Содержание тромбоцитов
уменьшается до (60—30) • 109/л
и ниже, удлиняется время кровотечения,
развивается геморрагический синдром.
Характерно ускорение СОЭ до
30—50мм/ч. В костном мозге выявляются
резкое снижение количества ядросодержащих
элементов, особенно эритроидного ряда,
торможение дифференциации клеток, почти
полное исчезновение мегакариоцитов.
Эритроцитозы
Увеличение количества
эритроцитов называется эритроцитозомилиполиглобулией. Это состояние
может быть первичным и вторичным
(относительным или абсолютным). Истинная
полиглобулия — эритремия (болезнь
Вакеза, polycythameaverarubra),
при которой число эритроцитов может
достигать 6-12 х1012л. Болезнь Вакеза
— заболевание, при котором в красном
костном мозге наблюдается тотальная
гиперплазия с аномальной пролиферацией
эритроидного, миелоидного и
мегакариоцитарного ростков, а также
трансформация желтого костного мозга
в красный. В результате возрастает ОЦК
(более 36 мл/кг массы тела), увеличивается
вязкость крови и гематокрит. Характерны
гепатоспленомегалия и резкое повышение
артериального давления. Срок жизни
больных, как правило, не превышает 10-15
лет; причина смерти — гипертензия,
тромбозы и нарушения мозгового
кровообращения.
Относительный
симптоматический эритроцитоз(гемоконцентрационный) возникает при
сгущении крови — усиленном потении,
рвоте, поносах, быстро нарастающих
отеках, при ожогах и интенсивной мышечной
работе.
Абсолютный
симптоматический эритроцитозявляется
результатом стимуляции эритропоэза.
Возникает при различных видах гипоксии.
Источник
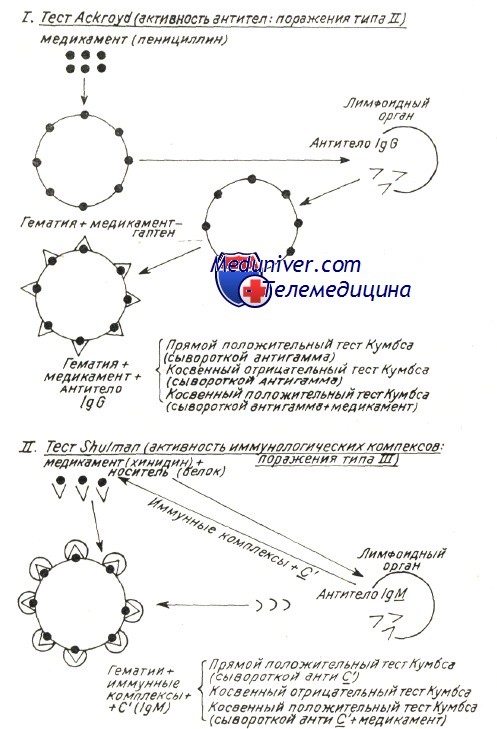
Механизмы развития аутоиммунной гемолитической анемии — патогенезВ механизме развития аутоиммунного гемолиза, независимо от вида антител, спорными представляются две проблемы: Начало аутоиммунного процесса общая проблема механизмов при всех аутоиммунных заболеваниях (Берчану), среди которых аутоиммунная гемолитическая анемия представляется как постоянная модель патогенетического исследования, применимая ряду аутоиммунных процессов. Существует ряд объяснений, в зависимости от вида аутоиммунной гемолитической анемии. Так, при вторичных формах после вирусной инфекции или сенсибилизации к медикаментозным препаратам происходит изменение антигенных структур оболочки эритроцита в результате собственно действия вируса или медикаментозного препарата. Прикрепление частиц вируса и химических антигенов к оболочке может создать новый иммуногенный комплекс, в котором инородные антигены выполняют роль сенсибилизирующего гаптена. Развивающиеся при этом антитела активны также в отношении антигенов эритроцитной оболочки и обусловливают расплавление крови. Таков механизм гемоцитолиза, описанный Ackroyd при гемоцитопении за счет сенсибилизации к медикаментозным препаратам. Поражение оболочки под воздействием вируса, медикаментозного препарата и прочих токсических веществ химической или инфекционной природы — среди широкого диапазона антигенов эритроцита — может «вскрыть» и его слабые антигены. Известно, что к последним иммуная переносимость небольшая, и что, под действием собственно острого, в частности хронического инфекционного процесса она нарушается, в результате чего развиваются аутоиммуные антиэритроцитные антитела, специфичные в отношении слабых антигенов. Проведенные в этом направлении исследования в условиях аутоиммунной гемолитической анемии доказали, что полные или неполные тепловые или холодовые антитела, выявляемые описанными выше способами в своем большинстве располагают групповой специфичностью, подобно изоантителам изоиммуной гемолитической анемии. Характеристика аутоантител при генуинной аутоиммунной гемолитической анемии в зависимости от иммунологических испытаний (видоизменение по Leddy) В таблице приведены не только физическая и биологическая характеристики антител, но и их групповая специфичность. Тепловые антитела вида IgG, выявляемые посредством прямой или косвенной реакции Кумбса с применением сыворотки антигамма и исследованные после их смыва с красных кровяных клеток, равно как и свободные антитела сыворотки специфично изоиммунные в отношении определенного резус-фенотипа. По данным Worlledge 38% тепловых антител антирезус, в то время как Weiner и Vos утверждают, что, с учетом форм резус с «делецией гена» эта пропорция равняется 70%. Доказать это удалось после пересмотра случаев, оказавшихся отрицательными к резус-специфичным антителам, но в которых, тем не менее, определяется наличие специфичности к более слабым резус-антигенам. Это антитела специфичные в отношении «нулевых» резус-гематий или тех, которые содержат лишь антигены ZW, рассматриваемые как D-like (Dacie и Worlledge, Eyster). Видимо они представляют собой антигенное вещество предшествующее антигенам резус-группы (Weiner и сотр.). Итак, иммунологические анализы доказали специфичность тепловых антител, при этом был уточнен ряд подгрупп Rr», h’ в рамках Rh наряду с группами ZW, реже JK и К (Yokoyama). Резус и иммуноглобулиновая специфичности объясняют их закрепление на красных кровяных клетках, но без связывания комплемента; это последнее явление видимо можно проследить лишь в отдельных подклассах иммуноглобулинов. По Muller-Eberhard связывание комплемента наблюдается только на подгруппах IgG1…IgG3 (исключается IgG4). В связи с этим не дано объяснение тому факту, что тепловые антитела, в принципе относящиеся к подгруппе IgG1 с анти-резус специфичностью, либо не связывают комплемент, либо связывают его очень редко.
Холодовые антитела проявили специфичность также к слабым антигенам, таким как антиген 1, который, вопреки этой слабости выявляется в размере примерно 100% той или иной популяции, как отметили Weiner и Vos на 20 тыс. образцов отобранной сыворотки. Лишь небольшой процент располагает специфичностью к антигену i, как было обнаружено в редких случаях гемолитической анемии после инфекционного моно-нуклеоза (Walheim и сотр.). Итак, удалось определить, что располагающие групповой специфичностью анти-I антитела это связывающие комплемент IgM. Другой механизм развития аутоантител можно проследить при гемолитической анемии за счет злокачественной лимфопролиферации, когда происходит расстройство клеточной системы иммунитета (КСИ). Следует предполагать, что в процессе злокачественной эволюции лимфоцитов в условиях хронической лимфатической лейкемии, ЛС или даже ОЛЛ разрастанием охвачены также «клоны» клеток, которые, по теории Burnet, рассматриваются как «запрещенные ». Таковыми являются линии лимфоидных клеток, ответственных за переносимость к сельфу, но остающихся неактивными или «спящими» в период зародышевой «клональной селекции» (Burnet). Их злокачественная пролиферация видимо обусловливает и развитие специфических антител к сельф-антигенам эритроцита в результате активации последних. Однако злокачественная пролиферация может ограничиться активными лимфоидными клетками вида В, ускальзывающими от избирательного угнетающего контроля клеток Т, сохраняющих врожденную иммуную переносимость. Таким образом создается иммуная функциональная диссоциация, обусловливающая выработку аутоиммуных антител. Независимо от гипотезы клиническое наблюдение доказало, что развитие антител и гемолиз прекращаются лишь после уничтожения образующего аутоантитела злокачественного клонуса, посредством цитостатической терапии. Возможно, что механизм пролиферации «запрещенных» клонусов действует и при гемолитической анемии с холодовыми антителами как следствие вирусной инфекции, такой как вирусная пневмония. Известно, что у индивидов в норме титр антител — холодовых агглютининов — невелик, составляя примерно 1/8—1/16. Резкая пролиферация за счет вирусной инфекции обусловливает активацию отдельных латентных лимфоидных клонусов, которые, возможно, ответственны за образование холодовых агглютининов (Van Loghem). В таких случаях, когда, по истечении определенного периода, расплавление крови не прекращается, показанная при гемолитической анемии с Холодовыми антителами цитостатическая терапия может оказать угнетающее действие на эти разросшиеся и образующие аутоантитела клонусы, подобно тому как наблюдается при злокачественной лимфопролиферации. Поскольку присутствие гемолитических аутоантител наблюдается и при некоторых реактивных процессах пролиферации во многих аутоиммунных и иммунодефицитных заболеваниях (Берчану) принято считать, что у подобных больных происходит более сложное нарушение иммунитета, неустойчивость гомеостатической системы иммунитета. В связи с этим, у страдающих иммунодефицитом к нонсельфу возможны отклонения иммунитета с понижением переносимости к сельфу. В механизме развития аутоиммунных заболеваний выявлено определенное отношение между иммунодефицитами к нонсельфу, состояниями гиперсенсибилизации, обусловливающими иммуные комплексы путем хронических неконтролируемых инфекций и развитием аутоиммуной болезни (Берчану). Тот факт, что аутоиммунные процессы, такие как аутоиммунная гемолитическая анемия при заболеваниях за счет отсутствия антител, улучшаются или даже исцеляются правильным назначением иммуноглобулина, подтверждает наличие нарушенного равновесия и лабильности иммунитета. И наконец, принято считать, что при определенных вирусных или микробных инфекциях, в частности отдельных новообразованиях — яичниковых и желудочных (Van Loghem) — в организме появляются антигены, структура которых близка к структуре антигенов отдельных эритроцитных групп. Эти перекрестнореагирующие антигены определяют развитие перекрестнореагирующих антител гемолитического действия и в отношении эритроцитов.
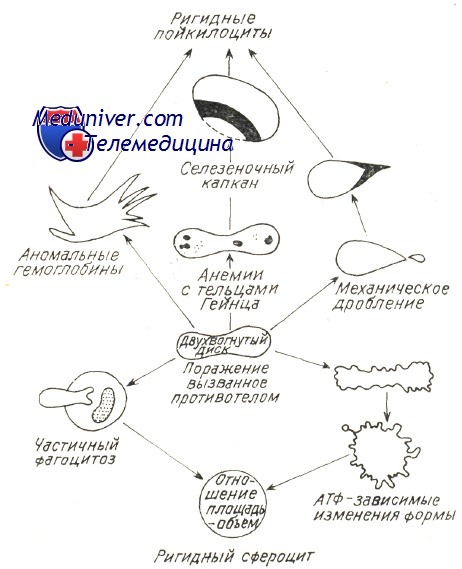
Во всех отмеченных стимулирующих иммунитет механизмах в патологических условиях (злокачественная лимфопролиферация, хроническое заболевание с чрезмерной нагрузкой на иммуную систему, заболевать за счет иммунодефицита), особенно когда аутоиммуная гемолитическая болезнь носит многолетний затяжной характер, следует предполагать нарушение врожденной иммуной переносимости с образованием гемолитических аутоантител, равно как и прочие аутоиммуные расстройства (Берчану). В принципе нарушается наиболее слабая иммуная переносимость к антигенам невысокой иммуногенной способности — Rh, I, i, Т. Реже встречаются случаи нарушения переносимости к крепким антигенам группы АВО, причем они редки в условиях злокачественной лимфопролиферации, когда развиваются «панагглютинины», расплавляющие эритроциты всех групп и переливание крови становится весьма опасным. По новым гипотезам о развитии аутоиммуных заболеваний предполагается наличие нарушения сотрудничества систем Th и Т8; дефицит Ts способствует дерепрессии «запрещенных » клонов В и выделению аутоантител (Берчану). Разрушение красных кровяных клеток в условиях аутоиммуного гемолиза подвергалось основательным исследованиям, в частности изучением реакций в пробирке между антителами и эритроцитами; при этом наблюдалось и действие комплемента в условиях гемолиза за счет холодовых антител, в частности при пароксизмальной холодовой анемии (Rosse и Dovramashkin). Электронномикроскопическое исследование оболочки эритроцита в условиях острого гемолиза при пароксизмальной гемоглобинурии показало, что, под воздействием связывающих комплемент холодовых антител на оболочке образуются «поры ». В связи с этим нарушается обмен катионов после проникновения воды в гематии и развивается острое внутрисосудистое расплавление крови. Поскольку существуют не расплавляющиеся гематии, со связанным на их оболочке комплементом, равно как и находящиеся в процессе расплавления гематии, на которых закрепляются лишь антитела (IgG), принято считать, что антитела необходимы для развертывания приоцесса гемолиза, который, следовательно, прижизненно не представляется возможным лишь под воздействием комплемента (Evans и сотр.). Фракции связанного комплемента видимо направляют механизм расплавления. Фракция С3 играет первостепенную роль в процессе гемолиза с холодовыми антителами. Issit установил роль фракции С3b, как при внутрисосудистом, так и печеночном внутриклеточном расплавлении крови. Явление пожирания красных кровяных клеток периферическими моноцитоидными макрофагами, неизменно наблюдаемое при гемолизе в условиях пароксизмальной гемоглобинурии, равно как и гистопатологическое исследование оперированной селезенки (Jandl) уже давно уточнили этот механизм. Недавно проведенные исследования выявили, что, в концентратах периферических лейкоцитов, несущие на себе Иг и комплемент эритроциты пожираются моноцитами. В зависимости от концентрации иммунных комплексов на эритроцитах увеличивается процент эритрофагоцитоза и наблюдается явление расположения розеткой гематий вокруг макрофагов (Abramson и сотр., Huber, и сотр.). В условиях аутоиммуной гемолитической болезни доказано наличие ряда механизмов внутриклеточного патологического расплавления крови, сокращающего продолжительность жизни красных кровяных телец. Возможно неполные антитела типа IgG или закрепленный на оболочке комплемент изменяют функциональную структуру эритроцита в отношении его подвижности в синусоидных органах, печени и селезенке, затем, посредством явления «секвестрации», его захватывает и разрушает макрофаг. Недавно уточнилось, что в селезенке, секвестрация осуществляется макрофаговыми рецепторами на несущий эритроцитом IgG. Макрофаги печени располагают рецепторами на С, вот почему несущие этот иммуноглобулин эритроциты разрушаются преимущественно в печени (Brown, Гологан и Берчану, Берчану). Этим объясняется положительный результат удаления селезенки лишь при гемолитической анемии с тепловыми антителами типа IgG (Бутояну и Берчану). В последние годы определилось, что в любом гемолитическом процессе, в том числе за счет ауто- или изоиммунных антител, происходит нарушение отношения объема и площади красной юровяной клетки, в связи с чем уменьшаются ее пластичность и элластичность (Weed). В главах, рассматривающих нормальное расплавление крови, говорилось о том, что элластичность гематий способствует их прохождению через поры синусовидиых эндотелиев, диаметром меньше 3 и. При этом эритроциты, располагающие большой степенью эластичности приспосабливают свою форму к размеру пересекаемого отверстия. Исследования в пробирке, при помощи оболочек с порами определенных размеров, уточнили условия прохождения в зависимости от «показателя элластичности», соответствующего показателю «фильтрации» (Jandl, Teitel). При иммуном патологическом гемолизе закрепленные на оболочке антитела или комплемент вызывают ее частичный разрыв и тем самым сокращение площади. Гематии приобретают вид сфероцита, как это отмечается в основном при приступах острого расплавления крови за счет тепловых или холодовых антител. После изменения отношения объем/площадь красные кровяные тельца становятся жесткими, пластичность понижается и прижизненно они более не проходят через поры эндотелия, а в пробирке — через поры циркуляционной мембраны. Итак наблюдается секвестрация гематий, «сенсибилизированных» гуморальными иммунными факторами, обусловливающими этим путем резкое пожирание красных кровяных клеток. Weed предложил схему, объясняющую механизм внутрисосудистого расплавления крови при любом гемолитическом эндоили экзоэритроцитном заболевании. Изменение эластичности, жесткость гематий предшествуют внутриклеточному гемолизу, обусловленному изменением количественного отношения площадь/объем и набуханием гематий в связи с изменением проницаемости или осаждением патологического гемоглобина. — Также рекомендуем «Лечение аутоиммунной гемолитической анемии — схема» Оглавление темы «Гемолитические анемии»:
|
Источник