Хроническая постгеморрагическая анемия цветовой показатель
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 30 декабря 2019;
проверки требует 1 правка.
Постгеморрагическая анемия — развивается после кровопотери. Постгеморрагические анемии подразделяются на острые и хронические. Острая постгеморрагическая анемия развивается после обильных, остро возникающих кровотечений(кровотечение органов) Хронические постгеморрагические анемии развиваются после длительных необильных кровотечений(язвы).
История заболевания[править | править код]
Этиология[править | править код]
- травмы
- геморрагические заболевания (тромбоцитопатии, коагулопатии, ДВС-синдром, геморрагический васкулит, лейкозы, апластические анемии, дизовариальные меноррагии у девушек).
- легочное кровотечение, ЖК кровотечения
Патогенез[править | править код]
При быстрой кровопотере уменьшается объём циркулирующей крови (олигемическая фаза). В ответ на уменьшение объёма циркулирующей крови возникает компенсаторная реакция : возбуждение симпатического отдела нервной системы и рефлекторный спазм сосудов, артериально-венозное шунтирование, что первоначально способствует поддержанию артериального давления, адекватному венозному притоку и сердечному выбросу. Пульс ускорен и ослаблен. Максимально сужены сосуды в коже и мышцах, минимально — сосуды мозга, коронарные, что обеспечивает лучшее кровоснабжение жизненно-важных органов. С продолжением процесса начинаются явления постгеморрагического шока.
Клиника[править | править код]
При постгеморрагической анемии клинически на первый план выходят явления острой сосудистой недостаточности вследствие резкого опустошения сосудистого русла (гиповолемии): — это сердцебиение, одышка, ортостатический коллапс. Тяжесть состояния определяется не только количеством, но и скоростью кровопотери. Наблюдается снижение диуреза соответственно степени кровопотери. Уровень гемоглобина и количество эритроцитов не являются надежным критерием степени кровопотери.
В первые минуты содержание Hb из-за уменьшения ОЦК может быть даже высоким. При поступлении тканевой жидкости в сосудистое русло эти показатели снижаются даже при прекращении кровотечения. Цветовой показатель, как правило, нормален, так как происходит одновременная потеря и эритроцитов и железа, то есть анемия нормохромная. На вторые сутки увеличивается количество ретикулоцитов, достигающее максимума на 4 — 7 день, то есть анемия является гиперрегенераторной.
Диагностика[править | править код]
В диагностике постгеморрагической анемии учитывают сведения о произошедшей острой кровопотере при внешнем кровотечении; в случае массивного внутреннего кровотечения диагноз основывается на клинических признаках в сочетании с лабораторными пробами (Грегерсена, Вебера), повышении уровня остаточного азота при кровотечении из верхних отделов желудочно-кишечного тракта.
При внешнем кровотечении диагноз поставить несложно. При внутреннем кровотечении из органа надо исключать коллапс иного генеза.
Лечение[править | править код]
Самое главное — устранить источник кровотечения. Затем восполняют кровопотерю (в зависимости от степени тяжести анемии — эритроцитарная масса, на фоне введения гепарина). Общий объём гемотрансфузии не должен превышать 60 % дефицита объёма циркулирующей крови. Остальной объём восполняется кровезаменителями (5 % раствором альбумина, реополиглюкином, раствором Рингера и т. д.). Пределом гемодилюции считают гематокрит 30 и эритроциты более
3*10¹²/л. По окончании острого периода необходимо лечение препаратами железа, витаминами группы В, С, Е.
После ликвидации анемии препараты железа назначают в половинной дозе до 6-ти месяцев.
Прогноз[править | править код]
Прогноз зависит от причины кровотечения, скорости, объёма кровопотери, рациональной терапии. При кровопотере с дефицитом объёма циркулирующей крови более 50 % прогноз неблагоприятный.
См. также[править | править код]
- Анемия
- Кровотечение
Примечания[править | править код]
Ссылки[править | править код]
- Постгеморрагические анемии
- Неотложная помощь при постгеморрагической анемии
Литература[править | править код]
- У. Россе, Ф. Бонн. ГЕМОЛИТИЧЕСКИЕ И ОСТРАЯ ПОСТГЕМОРРАГИЧЕСКАЯ АНЕМИИ. From Harrison’s Principles of Internal Medicine. 14-th edition.
- Н. Н. Зайко, Ю. В. Быць, А. В. Атаман и др. К.: «Логос», 1996 Патологическая физиология
Различают острую и хроническую
постгеморрагическую анемии.
Острая постгеморрагическая анемия
Возникает в результате острой массивной
потери крови в объеме от 5 мл/кг массы
тела и выше (травма, хирургическое
вмешательство, желудочные, маточные,
кишечные кровотечения, разрыв фаллопиевых
труб, нарушение гемостаза и др.). Сразу
после потери крови вследствие уменьшения
ее массы появляется общеанемические
признаки — тахикардия, одышка, бледность
кожных покровов и слизистых оболочек,
падение АД. Содержание эритроцитов и
гемоглобина снижается равномерно
(нормоцитемическая гиповолемия),
развивается нормохромная анемия.
Изменения периферической крови носят
стадийный характер. На 2–3-е сутки после
кровотечения в кровь поступает тканевая
жидкость, масса ее восстанавливается
(гидремическая фаза), а количество
эритроцитов и гемоглобина снижается,
падает гематокрит, но в связи с выходом
эритроцитов из депо цветовой показатель
сохраняется в норме (нормохромная
анемия), развивается лейкопения (утрата
лейкоцитов во время кровотечения,
гемодиллюция), тромбоцитопения (утрата
тромбоцитов при потере крови, потребление
при образовании тромба). Наблюдается
умеренный анизоцитоз и пойкилоцитоз
эритроцитов. Возникшая гипоксия ведет
к повышению уровня эритропоэтина и на
4–5-е сутки после кровотечения активируется
функция костного мозга (костномозговая
фаза компенсации) появляются регенеративные
формы эритроцитов — полихроматофилы,
единичные нормобласты (полихроматофильные,
оксифильные), ретикулоцитоз. Анемия
приобретает гипохромный характер, т.
к. ускоренная регенерация опережает
созревание эритроцитов из-за возникшего
дефицита железа. Развивается нейтрофильный
лейкоцитоз со сдвигом влево по
регенеративному типу.
Данные нарушения обусловлены уменьшением
объема циркулирующей крови и гипоксией.
В ответ на кровопотерю включаются
механизмы компенсации, направленные
на восстановление утерянного объема
крови и на борьбу с анемическим состоянием
(гипоксией).
Хроническая постгеморрагическая анемия
Развивается в результате длительно
повторяющихся небольших кровотечений.
Является вариантом железодефицитных
анемий, патогенез и проявления обусловлены
нарастающим дефицитом железа.
Железодефицитная анемия
Железо — один из важнейших микроэлементов,
входящих в состав организма человека.
Взрослому человеку требуется 15–18 мг/сут
железа, из которых всасывается 2–2,5 мг.
При этом биодоступность содержащегося
в пище гемового железа существенно
выше, чем негемового. Основные депо
железа: печень (гепатоциты и макрофаги),
костный мозг, селезёнка, мышцы. Если
метаболизм железа нормален, 30–40 %
нормобластов костного мозга содержат
гранулы ферритина (сидеробласты).
Отсутствие сидеробластов характерно
для железодефицита. Избыток гранул в
сидеробласте служит признаком переполнения
организма железом (гемосидероз) или
неспособности утилизировать его
(сидеробластная анемия). На рис. 2
представлена схема метаболизма железа.
Дефицит железа в организме существует
в двух формах, представляющих собой две
последовательные стадии одного процесса:
латентный (тканевый) дефицит железа
(ЛДЖ) и собственно железодефицитная
анемия (ЖДА).
ЖДА составляет около 80–90 % всех случаев
анемий и является одной из самых
распространенных ее форм. Женщины
страдают данным заболеванием чаще, чем
мужчины, поскольку запасы железа у
последних значительно превышают (на
100–200 %) таковые у женщин. Явный и скрытый
дефицит железа отмечается почти у 60 %
женщин земного шара. Железодефицитные
анемии встречаются во всех возрастных
группах. Различают «истинные» ЖДА —
при абсолютном дефиците железа и «ложные»
— при нарушении включения железа в
гемм, в отсутствие первичного истинного
железодефицита.
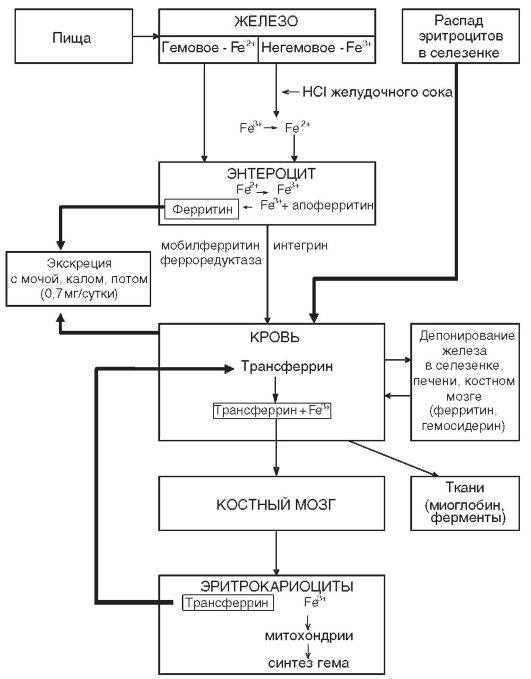
Рисунок 2 – Схема метаболизма
железа в организме
Этиология
По патогенетическому принципу с учетом
основных этиологических причин
железодефицитные анемии делят на пять
основных подгрупп (Л.И. Идельсон): 1)
связанные с повышенной потерей железа;
2) связанные с недостаточным исходным
уровнем железа; 3) связанные с повышенным
расходованием железа; 4) связанные с
нарушением всасывания железа и
недостаточным поступлением его с пищей
(алиментарные); 5) связанные с нарушением
транспорта железа.
Таблица 3. Причины и механизмы
развития железодефицитных состояний
Группы | Характеристика | Патогенез |
Особенные периоды | Дети недоношенные Дети первых лет | Недостаточный |
Интенсивный рост Беременность Лактация | Повышенное | |
Патологические | Хроническая При При Из Из При Припатологии | Повышенная потеря |
Патологические | Патология ЖКТ: Резекция желудка Гипосекреция Хронический Дисбактериозы; Глистные инвазии | Нарушение |
Наследственная Приобретённая | Нарушение | |
Алкоголизм | Комбинация Недостаточное | |
Нарушение | Нерациональное Голодание; Вегетарианская Искусственное | Недостаточное |
Избыточные | Повышенное |
Нередко действуют комбинации указанных
факторов, вызывающих отрицательный
баланс железа. Примером ЖДА, развивающейся
вследствие комплексного влияния
нескольких факторов, является хлороз
(от греч. «хлорос» — бледно-зеленый, или
«бледная немочь»). Название связано со
специфическим цветом лица таких больных.
При ЖДА уменьшается содержание железа
в плазме крови, костном мозге и в тканевых
депо.
Патогенез.
Основным звеном патогенеза заболевания
является снижение содержания железа в
депо, сыворотке крови и костном мозгу.
В результате нарушается синтез
гемоглобина, возникают гипохромная
анемия и трофические расстройства в
тканях, признаками которых являются:
сухость и вялость кожи, ломкость ногтей,
выпадение волос, атрофия слизистой
оболочки языка, повышенное разрушение
зубов, дисфагия, извращение вкуса,
мышечная слабость и др.. В патогенезе
клинических проявлений болезни имеет
значение: нарушение активности
железосодержащих ферментов в тканях
организма (цитохром С, цитохромоксидаза,
сукцинатдегидрогеназа, пероксидаза,
митохондриальная моноаминооксидаза,
α-глицерофосфатоксидаза) и недостаточное
снабжение тканей кислородом. Признаки
гипоксии тканей появляются лишь при
значительной выраженности малокровия,
когда наступает истощение компенсаторных
механизмов, обеспечивающих на ранних
этапах развития дефицита железа
нормализацию отдачи кислорода из
гемоглобина тканям.
Клиническая картинаскладывается
из двух основных синдромов: общеанемического
и сидеропенического.
Общеанемический синдром проявляется
симптомами, характерными для всех видов
анемии: бледность, общая слабость,
быстрая утомляемость, обмороки, одышка,
тахикардия, систолический шум.Сидеропенический синдром характеризуется
рядом трофических нарушений. Отмечаются:
сухость и трещины кожи, преждевременные
морщины, ломкость ногтей, койлонихия
(катлонихия) — ложкообразные ногти,
ангулярный стоматит, атрофия слизистых
оболочек рта, пищевода, желудка,
дыхательных путей. Нарушается иммунитет,
что приводит к хронизации инфекций,
частым ОРЗ; развивается мышечная
слабость, слабость физиологических
сфинктеров. Может возникнуть извращение
вкуса (поедание несъедобных продуктов
— мела, бумаги и др.), пристрастие к
необычным запахам (ацетон, бензин,
краска). Нарушается память, концентрация
внимания. При дефиците железа резко
усиливается абсорбция свинца, и у детей
на этом фоне развивается необратимая
задержка интеллектуального развития.
Нарушение проницаемости мелких сосудов
ведет к отекам лица. Иногда возникает
«сидеропенический субфебрилитет».
Картина крови.Основным признаком
железодефицитной анемии является
гипохромия со снижением цветового
показателя ниже 0,8 и, соответственно,
уменьшением содержания гемоглобина
ниже 110 г/л. Количество эритроцитов, как
правило, остается на исходном уровне,
но в ряде случаев может оказаться
сниженным до 2,0-1,5×1012/л вследствие
нарушения процессов пролиферации клеток
эритроидного ряда в костном мозгу и
усиления неэффективного эритропоэза
(в норме разрушение эритронормобластов
в костном мозгу не превышает 10-15%).
Ретикулоциты в норме или незначительно
увеличены, при прогрессировании ЖДА их
количество снижается. Важным морфологическим
признаком железодефицитных анемий
является анизоцитоз эритроцитов с
преобладанием микроцитов.
Нередко развивается нейтропения (в
результате уменьшения содержания
железосодержащих ферментов в лейкоцитах).
СОЭ в норме или незначительно
увеличена.
Уровень тромбоцитов может быть
незначительно повышен (на фоне
кровотечений).
Исследование костного мозга. В КМ
определяется нормобластическая
гиперплазия с нарушением гемоглобинизации
(преобладание базофильных и
полихроматофильных нормобластов при
снижении оксифильных), снижение индекса
созревания нормобластов, снижение
количества сидеробластов вплоть до
полного их отсутствия. Миелоидный и
мегакариоцитарный ростки не изменены.
Биохимический анализ крови – основной
диагностический критерий при ЖДА,
включающий набор тестов, при помощи
которых подтверждается факт дефицита
железа в организме:
снижение уровня сывороточного железа,
снижение уровня сывороточного ферритина,
снижение степени насыщения трансферрина
железом,увеличение содержания трансферрина в
сыворотке,повышение общей и латентной
железосвязывающей способности сыворотки,увеличение содержания растворимых
рецепторов к трансферритину в сыворотке,повышение свободного протопорфирина
IX в эритроцитах.
Количество железа в сыворотке крови
при выраженной ЖДА падает до 5,4–1,8
мкмоль/л при норме 12,5–30,4 мкмоль/л
(мужчины; у женщин этот показатель на
10–15% ниже. Под общей железосвязывающей
способностью сыворотки понимается
количество железа, которое может
связаться с трансферрином (в норме
54,0–72,0 мкмоль/л). В норме одна треть
трансферрина насыщена железом, а две
трети — свободны. Об уровне депонированного
железа можно судить по содержанию железа
в суточной моче после однократного
введения больному 500 мг десферала
(продукт метаболизма актиномицетов,
избирательно выводящий ион железа из
организма). В норме этот показатель
соответствует 0,6–1,3 мг железа, а при
железодефицитной анемии снижается до
0,2 мг в сутки и менее.
Сывороточный ферритин — очень точный
индикатор резервных запасов железа. Он
содержит примерно 15-20% общего запаса
железа в организме взрослого человека.
Определяется почти во всех тканях,
особенно высока его концентрация и
синтетическая способность в печени,
селезенке и костном мозге. Белок в
свободном от железа виде называется
апоферритином. Ферритин состоит из
белковой оболочки, которая окружает
ядро трехвалентного железа в виде
комплексов окиси и фосфата железа.
Каждая молекула апоферритина может
сорбировать до 5000 атомов железа, однако
большинство молекул ферритина содержат
от 1000 до 3000 атомов железа.
Анемии, ассоциированные с заболеваниями
внутренних органов, включают анемии
при эндокринных заболеваниях, заболеваниях
печени и почек.
К числу анемий при эндокринных
заболеваниях относятся анемии при
заболеваниях щитовидной и паращитовидных
желез, надпочечников, половых желез,
гипопитуитаризме и др., в основе патогенеза
которых лежит депрессия эритропоэза
при дефиците или, напротив, гиперсекреции
ряда гормонов. В частности, такие гормоны,
как тироксин, кортизол, тестостерон в
очень высоких концентрациях вызывают
угнетение пролиферативной активности
эритроидных прекурсоров. В случае
сгущения крови в результате дегидратации
(при надпочечниковой недостаточности,
гипотиреозе) диагностика анемии может
быть затруднена.
К анемиям при заболеваниях печени
относятся анемии, возникающие при
диффузных поражениях органа (циррозе,
хроническом гепатите, гемохроматозе и
др.).
Патогенез анемии при заболеваниях
печени отличается многообразием
патогенетических факторов, что
определяется особенностями патогенеза
основного заболевания. Выделяют следующие
механизмы развития анемии:
угнетение процессов кроветворения в
костном мозгу вследствие прямого
токсического влияния на клетки-предшественницы
гемопоэза алкоголя (при алкогольном
поражении печени) и эндогенных токсинов
(при нарушениях обезвреживающей и
клиренсной функции печени), при нарушениях
метаболизма железа и депонирования
витамина В12 и фолиевой кислоты
в пораженной печени;укорочение продолжительности жизни
эритроцитов в результате прямого
повреждающего действия токсических
продуктов экзогенного (алкоголь) и
эндогенного (при эндотоксемии)
происхождения, гиперспленизма, при
нарушениях внутриклеточного метаболизма
эритроцитов (например, в связи с дефицитом
в клетках НАДФ+) и их способности к
деформации (вследствие патологии
клеточной мембраны при изменениях
фракционного состава фосфолипидов,
снижении содержания сиаловых кислот);кровотечения из расширенных вен
желудочно-кишечного тракта (при циррозе
печени), носовые, геморроидальные и
иной локализации (при формирующейся
недостаточности синтеза факторов
свертывания крови вследствие нарушений
белкового обмена).
В подавляющем большинстве случаев при
заболеваниях печени регистрируется
нормохромная нормоцитарная анемия, при
присоединяющемся дефиците железа —
микроцитарная нормоили гипохромная,
при недостаточности витамина В12
и фолиевой кислоты, метастазах рака
желудка в печень — макроцитарная анемия
нормо- или гиперхромного типа.
Анемии при заболеваниях почек могут
выявляться у больных острым
гломерулонефритом, интерстициальным
нефритом, хронической почечной
недостаточностью. Патогенез анемии при
заболеваниях почек определяется
снижением продукции эритропоэтина
клетками юкстагломерулярного аппарата,
депрессией кроветворения в костном
мозгу (в результате нарушения
пролиферативной активности эритроидных
клеток, торможения процессов синтеза
гема) и сокращением срока жизни эритроцитов
(до 40-50 дней) при действии токсических
продуктов азотистого обмена.


