Гипо апластическая анемия патогенез
Гипопластическая анемия — заболевание системы крови, характеризующееся угнетением кроветворной функции костного мозга и проявляющееся недостаточным образованием эритроцитов, лейкоцитов и тромбоцитов (пангемоцитопенией) или только одних эритроцитов (парциальная гипопластическая анемия, эритробластофтиз). Основа патологического процесса — нарушение пролиферации и дифференциации клеток костного мозга. Характерным признаком этого заболевания системы крови является полное истощение (аплазия) костного мозга и глубокое нарушение его функции, что сопровождается резко выраженной анемией, лейкопенией и тромбоцитопенией. Недостаточная продукция костным мозгом клеток обусловливает основные механизмы развития заболевания — анемический синдром, инфекционные осложнения в связи с гранулоцитопенией и геморрагический синдром.
Основными этиологическими факторами гипопластических анемий являются: ионизирующая радиация; инсектициды; цитостатические препараты; другие лекарственные средства; антитела против клеток костного мозга; вирусные инфекции (вирусный гепатит); наследственные факторы; идиопатическая гипо- и апластические анемии.
Картина крови
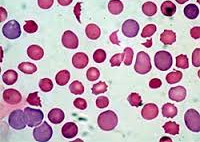
При исследовании периферической крови отмечаются панцитопения, резчайшая анемия с низким ретикулоцитозом, выраженным анизо-пойцилоцитозом. Содержание гемоглобина падает до 15—20 г/л. Лейкопения, тромбоцитопения разной степени. Резкое ускорение СОЭ — до 60—80 мин/ч. Исследование костномозгового кроветворения при апластической анемии обнаруживает картину почти полного опустошения костного мозга
Патогенез
В настоящее время основными патогенетическими факторами апластической анемии считаются:
- · поражение полипотентной стволовой гемопоэтической клетки;
- · поражение клеточного микроокружения стволовой кроветворной клетки и опосредованное нарушение ее функции;
- · иммунная депрессия кроветворения и апоптоз стволовых кроветворных клеток;
- · укорочение жизни эритроцитов;
- · нарушение метаболизма кроветворных клеток.
Поражение полипотентной стволовой гемопоэтической клетки — важнейший патогенетический фактор апластической анемии. Стволовая клетка является родоначальницей всех кроветворных клеток. При апластической анемии значительно снижается колониеобразующая способность костного мозга, нарушается пролиферация кроветворных клеток, в конечном итоге формируется синдром панцитопении — лейкопения, анемия, тромбоцитопения. Окончательно механизм угнетения активности полипотентной стволовой кроветворной клетки не выяснен.
Клиническая картина
Основная клиническая и лабораторная симптоматика приобретенной гипо- и апластической анемии с поражением всех трех кроветворных ростков костного мозга обусловлена тотальным угнетением гемопоэза, а также гипоксией органов и тканей и геморрагическим синдромом. Выраженность симптоматики зависит от степени тяжести и варианта течения анемии.
Больные предъявляют жалобы характерные для анемического синдрома. Характерны кровоточивость (десневые, носовые, желудочно-кишечные, почечные, маточные кровотечения) и частые инфекционно-воспалительные заболевания. При острой форме симптомы развиваются быстро и течение заболевания с самого начала тяжелое. Но у большинства больных заболевание развивается достаточно медленно, постепенно, в определенной мере пациенты адаптируются к анемии. Заболевание обычно распознается при выраженной симптоматике.
При осмотре больных обращает на себя внимание выраженная бледность кожи и видимых слизистых оболочек, часто с желтушным оттенком; геморрагические высыпания на коже, чаще в виде кровоподтеков различной величины. Часто на месте инъекций (внутримышечных, внутривенных, подкожных) образуются обширные гематомы. Геморрагическая сыпь локализуется преимущественно в области голеней, бедер, живота, иногда на лице. Могут наблюдаться кровоизлияния в конъюнктиву и видимые слизистые оболочки — губы, слизистую оболочку полости рта. Могут быть тяжелые носовые, желудочно-кишечные, почечные, легочные, маточные, внутрицеребральные кровотечения. Периферические лимфоузлы не увеличены.
При исследовании внутренних органов могут обнаруживаться следующие изменения:
- · Система органов дыхания — частые бронхиты, пневмонии.
- · Сердечно-сосудистая система — синдром миокардиодистрофии.
- · Система органов пищеварения — при выраженном геморрагическом синдроме могут обнаруживаться эрозии на слизистой оболочке желудка, 12-перстной кишки.
Нередко развивается гемосидероз внутренних органов вследствие повышенного разрушения неполноценных эритроцитов, снижения использования железа костным мозгом, нарушения синтеза гема, частых переливаний эритроцитарной массы.
Лабораторные данные и инструментальные исследования
Общий анализ крови — выраженное снижение количества эритроцитов и гемоглобина; анемия у большинства больных нормохромная, нормоцитарная; характерно отсутствие или резкое снижение количества ретикулоцитов (арегенераторная анемия); наблюдается лейкопения за счет гранулоцитопении с относительным лимфоцитозом; характерна тромбоцитопения. Таким образом, наиболее существенным лабораторным проявлением гипо- и апластической анемии является панцитопения. СОЭ увеличена.
Биохимический анализ крови — содержание сывороточного железа повышено, процент насыщения железом трансферина значительно увеличен.
Исследование стернального пунктата (миелограмма) — выраженное уменьшение клеток эритроцитарного и гранулоцитарного рядов, лимфоцитов и значительная редукция мегакариоцитарного ростка. В тяжелых случаях костный мозг выглядит «опустошенным», в стернальном пунктате можно обнаружить лишь единичные клетки. В костном мозге значительно увеличивается содержание железа, расположенного как внеклеточно, так и внутриклеточно.
Диагностические критерии
- · Нормохромная нормоцитарная арегенераторная анемия с резким снижением или полным отсутствием ретикулоцитов, увеличением СОЭ.
- · Лейкоцитопения, абсолютная гранулоцитопения, относительный лимфоцитоз.
- · Тромбоцитопения.
- · Резко выраженный абсолютный дефицит в миелограмме клеток эритро-, лейко- и тромбоцитопоэза, задержка их созревания.
- * Увеличение содержания железа внутри эритрокариоцитов и внеклеточно.
- · Резкое уменьшение количества или полное исчезновение кроветворных клеток и замещение кроветворного костного мозга жировой тканью в трепанобиоптате подвздошной кости является основным методом верификации диагноза гипо- и апластической анемии).
- · Повышение уровня сывороточного железа.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 января 2019;
проверки требуют 2 правки.
Апласти́ческая анеми́я — заболевание кроветворной системы, характеризуется угнетением кроветворной функции костного мозга и проявляется недостаточным образованием эритроцитов, лейкоцитов и тромбоцитов (пангемоцитопенией) или только одних эритроцитов (парциальная гипопластическая анемия, синонимы: апластическая анемия, арегенераторная анемия, геморрагическая алейкия, миелопарез, миелофтиз, панмиелофтиз, прогрессирующая гипоцитемия). Для апластических анемий характерна выраженная панцитопения — анемия, лейкопения, тромбоцитопения и лимфопения[3].
История заболевания[править | править код]
Впервые это заболевание было описано Паулем Эрлихом в 1888 году у 21-летней женщины. Термин «апластическая анемия» был предложен Чауфордом в 1904 году. Апластическая анемия — одно из самых тяжёлых расстройств гемопоэза. Без лечения больные тяжёлыми формами апластической анемии погибают в течение нескольких месяцев. При своевременном адекватном лечении прогноз достаточно хороший. Длительный период времени апластическая (гипопластическая) анемия рассматривалась как синдром, объединяющий патологические состояния костного мозга протекающие с выраженной гипоплазией кроветворения. Современная медицина относит апластическую анемию к арегенераторному виду анемий (гипо-, апластические анемии)[4].
Этиология[править | править код]
Причинами апластической анемии могут быть:
- Химические вещества (мышьяк, ароматические углеводороды, в частности бензол, соли тяжёлых металлов).
- Ионизирующее излучение (см. Мария Склодовская-Кюри)
- Лекарственные препараты (НПВС, цитостатики, мерказолил, анальгин, левомицетин).
- Инфекционные агенты (вирусы, м/о).
- Аутоиммунные процессы (СКВ, синдром Шегрена).
Патогенез[править | править код]
Апластическая анемия может развиться при воздействии ряда миелотоксических факторов: ионизирующего излучения, химических веществ — бензола, солей золота, мышьяка; лекарственных средств — хлорамфеникола (левомицетина), фенилбутазона (бутадион), хлорпромазина (аминазин), мепробамата, дилантина, антиметаболитов (6-меркаптопурина, метотрексата), алкилирующих (циклофосфана, хлорбутина) и некоторых других средств. Миелотоксический эффект от воздействия одних факторов (ионизирующее излучение, антиметаболиты) возникает всегда при достаточно большой дозе, других — проявляется индивидуально. Причина индивидуальной чувствительности, в частности к некоторым лекарственным средствам не всегда ясна, но может быть связана с генетическими дефектами кроветворных клеток. Это относится, например, к хлорамфениколу и фенилбутазону, которые вызывают супрессию (в зависимости от дозы) эритропоэза с частотой соответственно 1:24000 и 1:40000 лиц, их принимающих.
Наследственный характер индивидуальной чувствительности эритропоэтических клеток к данным лекарственным веществам подтверждается развитием аплазии костного мозга у разных членов одной семьи и у однояйцевых близнецов. В других случаях вероятна связь индуцированного лекарственными веществами угнетения кроветворения с иммунными механизмами появлением антител к эритроцитарным предшественникам. Описаны случаи возникновения апластической анемии после острого вирусного гепатита (возможно, вследствие способности вируса гепатита изменять кариотип клеток, что было прослежено на культуре лейкоцитов), перенесенной инфекции вирусом Эпштейна — Барр, парвовирусом.
Существует и наследственная форма апластической анемии — анемия Фанкони.
Более чем у половины больных не удается выявить какие-либо причинные факторы — это так называемая идиопатическая апластическая анемия. Механизмы, лежащие в основе идиопатической формы анемии, неясны. Возможен аутоиммунный механизм, связанный с воздействием на клетки костного мозга аутоантител при участии иммунных лимфоцитов. Показано, что лимфоциты (Т-супрессоры) больных тормозят образование эритроцитных колоний костного мозга донора и могут нарушать дифференциацию и пролиферацию гематопоэтических предшественников.
Предполагают также, что основой апластической анемии может быть поражение (внутренний дефект) стволовой клетки, о чём свидетельствует восстановление кроветворения у больных после трансплантации им аллогенного костного мозга, содержащего нормальные стволовые клетки. Существуют экспериментальные данные, свидетельствующие о значении для развития апластического процесса и нарушений микроокружения — первичного дефекта стромальных клеток костного мозга. Однако суть этих клеточных дефектов остается неясной, так же как и их первичность. Возможно, что при разных формах апластической анемии патогенетические механизмы неодинаковы.
Клиника[править | править код]
- Анемический синдром (головокружение, снижение работоспособности, утомляемость, бледность кожных покровов и слизистых, сердцебиение, непереносимость длительных физических нагрузок и т. д.)
- Геморрагический синдром (кровоточивость, склонность к диапедезам, геморрагии)
- Инфекционные осложнения.
Диагностика[править | править код]
Картина периферической крови представлена трицитопенией. Снижение гемоглобина значительно и может достигать критического уровня 20 — 30 г/л. Цветовой показатель обычно равен единице, но в ряде случаев может быть гиперхромия и макроцитоз эритроцитов. Количество ретикулоцитов резко снижено. Характерна выраженная лейкопения (агранулоцитоз). Абсолютное содержание лимфоцитов не изменено или снижено. Количество тромбоцитов всегда снижено, в некоторых случаях не удается обнаружить их вообще. В большинстве случаев увеличивается СОЭ (до 40 — 60 мм/час).
Клиническая картина заболевания позволяет сформировать первичное представление о патологии системы крови. Отправной точкой диагностического поиска является клиническое исследование крови с подсчетом количества ретикулоцитов и тромбоцитов. Выявление би- или трицитопении при исследовании периферической крови служит основанием для выполнения морфологического исследования костного мозга.
Диагноз АА устанавливают на основании типичной гистологической картины костного мозга, получаемого методом трепанобиопсии гребня подвздошной кости. Для получения качественного (информативного) биоптата используются трепаны, выпускаемые промышленным способом (Sherwood medical).
При гистологическом исследовании костного мозга обнаруживается большое количество жировой ткани, содержание которой может достигать 90 %. Среди доминирующей жировой ткани встречаются стромальные и лимфоидные элементы. Гематогенные клетки представлены крайне скудно: в небольшом количестве встречаются эритроидные и гранулоцитарные предшественники. Мегакариоциты отсутствуют.
Лечение[править | править код]
Лечение апластической анемии представляет собой очень сложную задачу.
- Лечение с глюкокортикоидами эффективно, если болезнь обусловлена аутоиммунными механизмами, появлением антител против клеток крови.
- Лечение анаболическими препаратами стимулируют кроветворение.
- Лечение андрогенами обладает анаболическим эффектом и стимулируют эритропоэз.
- Лечение цитостатиками (иммунодепресантами) — назначается лишь при отсутствии эффекта от других методов лечение у больных с аутоиммунной формой, в том числе при парциальной красноклеточной аплазии.
- Спленэктомия
- Лечение антилимфоцитарным глобулином рекомендуется при отсутствии эффекта от спленэктомии и других методов лечения.
- Лечение циклоспорином. Циклоспорин А (сандиммун) обладает иммунодепрессантным эффектом, селективно ингибирует транскрипцию гена интерлейкина-2 в Т-лимфоцитах, подавляет продукцию Гамма интерферона и альфа фактора некроза опухоли.
- Трансплантация костного мозга.
Основным и единственным патогенетическим методом лечения апластической анемии, позволяющим рассчитывать на спасение жизни больного, является трансплантация костного мозга от совместимого донора.
При невозможности подобрать донора проводится паллиативная терапия. В качестве базисного препарата используется иммунодепрессант циклоспорин А. У больных нетяжёлой апластической анемией использование данного препарата позволяет рассчитывать в ряде случаев на успех. Кроме того использование циклоспорина А целесообразно и с тех позиций, что глюкокортикоиды, андрогены и антилимфоцитарный глобулин способны улучшить состояние гемопоэза у больных нетяжёлой апластической анемией, но, однако, при этом следует принимать во внимание повышенный риск развития в последующем клональных заболеваний костного мозга. Применение циклоспорина А сводит такой риск к минимуму. Следует также отметить, что у части больных нетяжёлой апластической анемией, преодолевших 6-месячный порог выживаемости, может наступить спонтанное улучшение даже если им не проводилось никакой иммуносупрессивной терапии. Эффект от иммуносупрессивной терапии у больных тяжёлой и крайне тяжелой апластической анемией сомнителен.
- Лечение колониестимулирующими факторами или миелоидными факторами роста — эти гликопротеиды, стимулирующие пролиферацию и дифференциацию клеток-предшественниц гемопоэза различных типов.
- Трансфузии эритроцитов; показания: выраженная анемия, гипоксия мозга, гемодинамические нарушения.
Все больные апластической анемией нуждаются в заместительной трансфузионной терапии эритроцитарной и/или тромбоцитарной массой. Объём трансфузионной терапии определяется показателями периферической крови и клиническими проявлениями заболевания. Кроме того, проводится антибактериальная и микостатическая терапия с целью профилактики или лечения инфекционных осложнений.
Прогноз[править | править код]
Ремиссию удаётся получить примерно у половины больных. Прогноз несколько лучше у детей, чем у взрослых. Наличие большого количества жира в костном мозге не говорит о необратимости процесса. Бывают случаи, когда и у таких больных наступает полная ремиссия и полная репарация костномозгового кроветворения. Прогноз лучше, когда увеличено содержание ретикулоцитов, когда в костном мозге имеется более полиморфная картина, когда имеется небольшое увеличение размеров селезёнки и хотя бы небольшой, но чёткий эффект от кортикостероидных гормонов. В этих случаях спленэктомия оказывает чаще хороший эффект вплоть до полного выздоровления. У части больных апластический синдром является началом острого лейкоза. Иногда признаки гемобластоза выявляются лишь через несколько лет от начала болезни.
Примечания[править | править код]
ГИПО- И АПЛАСТИЧЕСКИЕ АНЕМИИ
Гипо- и апластические анемии (Г-АА) — это заболевания кроветворной системы, характеризующиеся истощением всех ростков (эритроидного, миелоидного и мегакариоцитарного) кроветворения и жировым перерождением костного мозга. Есть другое определение апластической анемии. Это панцитопения со сниженной клеточностью костного мозга, не сопровождающаяся гепатоспленомегалией, проявлениями острого лейкоза или миелодиспластического синдрома, при отсутствии миелофиброза.
Эпидемиология. Заболевание встречается с частотой 5-10 случаев на 1 млн населения в год.
Этиология. Выделяют врожденную (наследственную) и приобретенную гипо- апластическую анемию.
Врожденная апластическая анемия.
- Анемия Фанкони (конституционная, вызванная поломкой хромосом, с наличием врожденных аномалий развития).
- Анемия Эстрена-Дамешека (без врожденных аномалий развития)
- Парциальная анемия Блэкфана-Даймонда с избирательным поражением эритропоэза (предполагается аутоиммунный патогенез).
Приобретенная Г-АА подразделяется на идиопатическую (с неизвестной этиологией, предполагается аутоиммунный генез) форму и форму с известными этиологическими факторами. Идиопатическая форма составляет до 50-65% всех случаев Г-АА.
Вторичная апластическая анемия, обусловленная:
- Токсическим воздействием ряда химических агентов (бензола, неорганических соединений мышьяка, тяжелых металлов — ртуть, висмут и др., хлорорганических соединений, этилированного бензина за счет тетраэтил-свинца, инсектицидов, пестицидов).
- Токсическим воздействием ряда физических факторов (ионизирующей радиации, рентгеновского излучения).
3 Токсическим воздействием ряда лекарственных средств по механизму идиосинкразии:
- антибиотики: левомицетин, метициллин, стрептомицин и др.
- сульфаниламиды
- нестероидные противовоспалительные препараты: бутадион, анальгин, амидопирин, индометацин
- препараты золота
- тиреостатические препараты: мерказолил, пропилтиоурацил
- цитостатики: 6-меркаптопурин, 5-фторурацил, циклофосфан, цитозинарабинозид, винкристин, винбластин, рубомицин, мелфалан
- противосудорожные средства — гидантоины
- антиаритмические средства: хинидин, токаинид
- гипотензивные препараты: каптоприл, эналаприл, допегит
- Воздействием вирусов гепатита (чаще всего G, вероятность развития аплазии кроветворения не коррелирует с тяжестью гепатита), Эпштейна-Барр, эпидемического паротита, гриппа, герпеса, иммунодефицита человека, парвовируса В19, цитомегаловирусной инфекции, микобактерий туберкулеза и, возможно, другими инфекционными агентами.
- Иммунными заболеваниями: эозинофильный фасцит, тимома, карцинома тимуса, болезнь «трансплантат против хозяина».
- Осложняющая течение пароксизмальной ночной гемоглобинурии, зоба Хашимото и др.
Критерии тяжести. Мягкое (нетяжелое) течение: гематокрит >32%; сегментоядерные нейтрофилы > 2000/мкл; тромбоциты > 20 000/мм3; ретикулоциты — 1-2%; костный мозг — умеренное снижение клеточности, индекс созревания нейтрофилов 0,9-3,2, резко снижено количество мегакариоцитов.
Тяжелое течение: количество эритроцитов 0,7-2,5х1012/л, гемоглобин 25-84 г/л, число ретикулоцитов < 1%; сегментоядерные нейтрофилы < 500/мкл; тромбоциты < 20 000/мм3; костный мозг — выраженная гипоплазия или аплазия, индекс созревания нейтрофилов достигает 6,6, мегакариоциты не выявляются.
Патогенез. Патоморфология Г-АА — недостаток стволовых клеток или патология микроокружения. Основными патогенетическими факторами считаются:
- поражение полипотентной стволовой гемопоэтической клетки
- поражение клеточного микроокружения стволовой клетки и опосредованное нарушение ее функции
- иммунная депрессия кроветворения и индукция апоптоза стволовых клеток
- укорочение жизни эритроцитов
- нарушение метаболизма кроветворных клеток
Клинические проявления. Выраженность симптоматики зависит от степени тяжести и варианта течения анемии. При острой форме симптомы развиваются быстро, и течение заболевания с самого начала тяжелое. У большинства больных начало Г-АА постепенное, неопределенное. Первые признаки заболевания: слабость, повышенная утомляемость, анемический синдром. Пациенты обращаются за медицинской помощью уже при выраженной панцитопении и развитии геморрагического синдрома. Отмечаются экхимозы, кровоизлияния в слизистые оболочки, петехии, носовые, маточные, десневые кровотечения (геморрагический синдром обусловлен тромбоцитопенией). Возможны другие источники кровотечений — желудочно-кишечный тракт, легкие. Нередко заболевание может осложняться внутрице-ребральными кровоизлияниями, приводящими к летальному исходу. Селезенка не увеличена, наличие спленомегалии требует уточнения диагноза. У больных, имеющих нейтропению, часто присоединяются инфекционно-воспалительные осложнения. При тяжелом течении может развиться язвенно-некротическое поражение слизистой оболочки полости рта.
Параклиническая диагностика. Общий анализ крови — нормохромная, нормоцитарная анемия, нейтропения (число лейкоцитов может быть временно нормальным за счет сохранения популяции лимфоцитов), тромбоцитопения. Ретикулоцитопения вплоть до их отсутствия (арегенераторная анемия). Ускорение СОЭ. Суммируя данные, можно говорить о панцитопении.
Общий анализ мочи — как правило, без изменений.
Биохимический анализ крови — повышено содержание сывороточного железа, значительно увеличен процент насыщения трансферина железом, железосвязывающая способность сыворотки крови нормальная. При гемолизе может незначительно повышаться непрямой билирубин. Фетальный гемоглобин часто повышен (прогностическим фактором не является).
Стернальная пункция — выраженное уменьшение клеток эритроцитарного, гранулоцитарного рядов, лимфоцитов, значительная редукция мегакариоцитарного ростка. Задержка созревания клеток эритро-, лейко- и тромбо-поэза. Индекс созревания нейтрофилов (в норме составляет 0,6-0,8) повышен до 0,9-3,2 (в тяжелых случаях — до 5-6,6).
Трепанобиопсия подвздошной кости — резкое уменьшение количества костномозговых кроветворных элементов — «опустошение» костного мозга. Почти полное замещение кроветворного мозга жировой тканью. Стандартный критерий апластической анемии — цитоз в биоптате менее 25%.
Эритроидная культура дает плохой рост.
Сканирование костного мозга (с использованием радиоактивных препаратов железа): эритропоэтическая функция костного мозга резко снижена.
Дифференциальный диагноз. С иммунными цитопениями. Основан на сохранности и даже гиперплазии костного мозга при цитопениях и хорошем эффекте преднизолона и спленэктомии.
С острым лейкозом. Для острого лейкоза характерны боли в костях, увеличение периферических лимфоузлов, селезенки, поражение нервной системы — нейролейкемия. В общем анализе крови присутствуют властные клетки, определяется лейкемический провал даже на фоне лейкопении. В стер-нальном пунктате и биоптате костного мозга — высокий процент бластов (более 30%), сокращение эритропоэтического ростка и количества мегакариоцитов. Указанное выше не характерно для Г-АА.
С пароксизмальной ночной гемоглобинурией при развитии гемолитического синдрома. Основан на выявлении признаков гемолиза эритроцитов, гемосидерина в моче, положительный пробах сахарной и Хема, а также преходящем характере гипоплазии кроветворения при пароксизмальной ночной гемоглобинурии.
Течение. По течению выделяют мягкие и тяжелые формы. Возможны случаи спонтанного выздоровления. В тяжелых случаях — исход летальный.
Лечение. 1. Гемотрансфузнойная терапия.
- Эритроцитарная масса.
- Концентрат тромбоцитов.
- Концентрат гранулоцитов.
Два последних требуют подбора по системе НLА.
- Андрогены. Обладают анаболическим эффектом и стимулируют эритропоэз. Эффективность весьма различная, но у ряда больных определенно положительная. Эффект наступает через несколько месяцев или даже лет от начала терапии. Повышение уровня гемоглобина отмечается у 50% больных, нейтрофильных лейкоцитов — у 30%, тромбоцитов — у 25%. Суточные дозы составляют 1-2 мг/кг (иногда 3-4 мг/кг). Назначают тестостерона пропионат 5% р-р по 1 мл 2 раза в день или сустанон-250 1 мл 1 раз в месяц.
Лечение андрогенами проводят лицам мужского пола. При длительном применении возможно развитие гепатита с холестатическим синдромом.
- Кортикостероиды. Эффективность спорна, но в случаях аутоиммунного патогенеза (при наличии антител против клеток крови) вероятна. Суточная доза преднизолона составляет 1-2 мг/кг массы в сутки, чаще всего -60-120 мг/сут. Если в первые 2 недели лечения отмечается эффект, то лечение продолжают с переходом на поддерживающие дозы — 15-20 мг от 4 недель до 3-4 мес. Если в ближайшие 2 недели лечения глюкокортикоидами эффекта нет, то его можно отменить.
- Анаболические гормоны. С одной стороны нивелируют негативные катаболические эффекты кортикостероидов, с другой — стимулируют кроветворение. Назначают неробол по 20 мг/сут или анаполон (оксиметолон) по 200 мг/сут в течение 5-6 мес.
- Иммуносупрессивная терапия. Включает высокие дозы циклофос-фана или антилимфоцитарного глобулина. Последний вводится в/в капельно по 120-160 мг 1 раз в день в течение 10-15 дней. Сразу после 1-го введения отмечается снижение числа эритроцитов и лейкоцитов, уровня НЬ с тенденцией к нормализации их содержания к концу лечения.
В настоящее время средством выбора является циклоспорин А.
- Спленэктомия. Показана при отсутствии эффекта от глюкокортикои-дов и у больных, не имеющих септических осложнений. Эффективность ее составляет до 84%. В день операции необходимо увеличить дозу преднизолона в 2-3 раза по сравнению с исходной. Кроме того, для профилактики кровотечения вводят концентрат тромбоцитов (не менее 3-4 доз от одного донора). Противопоказания: выраженный геморрагический синдром; гипо-коагуляция, не обусловленная тромбоцитопенией; значительные изменения функциональных проб печени; пожилой возраст больных. Спленэктомия не показана при быстром и стойком положительном эффекте от других методов лечения.
- Трансплантация костного мозга. При отборе больных учитываются многие факторы: переливалась ли кровь и ее компоненты, есть ли кровный родственник, идентичный по HLA-системе, оцениваются общее состояние и возраст больных. Это метод выбора в лечении заболевания.
В каждом случае при выборе метода лечения следует учитывать характер этиологии и патогенеза апластической анемии.
При аутоиммунных формах программа лечения выглядит следующим образом:
- Терапия преднизолоном (1-2 мг/кг веса тела в сутки). Продолжительность -1-2 мес.
- Спленэктомия.
- При недостаточной эффективности — циклоспорин А. Предпринимаются и попытки использования этого препарата с самого начала лечения апластической анемии.