Генез анемии при болезни крона
Некоторые особенности болезни Крона характерны для наследственных заболеваний: начало болезни в детском и молодом возрасте, семейная отягощенность, сходство клинического течения заболевания внутри одной семьи, при этом дети заболевают раньше, чем родители. Обнаружено множество мутаций, чаще встречающихся при болезни Крона и неспецифическом язвенном колите, чем в среднем в популяции. В 1996 г. Дж.П. Хугот (с соавт.) впервые опубликовали результаты обнаружения участка генома в 16-й хромосоме, названного IBD1 и определяющего предрасположенность к болезни Крона.
Большинство генетических факторов, потенциально связанных с патогенезом заболевания, участвуют в механизмах иммунной защиты слизистой оболочки.
В настоящее время рабочей гипотезой патогенеза болезни Крона, является предположение о нарушении иммунного ответа на предрасполагающие факторы, в том числе на кишечную микрофлору у генетически предрасположенных лиц. Роль кишечной микрофлоры подтверждают исследования на мышах, у которых в стерильном состоянии болезнь Крона не развивалась, но признаки заболевания возникали при попадании в кишку обычных непатогенных микроорганизмов.
Болезнь Крона характеризуется иммунным ответом по Th1 типу (Т-хелперы — CD4+ клетки — 1-го типа), свойственному клеточному иммунному ответу, что ведёт к повышению продукции ИЛ-12, ФНО (фактора некроза опухоли) и ИФН-γ (интерферон-гамма). Было показано, что ФНО играет основную роль в воспалении при данном заболевании. Повышенная продукция ФНО макрофагами приводит к повышению уровней данного цитокина в кале, крови и слизистой оболочке.
У больных болезнью Крона могут выявляться антитела к клеткам кишки, бактериальным и вирусным антигенам, кишечной палочке и вирусу кори класса IgМ, к полисахаридам и чужеродному белку.
Кроме того, сообщается о сочетании болезни Крона с дефицитом IgА. Иммунные комплексы также можно считать входящими в группу факторов, ответственных за внекишечные проявления болезни Крона. Многие из иммунных нарушений исчезают в неактивном периоде болезни, что свидетельствует об их вторичности и неспецифичности.
- Патоморфология при болезни Крона
Патологический процесс при болезни Крона может локализоваться в любом отделе (от ротовой полости до анального отверстия) пищеварительного тракта. В большинстве случаев процесс начинается в терминальном отделе подвздошной кишки (терминальный илеит). Протяженность поражения пищеварительного тракта при болезни Крона может быть различной: от 3-4 см до 1 м и более.
При макроскопическом осмотре стенка кишки отечна, утолщена, с наличием белесоватых бугорков под серозным покровом. Брыжейка кишки утолщена за счет отложения жира и разрастания соединительной ткани. Регионарные лимфатические узлы увеличены. В зоне поражения слизистая оболочка имеет вид «булыжной мостовой», где участки сохраненной слизистой чередуются с глубокими щелевидными язвами, проникающими в подслизистый и мышечный слои. Здесь же выявляются свищи, абсцессы и стриктуры кишки. Между пораженными и здоровыми отделами кишки имеется четкая граница.
Свищи могут быть кишечно-кишечными, кишечно-мочепузырными, кишечно-влагалищными и кишечно-кожными.
При микроскопическом исследовании выявляется поражение всех слоев кишечной стенки, при этом на ранних стадиях развития заболевания возникают отек и инфильтрация лимфоидными и плазматическими клетками подслизистого слоя пораженного отдела кишки, гиперплазия лимфатических фолликулов и пейеровых бляшек, формирование гранулем, состоящих из гигантских эпителиоидных клеток (гранулематозный колит). В дальнейшем происходит нагноение и изъязвление измененных лимфоидных фолликулов, распространение инфильтрации на все слои кишечной стенки, гиалиновое перерождение гранулем.
Патологоанатомические изменения при болезни Крона:
- Значительное утолщение пораженной стенки кишечника с трансмуральным воспалением.
- Увеличенные брыжеечные лимфатические узлы.
- Очаговые гранулемы.
- Глубокие извитые и линейные изъязвления (придают стенке кишки вид «булыжной мостовой»), иногда с формированием свищей.
- Вторичные стриктуры при рубцевании.
- Чередование участков нормальной и пораженной слизистой оболочки.
Coombs-Negative Autoimmune Hemolytic Anemia in Crohn’s Disease
Источник: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4264829/
Вклад авторов:
Дизайн исследования
Сбор данных
Статистический анализ
Интерпретация данных
Подготовка рукописи
Поиск литературы
Сбор средств
Конфликт интересов: не объявлено
Пациент: женщина, 41
Конечная диагностика: отрицательная аутоиммунная гемолитическая анемия Кумбса
Симптомы: темная моча • головокружение • одышка
Лекарства: —
Клиническая процедура: Иммунорадиометрический анализ для RBC-IgG
Специальность: Гематология
Редкое заболевание
Анемия — распространенное, важное внеуниверсальное осложнение болезни Крона. Основными типами анемии у пациентов с болезнью Крона являются железодефицитная анемия и анемия хронических заболеваний. Хотя у пациентов с болезнью Крона может наблюдаться различный тип анемии, аутоиммунная гемолитическая анемия (АМСЗ) у пациентов с болезнью Крона, особенно с кумоз-отрицательной АМСЗ, встречается очень редко.
41-летняя женщина с болезнью Крона была представлена в нашу комнату скорой помощи (ER) с темной мочой, головокружением и одышкой. Активность болезни Крона контролировалась, при этом показатель активности болезни Крона (CDAI) оценивался ниже 100 баллов. При физическом обследовании у пациента были бледные конъюнктивы и слегка желтушные склеры. Билирубин в сыворотке повышался на уровне 3,1 мг / дл, уровень лактатдегидрогеназы (LDH) составлял 1418 ед / л, а уровень гаптоглобина составлял
Мы сообщаем о случае Кумс-отрицательного АМСЗ у пациента с болезнью Крона с хронической анемией, диагностированной эритроцитарным иммуноглобулином G (RBC-IgG) и лечившим терапию стероидами.
Болезнь Крона — это хроническое воспалительное заболевание с участием любой части желудочно-кишечного тракта. Анемия является распространенным и серьезным осложнением у пациентов с болезнью Крона [1]. Одна треть пациентов с воспалительными заболеваниями кишечника имеет рецидивирующую анемию [2] и дефицит железа, дефицит витамина B12, дефицит фолиевой кислоты, недоедание и воспаление. Лекарства могут вызвать различные виды анемии при болезни Крона. Тем не менее, АМСЗ у пациентов с болезнью Крона, особенно с кумбами-негативными, встречается очень редко. Здесь мы представляем случай Кумс-отрицательного АМСЗ у пациента с болезнью Крона, диагностированного РБК-IgG.
41-летняя женщина с болезнью Крона была представлена нашей скорой помощи (ER) с 2-дневной историей темной мочи, головокружением и одышкой. У нее была диагностирована терминально-подвздошная болезнь Крона 4 года назад с помощью эндоскопии капсул из-за кровавой диареи в другой больнице. Месалазин (1 г / сут) вводили перорально, а активность болезни Крона контролировалась, при этом показатель активности болезни Крона (CDAI) оценивался ниже 100 баллов и никаких жалоб на боль в животе, смолистый черный стул или кровавую диарею. Она не принимала другие лекарства, кроме фолиевой кислоты и сульфата железа для хронической анемии, и месалазин для болезни Крона. У нее не было истории замены механического клапана или семейной истории гематологических расстройств. Недавно она посетила местный медицинский центр для оценки хронической анемии, но конкретная причина не могла быть определена.
При физическом обследовании у пациента были бледные конъюнктивы и слегка желтушные склеры. Печень была осязаема ниже 2 см от правого нижнего реберного края в средней клиновидной линии, а кончик селезенки ощущался на левом берегу, но не было ощутимого лимфатического узла. Полный подсчет клеток крови показал уровень гемоглобина 7,5 г / дл (средний объем тела: 95,1 мкл, средний корпускулярный гемоглобин: 27,5 пг), гематокрит 27,8%, количество лейкоцитов 8,77 × 109 / л и 278 × 109 / L тромбоцитов. Дифференциальные показатели лейкоцитов составляли 67% нейтрофилов, 20,4% лимфоцитов, 11,7% моноцитов, 0,2% эозинофилов и 0,6% базофилов. Железо сыворотки, общая связывающая способность железа и уровень ферритина составляли 75 мкг / дл, 195 мкг / дл и 212 мкг / дл соответственно. Основные метаболические панели составляли 140 ммоль / л для натрия, 3,9 ммоль / л для калия, 108 ммоль / л для хлорида, 6,9 мг / дл для BUN и 0,5 мг / дл для креатинина. Билирубин в сыворотке повышали при 3,1 мг / дл (прямой билирубин 0,4 мг / дл). Аспартат-аминотрансфераза составляла 111 МЕ / л, а аланинаминотрансфераза составляла 18 МЕ / л. Уровень лактатдегидрогеназы (LDH) составлял 1418 U / L, а уровень haptoglobin составлял
Болезнь Крона — это хроническое воспалительное заболевание, поражающее желудочно-кишечный тракт с любой стороны от рта до ануса. Этиология болезни Крона неясна, но, по-видимому, она вызвана сочетанием факторов окружающей среды и генетической предрасположенности. Помимо воздействия на желудочно-кишечный тракт, у 20-40% пациентов с болезнью Крона было выявлено множество внеуниверсальных проявлений [1]. Экстрагинальные проявления болезни Крона включают анемию, узловатую эритему, периферическую артропатию, кожные язвы и увеит. Среди них анемия обычно усложняет CD, влияя на качество жизни, когнитивную функцию, способность работать [4]. Основными причинами анемии при болезни Крона являются железодефицитная анемия и анемия хронических заболеваний. Кроме того, дефицит витамина B12, дефицит фолиевой кислоты и терапевтические препараты, такие как сульфасалазин и метотрексат, способны вызывать анемию при болезни Крона [5].
АМСЗ существует как первичное расстройство в CD 50% случаев, а в остальных 50% случаев CD связано с другими состояниями, которые включают лимфопролиферативные заболевания, аутоиммунные нарушения и вызванные лекарственными средствами состояния. Воспалительное заболевание кишечника рассматривается как аутоиммунное расстройство, такое как АМСЗ [6], а аутоиммунные расстройства, как правило, сосуществуют [7,8]. Связь между АМСЗ и язвенным колитом относительно хорошо документирована [9], но связь между АМСЗ и болезнью Крона представляется крайне редкой [10].
В диагнозе АМСЗ тест Кумбса (в сочетании с прямым анализом антиглобулина) остается основным серологическим анализом [11]. Кум-негативный АМСЗ характеризуется лабораторными доказательствами гемолиза in vivo, а также отрицательным тестом Кумбса, проведенным методом агглютинации столбцов у пациентов, клинически подозреваемых в АМСЗ. Отрицательный результат теста Кумбса у пациентов с АМСЗ может быть обусловлен низкими уровнями антител на мембранах эритроцитов, низкой чувствительностью обычного метода пробирки Кумбса или другими аутоантителами, такими как IgA и IgM. Иммунорадиометрический анализ для RBC-IgG можно использовать для диагностики пациентов, у которых метод агглютинации колонки не обнаруживает низкие уровни аутоантител к красной клетке. Уровни RBC-IgG следует измерять для диагностики отрицательного АОМЗ с кубизмами, а используемое значение отсечки должно составлять 78,5 молекул / клеток со 100% -ной чувствительностью и 94% -ной специфичностью, когда или если RBC-IgG измеряется до лечения [3].
В этом случае можно исключить кумб-негативную неиммунную гемолитическую анемию, вызванную наркотиками, токсинами, инфекциями и другими гемолитическими заболеваниями (например, пароксизмальную ночную гемоглобинурию, гемолитический уремический синдром и тромботическую тромбоцитопеническую пурпуру). Аутоиммунная гемолитическая анемия была сильно заподозрена клинически, несмотря на отрицательный результат теста Кумбса и отрицательные антитела против IgA и анти-IgM. Иммунорадиометрический анализ для RBC-IgG был полезен при постановке диагноза Кумбса-отрицательного АМСЗ из-за низкого РВС-IgG, поэтому мы не тестировали возможность низкоаффинных аутоантител. Важно отличить Кумс-отрицательный АМСЗ от другого гемолиза, потому что лечение стероидами оказывает большое влияние на АМСЗ [12]. Кум-негативные пациенты АМСЗ одинаково хорошо реагируют на лечение стероидами и обычно имеют более мягкий курс заболевания, чем пациенты с положительным АОМЗ с кумбами [11]. Клинически, кумбс-отрицательный АМСЗ, по-видимому, почти эквивалентен кумоз-положительной АМСЗ.
Обнаружение случаев кубизма-отрицательных АМСЗ важно, поскольку АМСЗ может быть опасным для жизни состоянием, связанным с интенсивным гемолизом, шоком и смертью. Кубически-отрицательные АМСЗ должны быть признаны так, чтобы можно было провести раннюю диагностику и дать соответствующую терапию.
Абдоминальная КТ выявляет активную болезнь Крона, связанную с подвздошной кишкой, с многосегментным утолщением стенки и усилением слизистой оболочки с областями пропуска в подвздошной кишке (A: осевой вид, B, корональный вид).
Мазок периферической крови проявляет сфероцитоз (черная стрелка), ретикулоцитоз (красная стрелка) и микроцитарные гипохромные эритроциты.
Специалистам / Практика / Практика (статья)
Статья |
17-09-2014, 22:10
|
 АнемияВ практике гастроэнтеролога анемический синдром встречается достаточно часто. При этом основными видами анемий у пациентов с патологией органов пищеварения являются железодефицитная и В12-фолиеводефицитная анемии. В патогенезе анемий при заболеваниях желудочно-кишечного тракта ведущими механизмами выступают хроническая кровопотеря и нарушение всасывания гемопоэтических факторов.
АнемияВ практике гастроэнтеролога анемический синдром встречается достаточно часто. При этом основными видами анемий у пациентов с патологией органов пищеварения являются железодефицитная и В12-фолиеводефицитная анемии. В патогенезе анемий при заболеваниях желудочно-кишечного тракта ведущими механизмами выступают хроническая кровопотеря и нарушение всасывания гемопоэтических факторов.
Железодефицитная анемия – наиболее частая форма анемий в гастроэнтерологии, и причиной ее развития являются кровотечения, нарушения всасывания железа, диетические ограничения. Ряд хронических заболеваний пищеварительной системы сопровождается развитием анемии различной степени тяжести. Анемия может являться первым признаком основного заболевания, в частности, опухолевого процесса пищевого канала, а также быть причиной снижения качества жизни пациентов.
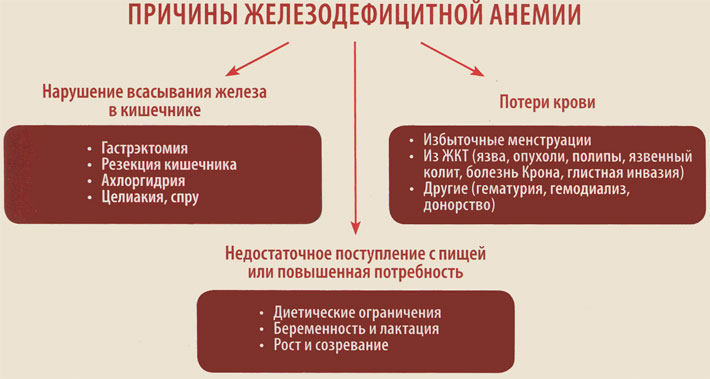
Выделяют три глобальные причины развития дефицита железа в организме:
- Недостаточное поступление с пищей или повышенная потребность.
- Нарушение всасывания железа в кишечнике.
- Хронические потери крови.
Заболевания желудочно-кишечного тракта являются одной из основных причин развития железодефицитной анемии, что обусловлено нарушением всасывания железа в кишечнике или его потерями вследствие эрозивно-язвенных, опухолевых или аутоиммунных воспалительных поражений слизистой оболочки кишечника.
Перечень заболеваний пищеварительного тракта, сопровождающихся развитием анемии, достаточно широк. Причиной железодефицитных состояний часто выступают болезни верхних отделов желудочно-кишечного тракта и толстой кишки.
Одной из важных причин развития железодефицитной анемии является нарушение процессов всасывания железа в двенадцатиперстной кишке и проксимальном отделе тощей кишки. Различные заболевания тонкой кишки, сопровождающиеся синдромом мальабсорбции (энтерит, амилоидоз, целиакея, идеопатическая стеаторея), а также оперативные вмешательства на желудке и тонкой кишке (состояние после тотальной гастроэктомии, субтотальной резекции желудка, ваготомии с гастроэктомией, резекция тонкой кишки) приводят к развитию дефицита железа.
Накапливаются данные о потенциальной связи инфекции H. pylory с железодефицитной анемией, которая может быть следствием скрытых кровотечений при эрозивном гастрите и язвенной болезни, нарушение всасывания железа при хеликобактерном атрофическом пангастрите, а также снижения содержания аскорбиновой кислоты в желудке и конкурентного захвата и утилизации железа самой бактерией. Таким образом, эрадикация H. pylory может стать еще одним подходом к лечению железодефицитной анемии в отсутствии других явных ее причин.
Этиологическим фактором анемии может стать прием нестероидных противовоспалительных препаратов (НПВП). Врачам хорошо известна возможность как массивных, так и скрытых кровотечений из эрозий и язв желудка и двенадцатиперстной кишки при НПВП-гастропатии. Однако, железодефицитная анемия может быть следствием НПВП-энтеропатии, другими клиническими проявлениями которой могут служить гипоальбуминемия, мальабсорбция и наличие измененной крови в кале.
Причиной нарушения всасывания гемопоэтических факторов являются и заболевания тонкой кишки. К ним можно отнести целиакию (половина пациентов с неясной этиологией железодефицитной анемии, резистентной к терапии препаратами железа), резекцию участка тонкой кишки, синдром избыточного бактериального роста в тонкой кишке, диабетическую энетропатию, амилоидоз, склеродермию, болезнь Уиппла, туберкулез, лимфому тонкой кишки, тропическое спру, паразитарные заболевания (лямблиоз) и гельминтозы (дифиллоботриоз).
Воспалительные заболевания кишечника, прежде всего, неспецифический язвенный колит и болезнь Крона, часто сопровождаются развитием анемии. Ведущими механизмами при этом выступают кровопотеря у пациентов с язвенным колитом и болезнью Крона, а также мальабсорбция при вовлечении в процесс тощей и подвздошной кишки при болезни Крона.
Ведущей причиной анемии при патологии нижних отделов желудочно-кишечного тракта, особенно у пациентов старше 50 лет, служит колоректальный рак. Хроническая кровопотеря наблюдается при полипах толстой кишки, дивертикулезе, ишемическом колите, геморрое и анальных трещинах.
Анемический синдром часто делает необходимым тщательное обследование желудочно-кишечного тракта. Для уточнения вида анемии проводят исследования общего и биохимического анализа крови.
Среди причин железодефицитной анемии (почти 30-50% всех случаев) прежде всего рассматривают острые или хронические кровопотери из желудочно-кишечного тракта.
Причины железодефицитной анемии
Как показали результаты открытого мультицентрового исследования, проведенного в Украине в 2008 году и базировавшиеся на анализе 1299 историй болезней больных железодефицитной анемией, основной причиной развития были эрозивно-язвенные поражения пищевого канала (44,58%) и заболевания, сопровождающиеся синдромом мальабсорбции. Циррозы печени являлись причиной железодефицитной анемии в 10,39% случаев, воспалительные заболевания кишечника – 4,54% больных.
Диагностируется железодефицитная анемия у больных с гастроэнтерологическими заболеваниями по совокупности анамнестических данных (указания на оперативные вмешательства на желудке или кишечнике, прием нестероидных или гормональных противовоспалительных препаратов, антикоагулянтов и антиагрегантов, язвенный анамнез, наличие хронических заболеваний печени и воспалительных заболеваний кишечника и т.д.), клинических проявлений (наличие специфического сидеропенического синдрома, проявляющегося сухостью и истончением кожи, ангулярный хейлит, дисфагия, ломкость ногтей, их поперечная исчерченность, вогнутость ногтевой пластинки, извращение вкуса и обоняния, симптом «голубых склер», мышечная слабость) и лабораторных показателей.
Диагностика анемии основывается, главным образом, на данных лабораторных исследований, в первую очередь – на результатах клинического исследования крови с определением концентрации гемоглобина.
Верхние отделы желудочно-кишечного тракта | Нижние отделы желудочно-кишечного такта | Весь желудочно-кишечный тракт |
— Язва желудка | — Аденома толстой кишки | — Болезнь Крона |
Согласно рекомендациям ВОЗ, критерием анемии является снижение концентрации гемоглобина до уровня 120 г/л для женщин (во время беременности – менее 110 г/л), для мужчин – менее 130 г/л. По степени тяжести различают анемию легкую (уровень гемоглобина крови 90-110 г/л), средней тяжести (гемоглобин – 70-89 г/л) и тяжелую (гемоглобин менее 70 г/л).
В лабораторной диагностике железодефицитной анемии основное практическое значение имеют три показателя: сывороточные концентрации железа, ферритина и общая железосвязывающая способность сыворотки (ОЖСС). ОЖСС – это общее количество железа, которое может связаться с трансферином. В норме сывороточная концентрация железа составляет 12-30 мкМоль/л (50-150мкг%), а ОЖСС – 30-85 мкМоль/л (300-360 мкг%).
Важное значение в лечении железодефицитной анемии имеет место устранение причин ее развития (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.), а также возмещение дефицита железа в крови и тканях и достижение полной клинико-гематологической ремиссии. В ряде случаев радикальное устранение причины железодефицитной анемии невозможно, и тогда основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами.
В качестве заместительной терапии при железодефицитной анемии используют препараты железа.
Терапия железодефицитной анемии при заболеваниях желудочно-кишечного тракта проводится преимущественно препаратами железа для перорального приема, за исключением случаев тяжелой мальабсорбции и состояний после резекции тонкой кишки.
Рекомендуемая ВОЗ оптимальная доза составляет 120 мг элементарного железа в сутки. Более высокие дозы не увеличивают эффективность, однако могут вызвать диспепсические явления вследствие раздражения желудочно-кишечного тракта. Лечение препаратами железа должно быть длительным.
Суточная доза для профилактики анемии и лечения легкой формы заболевания составляет 50-60 мг Fe2+, а для лечения выраженной анемии – 100-120 мг Fe2+.
При выборе препаратов железа необходимо учитывать и их состав.
В настоящее время существуют препараты двухвалентного и трехвалентного железа. По мнению специалистов, наибольшей биодоступностью обладает двухвалентная форма железа, именно поэтому старт терапии начинают с препаратов этой группы. Согласно проведенным клиническим исследованиям, терапия препаратами двухвалентного железа позволяет за более короткий временной интервал нормализовать показатели красной крови.
Таким образом, анемический синдром достаточно часто является «маской» многих распространенных и тяжелых заболеваний желудочно-кишечного тракта. Ключевыми моментами диагностики являются определение вида и причины развития анемии, а залогом успешного лечения служат своевременная терапия основного заболевания и правильная патогенетическая терапия с восполнением дефицита железа.


