Гемолитическая несфероцитарная анемия лечение
Гемолитическая анемия (лат. anaemia haemolytica от др.-греч. αἷμα «кровь» + λύσις «разрушение, растворение» + анемия) — групповое название редких заболеваний, общим признаком которых является усиленное разрушение эритроцитов, обусловливающее, с одной стороны, анемию и повышенное образование продуктов распада эритроцитов, с другой стороны — реактивно усиленный эритропоэз.
Клинические проявления[править | править код]
Увеличение продуктов распада эритроцитов клинически проявляется желтухой лимонного оттенка, повышением содержания в крови непрямого (неконъюгированного) билирубина (гипербилирубинемия) и сывороточного железа, плейохромией желчи и кала, уробилинурией.
При внутрисосудистом гемолизе добавочно возникают гипергемоглобинемия, гемоглобинурия, гемосидеринурия.
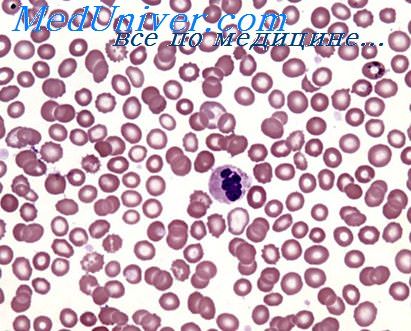
Об усилении эритропоэза свидетельствуют ретикулоцитоз и полихроматофилия в периферической крови, эритронормобластоз костного мозга.
Классификация гемолитической анемии[править | править код]
Наиболее часто встречающиеся формы гемолитической анемии:
- Наследственные (врождённые) формы гемолитической анемии:
- Мембранопатии эритроцитов (нарушение строения эритроцитов):
- микросфероцитарная,
- овалоцитарная,
- акантоцитарная.
- Энзимопенические (ферментопенические) — анемии, связанные с нехваткой какого-либо фермента.
- связанные с дефицитом ферментов пентозо-фосфатного ряда,
- связанные с дефицитом ферментов гликолиза,
- связанные с дефицитом ферментов, участвующих в образовании, окислении и восстановлении глутатиона,
- связанные с дефицитом ферментов, участвующих в использовании АТФ,
- связанные с дефицитом ферментов, участвующих в синтезе порфиринов.
- Гемоглобинопатии:
- гемоглобинопатии качественные (Серповидно-клеточная анемия)
- талассемия (нарушение синтеза одной из полипептидных цепей гемоглобина).
- Мембранопатии эритроцитов (нарушение строения эритроцитов):
- Приобретённые формы гемолитической анемии:
- Иммуногемолитические анемии:
- аутоимунные,
- изоимунные.
- Приобретённые мембранопатии:
- пароксизмальная ночная гемоглобинурия,
- шпороклеточная анемия.
- Связанные с механическим повреждением эритроцитов:
- маршевая гемоглобинурия,
- болезнь Мошкович (микроангиопатическая гемолитическая анемия),
- возникающая при протезировании клапанов сердца
- Токсические.
- гемолитические анемии при приеме лекарственных средств и гемолитических ядов.
- Иммуногемолитические анемии:
- Другие гемолитические анемии
- гемолитическая желтуха новорождённых, при которой материнские антитела разрушают эритроциты плода или ребёнка,
- идиопатическая (примерно 50 % случаев гемолитических анемий),
- вторичная (например при лимфоме, причём анемия может быть первым проявлением лимфомы)
Лечение[править | править код]
Так как любая анемия это синдром какого-либо заболевания, необходимо адекватное лечение вызвавшего анемию заболевания. Установить причину анемии.
При гемолитической анемии:
- спленэктомия
- глюкокортикостероиды при аутоиммунных гемолитических анемиях в средних дозах
- иммунодепрессанты
- трансфузия эритроцитов при гемолитических кризах, нужны отмытые эритроциты, индивидуально подобранные
- при повышении уровня железа необходимо его удалить — десферал
Если антитела при гемолитической анемии активны только при низкой температуре — они называются холодовыми, если они активны при температуре тела — тепловыми.
Классификация по МКБ-10
Источники информации[править | править код]
- Классификация гемолитической анемии приведена по: Ю.И. Лорие, 1967; Л.И. Идельсон, 1975.
- БМЭ. 1977. т.5
- Дж. Мёрта. Справочник врача общей практики. 1230 с, 540 илл. Пер. с англ. Мак-Гроу — Хилл Либри Италия.

АНЕМИИ ГЕМОЛИТИЧЕСКИЕ НЕСФЕРОЦИТАРНЫЕ (эритроцитопатии). В основе гемолитических несфероцитарных анемий лежат нарушения ферментных систем эритроцитов (глюкозо-6-фосфатдегидрогеназа, редуктаза, глютатион, дифосфоглицеромутаза, пируваткиназа, метгемоглобиновая редуктаза, аденозинтрифосфатаза — АТФ-аза), с помощью которых осуществляется анаэробный гликолиз глюкозы. Клинический дефицит того или иного фермента ведет к развитию несфероцитарной гемолитической анемии, обусловленной усиленным гемолизом эритроцитов, при сохранении компенсаторной активности эритропоэтической системы. Несфероцитарные анемии принято разделять на 2 группы по характеру течения аутогемолиза эритроцитов in vitro после инкубации в течение 24 часов при температуре 37°. При первом типе отмечается нормоцитарная анемия с легкой гипохромией. Заболевание обусловлено дефицитом глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) 2,3-дифосфо-глицеромутазы, глютатионредуктазы, понижением активности аденозинтрифосфатазы. Второй тип характеризуется нормальной по инкубации осмотической резистентностью эритроцитов, значительно снижающейся после 24 часов инкубации при 37°. Аутогемолиз значительно усилен, через 48 часов инкубации резко выражен и не смягчается глюкозой, но ослабляется добавлением АТФ. В крови у больных отмечается выраженный макроцитоз с множественными тельцами-включениями, которые становятся более отчетливыми после спленэктомии. Этот тип анемии возникает при дефиците пируваткиназы, а также 2,3-дифосфоглицеромутазы, приводящем к снижению уровня АТФ.
Гемолитическая анемия, обусловленная дефицитом глюкозо-6-фосфатдегидрогеназы (Г-6-ФД), фавизм. Примахиновая анемия. Наследование ограничено полом. Мутантный ген локализован в Х-хромосоме. Гетерозиготные девочки страдают меньше. Наибольшее распространение — в районе Средиземноморья. При дефиците Г-6-ФД в эритроците происходит блокирование первого этапа обмена глюкозо-6-фосфата в пентозном цикле, в результате чего уменьшается количество редуцированных нуклеотидов (НАДФ*Н2 и НАД*Н2), а также редуцированной формы глютатиона. В период новорожденности гипербилирубинемия в результате интенсивного гемолиза достигает высокой степени, в связи с чем нередко возникает необходимость в проведении заменных переливаний крови. В более старшем возрасте этот дефицит реализуется в виде внутри-сосудистого гемолиза с явлениями выраженной гемолитической анемии.
Гемолиз эритроцитов происходит под влиянием приема ряда лекарственных и химических веществ — примахина, сульфаниламидов, фенацетина, хинина, аспирина, ПАСК, салицилатов, нафталина, витамина К и др. Усиленный гемолиз эритроцитов может быть вызван также приемом в пищу или вдыханием пыльцы конских бобов и некоторых других растительных веществ. Усиление гемолиза наблюдается также под влиянием иитеркуррентных заболеваний, включая вирусные. При попадании в организм указанных выше веществ на 2-3-й день развивается резко выраженный гемолитический криз с гемоглобинемией и гемоглобинурией. В эритроцитах выявляются характерные для заболевания тельца Гейца. Наблюдаются анизоцитоз и пойкилоцитоз. Осмотическая резистентность обычно в норме, иногда может быть сниженной. В момент криза отмечается повышение числа ретикулоцитов, а у детей раннего возраста появляются и нормобласты. В период гемолитического криза отмечаются слабость, бледность с желтушным оттенком кожи, температура повышена, возможно увеличение селезенки. Гемоглобинурия может способствовать олигурии и даже анурии. Острый гемолитический криз длится 3-7 дней. Если прием препарата, вызвавшего гемолитический криз, продолжается, через несколько недель (5-6) вновь может возникнуть гемолитический криз.
Лечение. Необходимо исключить повторное применение вещества, вызвавшего гемолиз. При тяжелом гемолитическом кризе с резким падением гемоглобина — переливание крови, лучше всего капельно. У новорожденных с нарастающей непрямой гипербилирубинемией во время криза — заменное переливание крови. При гемоглобинурии и гемоглобинемии с целью предупреждения отложения гемоглобина в почечных канальцах необходимо применить алкилизирующие препараты.
Прогноз при своевременном диагнозе и предупреждении попадания в организм веществ, вызывающих гемолиз, благоприятный.
Гемолитическая анемия, обусловленная дефицитом редуктазы глютатиона. Описана в 1958 г. Lohr и Waller. Дефицит указанного фермента ведет к снижению редуцированного глютатиона, что способствует повышенному разрушению эритроцитов. Описаны различные варианты этой формы гемолитической анемии. Гемолитическая анемия в легкой степени, выявляемая в раннем детском возрасте, сопровождается ретикулоцитозом при отсутствии изменений осмотической резистентности. Прогноз благоприятный.
Гемолитическая анемия, обусловленная дефицитом 2, 3-дифосфоглицеромутазы. Впервые описана Praukerd. Наследуется по доминантному типу. Недостаток фермента способствует метаболическому блоку гликолиза, так как нарушается переход 3-фосфоглицерофосфата в 2-фосфоглицерофосфат, в результате чего возникает недостаточное образование АТФ и лактатов с наклонностью эритроцитов к более быстрому разрушению с одновременным развитием метгемоглобинемии. Заболевание проявляется в детском возрасте в виде анемии, желтухи, повышенного содержания ретикулоцитов в крови, спленомегалии.
Лечение. Общеукрепляющая терапия, диета, богатая витаминами. Спленэктомия непоказана. Прогноз благоприятный.
Гемолитическая анемия, обусловленная дефицитом аденозинтрифосфатазы (АТФ-азы). Впервые описана Harvald с соавт. в 1964 г. Наследуется по доминантному типу. Заболевание проявляется в раннем возрасте в виде гемолитической анемии различной степени в зависимости от интенсивности гемолитического процесса. В крови определяется повышенное содержание непрямого билирубина, ретикулоцитов. Отмечается спленомегалия.
Лечение при тяжелой анемии — переливание крови. Спленэктомия неэффективна.
Гемолитическая анемия, обусловленная дефицитом пируваткиназы эритроцита. Впервые описана Valentine с соавт. в 1961 г. Наследуется по доминантному типу. Фермент катализирует реакцию образования фосфоэкопирувата с одновременным образованием АТФ и АДФ. Поэтому при дефиците АТФ-азы тормозятся образование АТФ и лактата, что и способствует усиленному гемолизу эритроцитов с образованием незначительного количества метгемоглобина. В эритроцитах гетерозиготных лиц активность фермента снижена вдвое. Анемия гемолитического характера, сопровождающаяся гипербилирубинемией, выявляется у детей грудного возраста и новорожденных, отмечаются анизоцитоз и пойкилоцитоз. Спленомегалия не всегда выражена.
Лечение. При значительной гипербилирубинемии в периоде новорожденности показано заменное переливание крови. В более позднем возрасте — гемотрансфузии в период выраженной анемии. Спленэктомия неэффективна.
Метгемоглобинемия наследственная — заболевание, при котором нарушено равновесие между процессом окисления гемоглобина и метгемоглобина и процессами восстановления гемоглобина. Тип наследования зависит от характера нарушения, способствующего образованию метгемоглобина; возможен аутосомно-рецессивный и доминантный тип. Заболевание характеризуется выраженным диффузным цианозом, обнаруживаемым у детей в раннем возрасте и Даже в периоде новорожденности. Кровь имеет шоколадный оттенок за счет резкого повышения содержания метгемоглобина до 15-50% при норме от 0,5 до 1%. При тяжелых степенях метгемоглобинемии отмечаются одышка, слабость, головные боли. Развивается компенсаторная полиглобулия. Отмечается отставание детей в физическом и умственном развитии. В настоящее время принято выделять 3 формы наследственной метглобинемии.
Тип I описан Gibson в 1948 г. Обусловлен дефицитом фермента диафоразы или коэнзима, который принимает участие в восстановлении метгемоглобина в гемоглобин. Наследование аутосомно-рецессивное. Этот тип метгемоглобинемии выявляется при рождении ребенка и сохраняется всю жизнь. В большинстве случаев не дает выраженной клинической картины, кроме цианоза носогубного треугольника, слизистой оболочки рта и конъюнктивы; эти симптомы несколько усиливаются при физической нагрузке без ухудшения общего состояния.
Тип II, описанный Horlein с соавт. в 1948 г., характеризуется наличием патологического гемоглобина, обозначаемого как НbМ. В настоящее время установлено 4 варианта гемоглобина М, при наличии которых в организме развивается метгемоглобинемия, а именно НbМ Бостон (а258 typβ), HbM Саскатун — Чикаго (α2β263+typ) и НbМ (α287+typβ2). Содержание метгемоглобина у больных колеблется от 15 до 20%. Имеется выраженный цианоз. Общее состояние нарушается мало. У гетерозигот отмечено также повышенное содержание метгемоглобина в крови.
Тип III наследственной метгемоглобинемии, описанный Eder с сотр. в 1949 г., характеризуется отсутствием в эритроцитах аномального НbМ и заметных расстройств активности диафоразы 1, хотя клинически имелся выраженный цианоз с первых месяцев жизни, а содержание метгемоглобина доходило до 40%. В легких случаях специального лечения не требуется. В тяжелых случаях, при резком повышении содержания метгемоглобина в крови, вводят внутривенно метиленовую синюю в дозе 2 мг на 1 кг веса детям раннего возраста и 1,5 мг на 1 кг веса детям старшего возраста. Вводят медленно в виде 1% раствора. Назначают также аскорбиновую кислоту. Прогноз благоприятный.
Источники:
- Справочник по клинической генетике\Под общей редакцией профессора Бадаляна Л.О. — Москва: Медицина, 1971
Клиническая картина несфероцитарной гемолитической анемии близка к клинике, наблюдаемой при наследственной сфероцитарной форме заболевания, т. е. у больных отмечаются выраженные в той или иной мере желтуха, гепатоспленомегалия, анемия. По данным Ю. И. Лорие (1964), у больных с несфероцитарной гемолитической анемией преобладает увеличение печени над увеличением селезенки, в периферической крови, помимо анемии, наблюдается ретикулоцитоз при отсутствии сфероцитоза эритроцитов. Костный мозг представляет в той или иной степени эритробластическую реакцию. Биохимические показатели крови характеризуются увеличением содержания свободного билирубина и сывороточного железа.
В отношении тяжести течения наследственной несфероцитарной гемолитической анемии в литературе нет единого мнения. Бывают тяжело протекающие случаи (Г. С. Мухамедзинова, К. А. Москачева, 1959; А. X. Халилова, 1971), а иногда встречаются больные с удовлетворительной компенсацией гемолитического процесса (Ю. И. Лорие, 1964). Мы наблюдали 17 детей в возрасте от 1 года до 15 лет с наследственной несфероцитарной гемол и тическо й анемией. Преобладали мальчики (10). Среди больных в основном были дети старше 4 лет (16). Только у одного ребенка до поступления в клинику была заподозрена несфероцитарная гемолитическая анемия, остальные направлялись в клинику с диагнозом «цирроз печени», «неясная анемия», «гепатоспленомегалия», «болезнь Минковского — Шоффара», гемолитическая анемия «без уточнения ее формы.
При исследовании наследственного анамнеза у 12 детей в родословной было выявлено аналогичное заболевание, чаще всего по линии матери. Ранний анамнез у больных был без особенностей. Лишь в единичных случаях отмечался у матерей токсикоз беременности. Роды у большинства протекали благополучно (13), и вес детей при рождении был нормальным. В периоде новорожденности только у 3 больных отмечалась желтуха, расцененная как физиологическая. У некоторых детей имелась повышенная склонность к простудным заболеваниям, которые нередко обостряли течение гемолитической анемии. Наиболее частыми и ранними симптомами несфероцитарной гемолитической анемии были боли в животе, желтуха, бледность, увеличение печени и селезенки. У трети больных первым проявлением заболевания явился тяжелый гемолитический криз.
Клиническая картина несфероцитарной гемолитической анемии у больных зависела от периодов гемолитического процесса. В период ремиссии состояние детей было удовлетворительным. При осмотре у них отмечалась лишь небольшая субиктеричность склер, печень выступала из под ребер не более чем на 1 см, селезенка не прощупывалась или определялась глубоко в подреберье. Самочувствие детей было хорошим, содержание гемоглобина нормальным. В период субкомпенсации гемолитического процесса были четко выражены все клинико-гематологические симптомы заболевания, но гемолитический процесс был неинтенсивным и не сопровождался тяжелым состоянием, отмечалась умеренная желтуха. Печень и селезенка были увеличены на 2 — 3 см, содержание гемоглобина более 50 ед.
При обострении заболевания состояние становилось тяжелым и крайне тяжелым. Отмечалось повышение температуры, дети были резко бледными, желтушными. Печень в среднем была увеличена на 3 см, селезенка — на 4 — 5 см. Дети жаловались на головокружение, головную боль, боли в животе, тошноту, боли в конечностях. Отмечалась резкая анемия, обморочное состояние. У 2 больных гемолитический криз носил гипорегенераторный характер с явлениями начинающегося отека-набухания головного мозга.
Наряду с указанными симптомами отмечались отклонения в строении скелета («башенный череп», «высокое нёбо», прогнатизм, западание переносицы). У большинства больных выявлялись отклонения в состоянии сердечнососудистой системы. Нередко в моче обнаруживались кристаллы гемосидерина, что указывало на наличие смешанного типа гемолиза эритроцитов, протекающего как внутриклеточно, так и внутрисосудисто. По мере компенсации гемолитического процесса увеличивается количество эритроцитов и гемоглобина, в то время как ретикулоцитоз и билирубинемия уменьшаются. При обострении болезни намечается некоторая тенденция к увеличению среднего диаметра эритроцитов к уменьшению сферического индекса, однако их средние величины остаются в пределах нормальных колебаний. Осмотическая резистентность эритроцитов находилась в пределах 0,44 — 0,24%.
В лейкоцитарной формуле больных при обострении заболевания отмечался нейтрофилез со сдвигом влево до единичных бластных клеток и миелоцитов, это сочеталось с повышением СОЭ. У больных с гипорегенераторным кризом одновременно со снижением количества эритроцитов наблюдалось уменьшение числа лейкоцитов и тромбоцитов. Прямая реакция Кумбса у всех детей была отрицательной. Среди обследованных детей отмечалось увеличение числа резус-отрицательных лиц (46,1%) при средней норме 15 — 20%. При биохимическом исследовании крови у больных с несфероцитарной гемолитической анемией отмечалась склонность к гипогликемии. Со стороны белковых фракций у ряда больных имелось некоторое увеличение содержания глобулинов при небольшом уменьшении альбуминов. После клинико-гематологической характеристики различных периодов несфероцитарной гемолитической анемии следует остановиться на некоторых специальных исследованиях, имеющих значение в диагностике заболевания и в определении его типов.
«Гемолитические анемии у детей»,
М.Я.Студеникин, А.И.Евдокимова
При просмотре окрашенных мазков в оптическом микроскопе сфероцитоз эритроцитов не выявляется. Электронно-микроскопическое исследование красных кровяных телец констатирует глубокое нарушение их структуры на субмолекулярном уровне. Указанные данные свидетельствуют о сложных внутри-эритроцитарных метаболических нарушениях, обусловливающих неполноценность эритроцитов и приводящих к сокращению их жизненного цикла. Исследование эритрокинетики подтверждает это положение. У больных одновременно с патологическим усилением гемолиза эритроцитов…
Патогенез несфероцитарной гемолитической анемии сложен. Значительную роль в нем играют различные ферментные дефекты в эритроцитах. Kirkman, Riley (1961), Lausecker с соавт. (1965), Weinreich с соавт. (1968) часто отмечают дефицит фермента Г6ФД у данных больных. Недостаток энзима приводит к глубоким нарушениям метаболизма эритроцитов. Изменяются в них гликолитичеекие процессы, снижается процесс восстановления глютатиона, ответственного за нормальную структуру…