Гемолитическая анемия симптомы у новорожденных

Гемолитические анемии у детей – это группа разных по патогенезу заболеваний, главным признаком которых является уменьшение продолжительности жизни эритроцитов, развитие их гемолиза. Клиническая картина имеет общие симптомы: возникновение желтухи, спленомегалии, реже гепатомегалии, тёмное окрашивание мочи. Для лабораторных исследований характерно снижение гемоглобина, ретикулоцитоз, повышение уровня билирубина (в основном за счет непрямой фракции), повышение ЛДГ, уробилиногена мочи. Метод лечения зависит от этиологии анемии: возможна медикаментозная терапия, проведение гемотрансфузий, спленэктомия при гиперспленизме.
Общие сведения
Гемолитические анемии – это эритроцитопатии, при которых имеет место стойкое или массированное преобладание разрушения эритроцитов над их образованием. Среди всех анемий у детей встречаются в 11,5% случаев, в 5,3% ‒ от общего числа заболеваний крови. В числе больных незначительно преобладают лица мужского пола. Чаще диагностируются наследственные формы (76,6%) и особенно – наследственная сфероцитарная гемолитическая анемия (56,4%). Некоторые формы связывают с этнической принадлежностью: талассемия характерна для азиатов, жителей Кавказский республик, побережья Средиземного моря; серповидноклеточная анемия – для лиц негроидной расы, дефицит Г-6-ФД – для представителей еврейской национальности. Гемолитическая болезнь плода на территории РФ встречается у 0,6% новорожденных.
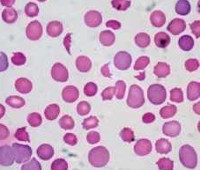
Гемолитическая анемия у детей
Причины
Этиология у наследственных и приобретенных гемолитических анемий различна. При наследственных анемиях патологии в строении эритроцитов запрограммированы на генетическом уровне: известно 16 вариантов с аутосомно-доминантным типом наследования, 29 – с рецессивным, 7 разновидностей – с Х-сцепленным. Все причины, которые приводят к гемолизу, разделяются на внеклеточные и внутриклеточные.
Внеклеточные причины типичны для анемий приобретенного характера. В этом случае эритроциты дефектов не имеют, а разрушаются под воздействием внешних факторов: ретикулоэндотелиальной гиперактивности (гиперспленизм), механических и химических нарушений целостности эритроцитов, иммунологических отклонений (под воздействием антител), паразитарной инвазии, витаминодефицита, некоторых инфекций. Внутриклеточные причины гемолиза – это нарушение структуры и функций эритроцитов, такие как дефекты эритроцитарного метаболизма, строения гемоглобина, мембран клеток.
Патогенез
В патогенезе наследственных гемолитические анемии главную роль играет внесосудистый гемолиз – разрушение эритроцитов происходит в клетках ретикулоэндотелиальной системы. Высвобождаемый гем распадается до несвязанного билирубина. В печени такое количество билирубина не может полностью связаться с глюкуроновой кислотой, развивается гипербилирубинемия. Клинически проявляется нарастанием желтухи, формированием у детей в раннем возрасте камней желчного пузыря, содержащих билирубинат кальция. В кишечнике билирубин метаболизируется в уробилин, избыток которого окрашивает мочу в темный цвет. Гиперактивность селезенки приводит к увеличению ее размеров с развитием гиперспленизма.
Внутрисосудистый гемолиз возникает при приобретенных гемолитических анемиях. Происходит распад эритроцитов в кровотоке, высвободившееся количество гемоглобина не связывается полностью с гаптоглобином в плазме, вследствие чего развивается гемоглобинурия. Избыток гемосидерина, который образуется в селезенке, почках, печени, способствует развитию гемосидероза данных органов и нарушению их функции. Компенсаторное усиление эритропоэза вызывает ретикулоцитоз. Гиперплазия костного мозга ведет к деформации черепа и скелета у детей.
Классификация
Общепринятая классификация гемолитических анемии у детей предложена Идельсоном Л.И. в 1975 году. Согласно ей выделяются две основные группы: наследственные и приобретенные, в каждой из которых обозначаются этиопатогенетические формы. Наследственные анемии классифицируются по локализации генетической аномалии, которая приводит к неполноценности эритроцитов. К ним относятся:
- Мембранопатии. Гемолитические анемии связаны с дефектами белковых и липидных комплексов мембран эритроцитов: врожденная эритропоэтическая порфирия, наследственные эллиптоцитоз и сфероцитоз – болезнь Минковского-Шоффара.
- Ферментопатии. Гемолиз обусловлен дефицитом эритроцитарных ферментов, которые обеспечивают пентозо-фосфатный цикл, гликолиз, синтез АТФ и порфиринов, обмен нуклеотидов и глютатиона.
- Гемоглобинопатии. Патологические состояния, вызванные структурными нарушениями гемоглобина и изменением синтеза его цепей: талассемия, серповидноклеточная анемия, эритропорфирия.
Приобретенные гемолитические анемии связаны с влиянием различных факторов, которые способствуют гемолизу в сосудистом русле и в органах ретикулоэндотелиальной системы. Среди них выделяют:
- Иммунные формы. Причиной гибели эритроцитов является выработка к ним антител. При изоиммунном варианте в организм проникают антиэритроцитарные антитела (гемолитическая болезнь новорожденных) или попадают красные кровяные клетки, к которым у больного есть сенсибилизация (посттрансфузионные анемии). Для гетероиммунных форм характерна фиксация на эритроцитах медикаментозных препаратов (пенициллины, сульфаниламиды, хинидин) или вирусов, что делает их антигеном. Аутоиммунные анемии вызваны образованием антител к собственным нормальным эритроцитам при онкологических заболеваниях, лимфолейкозе, миеломной болезни, системной красной волчанке, а также выработкой тепловых и холодовых антител.
- Механические формы. Гемолиз вызван механическим разрушением эритроцитов. Прямое повреждение возможно искусственными сердечными клапанами, паразитарной инвазией (малярийный плазмодий, токсоплазма), бактериальными токсинами (β-гемолитический стрептококк, менингококк), ядами змей, насекомых. При маршевой гемоглобинурии и анемии спортсменов после длительной интенсивной нагрузки гемолиз происходит в капиллярах нижних конечностей. Гиперспленизм является причиной разрушения нормальных эритроцитов в селезенке.
Симптомы
Клиническая картина, развивающаяся при разных типах гемолиза, имеет общие черты. Для приобретенных гемолитических анемий характерно острое нарастание симптоматики. Большинство наследственных анемий протекает хронически с периодическими гемолитическими кризами. Для развития криза необходимо воздействие триггера: переохлаждения, употребления токсичных препаратов, инфекционного заболевания. Первыми симптомами являются общая слабость, лихорадка, диспепсические расстройства, головная боль. В дальнейшем нарастают признаки билирубиновой интоксикации: иктеричность слизистых оболочек и желтушность кожи; появляются тяжесть, дискомфорт в верхних отделах живота из-за гепато- и спленомегалии, потемнение мочи — от розового до почти черного цвета. На фоне анемизации нарастает бледность с восковидным оттенком, появляются ощущения сердцебиения и перебоев в работе сердца. В тяжелых случаях развивается олигурия (уменьшение количества выделяемой мочи) и анурия, вплоть до шока.
Для наследственных форм характерно выявление стигм дизэмбриогенеза: челюстных и зубных деформаций, гиперхромии радужки, «башенного» черепа, западения переносицы, «готического» нёба; в анамнезе есть указания на гемолитические состояния у родственников, отягощена наследственность по желчнокаменной болезни. Клиническая картина изоиммунных анемий при конфликте «мать-плод» зависит от причины конфликта (резус-фактор, группа крови и другие). Высокий титр антител и их непосредственное влияние на плод на 20-29 неделе гестации приводят к водянке плода, попадание к плоду антител антенатально (после 29 недели) или в момент родов – к развитию гемолитической болезни.
Осложнения
При разных гемолитических анемиях возможны типичные только для них осложнения. Новорожденные с тяжелой гипербилирубинемией, вызванной наследственными формами, угрожаемы по развитию ядерной желтухи. К трем-четырем годам есть риск возникновения холестаза, хронического гепатита, цирроза печени. Большое количество гемотрансфузий у лиц с тяжелым течением способствует гемосидерозу селезенки, костного мозга, печени. Инфицирование парвовирусом В19 больных талассемией, серповидно-клеточной анемией ведет к фатальным последствиям – развитию арегенераторного криза. Для всех гемолитических состояний грозными осложнениями являются диссеминированное внутрисосудистое свертывание, острая сердечная и почечная недостаточность, анемическая кома.
Диагностика
Диагностика гемолитических анемий в педиатрии имеет некоторые особенности. После 12 месяцев в крови ребенка исчезают черты, характерные для неонатального типа кроветворения: макроцитоз, фетальный гемоглобин, пониженная минимальная осмотическая стойкость эритроцитов, нестабильность уровня ретикулоцитов. Поэтому точное типирование гемолитической анемии возможно только после этого возраста. В диагностике принимают участие педиатр и детский гематолог. В план обследования должны быть включены:
- Сбор анамнеза и общий осмотр. Выясняется этническая принадлежность, наличие у родственников гемолитических анемий, желчнокаменной болезни, история беременности и родов матери, группа крови, резус-фактор родителей. Педиатр осматривает ребенка на предмет выявления желтухи, типичной бледности, стигм дизэмбриогенеза; проводит пальпацию живота для выявления гепато-, спленомегалии, аускультацию сердца с целью выслушивания систолического шума на верхушке сердца, учащения сердцебиения.
- Клинические анализы. Общий анализ крови проводится с определением морфологии эритроцитов, лейкоцитов и тромбоцитов. При исследовании выявляются снижение гемоглобина, атипичные формы эритроцитов (при мембранопатиях и гемоглобинопатиях), наличие ретикулоцитов (как признака напряжения эритропоэза), тельца Гейнца-Эрлиха (при дефиците Г6ФД), повышение СОЭ. В общем анализе мочи отмечается повышение уробилина, гемоглобинурия.
- Биохимия крови. Для биохимического анализа типичны гипербилирубинемия, повышение ЛДГ, при внутрисосудистом гемолизе – гипергемоглобинемия, гипогаптоглобинемия. Прямая проба Кумбса (прямой антиглобулиновый тест) положительна при наличии аутоантител к поверхности эритроцитов, характерных для иммунных гемолитических анемий. Но при массивном гемолизе, а также при холодовых и гемолизиновых формах АИГА, вызванных IgА или IgM- аутоантителами, проба может быть отрицательной.
- Инструментальные методы. УЗИ либо КТ органов брюшной полости с высокой точностью определяют увеличения размер печени, селезенки, их структуру, состояние желчевыводящей системы. Трепанобиопсия костного мозга проводится с целью определения типа эритропоэза (нормо-, мегало- или сидеробластный), а также исключения патологии со стороны костного мозга (апластическая анемия, лейкоз, метастатическое поражение при злокачественных образованиях).
Специфические методы исследования. Определение длительности жизни эритроцитов может проводиться методами дифференциальной агглютинации, продукции угарного газа, проточной цитометрией (клеточное биотинилирование и др.), прямыми радиоизотопическими исследованиями. Генетические исследования и определение мутаций уточняют причины наследственного гемолиза.
Лечение
Лечение гемолитической анемии проводится в стационарных условиях, под наблюдением педиатра, гематолога, при переливаниях крови – трансфузиолога. Лечебный подход зависит от тяжести состояния пациента, периода заболевания (гемолитический криз или ремиссия), причины возникновения гемолиза. Методы терапии можно объединить в следующие группы:
- Медикаментозная терапия. Назначается как этиотропно, так и симптоматически. При увеличении селезенки и гепатомегалии применяют глюкокортикоидные гормоны. Аутоиммунные анемии требуют назначения цитостатиков, эритропоэтина. При дефиците фолатов назначают цианокобаламин и фолиевую кислоту. Гемолитический криз требует инфузионной терапии, снятия симптомов интоксикации. Для выведения избытка железа больным проводятся курсы хелаторной терапии (десферал). Во многих случаях с профилактической целью используются желчегонные средства.
- Гемотрансфузии. Переливание компонентов крови проводят в стационарных условиях при выраженной анемии по жизненным показаниям. Трансфузия эритроцитарной массы осуществляется строго по индивидуальному подбору, предпочтительно использовать отмытые и размороженные эритроциты. Длительная гемотрансфузионная терапия может осложниться избыточным отложением железа в тканях.
- Хирургическое лечение. Спленэктомия – хирургическое удаление селезенки – используется при спленомегалии, если лекарственная терапия не имеет эффекта. Метод особенно эффективен при гиперспленизме, когда секвестрация эритроцитов происходит в селезенке. При гемолитических анемиях часто развивается холелитиаз, который требует оперативного удаления желчного пузыря (холецистэктомии) или экстракции конкремента из желчных путей.
Прогноз и профилактика
Прогноз при гемолитических анемиях у детей зависит от этиологического фактора. Приобретенные формы и большинство наследственных имеют благоприятный исход при своевременно начатом лечении и соблюдении мер профилактики. В качестве системы питания используется диета №5 по Певзнеру, предназначенная для снижения нагрузки на билиарный тракт. Необходим охранительный режим: избегание перегрева и переохлаждений; исключение контактов с инфекционными больными; ознакомление со списком препаратов и веществ, которые могут вызвать гемолиз (хинин, сульфаниламиды, левомицетин, аспирин, нитрофураны и прочие); определение показаний и строгих противопоказаний к вакцинации (при дефиците глюкозо-6фосватдегидрогеназы, аутоиммунных анемиях иммунизация запрещена, при сфероцитозе – рекомендована).
Халбрехт в 1944 г, впервые установил, что ранее неизученная: форма неонатальной желтухи обычно связана с несовместимостью групп крови АВ0 между ребенком и матерью. Подобно водянке плода, болезнь АВ0 может вызвать желтуху в первые сутки после рождения, но в общем желтуха, анемия и гепатоспленомегалия выражены значительно меньше. Очень редко в литературе упоминаются случаи рождения мертвых детей. Ввиду редкости тяжелой анемии плода при этой болезни нет необходимости в антенатальном исследовании в отличие от резусного конфликта. Исследование новорожденных детей в основном направлено к тому, чтобы подтвердить диагноз болезни АВ0 в случаях ранней желтухи, так как иначе надо было бы искать другие причины, например инфекции. Лечение преследует цель предупредить ядерную желтуху и устранить позднюю анемию.
Патогенез
Несовместимость во системе АВ0 существует примерно в 20%. всех беременностей, причем у плода имеется антиген А или В, которого нет у матери. Но всех таких случаях материнская сыворотка содержит естественные антитела против А или В. Однако, лишь в 10% беременностей, несовместимых по группам АВ0, материнские антитела влияют на плод. Кроме того, гемолитическая болезнь АВ0 встречается почти исключительно у детей от матерей, имеющих нулевую группу крови.
Нормальные изоагглютинины АВ0 принадлежат преимущественно к типу макроглобулина 19S (IgM) и не переходят через плаценту. Однако у 10% всех взрослых и у всех матерей, дети которых страдали гемолитической болезнью АВ0, можно обнаружить «иммунные» антитела против А или В типа S (IgG). Эти антитела с меньшей молекулярной массой, по-видимому, существуют в равновесии по двум сторонам плаценты, так же как и резусные антитела. Изоагглютинины (анти-А или анти-В) у лиц с группой 0 крови чаще содержат «иммунную» фракцию, чем изоагглютинины людей группы А или В; этим и объясняется редкость гемолитической болезни АВ0 среди детей от матерей с группами В и А. Иммунные антитела против А или В могут быть обнаружены как у женщин, так и у мужчин. Наличие их не зависит от перехода через плаценту фетальных клеток или установленной в прошлом иммунизации веществом АВ. По этой причине гемолитическая болезнь АВ0 наблюдается среди первенцев также часто, как и среди детей, которые рождаются в дальнейшем.
Симптомы гемолитической анемии АВ0
Гемолитическая болезнь АВ0 обычно проявляется в желтухе, которая развивается в первые сутки жизни, но при легких формах может возникнуть позднее. Эта болезнь встречается не только при второй и дальнейших беременностях: примерно половина больных детей — первенцы. Не существует также постоянной тенденции к более тяжелому поражению детей, следующих за первым ребенком; иногда эти дети меньше поражены. Недоношенные дети, по-видимому, менее склонны к гемолитической болезни АВ0, что, вероятно, объясняется более слабыми эритроцитарными антигенами А и В, присутствующими до рождения. В первоначальной группе случаев, собранной Халбрехтом, не было описано ни гепатоспленомегалии, ни геморрагических явлений, и только 3 из 12 детей страдали легкой анемией. Однако при более тяжелых формах болезни иногда встречаются выраженная анемия и гепатоспленомегалия.
В старых работах описаны случаи ядерной желтухи. Вероятно, риск ее возникает, когда уровень билирубина в сыворотке достигает 20 мг%, как и при резусной болезни.
Поздняя анемия, развивающаяся в возрасте 2-6 недель, редко бывает тяжелой. Однако встречаются и: исключения среди детей, едва избежавших обменных переливаний. Обменные переливания создали бы популяцию клеток: группы 0, резистентных к преждевременному гемолизу. Возможно,, что эта проблема станет более серьезной из-за широкого применения светотерапии.
Лабораторные данные
У многих из этих детей наблюдается повышенный уровень непрямого сывороточного билирубина без анемии. Однако обычно есть признаки компенсированного гемолиза насчитывается более 10 нормобластов на 100 лейкоцитов и более 7% ретикулоцитов. Эти цифры являются верхней границей нормы у доношенных детей при рождении.
У 80% детей с болезнью AB0 имеются сфероциты, тогда как при резусной болезни они отсутствуют. Морфологически сфероциты неотличимы от клеток при наследственном сфероцитозе. Как те, так и другие отличаются пониженной осмотической резистентностью и тенденцией к аутогемолизу; однако добавление глюкозы снимает аутогемолиз при наследственном сфероцитозе, но не прекращает его при болезни AB0. На практике в большинстве случаев дифференциальный диагноз поставить легко, сопоставив группы крови-родителей и исследуя их кровь на сфероцитоз и компенсированную гемолитическую анемию. Иногда необходимо также дифференцировать сфероциты у детей с болезнью АВ0 от приобретенных сфероцитов, которые появляются при гемолитических анемиях, вызванных вирусными инфекциями, например врожденной краснухой. Но в таких случаях они сопровождаются фрагментацией эритроцитов и наличием венценосных клеток. При болезни АВ0 тромбоцитопения обычно отсутствует, хотя возможность ее точно доказана при тяжелой резусной болезни и при врожденных инфекциях, вызывающих гемолиз у новорожденных, т. е. цитомегалии, краснухе, сифилисе и токсоплазмозе.
Определение групп крови покажет почти всегда группу 0 у матери и группу А или В у ребенка. Иногда поражаются дети с группой А2. Если сыворотка матери вызывает видимый гемолиз клеток А или В от взрослых при 37 °С (в присутствии свежего комплемента), то возникает большое подозрение на наличие «иммунных» изоагглютининов. К сожалению, однако, эта реакция не вполне специфична, так как ее могут дать некоторые неиммунные антитела 19S. Даже «батарея» тестов, на материнской сыворотке не может с полной очевидностью подтвердить наличие болезни АВ0. Основное значение тестов на иммунные антитела против А или В в материнской сыворотке состоит в том, что если все тесты отрицательны, то болезнь АВ0 исключена.
Более специфическим признаком является наличие свободных антител против А в сыворотке ребенка группы А или антител против В у ребенка группы В. Это доказывает, что антитела перешли из циркулирующей крови матери в кровь ребенка и, следовательно, «иммунны». Для того чтобы обеспечить максимальную чувствительность этого теста, надо пользоваться клетками A1 или 3 от взрослых, так как они имеют более сильные антигены, чем клетки плода. Почти у всех детей с болезнью АВ0 в сыворотке можно обнаружить в первые 48 ч жизни несовместимые антитела при помощи папаина или непрямого метода Кумбса. После 48 ч тест может быть отрицательным. Антитела можно также смыть с эритроцитов ребенка и идентифицировать таким же образом.
При болезни AB0 новорожденных нельзя рассчитывать на положительный результат прямой пробы Кумбса. При использовании некоторых специально отобранных сывороток и технических модификаций чувствительность пробы повышается, по основным источником вариабельности ее результатов является тот факт, что антигенные рецепторы А и В на эритроците плода находятся на большем расстоянии друг от друга, чем на зрелой клетке. Фетальные клетки A1 в этом отношении соответствуют зрелым клеткам А2 и так же как последние, слабо агглютинируются. Смытые антитела, однако, интенсивно реагируют со зрелыми клетками А1и таким образом могут быть выявлены непрямой реакцией Кумбса, даже если прямая проба Кумбса на клетках ребенка отрицательна.
Если у матери при определении группы крови до родов обнаружен альфа- или бета-гемолизин или если в прошлом у нее рождались дети с болезнью АВ0, то желательно определить группу ребенка и поставить прямую пробу Кумбса на крови пуповины при рождении. При этом надо помнить об одной технической детали: антигены АВ0 при рождении часто бывают значительно слабее, чем в дальнейшем, а следовательно, у ребенка может быть ложно определена група 0; нельзя также доверять «обратной проверке» сыворотки новорожденных, т. е. наличию антител против В у детей группы А и т. д.
Лечение
В отличие от резусного конфликта при болезни АВ0 никогда не возникает вопрос о преждевременной провокации родов. Однако после рождения ребенка основной принцип лечебной тактики тот же, что и при резусной несовместимости, т. е. следует повторно определять сывороточный билирубин, так чтобы предупредить, пользуясь обменными переливаниями, его повышение сверх 20 мг%. Максимальный уровень достигается часто не раньше 3-го или 4-го дня. Показания к обменным переливаниям и техника их таковы же, как при резусной болезни, но надо использовать кровь нулевой группы, принадлежащую к той же резусной группе, как и кровь ребенка. Так называемых опасных доноров нулевой группы с высоким титром альфа-гемолизинов, конечно, надо избегать, так как их кровь может усилить гемолиз клеток ребенка. По-видимому, нет смысла пользоваться клетками нулевой группы, взвешенными в плазме АВ. Есть мнение, что в тяжелых случаях, когда следует заранее рассчитывать на множественные обменные переливания, желательно добавлять альбумин к донорской крови.
Для того чтобы выявить позднюю анемию: по поводу которой иногда требуется прямое переливание крови, необходимо внимательно наблюдать ребенка.
Светотерапия и фенобарбитал. Эти два лечебных средства были предложены для того, чтобы уменьшить необходимость в обменных переливаниях путем снижения уровня непрямого билирубина при желтухе недоношенных и «физиологической» желтухе доношенных детей. Ввиду успешных результатов, достигнутых при таких формах неонатальной желтухи, те же средства были испытаны и в легких случаях болезни АВ0 и резусного конфликта.
Фенобарбитал и светотерапия снижают билирубин относительно медленно, поэтому о них может идти речь, только когда уровень билирубина повышается также медленно. Если билирубин нарастает быстро, то они не могут заменить обменные переливания.
Фенобарбитал. Фенобарбитал активирует фермент глюкуронил-трансферазу и родственные ей ферменты, которые участвуют в экскреции билирубина. У новорожденных, особенно недоношенных, активность глюкуронил-трансферазы часто бывает низкой. Этот фермент катализирует лимитирующий скорость этап в процессе превращения жирорастворимого билирубина, который может быть токсичен для нервной системы, в безвредный водорастворимый глюкуронид. Лечение фенобарбиталом матери в течение 2 недель перед родами или ребенка в первые 3-4 дня после рождения снижает уровень сывороточного билирубина. Первые испытания позволяли предполагать, что введение этого медикамента матери более эффективно, чем лечение ребенка.
Однако в результате испытаний, проведенных недавно, был сделан противоположный вывод. Кроме того, ребенка лечить более удобно в практическом отношении, так как легкие формы неонатальной желтухи, особенно вызванной недоношенностью, обычно нельзя предвидеть заранее.
Было доказано, что лечение фенобарбиталом действительно уменьшает число обменных переливаний при желтухе, связанной с недоношенностью.
Высокие дозы фенобарбитала, вводившиеся детям, по-видимому, уменьшили также потребность в обменных переливаниях у китайских детей с болезнью АВ0 или дефицитом глюкозо-6-фосфат-дегидрогеназы и при легкой резусной болезни. На основании проведенных недавно испытаний и обзора литературы следует полагать, что даже умеренное снижение сывороточного билирубина, достигаемое при этом лечении, может быть важно, особенно у недоношенного ребенка, у которого ядерная желтуха может
развиться при уровне билирубина всего лишь 9 мг%.
При окончательной оценке фенобарбитала в качестве дополнительного средства борьбы с неонатальной желтухой надо будет учесть, что у детей, матери которых принимали барбитураты, обнаружен сниженный уровень протромбинового комплекса и что по данным одного испытания светотерапия оказалась более эффективной.
Светотерапия. Свет сине-фиолетовой и желто-зеленой частей спектра (300- 600 нм) вызывает прогрессирующее светоокисление жирорастворимого билирубина, который вначале превращается в биливердин, а татем в ряд водорастворимых бесцветных производных, не дающих реакции на билирубин и быстро выводимых с желчью и мочой. Опыты, проведенные на животных, позволяют предполагать, что эти бесцветные производные нетоксичны. Фундаментальная обзорная статья по этому вопросу, опубликованная Бехрманом, основана на данных симпозиума, посвященного влиянию света на метаболизм билирубина и применению его в клинике. В этой обзорной работе полностью сформулированы клинические показания к светотерапии и ее технические детали.
Как и при использовании фенобарбитала, наиболее очевидный: клинический эффект получен при светотерапии желтухи недоношенных. Недавно были закончены рандомизированные испытания на чернокожих детях с малой массой тела, которые показали, что в группе, получавшей светотерапию, билирубин сыворотки не был выше 10 мг%, тогда как среди детей, леченных фенобарбиталом, этот уровень был превышен у 2,6% (доза фенобарбитала 5 мг/кг в день), а среди детей, не получавших ни той, ни другой терапии, у 67%. Сиссон и соавторы установили, что при болезни АВ0 светотерапия. (видимый синий свет от 410 до 490 нм) вызывала значительное снижение уровня сывороточного билирубина, в то время как уровень его нарастал у контрольных детей, страдавших той же болезнью. В обменных переливаниях нуждалось 5 из 16 детей контрольной группы, но не нуждался ни один из 19 больных, леченных, светотерапией. Каплан и соавторы также отмечают хороший эффект при болезни АВ0, но предупреждают, что в тяжелых случаях светотерапия еще не исключает необходимости в обменных переливаниях. В литературе отмечалось, что светотерапия не всегда, останавливает повышение уровня сывороточного билирубина при; болезни АВ0 и резусном конфликте. Важно проводить светотерапию под контролем повторных измерений билирубина; это лечение может снять клинически: выраженную желтуху при наличии гипербилирубинемии. Кожа меняет свою окраску, прежде чем снижается уровень билирубина в сыворотке. Непрерывная светотерапия более эффективна, чем перемежающаяся.
Высказывались и следующие предостережения в отношении светотерапии:
а) возможно повреждение эритроцитов, увеличивающее гемолиз;
б) при наличии гемолитического статуса повышается частота тяжелой поздней анемии;
в) у недоношенных детей с малой массой тела, находящихся в плохом состоянии, может развиться ядерная желтуха, хотя билирубинемия кажется компенсированной;
г) в отдаленном периоде наблюдается отставание в росте с уменьшенной окружностью головы;
д) возможно повреждение глаз.
Недавно эти проблемы рассматривались в специализированной литературе. Следовательно, возможная роль светотерапии при гемолитической болезни новорожденных полностью еще не установлена. Однако она, по-видимому, может уменьшить потребность в обменных переливаниях, при относительно легких формах гемолиза, а также оказаться более удобной на практике и более эффективной, чем лечение фенобарбиталом.
Женский журнал www.BlackPantera.ru:
Митчел Уиллоуби

