Фенотип при бронхиальной астме

Бронхиальная астма (БА) входит в перечень наиболее распространенных хронических болезней, с которыми приходится сталкиваться человеку. При этом она характеризуется различной частотой обострений и степенью проявления симптомов, разной реакцией на применяемые препараты.
В современных условиях проводится глубинное исследование факторов, влияющих на прогрессирование БА и периодичность обострений, разрабатываются целевые терапевтические приемы, учитывающие фенотипы клинического характера, равно как и биологического. Лечение БА предусматривает использование достаточно ограниченного круга препаратов, которые на практике доказали свою эффективность.
Одной из важнейших задач лечащего доктора является определение, какой в каждом конкретном случае у бронхиальной астмы фенотип. Это позволяет существенно повысить эффективность терапевтического воздействия.
Бронхиальная астма и ее классификация

Пионерами составления классификации БА в советской медицине были Адо и Булатов, изложившие свое видение вопроса в 1968 году. Основной их классификации служила этиологическая теория, в соответствии с которой выделяется два базовых типа болезни: инфекционно-аллергический и неинфекционно-аллергический, называемый также атопическим.
В 1982 году Федосеевым была представлена кардинально отличающаяся классификационная система, в значительно степени схожая с современной, которая предусматривала группировку по фенотипам с учетом патогенетических причин развития болезни, ее этиологических признаков. В соответствии с данной классификацией выделяют следующие формы заболевания:
- аутоиммунную;
- аллергическую и неаллергическую;
- с четко выраженным нарушением адренергического баланса;
- дисгормональную;
- аспириновую;
- глюкокортикостероидную;
- с первично нетипичной реактивностью бронхов;
- нервно-психическую;
- холинергическую.
В современных реалиях практикуется два основных подхода к классификации БА: группирование с учетом клинико-биологических показаний заболевания и кластерный анализ.
Клинико-биологический подход несколько ограничен, так как предполагает фокусировку только на одном аспекте недуга. Наиболее удачным образцом подобной классификации является система, предложенная американским профессором Венцелем. Он выделил три основные группы фенотипов БА:
- Клинические/физиологические, при определении которых отталкиваются от того, как протекает астма, какова периодичность возникновения обострений, как отвечает организм на лечение.
- Фенотипы, определяемые триггерами (аллергены, аспирин, физактивность и т.д.).
- Фенотипы, при определении которых отталкиваются от типа протекающего воспалительного процесса (нейтро- или эозинофильный, малогранулоцитарный).
При кластерном анализе обязательным является ведение многогранной статистики, которая позволяет разделить комплекс объектов на схожие группы.
Общее понятие о фенотипе

Под фенотипом БА подразумевают устойчивую клиническую вариацию астмы, предусматривающую применение индивидуального подхода к лечению.
Фенотип болезни определяется при наличии стабильного биологического маркера, позволяющего выделить конкретную клиническую форму, обладающую специфическими для конкретного варианта астмы характеристиками. Современные ученые выделяют фенотипы с учетом характера воспаления, функционального состояния дыхательной системы, нюансов клинических проявлений.
Принципы деления астмы по фенотипам

При определении фенотипов бронхиальной астмы ориентируются на ряд характеристик, включая:
- клинические особенности (имеющая ранее или позднее начало, вызванная курением, менструацией, ожирением, сверхчувствительностью к аспирину и т.д.);
- демографические (принадлежность к определенной возрастной категории, полу, расе);
- функциональные параметры (обструкция дыхательной системы, чувствительность к определенному типу лекарственных препаратов, низкий ОФВ1);
- исход (развитие ОБЛ хронического типа, периодичность обострений, ухудшение или улучшение течения астмы);
- патогенетические пути (с ремоделированием дыхательных путей, с преобладанием воспаления и др.);
- наличие риска для жизни.
При традиционном подходе к определению фенотипа БА с применением классификации на базе клинических, функциональных, этиологических и воспалительных показателей удается учесть только один определенный параметр, в результате чего характеристика получается однобокой и формируется целое множество фенотипов, связь между которыми сложно установить.
Со второй половины 90-х годов прошлого столетия европейскими учеными проводились масштабные исследования, связанные с проблематикой классификации БА. В итоге был предложен совершенно новый подход к определению фенотипов данного заболевания. Ученые пришли к выводу, что опираться следует в первую очередь на ответ организма пациента на терапию, тип протекающего в дыхательных путях воспалительного процесса, а также особенности клинического и физиологического характера.
Современная группировка фенотипов бронхиальной астмы подразумевает выделение таких четырех групп:
- Аллергическая леченая активного типа у детей.
- Леченая активного типа, выявляемая у взрослых и имеющая ярко выраженный характер.
- Аллергическая нелеченая, не имеющая высокой активности.
- Неаллергическая нелеченая неактивного типа.
Фенотипы с тяжелым течением
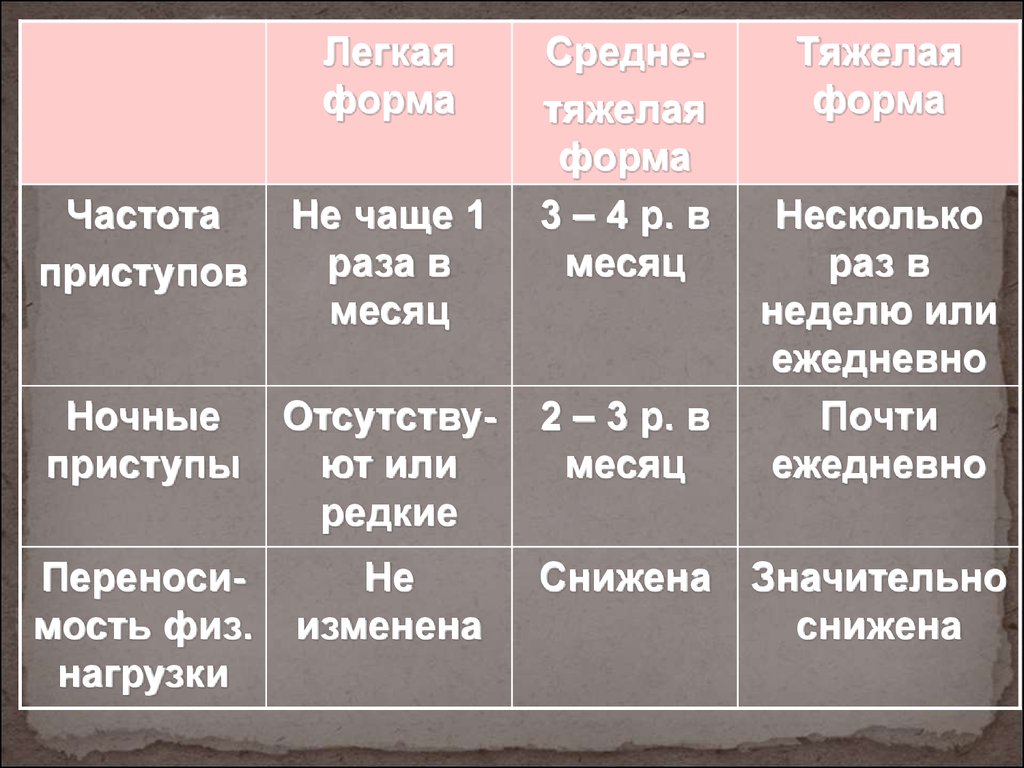
При тяжелом течении бронхиальной астмы фенотипы данного заболевания могут быть следующими:
- с тяжелой формой;
- с тяжелой формой хронического течения;
- БА второй половины жизни;
- фатальная.
Тяжелой БА уделяется значительное внимание в связи с тем, что на больных бронхиальной астмой данного фенотипа, численность которых составляет примерно 1/5 от общего числа страдающих недугом, затрачивается 4/5 всех средств, идущих на борьбу с БА. Тяжелая форма заболевания характеризуется наличием угрозы для жизни пациентов, резкими обострениями, внезапными и продолжительными приступами удушья, нестабильностью течения даже при правильно подобранном лечении.
К числу наиболее типичных фенотипов БА с тяжелой формой относится аспириновая, развивающаяся на фоне приема нестероидных препаратов с противовоспалительным эффектом.
Тяжелая форма БА хронического типа отличается плохим контролем при помощи ингаляций с глюкокортикостероидами. При возникновении подобной проблемы доктор обычно переходит к лечению системными стероидными препаратами. Группу больных хронической тяжело протекающей БА обычно объединяет наличие:
- перманентной симптоматики;
- частых приступов ночью;
- плохих функциональных показателей;
- сниженной и ограниченной физической активности и нарушений сна.
БА второй половины жизни, характерная для людей в возрасте, является достаточно распространенным явлением и раньше ассоциировалась с хронической обструктивной болезнью легких. Именно заболевание данного фенотипа часто заканчивается летальным исходом.
Фатальная БА – тип болезни, при котором происходит внезапная смерть пациента без видимых на то причин и изменения симптоматики. Развитие данного фенотипа заболевания крайне сложно предсказать, поскольку состояние резко ухудшается при нормальном дыхании.
Лечение бронхиальной астмы в зависимости от фенотипа

В прошлом врачи использовали примерно одинаковые подходы к лечению пациентов всех возрастных групп. Особенностям развития заболевания, его течения, реакции организма на те или иные препараты в разном возрасте не придавали особого значения, и стремились найти универсальные варианты терапии. Разработка методик лечения велась исходя из того, что причины развития заболевания являются у всех одинаковыми, и проводить разделения пациентов на основе их возраста не имеет смысла.
Однако более глубокое изучение БА позволило установить, что у каждой возрастной группы есть свои особенности протекания недуга, его диагностики, течения, реакции на лекарства. Кроме того, в разном возрасте у пациентов наблюдается различная реакция на сам факт наличия заболевания, у них разный психоэмоциональный настрой, что также оказывает существенное влияние на протекание болезни.
Поэтому в современных условиях диагностику и терапию бронхиальной астмы производят обязательно с учетом возраста пациентов. Также осуществляется скрупулезное изучение проблемы эффективности метода анти-IgE-терапии при БА и направленного лечения, ориентированного на фенотип заболевания.
В течение длительного времени на практике успешно применяется терапия атопической БА с использованием элиминационных мероприятий, направленных на исключение воздействия аллергенов, и аллергенспецифической иммунотерапии (АСИТ). Как показывает практика, такой подход выступает в качестве отличной альтернативы длительному поддерживающему лечению с использованием ингаляционных глюкокортикостероидов (ИГКС) для пациентов, у которых диагностирована легкая атопическая БА.
Отдельные направления в лечении
Еще одним примером эффективного лечения в соответствии с фенотипом является, терапия, направленная на уменьшение активности иммуноглобулина E. Она особенно эффективна для больных с атопической БА, число которых составляет до половины всех пациентов с тяжелой астмой.
У людей с данным фенотипом БА фиксируется повышенная восприимчивость к аллергенам, высокий уровень иммуноглобулина Е в крови, а также наличие предрасположенности к болезни, то есть отягощенный семейный анализ. Именно фенотип тяжелой БА является на сегодняшний день целевым для анти-IgE-терапии.
Согласно рекомендациям Американского пульмонологического и Европейского респираторного обществ, каждому пациенту следует проходить детальное анкетирование и вести дневник с записями симптомов. Благодаря этому упрощается оценка тяжести болезни, определение ее фенотипа, а также подбор наиболее эффективной методики лечения.
Назначение препаратов для терапии должно проводиться индивидуально для каждого пациента. Нередко случается, что человеку назначается кажущееся эффективным лечение, определяются оптимальные дозировки лекарств, однако при этом не удается должным образом контролировать заболевание, и вероятность развития его обострений остается на высоком уровне.
В таких случаях особенно важно провести правильное фенотипирование БА с учетом характера воспаления и атопического статуса, что даст дополнительную информацию, от которой можно отталкиваться для коррекции проводимого лечения.
Из большого спектра применяемых для лечения БА медикаментов наибольшую популярность получили ингаляционные глюкокортикостероиды. С их помощью удается добиваться эффективного снижения выраженности и частоты проявления симптомов БА, нормализовать функцию легких благодаря уменьшению гиперреактивности бронхов и интенсивности протекающих в них воспалительных процессов, снизить частоту обострений и в целом улучшить качество жизни пациентов.
В заключение
Бронхиальная астма представляет собой гетерогенное заболевание, характеризующееся наличием большого количества причин, приводящих к ее возникновению, а также изначально сложно прогнозируемым вариантом течения.
В этой связи первостепенную важность приобретает распознавание и классификация различных фенотипов болезни, благодаря чему врачи получают возможность проводить индивидуальное лечение бронхиальной астмы в каждом конкретном случае.
Именно при таком подходе терапия оказывается наиболее эффективной, позволяет ликвидировать симптоматику и контролировать протекание болезни.
Фото носит иллюстративный характер.
Материал адресован врачам: педиатрам, аллергологам, пульмонологам, терапевтам, общей практики.
— Астма — мультифакториальная патология. Развивается под действием агентов внешней среды при наличии генетической предрасположенности. Хроническое воспаление, свойственное астме, влечет за собой изменение структуры тканей органов дыхания — т. н. ремоделирование дыхательных путей.
Не всегда просто подобрать терапию, которая позволила бы достичь полного контроля над заболеванием. Когда не удается решить проблему сразу, то с ней справляются пошагово. Предложено выделять фенотипы для проведения оптимального лечения.
Вопросы классификации
Первое «деление» бронхиальной астмы было выполнено еще в I веке н. э. Античный лекарь Аретей описал две формы: одна возникает во время незначительной физической нагрузки, другая провоцируется холодным и влажным воздухом.
В международном консенсусе по астме у детей выделены: вирусиндуцированная, аллергениндуцированная, индуцированная физической нагрузкой, мультитриггерная и неуточненная.
Согласно современной классификации, различают:
- форму — аллергическая (IgЕ-опосредованная и не-IgЕ-опосредованная), неаллергическая, смешанная;
- степень тяжести — до начала базисной терапии диагностируется интермиттирующая, легкая персистирующая, средней тяжести персистирующая, тяжелая персистирующая;
- уровень контроля — полностью контролируемая, хорошо контролируемая, частично контролируемая, неконтролируемая;
- период — обострение, ремиссия.
Некоторые авторы все еще используют клинико-патогенетические варианты бронхиальной астмы, предложенные
Г. Б. Федосеевым в 1982 году: атопический, инфекционно-зависимый, аутоиммунный, дисгормональный, дизовариальный, выраженный адренергический дисбаланс, холинергический, нервно-психический, аспириновый, физического усилия.
Пациентов в первую очередь интересует успешное лечение, но золотой стандарт терапии — длительное использование ингаляционных кортикостероидов — дает положительный эффект лишь у 30–45% больных. Поэтому все больше внимания уделяется выяснению фенотипа — устойчивого клинического варианта астмы, требующего особых подходов в лечении.
Фенотип заболевания известен, когда найден надежный биологический маркер, на основании которого можно вычленить конкретную «клиническую форму» со специфическими для данного варианта астмы особенностями. Сегодня учеными предложено выделять фенотипы, учитывая характер воспаления, состояние функции внешнего дыхания, особенности клинических проявлений.
Среди характеристик, используемых для описания фенотипа, называют:
- демографические (возраст, пол, расовая принадлежность);
- клинические особенности (раннее/позднее начало; астма курильщиков; предменструальная; физического усилия; как профессиональное заболевание; ассоциированная с сопутствующей патологией — атопией, гастроэзофагеальным рефлюксом, ринитом, риносинуситом, ожирением, пищевой аллергией, аспириновой гиперчувствительностью);
- патогенетические пути (с преобладанием воспаления — эозинофильное, нейтрофильное, смешанное, негранулоцитарное; с ремоделированием дыхательных путей — гиперплазия бокаловидных клеток и гиперпродукция слизи, гиперплазия гладкомышечных клеток, утолщение малых дыхательных путей, ухудшение альвеолярных связей и эластина);
- функциональные параметры (низкий ОФВ1, фиксированная обструкция дыхательных путей, быстрое ухудшение функции внешнего дыхания, чувствительность к ингаляционным и системным стероидам, антагонистам лейкотриеновых рецепторов, анти-IgЕ-терапии);
- риск для жизни («хрупкая», близкая к фатальной, «мягкая» астма);
- исход (частота обострений, хроническая обструктивная болезнь легких, улучшение/ухудшение течения);
- для тяжелой астмы — также особенности обострений и персистирования симптомов.
Идеальный биомаркер — тот, что получен неинвазивным путем, воспроизводим, прост в оценке и обеспечивает точную информацию о текущем патофизиологическом процессе.
Современный взгляд
На настоящий момент известно несколько фенотипов заболевания.
Аллергический обычно проявляется в детстве и часто сочетается с предшествующим аллергическим ринитом и/или атопическим дерматитом. Первые симптомы связаны с воздействием аллергенов, приводящих к нарастанию воспаления в дыхательных путях. Последнее может персистировать и прогрессировать даже при отсутствии аллергенов. Ключевым патогенетическим считают механизм, опосредованный через Th2-лимфоциты.
При аллергическом фенотипе может быть повышен уровень оксида азота в выдыхаемом воздухе, что свидетельствует об эозинофильном воспалении.
Диагноз «аллергическая астма» требует определения атопического статуса: положительные кожные прик-тесты, специфические IgЕ в сыворотке, эозинофилия в периферической крови и/или индуцированной мокроте/бронхоальвеолярном лаваже, а также ассоциация с аллергическим ринитом и/или дерматитом.
Именно эозинофильный вариант характеризуется самыми частыми и тяжелыми приступами.
При этом фенотипе успешны лечение кортикостероидами, специфическая иммунотерапия; применение анти-IgЕ-, антиинтерлейкин-5- и антиинтерлейкин-4-терапии.
Эндогенная (неатопическая) астма обычно проявляется во второй половине жизни, преимущественно у женщин, характеризуется тяжелым течением. Диагностируют хронические синуситы, полипы носа, гиперчувствительность к аспирину. У детей неатопическая астма начинается рано. Как правило, они болеют респираторными инфекциями, подвергаются воздействию табачного дыма. Воспаление дыхательных путей сходно с таковым при аллергической астме: увеличение числа Th2-лимфоцитов, активация тучных клеток, эозинофильная инфильтрация. Ключевой патогенетический путь неизвестен.
Достоверные биомаркеры не выделены.
Для неэозинофильной астмы характерно отсутствие эозинофилии в дыхательных путях, возможна нейтрофилия. Существуют разногласия: это отдельный фенотип или астма с персистирующей бактериальной колонизацией дыхательных путей. При изучении индуцированной мокроты нейтрофильный фенотип был описан у 59% взрослых с симптомами астмы. Относительный риск возникновения последней в популяции вследствие эозинофильного воспаления составляет около 50%, во всех остальных случаях преобладают другие типы клеток. Нейтрофильное воспаление у ребенка чаще наблюдается при неатопической астме.
У детей с неэозинофильной астмой ремоделирование дыхательных путей выражено минимально (у взрослых утолщен субэпителиальный слой). Утолщение базальной мембраны и васкуляризация у детей возможны как при неэозинофильной, так и при эозинофильной астме.
Выявлено, что в патогенез неэозинофильной астмы вовлечены особенности иммунитета, вероятная роль бактерий, вирусов, характера питания. Ключевой диагностический инструмент — исследование индуцированной мокроты. Выделяют эозинофильное, нейтрофильное, смешанное и негранулоцитарное воспаления.
Эозинофильный вариант наблюдается при классической атопической астме с аллерген-опосредованным воспалением и, за исключением тяжелых случаев, характеризуется хорошим ответом на терапию ингаляционными кортикостероидами.
Уменьшается число эозинофилов в мокроте, улучшаются показатели функции внешнего дыхания, купируются симптомы.
Нейтрофильный вариант описан у пациентов с острыми или хроническими инфекциями, ожирением, у курящих, подвергавшихся воздействию поллютантов, у лиц с тяжелым течением астмы и в период обострения.
Смешанный эозинофильно-нейтрофильный вариант встречался у страдающих рефрактерной астмой. Характеризуется наиболее выраженным нарушением функции внешнего дыхания, частыми дневными симптомами и наибольшими затратами на лечение. Опубликованные результаты экспериментов говорят о том, что клеточный состав индуцированной мокроты с течением времени изменяется. К сожалению, данные о клеточном составе мокроты получены только у взрослых, а у детей не представлены.
Предложено выделять фенотипы
по ведущему иммунологическому пути (Th2 или Th1), выдвинута
гипотеза о существовании двух групп пациентов с астмой:
с повышенным и пониженным уровнем Th2-лимфоцитов.
Правда, преобладание активности Th1- или Th2-лимфоцитов у человека зависит от дозы антигенов: стимуляция оптимальными и высокими дозами способствует дифференцировке в Th1, а низкими — в Th2-лимфоцитах. Кроме того, уровень Th2-лимфоцитов повышается не только при аллергическом, но и при аутоиммунном процессе, строгого же разграничения между этими субпопуляциями часто не существует; бывает, что происходит плавный патоген-зависимый переход. Предполагают, что повышение уровня Th1- и Th2-лимфоцитов может рассматриваться как признак неконтролируемого течения заболевания.
Аспириновая форма диагностируется у 5–10% взрослых (чаще — у женщин) с астмой и более характерна для людей без атопии. У детей встречается редко. Порой этот фенотип развивается и прогрессирует, хотя нет указаний на применение ацетилсалициловой кислоты или других НПВС. Типичное проявление — старт в возрасте около 30 лет, чаще после ОРИ. Через несколько месяцев появляется ринорея, затрудненное дыхание через нос, назальные полипы с последующей манифестацией бронхиальной астмы. Течение продолжительное даже в том случае, когда не используются ингибиторы циклооксигеназы-1.
Многим пациентам для контроля синусита и астмы требуются системные кортикостероиды. Ключевым диагностическим методом признан провокационный тест с аспирином внутрь или интраназально. Пытались обнаружить биомаркеры данного фенотипа в моче, крови, индуцированной мокроте, слюне, конденсате выдыхаемого воздуха, но ни один их них не был надежен и специфичен, что ставит существование аспириновой астмы как отдельного фенотипа под сомнение.
Астма с ремоделированием дыхательных путей на гистологическом уровне характеризуется минимальным воспалением и выраженным ремоделированием, которое проявляется утолщением малых дыхательных путей, нарушением альвеолярного взаимодействия, потерей эластина, гипертрофией гладкой мускулатуры дыхательных путей, гиперплазией бокаловидных клеток и избыточной продукцией слизи, разрастанием новых кровеносных и лимфатических сосудов, утолщением базальной ретикулярной мембраны. Гипертрофию гладкой мускулатуры считают самым важным морфометрическим признаком ремоделирования. Утолщение гладкомышечного слоя коррелирует с гиперреактивностью дыхательных путей.
Виновно ли ожирение
Предложено выделять фенотипы, опираясь на результаты цветной 3D-резонансной импедансометрии. Новый метод исследования основан на принципах форсированной осциллометрии, позволяет измерить респираторный импеданс (взаимоотношение давления и потока воздуха) и результаты представляет в 3D. Фактическую часть импеданса называют сопротивляемостью респираторной системы (resistance), а предполагаемую — реактивностью. Они отражают соответственно эластические и инертные свойства легких. Метод мало используется: требуется специальное оборудование.
В качестве клинической характеристики для выделения фенотипов предложено рассматривать ожирение — возрастает число детей, страдающих одновременно от бронхиальной астмы и избыточного веса. По данным многоцентрового исследования, среди детей, поступивших в отделения неотложной помощи с приступом астмы, преобладают с ожирением.
Но и здесь не все однозначно. Так, Европейское общество по изучению механизмов тяжелой астмы продемонстрировало связь ИМТ и тяжести течения астмы только у женщин. Группа японских ученых доказала, что у больных с не-IgЕ-опосредованным фенотипом астмы и ИМТ более 30 кг/м2 риск терапевтически резистентной астмы выше, чем у пациенток с ИМТ в пределах нормы.
По данным датских ученых, ассоциация ИМТ и астмы встречается только у девочек. Бронхиальная астма, ассоциированная с ожирением, чаще регистрируется у женщин, но эта закономерность справедлива до значения ИМТ 31 кг/м2, а при больших цифрах отмечается экспоненциальный скачок частоты астмы у мужчин и линейный рост у женщин.
Патогенетическую связь бронхиальной астмы и ожирения подтверждает то, что за развитие и того и другого ответственны идентичные локусы генома человека. Ожирение является провоспалительным состоянием, характеризуется увеличением размера и количества адипоцитов (источника синтеза и секреции цитокинов) и адипоцитокинов (биологически активных медиаторов). Лептин стимулирует синтез провоспалительных цитокинов (фактор некроза опухоли α, интерлейкин-6) и влияет на Th1-опосредованный путь. А бронхиальная астма и есть хроническое воспалительное заболевание.
Терапевтическую устойчивость астмы, ассоциированной с ожирением, объясняют уменьшением выраженности
эозинофильного воспаления в дыхательных путях и снижением ответа рецепторов к глюкокортикостероидам. Установлено, что нейтрофилия в мокроте и крови страдающих астмой и ожирением выше, чем у пациентов, вес которых в норме. Но одно воспаление само по себе не может объяснить взаимосвязь ожирения и тяжести астмы.
Известно, что ожирение приводит к ухудшению функции внешнего дыхания: чем дольше «стаж» полноты, тем тяжелее течение бронхиальной астмы у взрослых. Выявлена связь между ИМТ и бронхиальной гиперреактивностью, описано улучшение функции внешнего дыхания и облегчение симптомов бронхиальной астмы после проведения консервативного и хирургического лечения ожирения.
Доказано, что вероятность развития астмы у людей с избыточной массой тела больше. Риск дебюта астмы носит «дозозависимый» характер: тем выше, чем полнее человек; при ожирении максимальный.
Увеличение ИМТ на 1 единицу сопряжено с возрастанием опасности бронхиальной астмы — на 6% у женщин и на 3% у мужчин. У детей с избыточной массой тела риск повышается на 60%, причем чаще у мальчиков. У родившихся с большим весом риск развития астмы значительнее.
У пациентов с ожирением II–III степени отмечается утяжеление течения астмы.
Предполагают, что ожирение усугубляет проявления ранее не выявленной гиперреактивности бронхов. Изменения механики дыхания связаны с прямым давлением большой массы подкожно-жировой клетчатки на грудную клетку и переднюю брюшную стенку, что ограничивает подвижность диафрагмы, стенок грудной клетки, уменьшает легочный объем. У пациентов с астмой и ожирением чаще регистрируются нарушения функции внешнего дыхания по рестриктивному, а не по обструктивному типу. Еще одно объяснение: на течение астмы влияет не само ожирение, а другие связанные с ним факторы, пока не определенные, или сопутствующие недуги, особенно апноэ сна и гастроэзофагеальная рефлюксная болезнь, инсулинорезистентность.
Есть и другая крайность. У детей с дефицитом массы тела астма манифестирует чаще, чем у имеющих нормальный вес. По данным эпидисследования, выполненного в Португалии, риск развития бронхиальной астмы у людей с ИМТ до 18,5 кг/м2 выше.
Итак, назвать ожирение признаком для выделения фенотипов бронхиальной астмы нельзя.
Генетические маркеры
Поиск «виновных» генов для выделения фенотипов астмы осуществляется по четырем направлениям: выработка аллерген-специфических IgЕ, развитие бронхиальной гиперреактивности, синтез медиаторов воспаления (цитокинов, хемокинов, факторов роста) и соотношение между типами иммунного ответа с участием Th1- и Th2-лимфоцитов. Изучение семей и анализ взаимосвязи в случай-контролируемых исследованиях выявили, что фенотипы могут определяться рядом локусов хромосом. Идентифицировано около 100 генов, ассоциированных с бронхиальной астмой. Однако данные различных специалистов порой противоречат друг другу, что можно объяснить этническими особенностями и ложноположительными взаимосвязями.
Предполагают, что клиническая картина и тяжесть течения бронхиальной астмы у детей определяются полиморфизмом генов системы детоксикации ксенобиотиков. Устойчивость организма к неблагоприятным факторам внешней среды зависит от активности работы ферментов системы детоксикации ксенобиотиков (цитохром Р450). Полиморфизм генов ферментов системы детоксикации и дисбаланс в этой системе называют возможной причиной формирования различных клинических фенотипов бронхиальной астмы, рассматриваемой как экологически обусловленное заболевание.
Эти данные интересно сопоставить с отчетами исследований ксенобиотического профиля водных объектов. Сообщается, что в поверхностных водах и питьевой обнаружены ксенобиотики с фармакологической активностью — сами лекарственные вещества и их метаболиты, попадающие в воду как загрязнители или как вторичные продукты физико-химической деградации, и ксенобиотики, не являющиеся лекарствами, но обладающие фармакологической активностью. В большинстве случаев это сведения о выявлении антибиотиков (ципрофлоксацин, эритромицин, пенициллин G, цефалексин), гормонов (17-эстрадиол, эстрон, эстриол, 17-этинилэстрадиол), НПВС (салициловая кислота, кетопрофен, диклофенак, индометацин, ибупрофен, парацетамол), противоэпилептических средств (карбамазепин), антидепрессантов (сертралин, циталопрам, флуоксетин, флувоксамин, венлафаксин).
Новые фенотипы?
Отечественные ученые проанализировали показатели функции внешнего дыхания с учетом аллельного состояния генов интерлейкина-6 GSTM1 и GSTT1 и пришли к выводу, что необходимо назначать лексредства в более высоких дозах. Однако исследования, связанные с выявлением и анализом генов, стоят дорого и для многих пациентов малодоступны.
На кафедре поликлинической педиатрии БелМАПО проведена научно-исследовательская работа, одним из результатов которой стало выделение нового фенотипа бронхиальной астмы у детей — астмы со структурными изменениями легких (пневмофиброз, фиброателектаз, усиление и деформация легочного рисунка и пр.). Клинические особенности — дебют в школьном возрасте, нарушение «классической» последовательности аллергического марша с манифестацией до проявления аллергического ринита, отсутствие ОРИ на первом году жизни, отхождение мокроты при приступе бронхиальной астмы, преимущественно неконтролируемое течение в случае тяжелой формы болезни, снижение проходимости мелких бронхов (МОС75), а также тенденция к дефициту массы тела у мальчиков, проживание в сыром помещении.
Структурные изменения можно выявить с помощью КТ органов грудной клетки. Если пациент с бронхиальной астмой среднетяжелого/тяжелого течения постоянно пребывает в условиях сырости, ему показана КТ. В других случаях величина риска рассчитывается по формуле: