Дизэритропоэтические анемии этиология патогенез проявления
Дизэритропоэтические
анемии встречаются в более чем 88 % случаев
всех анемий и развиваются в результате
нарушения эритропоэза в связи
(I)
с преимущественным повреждением
стволовых клеток – апластические и
гипопластические анемии;
(II)
с преимущественным повреждением
клеток-предшественниц миелопоэза и/или
эритропоэтинчувствительных клеток:
1. Анемии вследствие нарушения синтеза
нуклеиновых кислот в эритрокариоцитах
(мегалобластические дизэритропоэтические
анемии):
а) витамин В12- и/или фолиеводефицитные
анемии (пернициозная анемия, болезнь
Аддисона-Бирмера);
б)
витамин В12-
и/или фолиевонезависимые анемии;
2. Анемии в результате
нарушения синтеза гема:
а) железодефицитные
анемии;
б) порфиринодефицитные
анемии (железорефрактерные анемии);
3. Анемии в результате
нарушения регуляции деления и созревания
эритроцитов.
Дизэритропоэтические анемии, развивающиеся в результате преимущественного нарушения пролиферации стволовых клеток
Дизэритропоэтические
анемии, формирующиеся вследствие
преимущественного нарушения костномозгового
кроветворения, характеризуются
гипоплазией или аплазией костного мозга
и подавлением процесса кроветворения,
в основном миелопоэза. Как правило, эти
дизэритропоэтические анемии являются
проявлением (синдромом) других
патологических процессов, состояний
или болезней.
По происхождению
гипопластические и апластические
дизэритропоэтические анемии могут быть
наследственными или приобретенными.
Приобретенные дизэритропоэтические
анемии развиваются в результате действия
1) физических
факторов (например, ионизирующего
излучения);
2)
химических факторов (чаще всего
лекарственных препаратов – сульфаниламидов,
антибиотиков, транквилизаторов,
цитостатиков и других);
3)
биологических факторов (главным образом
вирусов, вызывающих гепатит, инфекционный
мононуклеоз и другие заболевания).
Патогенез.
Ионизирующее излучение вызывает
гипоплазию костного мозга. Химические
и биологические факторы реализуют свое
действие по нескольким механизмам:
1) Нарушают синтез
нуклеиновых кислот и белка в стволовых
клетках;
2)
Нарушают клеточное и/или физико-химическое
микроокружение стволовых клеток,
обусловливающее расстройство механизма
их пролиферации;
3)
Повреждают или вызывают гибель стволовых
клеток под действием образовавшихся
сенсибилизированных (цитотоксических)
лимфоцитов и/или антител. Любой из
указанных выше механизмов (или их
комбинация) обусловливает нарушение
пролиферации и/или гибель стволовых
гемопоэтических клеток, включая клетки
эритроидного ряда, что ведет к
гипопластическим или апластическим
анемиям.
Из
наследственных дизэритропоэтических
анемий отметим анемию Фанкони,
причиной которой является дефект
гемопоэтической клетки. Патогенез
связан с нарушениями процессов репарации
ДНК и потери чувствительности к
регуляторным цитокинам эритроидных
костного мозга, для которых характерна
повышенная мутабельность.
Проявления.
В костном мозге уменьшается количество
ядерных клеток миелоидного ряда, в том
числе эритрокариоцитов, увеличивается
число лимфоидных клеток (иммунный генез
дизэритропоэтических анемий) и содержание
железа. В периферической крови может
регистрироваться панцитопения –
снижение числа всех форменных элементов,
иногда за исключением лимфоцитов.
Наблюдается падение содержания
гемоглобина и количества ретикулоцитов;
анизоцитоз (чаще макроцитоз), укорочение
продолжительность жизни эритроцитов,
повышение концентрации железа в
сыворотке. Клинически выявляются
гипоксия, тромбоцитопения, гипокоагуляция,
лейкопения, сопровождаемая частыми
инфекционными заболеваниями.
Соседние файлы в папке Патофизиология 2
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

Первичные и вторичные дизэритропоэтические анемии

Схема кроветворения в костном мозге
Дизэритропоэтическая анемия — общее название патологий, при которых угнетаются функции костного мозга в области образования эритроцитов. Недостаточная выработка вызвана повреждением клеток, из которых продуцируются эритроциты. Повреждение может происходить на этапе зарождения либо на последующих стадиях развития эритроцита. В результате эритроциты, не успев обрести зрелую форму, погибают в костном мозге.
Первичная. Включает анемии либо заболевания, провоцирующие их образование, передающиеся по наследству. Определяется патология чаще всего на первом году жизни ребёнка. Характерные симптомы — бледность кожных покровов с желтоватым оттенком, белки глаз пожелтевшие, печень и селезёнка увеличены. Дети проявляют беспокойство, отказываются от еды, частым спутником заболевания становятся инфекции различной природы. Анемии протекают преимущественно в хронической форме.
Вторичная. Анемии приобретённого характера образуются вследствие нехватки микроэлементов либо витаминов, особой чувствительности к компонентам лекарственных средств, радиоактивного облучения, взаимодействия с опасными для здоровья химическими соединениями. Некоторые виды анемий возникают по неустановленной причине. Первыми признаками являются слабость, бледность, головокружения.
Этиология, патогенез

Наличие дефектных генов — причина первичных анемий
Этиология анемий носит различный характер. Первичная форма вызывается дефектными генами, передающимися от обоих родителей ребёнку. Существует ряд заболеваний, относящихся к наследственному виду дизэритропоэтических анемий. Их разделяют на 6 типов, каждый из которых имеет свои отличительные особенности при диагностике.
Патогенез врождённых форм обусловлен наличием повышенной ломкости хромосом. Причина заключается в мутации генов, связанных с рибосомальными белками. Факторы, влияющие на мутацию не установлены.
Анемии, вызванные недостатком элементов для эритропоэза, по своей природе делятся на 2 категории: заболевания при нехватке веществ (белка, железа, меди, витаминов группы В) и на патологии, связанные с некорректной усвояемостью данных веществ. Причины заключаются в дефиците поступающих в организм элементов (диеты, несбалансированное питание); повышенном расходе организмом (заболевания, кровотечения); наличии факторов, влияющих на переработку необходимых микроэлементов (курение, алкоголизм, стрессы, приём медицинских препаратов).
Патогенез сопровождается нарушением развития эритроцита. Например, при отсутствии меди эритроциты замирают на стадии ретикулоцитов и не переходят в зрелую форму.
Этиология анемий, спровоцированных угнетением костного мозга излучением, химическими соединениями и токсическими веществами — радиоактивная терапия, приём лекарств (антибиотики, антидепрессанты, противоопухолевые), взаимодействие с нефтепродуктами, ртутью.
Патогенез. Происходит повреждение стволовых клеток либо нарушение их микроокружения; угнетается процесс синтеза нуклеиновых кислот.
Симптомы

Бледность кожных покровов как один из признаков анемии
Недостаток эритроцитов провоцирует кислородное голодание тканей всех органов. В начальной стадии организм, испытывая дефицит кислорода, начинает качать кровь в ускоренном темпе. Пациент может ощущать учащённое сердцебиение, нехватку воздуха, одышку. Постепенно развиваются и другие симптомы болезни:
- быстрая утомляемость;
- головные и суставные боли;
- бледность или желтизна кожи;
- рассеянность внимания;
- тахикардия;
- ломкость волос и ногтей, возможна деформация ногтевой пластины;
- головокружения, обмороки;
- частые вирусные заболевания, грибковые и бактериальные заражения;
- трещины в уголках рта, кровоточивость дёсен;
- повышение температуры на 1 — 1,5 градуса;
- шум в ушах, появление тёмных точек перед глазами.
Диагностика и терапевтический прогноз

Комплексное обследование пациента — путь к верному диагнозу
Все виды анемий имеют свои отличия в показателях анализов. Для верификации диагноза проводятся дополнительные исследования. Наиболее распространённые показатели при дизэритропоэтической анемии:
- При физикальном обследовании:
- селезёнка увеличена в размерах;
- печень увеличена;
- кожные покровы отличаются бледностью с желтоватым оттенком.
- При исследовании крови:
- увеличение объёма эритроцита;
- патологические включения в эритроцитах;
- формы и структуры ядер изменены;
- повышенный уровень билирубина в сыворотке;
- избыточное отложение железа в митохондриях и лизосомах;
- нарушение структуры оболочки незрелого эритроцита.
- При морфологическом исследовании костного мозга:
- мегалобласты, эритробласты связаны хроматиновыми ядерными мостиками;
- клетки многоядерные (могут содержать до 12 ядер).
Прогноз благоприятен для нетяжёлых форм дизэритропоэтической анемии. При своевременном обнаружении и лечении заболеваний функция костного мозга восстанавливается. Очень тяжёлые формы патологии провоцируют критическое снижение иммунитета, кислородное голодание, риск летальности составляет 80%.
Лечение

Первое и главное в лечении — устранить причину
- Выявление причины и её устранение. При тяжёлых формах пациента помещают в отдельный бокс во избежание инфицирования.
- При анемиях, вызванных нехваткой веществ, назначается курс витаминов и микроэлементов.
- Переливание эритроцитной массы — временная мера для восстановления циркуляции эритроцитов в крови. Не влияет на продуктивность костного мозга.
- Приём стимуляторов эритропоэза, в частности эритропоэтина.
- Пересадка костного мозга. Процедура позволяет полностью возродить работу костного мозга, эффект достигается даже при тяжёлых формах заболевания. Трансплантация — единственный способ оптимизации кроветворения в большинстве случаев врождённых патологий.
Дизэритропоэтические
анемии встречаются в более чем 88 % случаев
всех анемий и развиваются в результате
нарушения эритропоэза в связи
(I)
с преимущественным повреждением
стволовых клеток – апластические и
гипопластические анемии;
(II)
с преимущественным повреждением
клеток-предшественниц миелопоэза и/или
эритропоэтинчувствительных клеток:
1. Анемии вследствие нарушения синтеза
нуклеиновых кислот в эритрокариоцитах
(мегалобластические дизэритропоэтические
анемии):
а) витамин В12- и/или фолиеводефицитные
анемии (пернициозная анемия, болезнь
Аддисона-Бирмера);
б)
витамин В12-
и/или фолиевонезависимые анемии;
2. Анемии в результате
нарушения синтеза гема:
а) железодефицитные
анемии;
б) порфиринодефицитные
анемии (железорефрактерные анемии);
3. Анемии в результате
нарушения регуляции деления и созревания
эритроцитов.
Дизэритропоэтические анемии, развивающиеся в результате преимущественного нарушения пролиферации стволовых клеток
Дизэритропоэтические
анемии, формирующиеся вследствие
преимущественного нарушения костномозгового
кроветворения, характеризуются
гипоплазией или аплазией костного мозга
и подавлением процесса кроветворения,
в основном миелопоэза. Как правило, эти
дизэритропоэтические анемии являются
проявлением (синдромом) других
патологических процессов, состояний
или болезней.
По происхождению
гипопластические и апластические
дизэритропоэтические анемии могут быть
наследственными или приобретенными.
Приобретенные дизэритропоэтические
анемии развиваются в результате действия
1) физических
факторов (например, ионизирующего
излучения);
2)
химических факторов (чаще всего
лекарственных препаратов – сульфаниламидов,
антибиотиков, транквилизаторов,
цитостатиков и других);
3)
биологических факторов (главным образом
вирусов, вызывающих гепатит, инфекционный
мононуклеоз и другие заболевания).
Патогенез.
Ионизирующее излучение вызывает
гипоплазию костного мозга. Химические
и биологические факторы реализуют свое
действие по нескольким механизмам:
1) Нарушают синтез
нуклеиновых кислот и белка в стволовых
клетках;
2)
Нарушают клеточное и/или физико-химическое
микроокружение стволовых клеток,
обусловливающее расстройство механизма
их пролиферации;
3)
Повреждают или вызывают гибель стволовых
клеток под действием образовавшихся
сенсибилизированных (цитотоксических)
лимфоцитов и/или антител. Любой из
указанных выше механизмов (или их
комбинация) обусловливает нарушение
пролиферации и/или гибель стволовых
гемопоэтических клеток, включая клетки
эритроидного ряда, что ведет к
гипопластическим или апластическим
анемиям.
Из
наследственных дизэритропоэтических
анемий отметим анемию Фанкони,
причиной которой является дефект
гемопоэтической клетки. Патогенез
связан с нарушениями процессов репарации
ДНК и потери чувствительности к
регуляторным цитокинам эритроидных
костного мозга, для которых характерна
повышенная мутабельность.
Проявления.
В костном мозге уменьшается количество
ядерных клеток миелоидного ряда, в том
числе эритрокариоцитов, увеличивается
число лимфоидных клеток (иммунный генез
дизэритропоэтических анемий) и содержание
железа. В периферической крови может
регистрироваться панцитопения –
снижение числа всех форменных элементов,
иногда за исключением лимфоцитов.
Наблюдается падение содержания
гемоглобина и количества ретикулоцитов;
анизоцитоз (чаще макроцитоз), укорочение
продолжительность жизни эритроцитов,
повышение концентрации железа в
сыворотке. Клинически выявляются
гипоксия, тромбоцитопения, гипокоагуляция,
лейкопения, сопровождаемая частыми
инфекционными заболеваниями.
Соседние файлы в папке Патофизиология 2
- #
- #
15.04.20151.55 Mб43~WRL0001.tmp
- #
- #
- #
- #
Связанные с нарушением или прекращением
эритропоэза:
Дефицитные анемии
– при дефиците веществ, необходимых
для нормального кроветворения (дефицит
микроэлементов (железо, медь, кобальт),
витаминов (В12,
В6,
В2,
фолиевая кислота) и белков)Ахрестические –
при неспособности костного мозга
усваивать гемопоэтические факторы
Апластические анемии
Метапластические анемии. При замещении
костномозговой полости жировой, костной
или опухолевой тканью (метастазы
опухолей в костный мозг, лейкоз), а также
при действии физических (ионизирующая
радиация)Анемия, обусловленная неполноценностью
формирования и функционирования
гемопоэтического микроокружения.
Развитие связано с расстройством
межклеточных взаимодействий стволовых
кроветворных клеток с нарушением у
последних процессов дифференцировки
и пролиферации. Проявляется макроцитозом,
нейтропенией, дефицитом тучных клеток.
Обнаружена в эксперименте. Полагают
возможность подобного механизма и у
человека.
В12-дефицитные
и фолиеводефицитные анемии.
Витамин В12и фолиевая кислота —
кофакторы синтеза ДНК. Их дефицит
сопровождается нарушением процессов
пролиферации клеток с высоким кругооборотом
— клеток крови, клеток кишечного эпителия
и как следствие развитием анемии,
характеризующейся наличием и костном
мозгу мегалобластов, расстройствами
пищеварения. Сочетанный дефицит витамина
В12 и фолиевой кислоты встречается редко,
чаще наблюдается изолированный дефицит
витаминов.
Этиология.Дефицит витамина В12чаще развивается в результате нарушения
его всасывания при снижении секреции
внутреннего фактора Касла вследствие
атрофии слизистой желудка либо после
резекции желудка (агастрические анемии).
У большинства на больных с дефицитом
витамина В12обнаруживаются
антитела, направленные против обкладочных
клеток желудка и внутреннего фактора
Касла. В12- и фолиеводефицитные
состояния могут разминаться также при
инвазии широким лентецом, поглощающим
большое количество витамина В12,
при беременности, нарушении всасывания
витамина В12в кишечнике, реже —
при недостатке поступления с пищей
(табл. 2).
Таблица 2.
Причины развития мегалобластных
анемий
В12-дефицитная | Фолиеводефицитная |
Недостаточное Голодание; Строгая Нарушение У недоношенных Дефицит внутреннего Наследственная Приобретённая Патология тонкого Заболевания Приём лекарственных Повышенное В физиологических В условиях Конкурентное Нарушение При наследственном | Недостаточное Голодание; Вскармливание Отсутствие Длительная Нарушение У недоношенных дефицит витамина патология тонкого алкоголизм; приём лекарственных Повышенное В физиологических В условиях Нарушение (при токсическом |
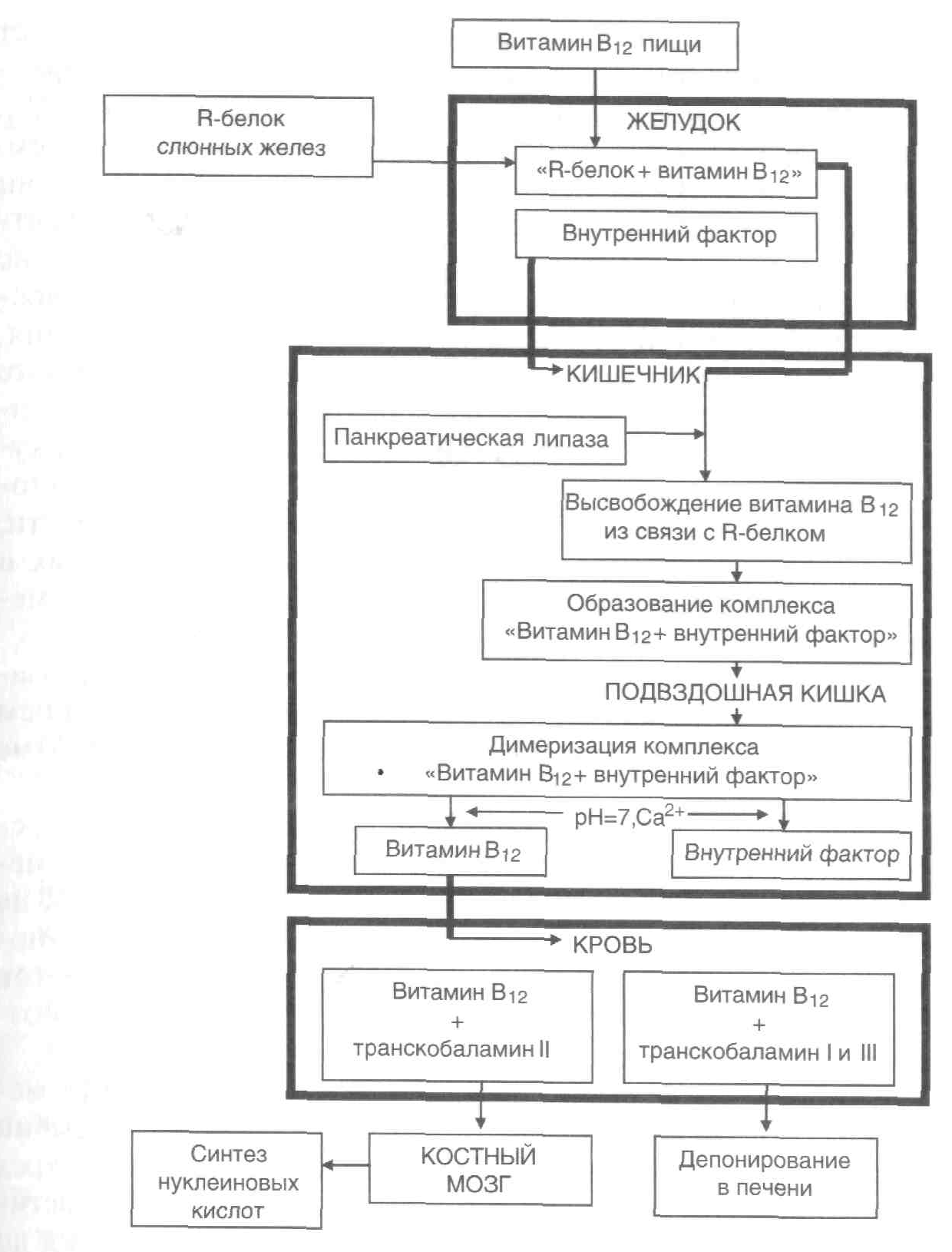
Рисунок 2. – Схема
метаболизма витамина В12
в организме
ПатогенезВ12-дефицитной
анемии
В норме витамин В12 (внешний
антианемический фактор) образует
комплекс с гастромукопротеином
(внутренним антианемическим фактором),
который взаимодействует со специфическими
рецепторами в нижней и средней частях
подвздошной кишки, что обеспечивает
всасывание витамина В12. Около 1 %
витамина В12может всосаться
независимо от внутреннего фактора. Один
из коферментов витамина В12—
метилкобаламин участвует в нормальном
кроветворении. С его участием из
уридинмонофосфата образуется
тимидинмонофосфат, входящий в состав
ДНК. Для синтеза тимидинмонофосфата
необходима также фолиевая кислота. При
отсутствии метилкобаламина ДНК не
образуется, нарушаются процессы деления
активно регенерирующих клеток, наиболее
резко проявляющиеся со стороны
эритропоэза; нормобластический тип
кроветворения переходит в мегалобластический.
Для последнего характерны сравнительно
меньшее число митозов (вместо трех
митозов, свойственных нормобластическому
эритропоэзу, происходит один), удлинение
времени митотического цикла, ранняя
гемоглобинизация мегалобластов, снижение
осмотической резистентности мегалоцитов,
сокращение продолжительности их жизни,
увеличение неэффективного эритропоэза,
сокращение продолжительности жизни
эритроцитов, повышение активности
гемолитических свойств плазмы крови,
что ведет к развитию билирубинемии.
Появляются экстрамедуллярные очаги
мегалобластического кроветворения.
Нарушается также лейко- и тромбоцитопоэз.
Второй кофермент — дезоксиаденозилкобаламин
участвует в обмене жирных кислот, в
превращении метилмалоновой кислоты в
янтарную. При дефиците витамина В12
в организме накапливается метилмалоновая
кислота, вызывающая дистрофию заднебоковых
столбов спинного мозга, развитие
фуникулярного миелоза, нарушение функции
центральной нервной системы.
В периферической крови: выраженная
гиперхромная анемия (ЦП > 1,0). Количество
эритроцитов снижается в большей степени,
чемНb, обнаруживают лейкопению с
нейтропенией, относительный лимфоцитоз,
тромбоцитопению.
В мазке:мегалобласты, мегалоциты,
анизоцитоз, пойкилоцитоз, макроцитоз,
эритроциты с тельцами Жолли, кольцами
Кабо, базофильной зернистостью, гигантские
полисегментоя-дерные нейтрофилы,
снижается число ретикулоцитов (увеличение
его свидетельствует о ремиссии), СОЭ
увеличивается.
В костном мозгеиногда отсутствуют
оксифильные мегалобласты, преобладают
базофильные формы («синий костный
мозг»). В клетках отмечаются дегенеративные
изменения.
Нарушения в желудочно-кишечном тракте
и нервной системе усугубляют течение
анемии. Развиваются глоссит Гунтера
(воспаление с последующим формированием
«лакированного» языка в связи с атрофией
его сосочков), стоматит, гастроэнтероколит.
Неврологический синдром проявляется
психическими расстройствами (бред,
галлюцинации), шаткой походкой,
парестезиями, болевыми ощущениями,
онемением конечностей, парапарезами,
возникновением патологических рефлексов
и др.
Патогенез фолиево-дефицитной анемии
В условиях дефицита фолатов происходит
нарушение процесса включения уридина
в ДНК развивающихся гемопоэтических
клеток и образованиея тимидина, что
приводит к прерыванию синтеза ДНК,
нарушению процессов дифференцировки
активно пролиферирующих клеток гемопоэза
и развитию мокроцитарной гиперхромной
анемии с мегалобластическим типом
кроветворения.
Картина периферической крови и клиническая
картина при фолиево-дефицитной анемии
аналогична В12-дефицитной анемии
за исключением неврологической
симптоматики, аторофические изменения
со стороны ЖКТ встречаются реже.
В12-ахрестическая анемия
При данной анемии процесс выработки
внутреннего антианемического фактора
не нарушается, отсутствуют изменения
со стороны пищеварительной и нервной
систем. Развитие этой анемии связывают
с нарушением метаболизма метилкобаламина,
в результате чего костный мозг утрачивает
способность утилизировать гемопоэтические
вещества, возникает мегалобластический
эритропоэз. Картина крови, как при В12-
и фолиеводефицитной анемиях. Содержание
витамина В12в плазме крови бывает
нормальным или повышенным.
В тропических и субтропических странах
встречается тяжелый прогрессирующий
энтероколит инфекционной природы —
СПРУ. Он протекает с нарушением всасывания
в кишечнике витамина В12и фолиевой
кислоты, дисбактериозом, синдромом
мальабсорбции, пенистым поносом,
истощением, белковым голоданием. Все
эти явления связаны со снижением, вплоть
до полного подавления, процесса выработки
воспаленной кишечной стенкой
белка-акцептора, ответственного за
перенос витамина В12и фолиевой
кислоты через кишечную стенку, быстрым
прохождением витаминов по кишечнику
из-за диареи, а также нарушением
образования фолиевой кислоты вследствие
дисбактериоза. Картина крови аналогична
таковой при В12и фолиеводефицитных
анемиях.


