Дифференциальный диагноз анемии фанкони
Анемия Фанкони – это генетическое заболевание, которое передается по аутосомно-рецессивному типу и характеризуется нарушением кроветворения, формированием злокачественных новообразований, пороками развития, ломкостью хромосом. Проявляется частыми кровотечениями, кровоподтеками на коже, вялостью, бледностью, склонностью к инфекциям. Диагностика проводится лабораторными методами, назначаются цитогенетическое, молекулярно-генетическое и клиническое исследования крови, миелограмма. Основные способы лечения – пересадка костного мозга, медикаментозное поддержание кроветворения, переливание крови.
Общие сведения
Синонимичные названия анемии Фанкони – врожденная панмиелопатия Фанкони, наследственная панмиелопатия. Заболевание названо по фамилии швейцарского педиатра Гвидо Фанкони, который в 1927 году описал врожденную апластическую патологию на основе симптомов у трех братьев. Анемия Фанкони является редкой генетической болезнью, наследуется согласно аутосомно-рецессивному принципу. Эпидемиологические показатели низкие – 1 больной ребенок на 350 тысяч новорожденных. Распространенность одинакова среди представителей женского и мужского пола, выше в сообществах с разрешенными близкородственными браками, например, у некоторых южноафриканских народов.
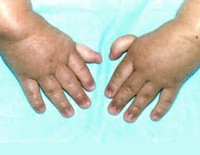
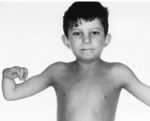
Анемия Фанкони
Причины
Заболевание является наследственным, развивается при передаче дефектного гена от родителей к ребенку. Выявлено 15 генов, мутации которых проявляются анемией Фанкони. Из них 14 расположены в аутосомах и являются рецессивными, 1 тип гена находится в X-хромосоме (сцепленной с полом). Все эти гены отвечают за производство определенного фермента, участвующего в репарации ДНК.
Аутосомно-рецессивное наследование подразумевает, что и отец, и мать должны быть носителями патологической генетической информации. При этом сами они, как правило, здоровы. Вероятность рождения больного ребенка в такой паре составляет 25%. Генетическая панмиелопатия диагностируется у детей и взрослых, получивших от каждого из родителей один и тот же измененный ген. В крайне редких случаях анемия провоцируется передачей дефектной Х-сцепленной хромосомы. Женщины могут быть носительницами мутации, заболевание проявляется только у мальчиков. Риск развития патологии у сына при наличии у матери мутированного гена – 50%.
Патогенез
В норме в клетках организма существуют специальные ферментные системы, которые исправляют разрывы молекул ДНК, поврежденных в процессе биосинтеза или воздействия химических, физических реагентов. При анемии Фанкони обнаруживается генетический дефект в кластере белков, ответственных за репарацию ДНК, что приводит к повышенной ломкости хромосом. В итоге у пациентов развиваются нарушения функций костного мозга – неоплазии и апластическая анемия. Онкологические заболевания чаще всего представлены острым миелоидным лейкозом – злокачественной опухолью миелоидного ростка крови, провоцирующей накопление измененных белых клеток, подавляющих рост эритроцитов, тромбоцитов и нормальных лейкоцитов. При апластической анемии в результате дисплазии костного мозга резко угнетается рост и созревание всех трех видов клеток крови.
Симптомы анемии Фанкони
Более чем у половины пациентов наблюдаются врожденные аномалии развития внутренних органов и скелета. Костные деформации проявляются специфическим внешним видом: больные низкорослые, с уменьшенным размером головы, отсутствием или заметным укорочением большого пальца на руках, недоразвитием лучевой кости, врожденным вывихом бедра и/или наличием шейного ребра, косолапостью, недоразвитым подбородком («птичьим лицом»). Характерна гиперпигментация кожи в виде светлых и коричневатых пятен.
Неврологические расстройства представлены косоглазием, недоразвитием одного или двух глаз, опущением верхнего века, глазным дрожанием, глухотой, умственной отсталостью. Больные зачастую имеют незрелые половые органы, у них отсутствует одно или оба яичка. К распространенным аномалиям строения органов относятся пороки мочевыделительной системы: удвоение мочеточников или лоханки, подковообразные почки, почечные кисты, смещенное наружное отверстие уретры (гипоспадия). Врожденные пороки сердца включают атрезию трехстворчатого клапана, дефект межпредсердной перегородки, митральный стеноз, дефект межжелудочковой перегородки. Пациенты страдают от почечной и сердечной недостаточности.
Ключевые симптомы связаны с постепенным нарастанием нарушений в работе костного мозга. Чаще они дебютируют в детском возрасте (в 5-10 лет). Из-за снижения количества тромбоцитов развивается повышенная кровоточивость: при ранениях кровь долго не сворачивается, легко возникают носовые кровотечения, выделения при менструациях обильны, на теле обнаруживается много «беспричинных» кровоподтеков. Уменьшение числа эритроцитов проявляется анемией с характерной слабостью, быстрой утомляемостью, головокружениями, обмороками, бледностью кожи, учащенным сердцебиением и одышкой. Недостаток лейкоцитов способствует ухудшению сопротивляемости инфекциям. Впоследствии формируется лейкоз, миелодиспластический синдром, онкологические болезни.
Осложнения
Наиболее распространенным осложнением считаются частые инфекционные заболевания. У пациентов развивается ОРВИ, ангина, ринит, бронхит, грипп, тиф, герпес. Рецидивирующий характер болезней и их тяжелое течение приводят к деструкции органов, сопровождаются риском сепсиса. Другим осложнением наследственной анемии являются злокачественные новообразования – лейкемия, эпителиальные опухоли органов шеи и головы, половых органов. Рак у таких больных тяжело поддается лечению из-за повышенной ломкости и сниженной репарации ДНК. Это явление ограничивает применение лучевой терапии, цитотоксических препаратов. Нарушение свертываемости становится причиной больших кровопотерь.
Диагностика
Обследование больных проводят онкологи, гематологи, педиатры, врачи-генетики. Диагностика начинается с анализа анамнестических данных и жалоб. Врач выясняет, имеется ли данное наследственное заболевание у близких родственников, уточняет время появления первых признаков болезни, ранние обращения к врачам. При осмотре оценивает общее состояние пациента, выявляет наличие аномалий развития, гиперпигментированных пятен, кровотечений, кровоподтеков. В большинстве случаев не составляет труда обнаружить типичные деформации костей, недоразвитие глаз. Для подтверждения диагноза и различения анемии Фанкони с приобретенной анапластической анемией проводится ряд лабораторных исследований:
- Клинический анализ крови. Характерны изменения клеточного состава крови. На ранних этапах нарушения кроветворения диагностируется тромбоцитопения и лейкопения, на более поздних – панцитопения (резкое снижение объема эритроцитов, лейкоцитов и тромбоцитов). Возможен умеренный гемолиз без гипербилирубинемии, но с ретикулоцитозом. Значение СОЭ увеличено до 60-80 мм/ч.
- Цитогенетическое исследование клеток. Выполняется проба с диэпоксибутаном, митомицином C, указывающая на частоту и спектр хромосомных аберраций. В пользу генетической анемии рассматриваются показатели ДЭБ-теста более 45%, пограничный уровень – 11-45% (процент клеток с хромосомными разрывами).
- Молекулярно-генетический анализ клеток. Исследуются гены, мутации в которых могут привести к развитию заболевания. В 60-70% случаев мутации обнаруживаются в паре генов FANCA, в 14% – в аллели FANCC, в 10% – в генах FANCG. Частота мутаций в других парах – 0,2-3%.
- Миелограмма. По данным исследования определяется увеличение количества плазматических клеток и макрофагов, фагоцитирующих жиры. Содержание недифференцированных клеток – в пределах нормы. Снижена концентрация клеток миелоцитарного ростка, увеличен показатель лимфоцитов.
Лечение анемии Фанкони
Основная терапия направлена на восстановление процесса кроветворения. Методы лечения подбираются индивидуально, зависят от тяжести заболевания, возраста пациента, наличия и выраженности врожденных аномалий. Дополнительно проводится лечение инфекций и онкопатологий, осуществляются реабилитационные мероприятия. Для устранения анемии используются следующие методы:
- ТКМ. Трансплантация костного мозга является наиболее эффективной в долгосрочной перспективе, но имеет противопоказания, нередко сопровождается развитием осложнений. Оптимальный возраст для проведения операции – до десяти лет. Донорами могут выступать здоровые сестра и братья, подходящие по критериям совместимости. Предварительная интенсивная терапия (кондиционирование) связана с риском токсического воздействия на органы. После трансплантации сохраняется высокая вероятность острого или хронического иммунного конфликта между клетками донора и реципиента.
- Медикаментозная стимуляция кроветворения. При невозможности проведения трансплантации пациентам показано консервативное лечение, временно улучшающее их состояние. Выработка кровяных клеток стимулируется андрогенами (мужскими половыми гормонами) и гематопоэтическими факторами роста – эритропоэтином, фактором стволовых клеток, интерлейкинами-1-12. Параллельно применяются иммунодепрессанты. Медикаментозная терапия способна на протяжении многих лет поддерживать высокое качество жизни больных, но ее эффективность постепенно снижается.
- Переливание компонентов крови. При выраженных побочных эффектах или противопоказаниях к этиотропной терапии (трансплантации, стимуляции кроветворения) назначаются процедуры гемотрансфузии. Переливаются отмытые эритроциты – донорские красные кровяные тельца, освобожденные от поверхностных белков. При кровотечениях и снижении уровня тромбоцитов пациентам вводится тромбоцитарная масса.
Прогноз и профилактика
Продолжительность жизни больных определяется степенью нарушения функции костного мозга. Иногда пациенты доживают до 40 лет без лечения, но нередко умирают в детстве от тяжелой анемии или онкологических заболеваний. Прогноз наиболее благоприятен при своевременном проведении аллогенной трансплантации костного мозга, после которой есть шанс полного восстановления нормального кроветворения и увеличения срока жизни. Поскольку заболевание генетическое, предотвратить его развитие невозможно. Профилактика сводится к медико-генетической консультации супружеских пар из групп риска, планирующих беременность, а также к проведению пренатальной диагностики патологии, в ходе которой из пуповинной вены плода производится забор крови и выполняется ДЭБ-тест. При его положительном результате рассматривается вопрос о прерывании беременности.
Теперь перейдем к частной патологии анемического синдрома. В этом же подразделе разберем дифференциальную диагностику различных анемических состояний, основное место в которой занимает гематологический фактор (т.е. лабораторные показатели).
Острая постгеморрагическая анемия – наблюдается при потере большого количества крови за короткий промежуток времени. Минимальная одноразовая кровопотеря, представляющая опасность для здоровья взрослого человека – 500 мл.
Этиология. Причинами острой постгеморрагической анемии могут быть внешние травмы или кровотечения из внутренних органов: после массивных кровотечений из расширенных вен пищевода, сосудов желудка или 12-перстной кишки при язвенной болезни, из язвы тонкой кишки при брюшном тифе, при разрыве маточной трубы в случае внематочной беременности, разъедании ветви легочной артерии при туберкулезе легких, разрыве аневризмы аорты или ранении ее стенки и отходящих от аорты крупных ветвей. Чем крупнее калибр пораженных сосудов и чем ближе он расположен к сердцу, тем опаснее для жизни кровотечение. При разрыве дуги аорты достаточно потерять 1 л крови, чтобы наступила смерть. Смерть наступает в таких случаях прежде, чем происходит обескровливание органов из-за резкого падения артериального давления и дефицита наполнения полостей сердца. При кровотечении из сосудов мелкого калибра смерть наступает при потере более половины общего количества крови.
Патогенез постгеморрагической анемии связан с острой сосудистой недостаточностью за счет резкого уменьшения ОЦК и снижением кислородно-транспортной функции крови (гипоксии) вследствие потери эритроцитов, когда эта потеря уже не может быть компенсирована за счет учащения сердечных сокращений (компенсаторной тахикардии).
Клиническая картина. У больного прежде всего появляются симптомы коллапса: резкая слабость, головокружение, бледность, сухость во рту, холодный пот, рвота, падает артериальное и венозное давление, уменьшается сердечный выброс крови, резко учащается пульс, наполнение пульса становится слабым. Определенное значение имеет источник кровопотери: к примеру, кровотечение в желудочно-кишечный тракт может сопровождаться повышением температуры тела, картиной интоксикации и т.п.
Как уже было сказано, клиническая картина и тяжесть состояния пациента определяются не только количеством потерянной крови, но и скоростью кровопотери, калибром пораженного сосуда.
Картина крови. В периферической крови сразу после кровотечения цифровые показатели эритроцитов и гемоглобина мало отличаются от исходных. Анемия выявляется через 1–2 дня. К этому времени объем крови восполняется за счет поступления в сосуды тканевой жидкости. В периферической крови увеличивается количество ретикулоцитов и юных эритроцитов (нормобластов). Из-за дефицита железа уровень гемоглобина снижен.
Хроническая постгеморрагическая анемия – чаще всего это вариант ЖДА (разбор впереди).
Картина крови:
— равномерное снижение количества эритроцитов и гемоглобина
— ЦП – N
— умеренный нейтрофильный лейкоцитоз и ретикулоцитоз
— увеличение числа тромбоцитов
Железодефицитные анемии (ЖДА).Обусловлены нехваткой железа в организме, что приводит к множественным трофическим нарушениям (ломкость ногтей, сухость кожи, выпадение волос, снижение мышечной силы), а затем к недостаточному образованию гемоглобина в клетках эритроидного ряда, что проявляется гипохромной анемией.
Этиология и патогенез. Основная часть поступающего в организм железа расходуется на образование гемоглобина. Депонирование осуществляется за счет связывания со специфическими белками в форме ферритина и гемосидерина. Трансферрин является транспортным белком: благодаря ему депонированное или всасывающееся в ЖКТ железо доставляется к клеткам, синтезирующим гемоглобин. У здоровых мужчин в запасе находится примерно 1000 мг (1г) железа. У женщин количество депонированного железа может варьировать от 0 до 500 мг. Примерно у 1/3 клинически здоровых женщин запасы железа в депо вовсе отсутствуют. Всасывание железа осуществляется во всех отделах ЖКТ, однако наиболее эффективно – в двенадцатиперстной кишке. У здоровых людей из пищи всасывается примерно 10% железа. Чаще всего железодефицитные анемии наблюдаются у женщин в связи с тем, что потеря железа у них примерно в 2 раза выше, чем у мужчин. Основная причина избыточной потери железа – менструальные кровотечения (меноррагии) и рождение детей.
Причиной дефицита железа может стать неполноценная диета (голод, невозможность или отказ от употребления мяса). Особую группу составляют больные с тяжелым поражением тонкого кишечника, при котором нарушается всасывание железа. Дефицит железа нередко развивается после резекции тонкой кишки вследствие кровотечений из ЖКТ (геморрой, язва желудка или двенадцатиперстной кишки, грыжа пищеводного отверстия диафрагмы, ангиоматоз, дивертикулез или полипоз толстого кишечника, неспецифический язвенный колит, болезнь Крона).
Клиническая картина. Характерны вялость, повышенная утомляемость, головная боль, сухость кожи и другие трофические нарушения, причем эти симптомы появляются у больного еще до развития выраженной анемии.
Характерным является сидеропенический синдром – снижение аппетита, затруднение при глотании твердой пищи, извращения вкуса в виде желания есть мел, глину, уголь и т.п., появляется пристрастие к необычным запахам (керосин, гуталин, ацетон).
Отмечается ломкость, искривление, поперечная исчерченность ногтей. Определяются бледность кожи, слизистых оболочек, сердцебиение, часто выслушивается “невинный” систолический шум, беспокоит одышка при физической нагрузке. Примерно у 10% больных пальпируется селезенка.
Важное значение в клинической картине имеет характер заболевания, определившего дефицит железа (язвенная болезнь желудка и 12-перстной кишки, геморрой, миома матки и т.п.) В связи с этим необходимо отметить, что многие хронические внутренние кровотечения могут оставаться скрытыми в течение многих лет, несмотря на многократные рентгенологические, гастро-, дуодено- и колоноскопические исследования.
Дифференциальный диагноз проводят с анемией, наблюдающейся при хронических воспалительных процессах и онкологических заболеваниях.
Картина крови:
— гипохромия (ЦП ниже 1,0)
— микроцитоз (см. классификацию)
— снижение содержания сывороточного железа (ниже 12 ммоль/л)
— может быть ускорение СОЭ
Анемии, связанные с нарушением синтеза или утилизацией порфиринов (сидероахрестические).Подобные анемии бывают наследственными и приобретенными.
Наследственными формами сидероахрестической анемиичаще болеют мужчины. Заболевание наследуется по рецессивному типу и передается с X-хромосомой.
Патогенез: в большинстве случаев обнаруживается снижение содержания протопорфирина эритроцитов, что обусловливает невозможность связывания железа. Вследствие этого происходит накопление железа в организме при резко нарушенном образовании гемоглобина.
Клиническая картина. Заболевание начинается с детства или с юности. Жалобы могут отсутствовать, иногда больные жалуются на небольшую слабость, повышенную утомляемость. Печень увеличена, иногда увеличена и селезенка. При выраженных отложениях железа в тех или иных органах развивается соответствующая клиника. Если железо поступает преимущественно в печень, развивается цирроз (гемосидероз печени). При отложении в поджелудочной железе может развиться сахарный диабет. Накопление железа в сердечной мышце приводит к недостаточности кровообращения, в яичках — к развитию евнухоидизма. Иногда кожа приобретает серый оттенок. Характерным является отсутствие клинических признаков ЖДА (нет астенизации, сухости кожи, выпадения волос, деформации ногтей и т.п.) при наличии выраженной гипохромной анемии.
Картина крови: цветовой показатель — 0,4–0,6 (снижен). Эритроциты в мазке гипохромные, повышен уровень сывороточного железа. Но окончательный диагноз может быть выставлен при исследовании уровня порфиринов в эритроцитах.
Приобретенные формы сидероахрестической анемии связаны с попаданием большого количества свинца в организм. Свинец блокирует сульфгидрильные группы ферментов, участвующие в синтезе гемоглобина.
Для свинцовой интоксикации типично сочетание признаков: мишеневидные эритроциты в мазке крови, высокое содержание железа в сыворотке крови, повышенный гемолиз эритроцитов, боли в животе, симптомы полиневрита.
Характерным признаком является развитие гипохромной анемии при высоком уровне сывороточного железа, а также наличие клинических и анамнестических признаков свинцовой интоксикации.
Витамин В12 – дефицитная анемия —по другому – пернициозная анемия, болезнь Аддисона-Бирмера; по картине крови – мегалобластическая (мегалобластная). Заболевание характеризуется появлением в костном мозге мегалобластов, внутрикостномозговым разрушением эритроцитов, гиперхромной макроцитарной анемией, тромбоцитопенией и нейтропенией, атрофическими изменениями слизистой оболочки ЖКТ и изменениями нервной системы в виде фуникулярного миелоза.
Этиология и патогенез. Идиопатическая форма В12-дефицитной анемии (пернициозная анемия) развивается в результате недостаточного поступления в организм экзогенного цианокобаламина преимущественно у лиц пожилого возраста. Патогенез дефицита витамина В12 чаще связан с нарушением выработки гликопротеина (внутреннего фактора), соединяющегося с пищевым витамином В12 (внешний фактор Кастла) и обеспечивающего его всасывание. Нередко первые признаки заболевания появляются после перенесенного энтерита, гепатита. В первом случае это обусловлено нарушением всасывания витамина в тонкой кишке, во втором – расхождением его запасов в печени, являющейся основным депо витамина В12. Развитие В12-дефицитной анемии после тотальной гастрэктомии (когда полностью ликвидируется секреция внутреннего фактора) происходит через 5-8 лет и более после операции. В течение этого срока больные живут запасами витамина в печени при минимальном пополнении его за счет очень незначительного всасывания в тонкой кишке, не соединенного с внутренним фактором Кастла.
Более редкими причинами нарушенного выделения внутреннего фактора может быть хроническая алкогольная интоксикация, когда она сопровождается токсическим поражением слизистой оболочки желудка или при инвазии широким лентецом, когда паразит поглощает большое количество витамина В 12.
Клиническая картина. Характерна триада: сочетание анемического синдрома с поражением ЦНС и ЖКТ. Отмечаются похудение, слабость, утомляемость, сердцебиение при физической нагрузке. Один из характерных признаков – фуникулярный миелоз – разрушение миелина в спинном мозге и из-за этого нервные расстройства – нарушение координации движений, неустойчивая походка, нарушение чувствительности в кончиках пальцев, мышечная слабость и боли в ногах. Желудочная секреция угнетена, возможна стойкая ахлоргидрия, признаки глоссита – “полированный” (или «малиновый») язык, ощущение жжения в нем, потеря аппетита. Кожа больных иногда слегка желтушна, так как в сыворотке крови увеличен уровень непрямого билирубина (за счет повышенной гибели мегалобластов костного мозга). Может быть незначительное увеличение печени и селезенки.
Картина крови:
— гиперхромия эритроцитов (ЦП выше 1,0)
— пониженное количество эритроцитов
— макроцитоз (мегалоцитоз или мегалобластоз – это практически синонимы)
— тромбоцитопения и лейкопения
— ускоренное СОЭ
— появление мелких шизоцитов
Но решающее значение в диагностике имеет исследование костного мозга, которое обнаруживает резкое увеличение в нем мегалобластов.
Фолиеводефицитная анемия – та же мегалобластная анемия, по сути почти В12- дефицитная. Существенная разница заключается в том, что болезнью Аддисона – Бирмера страдают взрослые дяди (за 40 лет), а типичным для развития фолиеводефицитной анемии является младший детский возраст, так что эта нозология – прерогатива педиатров, но мы с нею позднее познакомимся.
Гемолитические анемии —включают в себя целую группу нозологических единиц, объединяющим признаком которых является преобладание процессов кроворазрушения над процессами кровеобразования. Кроворазрушение может происходить преимущественно внутри сосудов или вне сосудов. Причины внутрисосудистого гемолиза: гемолитические яды, тяжелые ожоги, малярия, сепсис, переливание несовместимой крови, иммунопатологические процессы, вирусные инфекции, хронический лимфолейкоз, системная красная волчанка, пароксизмальная холодовая гемоглобинурия. Причины внесосудистого гемолиза носят семейный наследственный характер.
Гемолиз эритроцитов имеет место прежде всего в селезенке. Он может быть связан с дефицитом ферментов (глюкозо-6-фосфат-дегидрогеназы, пируваткиназы); с нарушением синтеза гемоглобина.В нашей стране наиболее распространенной гемолитической анемией является наследственный сфероцитоз.
Этиология: заболевание передается генетическим путем, но с полом не связано.
Патогенез. Дефект структуры мембран эритроцитов приводит к потере ими нормальной формы двояковогнутого диска и приобретению формы шара (сферуляция). Подобные клетки быстро разрушаются в селезенке. Вследствие ранней гибели эритроцитов уменьшается их количество. Сферуляция эритроцитов происходит только в периферической крови, а не в костном мозге.
Клиническая картина. У больных развивается желтуха, увеличивается селезенка, большая или меньшая степень анемии, склонность к образованию камней в желчном пузыре. Если болезнь развивается в раннем детстве, имеет место деформация скелета, особенно черепа. Череп приобретает башенную квадратную форму, отмечается микроофтальмия, изменяется расположение зубов, выявляется высокое небо. У ряда больных имеет место укорочение мизинца. Гемолитические кризы чаще всего провоцируются инфекцией.
Картина крови. В периферической крови увеличено число ретикулоцитов до 10 %, иногда до 50–60 %. В мазке крови сфероциты выглядят в виде маленьких клеток с интенсивной окраской, без обычной для нормальных эритроцитов бледности в центре. Относительное число сфероцитов — в среднем 20– 30 %, но нередко они составляют большинство красных клеток.
Дифференциальный диагноз. Следует проводить с аутоимунной гемолитической анемией. В этом случае помогает анамнез, наличие изменений скелета (башенный череп, короткие мизинцы), выявление аутоантител.
Апластические анемии.Заболевание, характеризующееся панцитопенией периферической крови и снижением содержания клеток костного мозга.
Этиология и патогенез. Апластическая анемия – относительно редкое заболевание. Встречается с частотой примерно 0,5 на 100 000 населения. Число случаев болезни возрастает по мере увеличения возраста от 1 года до 20 лет. Существенных различий в заболеваемости от 20 до 60 лет не выявлено. После 60 лет число случаев болезни возрастает. В некоторых семьях отмечается генетическая предрасположенность к болезни. Есть сообщения о развитии аплазии после приема некоторых лекарственных препаратов. Примерно у 50% больных установить этиологию заболевания практически не удается (идиопатическая апластическая анемия).
Клиническая картина связана в основном с цитопеническим синдромом и зависит от его глубины. Чаще всего наблюдается геморрагический синдром, в особенности при снижении уровня тромбоцитов (петехиальные высыпания на коже, синячки, кровотечения из десен, носа, почек, матки; возможны тяжелые кровотечения из желудочно-кишечного тракта). Появление геморрагии на слизистой оболочке полости рта, кровоизлияния в конъюктиву являются грозными симптомами, свидетельствующими о весьма возможном кровоизлиянии в головной мозг. Наряду с геморрагическим синдромом в клинической картине превалируют инфекционные осложнения (бронхит, пневмония, сепсис, парапроктит). Возможны тяжелые грибковые поражения слизистых оболочек, грибковый сепсис. Наряду с геморрагическими и инфекционными осложнениями часто выявляются симптомы, связанные с глубокой анемией (слабость, одышка при физической нагрузке, стенокардия).
При проведении дифференциальной диагностики необходимо учитывать, что панцитопения может явиться первым признаком острого лейкоза, метастазов рака в костный мозг, костномозговой формы хронического лимфолейкоза, волосато-клеточного лейкоза, туберкулеза, гепатита вирусной этиологии. Диагноз “апластическая анемия” в принципе является диагнозом исключения и устанавливается лишь в том случае, если перечисленные выше причины развития аплазии отвергнуты.
Картина крови: — панцитопения (снижение эритрцитов, лейкоцитов, тромбоцитов). Для уточнения диагноза необходима стернальная пункция и исследование пунктата.
Дата добавления: 2015-05-20; просмотров: 8343; Опубликованный материал нарушает авторские права? | Защита персональных данных
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: На стипендию можно купить что-нибудь, но не больше… 9472 — | 7512 — или читать все…
Читайте также: