Диагностика бронхиальной астмы у детей до 5 лет
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Федоров И.А.
1
Рыбакова О.Г.
1
1 ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Диагностика бронхиальной астмы у детей раннего возраста остается сложной задачей для врачей первичного звена здравоохранения. Когортное исследование уровня эозинофилов индуцированной мокроты проводилось в течение 10 лет, под наблюдением находилась группа 75 детей в возрасте от 1 года до 5 лет (средний возраст 2,8±1,2 года) с острым обструктивным бронхитом в анамнезе. Исследование проводили поэтапно. Повторное обследование детей проведено через 18 месяцев и через 10 лет от начала исследования. По окончании наблюдения пациенты были разделены на две группы. Первая группа (n=46) – дети, у которых бронхиальная астма не сформировалась за время исследования. Вторая группа (n=29) – дети со сформировавшейся бронхиальной астмой. На втором этапе работы проводилось сравнение лабораторных показателей, из алгоритма диагностики БА у детей: уровень эозинофилов общего анализа крови, уровень общего иммуноглобулина Е крови и уровень эозинофилов индуцированной мокроты по таким показателям, как чувствительность и специфичность. Было доказано, что уровень эозинофилов индуцированной мокроты ≥5% является специфичным, чувствительным и воспроизводимым маркером бронхиальной астмы и может быть использован для дифференциальной диагностики бронхиальной астмы и острого обструктивного бронхита.
эозинофилы
индуцированная мокрота
дети
острый обструктивный бронхит
бронхиальная астма
1. Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика». – 5-е изд., перераб. и доп. – М.: Оригинал-макет, 2017. – 160 с.
2. Горлова Н.В. Диагностические возможности компьютерного комплекса «Паттерн» в оценке функции внешнего дыхания у детей / Н.В. Горлова, А.Н. Узунова, М.Л. Зайцева // Человек. Спорт. Медицина. – 2006. – № 3. — C. 215-217.
3. Гиниатуллин Р.У. Морфологические аспекты патогенеза атопической бронхиальной астмы тяжелого течения у детей / Р.У. Гиниатуллин, Я.И. Жаков, И.А. Федоров // Педиатрия. – 1997. — Т. 76, № 5. — С. 4-8.
4. Global Initiative for Asthma. Global Strategy for asthma management and prevention. – URL: https:// www.ginasthma.com. (дата обращения: 14.01.2018).
5. Жаков Я.И. Клинико-анамнестические и лабораторные особенности у детей групп риска по формированию бронхиальной астмы / Я.И. Жаков, О.Г. Рыбакова, Е.Е. Минина и др. // Сибирский мед. журн. (Иркутск). – 2015. — № 5. – С. 31-34.
6. Мизерницкий Ю.Л. Дифференциальная диагностика и дифференцированная терапия острой бронхиальной обструкции при ОРВИ у детей раннего возраста // Практическая медицина. – 2014. — № 9 (85). – С. 82-88.
7. Федоров И.А. Диагностика бронхиальной астмы у детей, перенесших эпизоды острого обструктивного бронхита в дошкольном возрасте, по результатам десятилетнего наблюдения / И.А. Федоров, О.Г. Рыбакова, О.Г. Степанов // Человек. Спорт. Медицина. – 2017. – Т. 17, № 1. – С. 28-35.
8. Brozek G. Childhood asthma prevalence and risk factors in three Eastern European countries — the Belarus, Ukraine, Poland Asthma Study (BUPAS): an international prevalence study / G. Brozek, J. Lawson, A. Shpakou [et al.] // BMC Pulm Med. – 2016. – Vol. 16, № 1. – P. 11-16.
9. Жаков Я.И. Клиническая информативность метода индуцированной мокроты при бронхиальной астме у детей / Я.И. Жаков, Ю.Л. Мизерницкий, Е.Е. Минина и др. // Пульмонология детского возраста: проблемы и решения. — 2009. — № 9. – С. 120-124.
10. Wenzel S.E. Asthma phenotypes: the evolution from clinical to molecular approaches // NatMed. – 2012. – Vol. 18. – P. 716-725.
11. Staticescu S. The value of induced sputum in the diagnosis and management of children with bronchial asthma / S. Staticescu, P. Chereches-Panta, G. Ichim et al. // Clujul Medical. — 2014. — Vol. 87 (3). — Р. 171-176.
12. Wang F. Different inflammatory phenotypes in adults and children with acute asthma / F. Wang, X.Y. He, K.J. Baines [et al.] // Eur. Respir. J. – 2011. – Vol. 38, № 3. – P. 567-574.
13. Vijverberg S. Clinical utility of asthma biomarkers: from bench to bedside / S.Vijverberg, B.Hilvering, Jan AM. Raaijmakers et al. // Biologics. — 2013. – Vol. 7. – P. 199–210.
14. Walford H.H. Diagnosis and management of eosinophilic asthma: a US perspective / H.H. Walford, A.T. Doherty // J. Asthma Allergy. – 2014. – Vol. 7. – P. 53-65.
Диагноз «бронхиальная астма» (БА) у детей раннего возраста является клинико-анамнестическим, так как не все существующие методы лабораторной и функциональной диагностики могут использоваться в практике врача-педиатра либо в связи с их дороговизной и трудоемкостью, либо вследствие возрастных ограничений [1-3]. Особенности течения БА у детей дошкольного возраста и отсутствие специфических методов диагностики приводят к определенным трудностям у врачей первичного звена здравоохранения при постановке диагноза [1; 4; 5]. Популяционные исследования, которые регулярно проводятся в мире, демонстрируют, что, несмотря на существующий прогресс в изучении и ведении бронхиальной астмы, все еще сохраняется гиподиагностика этого заболевания у детей раннего возраста [1; 4; 6]. Основные трудности возникают при дифференциальной диагностике острого обструктивного бронхита (ООБ) и БА, особенно при первых их проявлениях [1; 7]. Вирусная инфекция является как этиологическим фактором ООБ, так и самым частым триггером БА у детей дошкольного возраста. И в том и в другом случае развивается синдром бронхиальной обструкции, который у детей этой возрастной группы имеет схожие клинические проявления, одинаковые рентгенологические, функциональные и лабораторные изменения [1; 7; 8]. Также обращает на себя внимание субъективность оценки ряда клинических параметров (тяжесть течения обструктивного синдрома, ответ на терапию), отданных на откуп врачу, который на своем рабочем месте, ограниченный временем приема, должен решать как «более» или «менее» выражен тот или иной симптом. В результате практически ни один из этих показателей не может служить достоверным дифференциально-диагностическим критерием ООБ и БА. Заболевание не диагностируется, больные не получают своевременно базисную терапию, что приводит к снижению качества жизни, образования и может приводить к росту инвалидизации от БА. Необходимость разработки новых диагностических критериев позволила нам более десяти лет назад модифицировать и внедрить в алгоритм диагностики бронхиальной астмы у детей раннего возраста метод индуцированной мокроты (ИМ) [9]. В детской практике методы оценки воспаления слизистой оболочки дыхательных путей должны быть простыми, неинвазивными, дающими возможность многократного проведения с отсутствием противопоказаний, ограничений и возможных осложнений. Многие методы являются трудоемкими, устаревшими, не информативными, сложными, инвазивными, очень дорогостоящими и не могут претендовать на роль релевантных. Метод индуцированной мокроты, «пришедший» в педиатрию из взрослой службы, является безопасной процедурой, которая обеспечивает многофункциональной информацией о воспалительном процессе на уровне слизистой оболочки бронхиального дерева, в частности по эозинофильному воспалению, его динамике на фоне лечения, т.е. может являться средством лабораторной диагностики и мониторирования БА во время лечения [9-11].
Цель исследования. Оценить эффективность определения уровня эозинофилов индуцированной мокроты как дополнительного диагностического критерия бронхиальной астмы.
Материалы и методы. Когортное исследование уровня эозинофилов индуцированной мокроты проводилось в течение 10 лет, под наблюдением находилась группа 75 детей в возрасте от 1 года до 5 лет (средний возраст 2,8±1,2 года.) с ООБ в анамнезе, сформированная методом случайной выборки из детей, перенесших один и более эпизодов острого обструктивного бронхита, обратившихся на прием к врачу-аллергологу с целью обследования для исключения бронхиальной астмы. На всех детей была заполнена персональная анкета, содержащая данные анамнеза, объективного осмотра и результаты проведенных исследований. Всем респондентам в декретированные сроки был проведен цитологический анализ назального секрета, индуцированной мокроты, исследование уровня общего IgE крови, уровня эозинофилов крови. Для получения мокроты с целью ее цитологического анализа проводили процедуру индукции мокроты [9; 11; 12]. В данном исследовании за диагностически значимый уровень эозинофилов индуцированной мокроты принят показатель ≥ 5%. Из исследования исключались пациенты с подтвержденной паразитарной инфекцией.
Исследование проводили поэтапно. Повторное обследование детей проведено через 18 месяцев и через 10 лет от начала исследования. По окончании наблюдения пациенты были разделены на две группы. Первая группа (n=46) – дети, у которых бронхиальная астма не сформировалась за время исследования. Вторая группа (n=29) – дети со сформировавшейся бронхиальной астмой.
Статистический анализ полученных результатов проводился при помощи пакетов статистических программ STATISTICA 6.0 (StatSoft, 2001) и SPSS 12.0. Для описания количественных признаков в выборке рассчитывались медиана и квартили (Ме; 25-75%). Для сравнительного анализа данных в двух зависимых группах при распределении количественных признаков, отличных от нормального, использовался критерий Вилкоксона. С целью оценки клинической информативности диагностических тестов проводился ROC-анализ и анализ четырехпольной таблицы для оценки чувствительности и специфичности диагностического критерия. Для всех видов анализа статистически достоверными считались значения p<0,05.
Результаты и обсуждения. За первый год наблюдения детей с эпизодами ООБ в анамнезе БА сформировалась примерно у каждого пятого ребенка (17% детей). Через 2 года диагноз БА имел уже каждый третий ребенок (33% детей), через 3,5 года БА была диагностирована в общей сложности у 36% детей, через десять лет — у 39% детей, что соответствует статистическим данным других исследователей [1; 6].
При сравнении детей 2 группы с детьми 1 группы по уровню эозинофилов ИМ и его динамике за первые 18 месяцев наблюдения было выявлено, что у детей первой группы уровень эозинофилов ИМ в начале исследования был диагностически не значимым (Ме; 25-75%) — 1,0 (0,0-4,0) и в динамике, через 18 месяцев наблюдения, статистически значимо не изменился – 2,0 (1,0-3,0) (рwilc.>0,05). У детей второй группы уровень эозинофилов ИМ был изначально высоким — 6,0 (2,4-17,0), и отмечался его статистически значимый рост в динамике через 18 месяцев наблюдения – 12,0 (4,0 — 22,0) (рwilc.<0,05). Также наблюдали следующую закономерность: у детей, имевших через 18 месяцев наблюдения уровень эозинофилов ИМ ≥5%, независимо от исходного уровня эозинофилов ИМ (<2,5% или ≥2,5%) сформировалась БА в 95,2% случаев. У детей с исходным уровнем эозинофилов ИМ <2,5%, имевших через 18 месяцев уровень эозинофилов ИМ <5%, в 80,8% случаях не сформировалась БА в отдаленные сроки наблюдения. Связь между уровнем эозинофилов ИМ и наличием БА также была отмечена в работах иностранных исследователей [10; 11; 13].
На втором этапе работы проводилось сравнение лабораторных показателей, из алгоритма диагностики БА у детей: уровень эозинофилов общего анализа крови, уровень общего иммуноглобулина Е крови и изучаемого показателя — уровня эозинофилов индуцированной мокроты по таким критериям, как чувствительность и специфичность. Для этого мы сопоставили результаты лабораторных методов исследования у детей двух групп. Полученные результаты представлены в таблице. Следует отметить, что в этом случае нами использованы не исходные результаты обследования, а данные, полученные при исследовании, проведенном через 18 месяцев, то есть когда БА у детей сформировалась.
Анализ основных лабораторных показателей у детей в зависимости от наличия/отсутствия бронхиальной астмы
Показатели | Бронхиальная астма есть (n=46) | Бронхиальной астмы нет (n=29) | Всего |
Уровень эозинофилов ОАК (n=46) | |||
Эозинофилы ОАК ≥5 % | 17-77,3% | 5-22,7% | 22 |
Эозинофилы ОАК <5 % | 15-62,5% | 9-37,5% | 24 |
Уровень общего IgE крови (n=74) | |||
≥100 МЕ/мл | 25-86,2% | 4-13,8 | 29 |
<100 МЕ/мл | 21-46,7% | 24-53,3% | 45 |
Уровень эозинофилов индуцированной мокроты (n=75) | |||
Эозинофилы ИМ ≥5 % | 44-95,6% | 2-4,4% | 46 |
Эозинофилы ИМ < 5% | 2-6,9% | 27-93,1% | 29 |
При оценке диагностической ценности такого параметра, как уровень эозинофилов ОАК, было выявлено отсутствие статистически значимых различий в вероятности наличия БА у детей из групп риска (эпизоды ООБ в анамнезе) при уровне эозинофилов ОАК ≥5% (77,3%) и вероятности таковой при уровне эозинофилов ОАК < 5% (62,5%). В отношении повышенного уровня общего IgE крови и уровня эозинофилов ИМ различия были статистически значимыми (р<0,001), однако наиболее высокие чувствительность, специфичность и соответственно прогностическая ценность положительного результата и прогностическая ценность отрицательного результата были у уровня эозинофилов ИМ. Так, чувствительность, то есть доля лиц с положительным результатом теста (уровень эозинофилов ИМ ≥ 5%) среди лиц с изучаемым заболеванием, составила в данном случае, так же как и прогностическая ценность положительного результата, 95,6%. Специфичность, то есть доля лиц с отрицательным результатом теста, среди лиц без изучаемого заболевания составила, так же как и прогностическая ценность отрицательного результата, 93,1%. Диагностическая эффективность уровня эозинофилов ИМ ≥5% составила 94,4%, что оценивается как высокая [9; 11].
Повышенный уровень общего IgE крови (≥ 100 МЕ/мл) свидетельствовал о вероятности БА в 86,2% случаев, что статистически значимо меньше (р<0,05), чем при наличии уровня эозинофилов ИМ ≥5%. У детей из группы риска по развитию БА при уровне общего IgE крови < 100 МЕ/мл вероятность наличия БА — 46,7%, то есть достаточно высокая, что не позволяет считать данный признак диагностическим критерием БА у детей групп риска. Комплексный учет всех трех лабораторных методов (эозинофилы ИМ, эозинофилы ОАК, общий IgE крови) не повышает предсказательной способности изолированного определения уровня эозинофилов ИМ.
Для наглядного выражения соотношения между чувствительностью и специфичностью теста по определению уровня эозинофилов в ИМ с целью диагностики БА у детей раннего возраста было проведено построение ROC-кривой (ROC – Receiver operating characteristic curve) (рис. 1). Для получения численного значения клинической значимости теста используется показатель AUC (Area Under Curve). Судить о качестве теста можно по экспертной шкале для значений AUC. Характеристика качества метода диагностики может быть представлена в виде площади под ROC-кривой — AUC-ROC: >1,0-0,9 – отличное, 0,9-0,8 – очень хорошее, 0,8-0,7 – хорошее, 0,7-0,6 – среднее, 0,6-0,5 – метод неинформативен. Таким образом, чем больше эта площадь, тем эффективнее метод диагностики. В данном исследовании AUC-ROC (рис. 1) площадь под кривой равна 0,944, что говорит о высокой диагностической эффективности этого метода – 94,4%. В аналогичных исследованиях с участием детей старше 5 лет и взрослых было продемонстрировано, что процент эозинофилов в мокроте является наиболее чувствительным и специфичным маркером в сравнении с эозинофилией крови и уровнем общего IgE крови при БА [12-14].
Для того чтобы была возможность сравнить чувствительность и специфичность использующихся в настоящее время показателей для диагностики БА, было проведено построение ROC-кривой по другим диагностическим тестам. Построены ROC-кривые диагностики по уровню эозинофилов ОАК (%) и общему IgE крови (МЕ/мл). Эти показатели были использованы, так как они являются лабораторными критериями, отражающими наличие аллергии и/или атопии, и используются врачами педиатрами и аллергологами при постановке диагноза БА (рис. 2, 3).
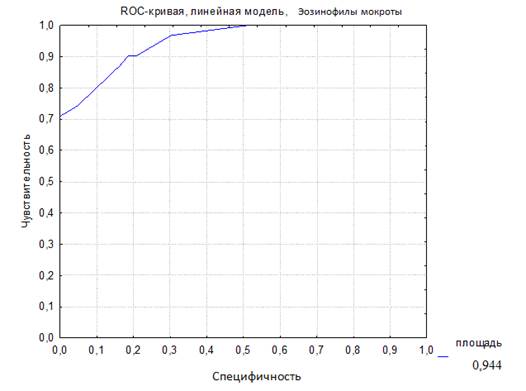
Рис. 1. ROC-кривая диагностической эффективности уровня эозинофилов индуцированной мокроты (AUC-ROC 0,944)
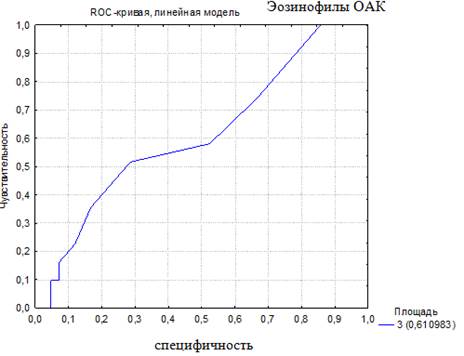
Рис. 2. ROC-кривая диагностической эффективности уровня эозинофилов в общем анализе крови (AUC-ROC 0,61)
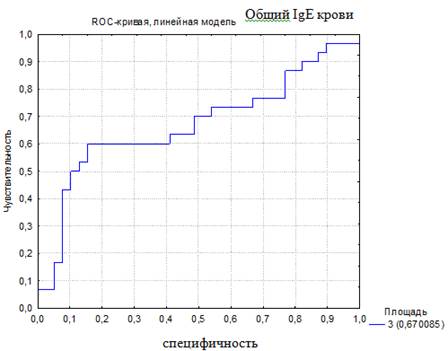
Рис. 3. ROC-кривая диагностической эффективности уровня общего IgE крови
(AUC-ROC 0,67)
Таким образом, полученные результаты помогут врачу определиться с количественной оценкой такого критерия, как уровень эозинофилов мокроты, так как даже в пятом пересмотре Национальной программы «Бронхиальная астма у детей. Стратегия лечения и профилактика» (2017) говорится о качественной оценке этого показателя: «у детей с БА средний уровень эозинофилов в индуцированной мокроте достоверно выше и превышает показатели у здоровых». В то же время что такое средний уровень и его количественное отображение не приводится. По данным этого исследования установлено, что уровень эозинофилов ИМ ≥5% является чувствительным и специфичным маркером и поэтому рекомендован для диагностики БА у детей.
Библиографическая ссылка
Федоров И.А., Рыбакова О.Г. РАННЯЯ ДИАГНОСТИКА БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ МЛАДШЕ 5 ЛЕТ // Современные проблемы науки и образования. – 2018. – № 2.;
URL: https://science-education.ru/ru/article/view?id=27492 (дата обращения: 07.05.2020).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Анамнез и физикальное обследование
Вероятность бронхиальной астмы возрастает, если в анамнезе присутствуют:
- атопический дерматит;
- аллергический риноконъюнктивит;
- отягощенный семейный анамнез по бронхиальной астме или другим атопическим заболеваниям.
Диагноз бронхиальной астмы часто можно предположить, если у пациента присутствуют следующие симптомы:
- эпизоды одышки;
- свистящие хрипы;
- кашель, усиливающийся преимущественно в ночные или предутренние часы;
- заложенность в грудной клетке.
Появление или усиление симптомов бронхиальной астмы:
- после эпизодов контакта с аллергенами (при контакте с животными, клещами домашней пыли, пыльцевыми аллергенами);
- в ночные и предутренние часы;
- при контакте с триггерами (химические аэрозоли, табачный дым, резкий запах);
- при перепадах температуры окружающей среды;
- при любых острых инфекционных заболеваниях дыхательных путей;
- при сильных эмоциональных нагрузках;
- при физической нагрузке (пациенты отмечают типичные симптомы бронхиальной астмы или иногда длительный кашель, обычно возникающий через 5-10 мин после прекращения нагрузки, редко — во время нагрузки, который самостоятельно проходит в течение 30-45 мин).
При осмотре необходимо обратить внимание на следующие признаки, характерные для бронхиальной астмы:
- одышка;
- эмфизематозная форма грудной клетки;
- вынужденная поза;
- дистанционные хрипы.
При перкуссии возможен коробочный перкуторный звук.
Во время аускультации определяют удлинение выдоха или свистящие хрипы, которые могут отсутствовать при обычном дыхании и обнаруживаться только во время форсированного выдоха.
Необходимо учитывать, что в связи с вариабельностью астмы проявления болезни могут отсутствовать, что не исключает бронхиальную астму. У детей в возрасте до 5 лет диагноз бронхиальной астмы основан главным образом, на данных анамнеза и результатах клинического (но не функционального) обследования (большинство педиатрических клиник не располагают такой точной аппаратурой). У детей грудного возраста, имевших три эпизода свистящих хрипов и более, связанных с действием триггеров, при наличии атопического дерматита и/или аллергический ринит, эозинофилии в крови следует подозревать бронхиальную астму, проводить обследование и дифференциальную диагностику.
 [12], [13], [14], [15], [16]
[12], [13], [14], [15], [16]
Лабораторная и инструментальная диагностика бронхиальной астмы
Спирометрия
У детей старше 5 лет необходимо проводить оценку функции внешнего дыхания. Спирометрия позволяет оценить степень обструкции, её обратимость и вариабельность, а также тяжесть течения заболевания. Однако спирометрия позволяет оценивать состояние ребёнка только на момент осмотра. При оценке показателей ОФВ1 и форсированной жизненной ёмкости лёгких (ФЖЁЛ) важно ориентироваться на должные показатели, полученные в ходе популяционных исследований, которые учитывают этнические особенности, пол, возраст, рост.
Таким образом, оценивают следующие показатели:
- ОФВ ;
- ФЖЕЛ;
- отношение ОФВ,/ФЖЁЛ;
- обратимость бронхиальной обструкции — увеличение ОФВ, по крайней мере на 12% (или 200 мл) после ингаляции сальбутамола либо в ответ на пробное лечение глюкокортикостероидами.
Пикфлоуметрия
Пикфлоуметрия (определение ПСВ) — важный метод диагностики и последующего контроля лечения бронхиальной астмы. Последние модели пикфлоуметров относительно недороги, портативны, выполнены из пластика и идеально подходят для использования пациентами старше 5 лет в домашних условиях с целью ежедневной оценки течения бронхиальной астмы. При анализе показателей ПСВ у детей используют специальные номограммы, но более информативен ежедневный мониторинг ПСВ в течение 2-3 нед для определения индивидуального наилучшего показателя. ПСВ измеряют утром (обычно наиболее низкий показатель) до ингаляций бронхолитиков, если ребёнок их получает, и вечером перед сном (как правило, наиболее высокий показатель). Заполнение больным дневников самоконтроля с ежедневной регистрацией в нём симптомов, результатов ПСВ играет важную роль в стратегии лечения бронхиальной астмы. Мониторинг ПСВ может быть информативен для определения ранних симптомов обострения заболевания. Дневной разброс показателей ПСВ более 20% рассматривают как диагностический признак бронхиальной астмы, а величина отклонений прямо пропорциональна тяжести заболевания. Результаты пикфлоуметрии свидетельствуют в пользу диагноза бронхиальной астмы, если ПСВ увеличивается по крайней мере на 15% после ингаляции бронхолитика или при пробном назначении глюкокортикосетроидов.
Таким образом, важно оценить:
- суточную вариабельность ПСВ (разность между максимальным и минимальным значениями в течение дня, выраженную в процентах от средней за день ПСВ и усреднённую за 1-2 нед);
- минимальное значение ПСВ за 1 нед (измеряемой утром до приёма бронхолитика) в процентах от самого лучшего в этот же период показателя (Min/Max).
Выявление гиперреактивности дыхательных путей
У пациентов с симптомами, характерными для бронхиальной астмы, но с нормальными показателями функции лёгких, в постановке диагноза БА может помочь исследование реакции дыхательных путей на физическую нагрузку.
У некоторых детей симптомы бронхиальной астмы провоцирует только физическая нагрузка. В этой группе полезно проведение нагрузочного теста (6-минутный протокол нагрузки бегом). Использование этого метода исследования совместно с определением ОФВ, или ПСВ может быть полезно для постановки точного диагноза бронхиальной астмы.
Для выявления бронхиальной гиперреактивности можно применять тест с метахолином или гистамином. В педиатрии их назначают крайне редко (в основном у подростков), с большой осторожностью, по особым показаниям. При диагностике бронхиальной астмы эти тесты имеют высокую чувствительность, но низкую специфичность.
Специфическую аллергологическую диагностику проводят врачи-аллергологи/иммунологи в специализированных учреждениях (отделениях/кабинетах).
Аллергологическое обследование обязательно для всех больных с бронхиальной астмой, оно включает: сбор аллергологического анамнеза, проведение кожного тестирования. определение уровня общего IgE (и специфических IgE в случаях, когда невозможно проведение кожных проб).
Кожные тесты с аллергенами и определение уровней специфических IgE в сыворотке крови помогают выявить аллергический характер заболевания, установить причинно-значимые аллергены, на основании чего рекомендуют соответствующий контроль факторов окружающей среды (элиминационный режим) и разрабатывают схемы специфической иммунотерапии.
Неинвазивное определение маркёров воспаления дыхательных путей (дополнительные диагностические методы):
- исследование мокроты, спонтанно продуцируемой или индуцированной ингаляцией гипертонического раствора натрия хлорида, на клетки воспаления (эозинофилы или нейтрофилы);
- определение уровня оксида азота (NО) и окиси углерода (FeCO) в выдыхаемом воздухе.
 [17], [18], [19], [20], [21], [22], [23], [24], [25], [26], [27], [28]
[17], [18], [19], [20], [21], [22], [23], [24], [25], [26], [27], [28]
Определение степени тяжести обострений бронхиальной астмы и показаний к госпитализации при обострении
Определение тяжести обострений бронхиальной астмы
Показатель | Лёгкое обострение | Средне-тяжёлое обострение | Тяжёлое обострение | Остановка дыхания неизбежна |
Одышка | При ходьбе; может лежать | При разговоре; плач тише и короче, трудности при кормлении; предпочитает сидеть | В покое; прекращает принимать пищу; сидит, наклоняясь вперед | |
Речь | Предложения | Отдельные фразы | Отдельные слова | |
Уровень бодрствования | Может быть возбуждён | Обычно возбуждён | Обычно возбуждён | Заторможен или в состоянии спутанного сознания |
ЧДД | Повышена | Повышена | Высокая (>30 в минуту) | Парадо-ксальное дыхание |
Свистящие хрипы | Умеренные | Громкие | Обычно громкие | Отсутствуют |
ЧСС | 100-120 в минуту | >120 в минуту | Брадикардия | |
ПСВ | >80% | 60-80% | ||
РаСО2 | Обычно нет необхо-димости измерять | >60 мм рт. ст. | ||
РаСО2 | >45 мм рт.ст. | |||
SaO2 | >95% | 91-95% | ||
Парадок-сальный пульс | Отсутствует, | Возможен, 10-25 мм рт. ст. | Часто, 20-40 мм рт. ст. | Отсутствие указывает на усталость дыхательных мышц |
Участие вспомо-гательных мышц в акте дыхания, втяжение надключичных ямок | Обычно нет | Обычно есть | Обычно есть | Парадок-сальные движения грудной клетки и брюшной стенки |
Нормальная частота дыхания у детей:
- более 2 мес —
- 2-12 мес —
- 1-5 лет —
- 6-8 лет —
Нормальный пульс у детей:
- 2-12 мес —
- 1-2 лет —
- 2-8 лет —
 [29], [30], [31], [32], [33], [34], [35], [36], [37]
[29], [30], [31], [32], [33], [34], [35], [36], [37]