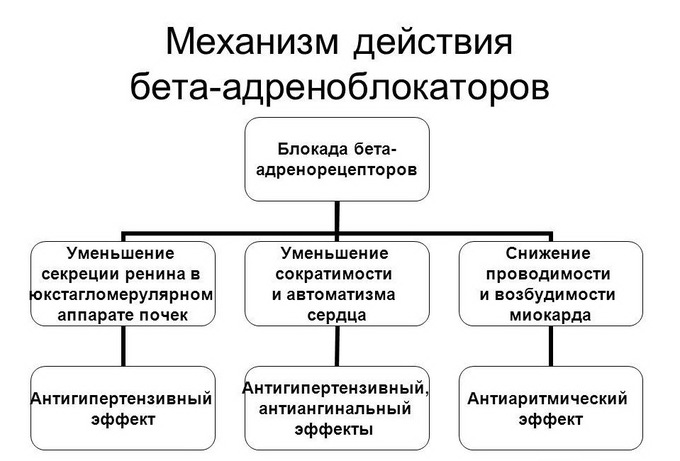
Что такое полное и неполное сочетание бронхиальной астмы
Контроль
БА – это конечная цель терапии, состояние,
при котором течение заболевания остается
стабильным на протяжении длительного
времени (отсутствуют приступы удушья
и их эквиваленты в дневное и ночное
время, нет потребности в короткодействующих
β2-агонистах для купирования симптомов,
ограничений повседневной активности,
не снижены функции внешнего дыхания
(ФВД).
83. Бронхиальная астма. Пинципы базисной терапии.
Программа
лечения больных бронхиальной астмой:
1.
Обучение больных, в результате которого
они должны стать соратниками врачей
2.
Оценка и мониторинг тяжести бронхиальной
астмы с помощью объективных показателей,
отражающих легочную функцию
3.
Избегание контакта или контролирование
влияния факторов, являющихся пусковыми
механизмами развития приступов
бронхиальной астмы
4.
Разработка плана медикаментозной
терапии для постоянного лечения
5.
Разработка плана мероприятий в период
обострения
6.
Обеспечение регулярного наблюдения за
больным.
Задачи
успешного лечения заключаются в:
1.
достижении и установлении контроля над
симптомами;
2.
предотвращении обострений астмы;
3.
поддержании функции легких максимально
близко к нормальному уровню;
4.
поддержании нормального уровня физической
активности, включая занятия спортом;
5.
избежании побочных эффектов от препаратов,
применяемых для лечения астмы;
6.
предотвращении развития необратимой
обструкции;
7.
предотвращении смерти от астмы.
Приведенные
задачи терапии отражают новое понимание
астмы как заболевания и принципов ее
лечения. С учетом того, что астма — это
хроническое воспалительное заболевание,
было показано, что любую астму, кроме
легкой интермиттирующей, можно более
эффективно контролировать лечением,
направленным на подавление и обратимость
воспаления, чем лечение только острого
бронхоспазма и связанных с ним симптомов.
Противоастматические
препараты сегодня разделяют на две
группы:
1.
Средства, обеспечивающие длительный
контроль астмы (то есть профилактические),
2.
Средства, использующиеся для купирования
приступов (то есть симптоматические).
К
препаратам первой группы относят
противовоспалительные средства
(ингаляционные и системные кортикостероиды,
кромогликат натрия и недокромил),
длительно действующие бронходилататоры
(b-адреномиметики и теофиллины) и
антагонисты лейкотриенов,
К
препаратам второй группы — коротко
действующие b-адреномиметики,
антихолинергические средства (ипратропиума
бромид).
Первые
могут предотвратить развитие воспаления
в бронхах, они также оказывают
профилактическое и супрессивное
действие. Противовоспалительные
препараты и, в частности, ингаляционные
кортикостероиды в настоящее время
являются наиболее эффективными
препаратами, контролирующими течение
заболевания.
Препараты,
использующиеся для неотложной помощи,
быстро купируют бронхоспазм и сопутствующие
ему симптомы. Однако они не устраняют
воспаления и гиперреактивности бронхов.
Рассмотрим
препараты, применяемые для контроля
над бронхиальной астмой.
Профилактические
средства необходимо принимать ежедневно
в течение длительного времени с целью
стойкого контроля над астмой. Постоянным
морфологическим признаком этого
заболевания является эозинофильное
воспаление слизистой оболочки дыхательных
путей, поэтому наиболее эффективными
считают средства, уменьшающие
воспалительную реакцию и гиперреактивность
бронхов.
Сегодня
известно, что многие противоастматические
препараты (в том числе b-адреномиметики
и теофиллины) обладают определенной
противовоспалительной активностью,
однако наиболее выраженный
противовоспалительный эффект дают
ингаляционные кортикостероиды, которые
сегодня считают основой лечения
среднетяжелой и тяжелой астмы.
Негормональные
противовоспалительные препараты
Кромогликат
натрия и недокромил натрия подавляют
выброс медиаторов тучными клетками и
хемотаксис эозинофилов. Оба препарата
обладают сопоставимой противовоспалительной
активностью, однако по эффективности
уступают ингаляционным кортикостероидам,
поэтому их обычно применяют для лечения
астмы легкого течения.
Имеются
сведения о том, что применение недокромила
позволяет несколько снизить потребность
в ингаляционных кортикостероидах.
Преимуществом недокромила является
возможность применения два, а не четыре
раза в день. Важным достоинством обоих
препаратов является безопасность.
Рекомендуемые
дозы ингаляционных негормональных
противовоспалительных препаратов,
применяемых для лечения бронхиальной
астмы (дозы, используемые у взрослых):
Кромогликат
натрия — низкая доза: 6 мг/сутки в 3 приема,
средняя доза: 9-12 мг/сутки в 3 приема,
высокая доза: 16 мг/сутки в 3 приема,
Недокромил
натрия — низкая доза: 8-12 мг/сутки в 2-3
приема, средняя доза: 18-24 мг/сутки в 2-3
приема, высокая доза: 16 мг/сутки в 4
приема.
Примечание:
Наиболее важный критерий определения
подходящей дозы — суждение врача об
ответе на проводимую терапию.
По
материалам
Expert Panel Report 2: Guidelines for the Diagnosis and Management of
Asthma. National Institutes of Health pub no 97-4051. Bethesda, MD,
1997.
Дополнительная
информация:
1.
Необходимо провести 4-6-недельный курс
лечения кромогликатом натрия, чтобы
подтвердить его эффективность у данного
больного.
2.
Перед применением кромогликата натрия
в капсулах, особенно в период обострения,
рекомендуется вдохнуть бронхорасширяющий
препарат, чтобы лекарство лучше проникало
в глубь бронхиального дерева.
3.
При сопутствующей терапии гормонами
добавление кромогликата натрия может
позволить уменьшить их поддерживающую
дозу. Темп снижения дозы ингаляционных
кортикостероидов не должен превышать
10% в неделю. Увеличение дозы гормонов
может потребоваться при усилении
симптомов заболевания, сопутствующей
инфекции, антигенном воздействии,
стрессе.
Антагонисты
лейкотриенов
Являются
относительно новыми профилактическими
противоастматическими средствами.
Лейкотриены
— биохимические медиаторы, которые
высвобождаются тучными клетками,
эозинофилами и базофилами и вызывают
сокращение гладких мышц бронхов, повышают
проницаемость сосудов и секрецию слизи
и активируют воспалительные клетки в
дыхательных путях.
К
препаратам этой группы относятся
антагонисты лейкотриеновых рецепторов
(зафирлукаст — Аколат, монтелукаст —
Сингуляр) и ингибиторы 5-липоксигеназы
(зилеутон).
Имеющиеся
данные свидетельствуют о том, что
антагонисты лейкотриенов улучшают
функцию легких, уменьшают симптомы
астмы и потребность в ингаляционных
b2-адреномиметиках. Большинство
исследований антагонистов лейкотриенов
проводились у больных астмой легкого
или среднетяжелого течения, а достигнутый
эффект был умеренным. Антагонисты
лейкотриенов можно считать альтернативой
ингаляционным кортикостероидам в низких
дозах у больных астмой легкой тяжести,
хотя необходимы дальнейшие исследования
с целью установления их роли в лечении
астмы.
Ингаляционные
глюкокортикостероиды
Глюкортикостероиды
(ГК) в настоящее время являются наиболее
эффективными противовоспалительными
препаратами для лечения астмы. Широкий
спектр воздействия препаратов этой
группы на процессы воспаления определяет
эффективность кортикостероидов, как
средств превентивной терапии.
Клинические
эффекты кортикостероидов включают в
себя снижение активности симптомов,
улучшение пиковой скорости выдоха и
показателей спирометрии, уменьшение
бронхиальной гиперреактивности,
предотвращение обострений и, возможно,
предотвращение ремоделирования
бронхиальной стенки.
Первый
ингаляционный ГК был синтезирован в
начале 70-х годов. Это был беклометазона
дипропионат. Синтезировали его
одновременно две фирмы «Glaxo»
(Великобритания) и «Shering-Plough» (США).
Однако зарегистрировала его раньше
«Glaxo» под названием бекотид, поэтому
эта фирма и считается создателем
ингаляционных ГК. С тех пор было создано
много ингаляционных ГК.
В
настоящее время наибольшее применение
в клинике имеют следующие препараты
ингаляционных кортикостероидов:
беклометазона
дипропионат,
флунисолид,
флютиказона
пропионат,
будесонид,
триамцинолона
ацетонид.
Для
того чтобы оказать действие, ГК должен
проникнуть внутрь клетки, для этого он
должен быть липофильным. Чем больше
коэффициент липофильности, тем лучше
он проникает в клетки. Затем он должен
связаться с ГК-рецепторами, для чего
препарат должен обладать большой
селективностью.
Таким
образом, к ингаляционным ГК в настоящее
время предъявляют следующие требования:
липофильность,
селективность,
аффинность
(сродство к рецепторам),
низкая
биодоступность,
разрушение
в печени всосавшейся части препарата
при первом прохождении.
Ингаляционные
кортикостероиды отличаются друг от
друга по активности и фармакокинетическим
свойствам.
По
данным экспериментальных исследований,
наиболее высокой активностью обладает
флютиказона пропионат (Фликсотид), за
ним следуют будесонид (Пульмикорт),
беклометазона дипропионат (Альдецин,
Бекотид, Бекломет) и флунисолид (Ингакорт).
Флютиказона пропионат обладает также
максимальным сродством к рецепторам.
Вероятность
системных эффектов ингаляционных
кортикостероидов определяется их
активностью и биодоступностью: при
применении дозированных аэрозолей без
спейсера около 80% дозы проглатывается
и поступает в желудочно-кишечный тракт.
Благодаря активной биотрансформации
в печени (эффект первого прохождения)
ингаляционные кортикостероиды обладают
очень низкой биодоступностью (беклометазона
дипропионат — 20%, флунисолид — 21%, будесонид
— 11%, флютиказона пропионат — 1%), что
снижает риск системных нежелательных
эффектов.
Ограничение
применения ингаляционных ГК: структурные
изменения легочной ткани, грибковые
инфекции легких, туберкулез, иммунодефицит.
Использование
кортикостероидов в любой форме всегда
вызывает опасение возможности развития
системных эффектов.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Бронхиальная астма — это хроническое аллергическое воспаление бронхов, развивающееся у предрасположенных лиц, характеризующееся обратимой диффузной бронхиальной обструкцией, гиперреактивностью бронхов и клинически проявляющееся периодически возникающими приступами затрудненного дыхания или удушья.
Бронхиальной астмой страдают до 10 % детей. Начавшись в детстве, заболевание часто продолжается в зрелом возрасте, становясь причиной инвалидности. Больные с бронхиальной астмой нуждаются в длительной медицинской помощи, требующей больших экономических затрат.
Этиология и патогенез. Факторами, предрасполагающими к развитию бронхиальной астмы, являются атопия, гиперреактивность бронхов, наследственность (гены болезни находятся в 5-й и 11-й хромосомах).
Атопия — это генетически опосредованная способность организма к выработке повышенного количества IgE в ответ на воздействие низких доз антигена, которая подтверждается положительными аллергическими пробами и повышением уровней общего и специфических IgE.
Гиперреактивностью бронхрв называется индивидуальная реакция организма, при которой в»ответ на раздражение бронхиальная обструкция развивается более быстро и мощно, что не характерно для здоровых лиц. Это состояние определяется наследственной предрасположенностью.
В развитии бронхиальной астмы имеет значение сенсибилизация к неинфекционным (пищевым, бытовым, лекарственным, животного и растительного происхождения и др.) и инфекционным (бактериальным, вирусным, грибковым) аллергенам, а также физические перегрузки, нервно-психические и эндокринные нарушения.
К факторам, способствующим возникновению болезни, относятся патология в период беременности, недоношенность, нерациональное вскармливание, воздействие поллютантов (загрязнителей окружающей среды), атопический дерматит, табакокурение (табачный дым), ОРВИ.
Механизм развития бронхиальной астмы складывается из иммунологической, патохимической и патофизиологической фаз. Морфологической основой заболевания является хроническое аллергическое воспаление стенки дыхательных путей. При контакте с аллергеном развиваются воспалительный отек слизистой оболочки и спазм гладкой мускулатуры бронхов, гиперсекреция слизи, что обусловливает обструкцию мелких бронхов вязкой плохо эвакуируемой мокротой. У ребенка появляются признаки обструктивного синдрома и дыхательной недостаточности.
Клиническая картина
По форме бронхиальная астма классифицируется на атопическую (у 90% детей), неатопическую (IgE-независимую) и смешанную.
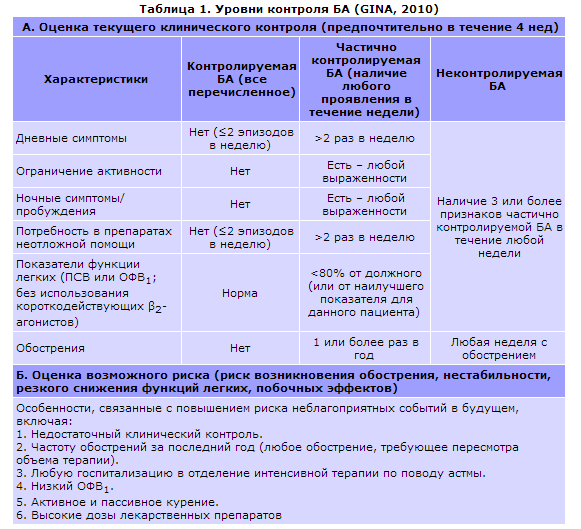
Согласно Национальной программе «Бронхиальная астма у детей. Стратегия лечения и профилактика» (2008) по тяжести течения различают:
- I ступень (легкая интермиттирующая бронхиальная астма) —приступы менее 1 раза в неделю, легко купируются; ночные симп
томы отсутствуют; переносимость физической нагрузки не нарушена; показатели функции внешнего дыхания до назначения базисной терапии (ОФВ* и ПСВ**) 80 % и более от должного; суточные колебания бронхиальной проходимости не более 20 %; - II ступень (легкая персистирующая бронхиальная астма) —симптомы менее 1 раза в неделю, легко купируются; ночные симптомы отсутствуют или редки; переносимость физической нагрузки нарушена; ОФВ и ПСВ более 80 %, суточные колебания бронхи
альной проходимости не более 20 %; - III ступень (среднетяжелая персистирующая бронхиальная астма) — симптомы более 1 раза в неделю; приступы средней тяжести; частые ночные симптомы; переносимость физических нагрузок ограничена; ОФВ и ПСВ 60 — 80%; суточные колебания бронхиальной проходимости 20 — 30%, ремиссия неполная;
- IV ступень (тяжелая персистирующая бронхиальная астма) —ежедневные симптомы; приступы тяжелые, длительные, трудно
купируются и переходят в астматический статус; ночные симптомы ежедневные, по несколько раз; переносимость физических нагрузок значительно снижена; ОФВ и ПСВ менее 60 %; суточные колебания бронхиальной проходимости более 30 %.
В течении бронхиальной астмы выделяют несколько периодов.
Период предвестников (от нескольких минут до нескольких дней до приступа) характеризуется появлением беспокойства, раздражительности, изменением поведения, нарушения аппетита и сна. Нередко отмечаются чиханье, зуд глаз и кожи, першение в горле, навязчивый сухой кашель, заложенность носа, головная боль, полиморфная сыпь, обострение атопического дерматита.
Приступный период характеризуется появлением удушья, признаков обструктивного синдрома и дыхательной недостаточности. У ребенка возникают ощущение нехватки воздуха и сдавления в груди, экспираторная одышка, свистящее дыхание. Больные принимают вынужденное положение с приподнятым плечевым поясом. При этом отмечаются бледность лица, периоральный цианоз, раздувание крыльев носа, участие вспомогательной мускулатуры в акте дыхания; грудная клетка находится в состоянии максимального вдоха. Мокрота при кашле отделяется с трудом, она вязкая, густая. При перкуссии над областью легких определяется коробочный звук, при аускультации на фоне жесткого или ослабленного дыхания выслушивается большое количество сухих свистящих хрипов, нередко — крепитация.
У детей раннего возраста в связи с более выраженным отеком слизистой оболочки стенки бронхов и гиперсекреции приступ удушья развивается медленнее, протекает более продолжительно и тяжело, в легких выслушиваются сухие свистящие и влажные мелкопузырчатые хрипы.
Для оценки степени тяжести приступа бронхиальной астмы учитывают клинические проявления дыхательной недостаточности (см. подразд. 18.5), а также степень ограничения физической активности, эффективность ранее проведенных лечебных мероприятий (дозы и пути введения препаратов).
Развитие астматического статуса — тяжелого затяжного приступа бронхиальной астмы — характеризуется нарастанием дыхательной недостаточности. При этом выслушивается большое количество сухих и (или) влажных хрипов. Постепенно дыхание становится ослабленным, исчезают хрипы а легких («немое» легкое). При про-грессировании заболевания развивается гипоксемическая кома.
В постприступном периоде состояние больного постепенно улучшается. В течение нескольких дней могут сохраняться влажный кашель с отхождением слизистой мокроты и единичные хрипы в легких.
Диагностика астмы
Диагностику бронхиальной астмы начинают с тщательного анализа анамнестических данных (наличие отягощенного аллергологического анамнеза, эпизодов ночного кашля, особенно после контакта с аллергенами, при респираторных инфекциях, после физической нагрузки и т.д.).
В клиническом анализе крови у больных бронхиальной астмой может наблюдаться эозинофилия. При исследовании мокроты обнаруживается большое количество эозинофилов, кристаллы Шарко — Лейдена (пласты и гранулы эозинофилов, вытесненные из разрушенных клеток). Для детей характерно повышение уровня IgE в крови, а также положительные кожные пробы со специфическими аллергенами (пробы проводятся в периоде ремиссии заболевания) .
Для оценки тяжести дыхательной недостаточности исследуется газовый состав крови, КОС и показатели функции внешнего дыхания. По данным спирографии, вентилометрии или пикфлоумет-рии выявляется обструктивный тип нарушения бронхиальной проходимости, рентгенологически — признаки эмфиземы и отсутствие инфильтративных изменений в легочной ткани.
Дифференциальная диагностика
Бронхиальную астму дифференцируют с рецидивирующим обструктивным бронхитом, муко-висцидозом, врожденными аномалиями развития бронхов, первичной цилиарной дискинезией, экзогенным аллергическим альвео-литом, инородным телом трахеобронхиального дерева, дыхательными нарушениями нейрогенного и психогенного генеза, сужением дыхательных путей при опухоли вилочковой железы.
Лечение. Всем больным с бронхиальной астмой рекомендуются максимально возможное разобщение с причинно-значимыми аллергенами (элиминационная диета, гигиена жилища, ограничение контакта с животными, перемена места жительства и т.д.), санация очагов хронической инфекции, ограничение или исключение физических нагрузок.
Для купирования приступа бронхиальной астмы применяются селективные (32-адреномиметики короткого действия (сальбутамол, вентолин, беротек), М-холинолитики (ипратропиум бромид, атро-вент), их комбинации (беродуал), метилксантины в сочетании с ингаляционными ГКС.
Объем лечебных мероприятий зависит от тяжести обструкции и степени дыхательной недостаточности. Купирование легкого или среднетяжелого приступа бронхиальной астмы начинается с назначения (32-адреномиметиков (сальбутамол) или беродуала в сочетании с ингаляционными ГКС (пульмикорт) через небулайзер. Через 15 мин симптомы повторно оцениваются. При недостаточном бронходилатирующем эффекте можно применить сальбутамол или беродуал по одной ингаляции через 20 мин в течение часа.
В случае неполного или плохого ответа на проведенное лечение, а также при тяжелом приступе бронхиальной астмы используются ГКС системного действия (преднизолон, метилпреднизолон). Стартовая доза преднизолона составляет 2 — 4 мг на 1 кг массы тела (внутривенно); при отсутствии эффекта доза может быть увеличена через каждые 4 ч на 20 — 50 % до получения клинического эффекта.
При тяжелых приступах, резистентных к терапии |}2-агониста-ми, а также при астматическом статусе назначается инфузионная терапия эуфиллином (2,4% раствор в разовой дозе 5 — 6 мг/кг); возможно проведение интубации и ИВЛ, в исключительных случаях — лечебная бронхоскопия (с целью санации трахеобронхиального дерева).
При обострении бронхиальной астмы всем больным назначается оксигенотерапия через маску или носовой катетер. При развитии дегидратации вследствие увеличения частоты дыхания и уменьшения приема жидкости проводится инфузионная терапия (изотонический раствор хлорида натрия и 5% раствор глюкозы).
Для купирования приступа бронхиальной астмы не используются: антигистаминные и седативные препараты, фитолечение, препараты кальция, муколитики, пролонгированные бронхолитики, горчичники, банки. Антибиотики назначаются только при наличии пневмонии или другой бактериальной инфекции.
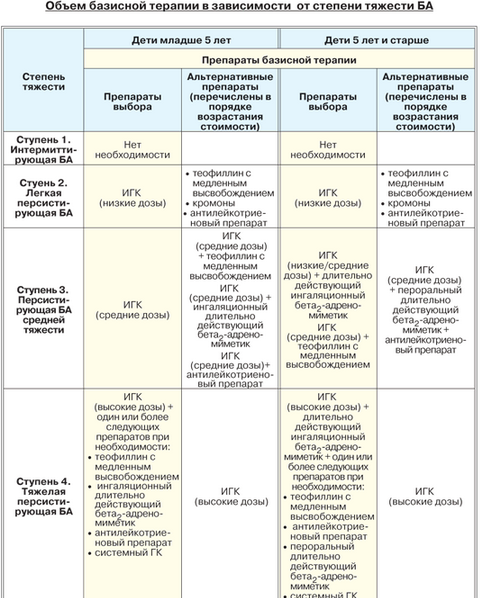
Больным с персистирующей бронхиальной астмой с целью предупреждения приступов назначается базисная противовоспалительная терапия. В качестве основных средств используются ингаляционные (пульмикорт, ингакорт, фликсотид) и системные ГКС (преднизолон, метилпред), кромоны (интал, тайлед, кромогексал), антилейкотриеновые препараты (монтелукаст, зафирлукаст), pYaA,-реномиметики длительного действия (салметерол, формотерол), теофиллины длительного действия (теопек, ретафил, теотард, эуфилонг), антитела к IgE (ксолар), аллергенспецифическая иммунотерапия.
Выбор лекарственных средств зависит от тяжести заболевания и осуществляется по принципу ступенчатой терапии (табл. 18.5).
Если не удается достичь контроля над заболеванием, используя терапию в пределах какой-либо ступени, то пересматривают тяжесть заболевания и объем лечения (терапия Stepup). Если на той или иной ступени получен хороший лечебный эффект, то базисная терапия не может быть изменена в течение 3 мес. В последующем возможен переход на более низкую ступень лечения (терапия Stepdown). У детей старше 6 лет базисная терапия проводится под контролем пикфлоуметрии.
При сочетании бронхиальной астмы с поллинозами, кожной или интестинальной аллергией (особенно у детей раннего возраста) в качестве базисных средств используются антиаллергические препараты (кетотифен, кларитин, телфаст, эриус, зиртек).
При ограниченном числе неустранимых из окружающей среды причинно-значимых аллергенов (выявленных по данным кожного тестирования и определения специфических IgE-антител in vitro) проводится аллергенспецифическая иммунотерапия — введение пациенту возрастающих доз причинно-значимого аллергена с целью снижения сенсибилизации и тяжести заболевания.
В комплексном лечении бронхиальной астмы в период ремиссии используются немедикаментозные методы терапии: массаж, дыхательная гимнастика, иглорефлексотерапия, климатотерапия, закаливание с целью повышения резистентности к вирусным инфекциям, физиотерапия.
Прогноз. Прогноз зависит от тяжести течения и степени контроля над заболеванием. Неконтролируемое течение бронхиальной астмы приводит к ограничению физических возможностей, негативно влияет на психоэмоциональную сферу и снижает качество жизни больных. Летальные исходы при тяжелой бронхиальной астме у детей составляют 1 — 3 % случаев, а при наиболее тяжелой кортикостероидозависимой форме заболевания — до 6 %.
Профилактика
Первичная профилактика проводится детям из группы высокого риска формирования респираторной аллергии
(дети с атопическим дерматитом, рецидивирующим обструктив-ным бронхитом и др.). Первичная профилактика включает сохранение грудного вскармливания, питание с исключением облигат-ных аллергенов, гипоаллергенное содержание жилища, исключение пассивного и активного курения, закаливание, благополучную экологическую обстановку.
Вторичная профилактика, направленная на предупреждение обострений бронхиальной астмы, включает: элиминационный режим (устранение контактов с причинно-значимыми аллергенами и триггерами или максимальное снижение экспозиции их воздействия), гипоаллергенную диету, исключение приема препаратов ацетилсалициловой кислоты, профилактику ОРВИ.