Что такое анемия в кардиологии
Число случаев смерти от сердечно-сосудистых заболеваний (ССЗ) в мире продолжает расти. Заключение о том, что ишемическая болезнь сердца (ИБС) «…является ведущей причиной смерти во всем мире, ее уровень постоянно растет и в настоящее время достиг размеров пандемии, не знающей границ», появившееся на сайте Всемирной организации здравоохранения (ВОЗ) в 2009 г., воспринимается как все более актуальное. В 2011 г. ИБС стала причиной гибели 7,3 млн человек [1, 2].
Анемией в мире, по оценкам ВОЗ, страдает 1,62 млрд человек [3]. Частота анемии, также как ИБС, значительно увеличивается с возрастом. Признаки анемии имеют более 10% лиц старше 65 лет и до 50% пожилых пациентов с хроническими заболеваниями, проживающих в домах престарелых [4].
В практике врача терапевта и кардиолога часто встречается сочетание сердечно-сосудистой патологии с анемией. Анемия определяется у 25–40% больных с хронической сердечной недостаточностью (ХСН) и 10–20% пациентов с ИБС [5–7].
Вышедшие в последние два года европейские и американские рекомендации по ведению пациентов со стабильной стенокардией предполагают обязательное определение уровня гемоглобина у всех пациентов и рассматривают анемию как фактор, провоцирующий коронарную недостаточность [8, 9]. В последних рекомендациях по диагностике и лечению пациентов с ХСН американские и европейские эксперты отмечают, что анемия не только усиливает симптомы ХСН, ухудшает качество жизни пациентов, снижает толерантность к физической нагрузке, может являться причиной развития острой декомпенсации ХСН и увеличения частоты госпитализаций, но и является независимым негативным предиктором прогноза [10, 11]. Риск смерти при ХСН у больных с анемией в два раза выше, чем без нее даже при учете дополнительных переменных (почечная дисфункция, тяжесть ХСН и другие) [13]. Негативное влияние на прогноз при ХСН может оказывать уже латентный дефицит железа [14], что делает целесообразным определение его маркеров у всех пациентов с ХСН.
При остром коронарном синдроме наличие анемии может в четыре раза повышать вероятность смерти пациентов и рассматривается как независимый предиктор риска неблагоприятных клинических исходов [15, 16]. Даже синдром болей в груди у женщин при его сочетании с анемией оказывается более прогностически неблагоприятным (риск смерти увеличивается вдвое) [17].
Предоперационная анемия при кардиохирургических операциях определяет высокий риск последующего переливания крови и худшие результаты лечения, что делает актуальной задачи раннего выявления анемии и качественного, своевременного ее лечения [18].
Доказана роль анемии как независимого фактора риска неблагоприятного прогноза при фибрилляции предсердий у лиц пожилого и старческого возраста [19].
Как показал анализ влияния сочетания анемии и нарушения функции почек на ИБС в популяционном исследовании ARIC (The Atherosclerosis Risk in Communities Study), анемия встречается у лиц с незначительным и умеренным снижением функции почек намного чаще, чем предполагалось. А сочетание анемии и почечной дисфункции значимо повышает риск развития ИБС даже после учета таких известных факторов риска, как сахарный диабет, уровень липидов крови, артериальное давление и применение антигипертензивной терапии. В выводах подчеркивается необходимость своевременного выявления и лечения анемии для улучшения прогноза пациентов [20].
Неблагоприятное взаимное влияние ХСН, анемии и почечной дисфункции дало основание для выделения новых синдромов: «синдром кардиоренальной анемии», «кардиоренальный железодефицитный синдром» и даже «синдром кардиоренальной анемии и дефицита железа». Последние термины подчеркивают значение дефицита железа как самостоятельного фактора риска неблагоприятного прогноза при ХСН. Возможность непосредственного влияния дефицита железа на диастолическую функцию, гипертрофию, фиброз и дилатацию миокарда, уровень циркулирующего эритропоэтина, молекулярные сигнальные пути и активацию воспаления доказана в экспериментах на животных [21]. Такой широкий спектр негативных последствий дефицита железа, вероятно, связан с ролью железа в организме. Оно не только входит в состав гемоглобина и миоглобина, но и находится в ферментах, участвующих в процессах превращения аденозинтрифосфата в аденозиндифосфат, способствует транспорту электронов в митохондриальных цепях, определяет тканевой метаболизм и поглощение свободных радикалов [19]. Железо задействовано в иммунных реакциях, необходимо для миелинизации нервных волокон, синтеза ДНК [22, 23].
Анемия у лиц с сердечно-сосудистыми заболеваниями может иметь те же этиологические факторы, что и в целом в популяции. Дополнительную роль в развитии анемии при сердечно-сосудистой патологии могут играть характерные для нее более старший возраст пациентов, что само по себе связано с более низким значением гемоглобина, возрастающая частота хронической болезни почек, высокая распространенность сахарного диабета. Предполагается, что в развитие анемии при патологии сердечно-сосудистой системы вносят вклад: хронический воспалительный процесс (повышение синтеза провоспалительных цитокинов — фактора некроза опухоли альфа, интерлейкина-6), ишемическая депрессия костно-мозгового кроветворения, снижение синтеза эндогенного эритропоэтина вследствие почечной дисфункции. При ХСН в формировании анемии может играть роль гемодилюция с задержкой натрия и воды и нарушение всасывания железа и витаминов в кишечнике. Дополнительным фактором для развития анемии может быть проводимая медикаментозная терапия, вызывающая кровопотери (при приеме Аспирина, антикоагулянтов), снижение продукции эритропоэтина и чувствительности к нему костного мозга (при использовании блокаторов ренин-ангиотензин-альдостероновой системы) и т. д.
Актуальность вопроса ранней диагностики анемии у пациентов с сердечно-сосудистой патологией определяется тем, что запоздалое ее выявление приводит к задержке или отсутствию необходимого вмешательства в отношении потенциально корригируемого состояния.
Значительная часть пациентов с сердечно-сосудистой патологией имеют латентный дефицит железа, либо железодефицитную анемию (ЖДА) или сочетание этих состояний с другими видами анемий.
Клинические признаки ЖДА складываются из анемического и сидеропенического синдромов, последний определяется также при дефиците железа. Анемический синдром может включать следующие проявления: слабость, головокружение, синкопальные и ортостатические состояния, снижение памяти, эпилептические припадки, симптомы коронарной недостаточности (ангинальные боли, нарушения реполяризации на ЭКГ, аритмии), симптомы миокардиальной недостаточности, систолический шум при аускультации сердца. Сидеропенический синдром приводит к множественным нарушениям различных органов и систем. Общеизвестны поражения при дефиците железа кожного покрова, придатков кожи и слизистых (сухость, поражение волос и ногтей и т. д.). Не менее частыми проявлениями являются симптомы со стороны желудочно-кишечного тракта (снижение и извращение аппетита, дисфагия, запоры или диарея, глоссит, жжение языка, эзофагит, дистрофические изменения клеток слизистой оболочки желудка); нервной системы (повышенная утомляемость, шум в ушах, головокружение, головные боли, снижение интеллектуальных возможностей); сердечно-сосудистой системы (тахикардия, диастолическая дисфункция); мочевыделительной системы (дизурия и недержание мочи при кашле, смехе, ночной энурез).
При лабораторной диагностике хронической ЖДА микроскопия мазка периферической крови выявляет микроцитарную гипохромную анемию с гипопролиферацией ретикулоцитов. Для подтверждения дефицита железа необходимо сниженное содержание железа и ферритина в сыворотке крови.
Лечение ЖДА направлено на терапию заболевания, лежащего в основе дефицита железа и собственно компенсацию дефицита железа.
Хотя пациентам с ЖДА необходимы диетические рекомендации, важно четко объяснить, что диета не является основой терапии. Наибольшее количество железа содержится в мясе (гемовое железо). Все остальные продукты содержат железа меньше, а, главное, всасывается оно из них значительно меньше (1–5% из яблок, 10–15% из яиц и рыбы при 25–30% из мяса).
В медикаментозной терапии ЖДА главным направлением было и остается применение препаратов железа. Выбор лекарственного препарата железа определяется его эффективностью (количеством и биодоступностью содержащегося в нем железа) и переносимостью. Необходимо поступление от 100 до 300 мг элементарного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. Препараты железа на отечественном рынке представлены гидроксиполимальтозным комплексом, железосорбитоловым комплексом, протеин сукцинилатом железа, железосахарозным комплексом. Для пациентов с кардиальной патологией крайне важно при проведении дополнительной медикаментозной терапии ЖДА, кроме высокой эффективности, отсутствие негативных лекарственных взаимодействий и хорошая переносимость препарата. Этим требованиям отвечает препарат Мальтофер — полимальтозный комплекс железа сульфата (ІІІ). Мальтофер — неионный препарат железа. Его абсорбция обеспечивается активным транспортом, без предварительной диссоциации в кишечнике, что позволяет исключить раздражающее действие на слизистую оболочку и избежать большинства нежелательных реакций со стороны желудочно-кишечного тракта, типичных для ионизированных препаратов железа [25, 26]. Мальтофер не взаимодействует ни с пищей, ни с другими лекарственными препаратами, а форма выпуска в виде жевательных таблеток позволяет применять его в любое время и в любой обстановке [27–30]. В то же время всасывание железа из других препаратов железа может уменьшаться под влиянием содержащихся в некоторых пищевых продуктах веществ — фитинов (рис, соя), фосфатов (рыба, морепродукты), танина (чай, кофе), при одновременном приеме ряда медикаментов (тетрациклины, антациды, соли кальция и магния), что требует приема этих лекарственных средств с учетом времени употребления пищи и указанных медикаментов. Препараты солей железа содержат двухвалентное железо, которое после поступления в кровь превращается в трехвалентное для последующего его включения в молекулу гемоглобина, что может сопровождаться образованием свободных радикалов и оказывать негативное влияние на физиологические процессы в различных органах и тканях [31]. Мальтофер содержит трехвалентное железо, непосредственно использующееся для построения молекулы гемоглобина, поэтому не имеет прооксидантного действия [32]. При использовании препаратов железа в адекватных дозах уже через несколько дней может отмечаться субъективное улучшение самочувствия. Первый объективный критерий — ретикулоцитарный криз (увеличение числа ретикулоцитов в 2–10 раз по сравнению с исходным) отмечается к концу первой недели терапии. Отсутствие ретикулоцитарного криза говорит либо о неадекватной дозе препарата, либо об ошибочном назначении препарата. Повышение уровня гемоглобина и числа эритроцитов отмечается на третьей неделе терапии. После нормализации уровня гемоглобина половинную дозу препарата железа рекомендуется применять еще 4–8 недель для насыщения им депо железа.
В 2013 г. вышли первые рекомендации по лечению анемии у пациентов с сердечно-сосудистой патологией, выпущенные американским колледжем врачей [20]. Они в целом определяют тактику ведения пациента с кардиальной патологией и анемией независимо от ее этиологии. Рассматривается три стратегии лечения: использование эритропоэтин-стимулирующих агентов, переливание эритромассы и восполнение дефицита железа. Подчеркивается, что переливание эритромассы не дает пользы и может нанести вред пациентам, поэтому оно возможно только у госпитализированных тяжелых пациентов с ИБС при тяжелой анемии. Не рекомендуется применение эритропоэтин-стимулирующих средств при легкой и среднетяжелой анемии у пациентов с ХСН и ИБС из-за потенциального риска развития тромбоэмболических осложнений и отсутствия влияния терапии на прогноз и частоту госпитализаций. Положительные данные на сегодня имеются для стратегии восполнения дефицита железа введением внутривенно карбоксимальтозата железа, эта тактика улучшает толерантность к физической нагрузке, качество жизни, снижает смертность и частоту госпитализаций [33].
Таким образом, анемия является частой сопутствующей патологией при сердечно-сосудистых заболеваниях. Сегодня в кардиологии она оценивается как независимый предиктор риска неблагоприятных клинических исходов, поэтому пациенты с сердечно-сосудистой патологией нуждаются в своевременной диагностике анемии для проведения адекватной терапии.
Литература
- World Health Organization Сердечно-сосудистые заболевания // Информационный бюллетень № 317. Март 2013 г. [Электронный ресурс] — Режим доступа: https://www.who.int/mediacentre/factsheets/fs317/ru/ [Дата обращения: 10.04.2014].
- World Health Organization 10 ведущих причин смерти в мире // Информационный бюллетень № 310. Июль 2013 г. [Электронный ресурс] — Режим доступа: https://www.who.int/mediacentre/factsheets/fs310/ru/ [Дата обращения: 10.04.2014].
- Worldwide prevalence of anaemia 1993–2005. WHO Global Database on Anaemia. [Электронный ресурс] — Режим доступа: https://whqlibdoc.who.int/publications/2008/9789241596657_eng.pdf [Дата обращения: 10.04.2014].
- Bross M. H., Soch K., Smith-Knuppel T. Anemia in older persons // Am Fam Physician. 2010. Sep 1; 82 (5). P. 480–487.
- Boyd C. M., Leff B., Wolff J. L. et al. Informing clinical practice guideline development and implementation: prevalence of coexisting conditions among adults with coronary heart disease // J Am Geriatr Soc. 2011. 59. P. 797–805.
- Felker G. M., Adams K. F. Jr., Gattis W. A. et al. Anemia as a risk factor and therapeutic target in heart failure // J Am Coll Cardiol. 2004. 44. P. 959–966.
- Malyszko J., Bachorzewska-Gajewska H., Malyszko J. et al. Prevalence of chronic kidney disease and anemia in patients with coronary artery disease with normal serum creatinine undergoing percutaneous coronary interventions: relation to New York Heart Association class // Isr Med Assoc J. 2010. 12. P. 489–493.
- Stable Coronary Artery Disease (Management of). ESC Clinical Practice Guidelines. [Электронный ресурс] — Режим доступа: https://www.escardio.org/GUIDELINES-SURVEYS/ESC-GUIDELINES/Pages/GuidelinesList.aspx [Дата обращения: 10.04.2014].
- Fihn S. D., Cardin J. M., Abrams J. et al. 2012 ACCF/AHA/ACP/FCP/AATS/PCNA/SCAI/ SNS Guideline for the Diagnosis and Management of Patients With Stable Ischemic Heart Disease // J. Am. Coll. Cardiol. 2012. Vol. 60. № 24. P. e44-e164.
- 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. [Электронный ресурс] — Режим доступа: https://circ.ahajournals.org/content/128/16/e240.extract [Дата обращения: 10.04.2014].
- Acute and Chronic Heart Failure. ESC Clinical Practice Guidelines. [Электронный ресурс] — Режим доступа: https://www.escardio.org/GUIDELINES-SURVEYS/ESC-GUIDELINES/Pages/GuidelinesList.aspx [Дата обращения: 10.04.2014].
- Groenveld H. F., Januzzi J. L., Damman K. et al. Anemia and mortality in heartfailure patients a systematic review and metaanalysis // J Am Coll Cardiol. 2008. 52 (10). P. 818–827.
- Jankowska E. A., Rozentryt P., Witkowska A. et al. Iron deficiency: an ominous sign in patients with systolic chronic heart failure // Eur Heart J. 2010. 31 (15). P. 1872–1880.
- Meneveau N., Schiele F., Seronde M. F. et al. Anemia for Risk Assessment of Patients With Acute Coronary Syndromes // Am J Cardiol. 2009. Feb 15; 103 (4). P. 442–447.
- Hasin T., Sorkin A., Markiewicz W. et al. Prevalence and Prognostic Significance of Transient, Persistent, and New-Onset Anemia After Acute Myocardial Infarction // Am J Cardiol. 2009. Aug 15; 104 (4). P. 486–491.
- Arant C., Wessel T., Olson M. et al. Hemoglobin Level Is an Independent Predictor for Adverse Cardiovascular Outcomes in Women Undergoing Evaluation for Chest Pain. Results From the National Heart, Lung, and Blood Institute Women’s Ischemia Syndrome Evaluation Study // J Am Coll Cardiol. 2004. 2, Jun 2; 43 (11). P. 2009–2014.
- Muñoz M, Ariza D., Gómez-RamÍrez S. et al. Preoperative Anemia in Elective Cardiac Surgery: Prevalence, Risk Factors, and Influence on Postoperative Outcome // Transfusion Alternatives in Transfusion Medicine. 2010. 11 (2). P. 47–56.
- Sharma S., Gage B. F., Deych E. et al. Anemia: an independent predictor of death and hospitalizations among elderly patients with atrial fibrillation // Am Heart J. 2009. Jun; 157 (6). P. 1057–1063.
- Astor B. C., Coresh J., Heiss G. et al. Kidney function and anemia as risk factors for coronary heart disease and mortality: the Atherosclerosis Risk in Communities (ARIC) Study // Am Heart J. 2006. Feb; 151 (2). P. 492–500.
- Naito Y., Tsujino T., Matsumoto M. et al. Adaptive response of the heart to long-term anemia induced by iron deficiency // Am J Physiol Heart Circ Physiol. 2009. 296. P. 585–593.
- Ordway A. G., Garry D. J. Myoglobin: an essential hemoprotein in striated muscle // J Exp Biol. 2004. 20; 7. P. 3441–3446.
- Arredondo M., NbЦеz M. T. Iron and copper metabolism // Mol Aspects Med. 2005. 26. P. 313–327.
- Ortiz E., Pasquini J. M., Thompson K., Felt B. et al. Effect of manipulation of iron storage, transport, or availability on myelin composition and brain iron content in three different animal models // J Neurosci Res. 2004. 77. P. 681–689.
- Treatment of anemia in patients with heart disease: A clinical practice guideline from the American college of physicians // Annals of Internal Medicine. [Электронный ресурс] — Режим доступа: https://annals.org/article.aspx?articleid=1784292 [Дата обращения: 10.04.2014].
- Geisser P., Muller A. Pharmacokinetics of iron salts and ferric hydroxide carbohydrate complexes // Drug Research 1987. 37. P. 100–104.
- Pestaner J. P., Ishak K. G., Mullick.F. G., Centeno J. A. Ferrous Sulfate toxicity. A review of autopsy findings // Biol Trace Elem Res. 1999. 69 (3). P. 191–198.
- Andrade J. V. D., Rodrigues P. P. B., Fontoura I. B. et al. Tratamento da anemia ferropriva com hidróxido de ferro polimaltosado — Estudo multicêntrico comparativo entre tratamento ministrado com e sem alimentação concomitante // Arq bras Med (Suppl). 1992. 66. P. 253–258.
- Funk F., Canclini C., Geisser P. Interactions between iron (III)-hydroxide polymaltose complex and commonly used medications. Laboratory studies in rats // Arzneimittel-Forschung (Drug Research). 2007. 57 (6 a). P. 370–375.
- Potgieter M. A., Potgieter J. H., Venter C., Venter J. L., Geisser P. Effect of oral tetracycline on iron absorption from iron (III)-hydroxide polymaltose complex in patients with iron deficiency anemia. A single-centre randomized controlled isotope study // Arzneimittel-Forschung (Drug Research). 2007. 57 (6 a). P. 376–384.
- Burckhardt-Herold S., Klotz J., Funk F. et al. Interactions between iron (III)-hydroxide polymaltose complex and commonly used drugs. Simulations and in-vitro studies // Arzneimittel-Forschung (Drug Research). 2007. 57 (6a). P. 360–369
- Hutchinson C., Al-Ashgar W., Liu D. Y. et al. Oral ferrous sulphate leads to a marked increase in pro-oxidant nontransferrin-bound iron // Eur. J. Clin. Invest. 2004. 34. P. 782–784.
- Geisser P. Safety and Efficacy of Iron (III) hydroxide Polymaltose Complex. A review of 25 years experience. Arzneimittel-Forschung (Drug Research) 2007. 57 (6 a). P. 439–452.
- Anker S. D., Comin-Colet J., Filippatos G. et al. Ferric Carboxymaltose in Patients with Heart Failure and Iron Deficiency // N. Engl. J. Med. 2009. 361. P. 2436–2448.
Е. С. Темникова, доктор медицинских наук, профессор
ГБОУ ВПО ОмГМА МЗ РФ, Омск
Контактная информация: temnikovaomsk@mail.ru
Купить номер с этой статьей в pdf
Ишемическая болезнь сердца (ИБС) – патология, в основе которой лежит поражение миокарда, обусловленное недостаточным его кровоснабжением. Атеросклеротическое сужение коронарных артерий является патогенетической основой ИБС, но для развития ишемии миокарда требуется еще дополнительный фактор, ведущий к нарушению баланса пропускной способности коронарных артерий и потребности миокарда в кислороде.
Чаще всего это увеличение работы ЛЖ (тахикардия, повышение систолического АД) или недостаточность коронарного кровотока (тромбообразование в венечных артериях, спазм). Реже как факторы, способствующие развитию или прогрессированию ИБС, рассматриваются снижение перфузионного давления (ДАД) или нарушение кислород-транспортной функции крови и т. д.
Для наглядности приводим выписки из историй болезни пациентов, у которых эти факторы играли роль «запускающего механизма». Мнение о том, что штаны принято носить только мужчинам, а женщины должны быть утонченные и элегантные, отдавая предпочтение юбкам и платьям, в нынешнее время абсолютно не актуально.
Клинический случай 1
Больной Ш., 84 года, был госпитализирован в мае 2013 г. с жалобами на давящие боли за грудиной при небольшой физической нагрузке и в покое.
Более 30 лет регистрируются высокие цифры АД (до 200/120 мм рт. ст.), сахарный диабет 2-го типа.
4 мес. назад перенес острый инфаркт миокарда без зубца Q боковой стенки левого желудочка. При коронарографии: передняя межжелудочковая ветвь (ПМЖВ) левой коронарной артерии (ЛКА) стенозирована в проксимальной трети на 50%, в дистальной трети — последовательные стенозы 30–50%; огибающая артерия (ОА) стенозирована в средней трети на 70%, правая коронарная артерия (ПКА) субокклюзирована в передней трети, окклюзирована в средней трети, дистальная часть слабо контрастируется по меж- и интраартериальным анастомозам. Выполнено стентирование средней трети ОА. Реканализацию ПКА выполнить не удалось.
Обращено внимание на наличие гипохромной анемии легкой степени (гемоглобин -106 г/л). Проведенное обследование возможного источника кровотечения не выявило. Выписан в удовлетворительном состоянии с рекомендацией приема ацетилсалициловой кислоты и клопидогрела, сахароснижающей терапии, препаратов железа.
Дома рекомендованные препараты принимал нерегулярно, врача не посещал.
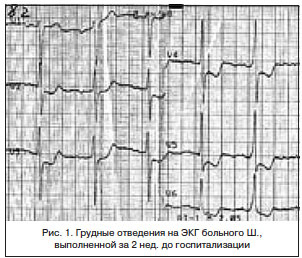
Около 2 мес. назад отметил нарастание слабости. Стали беспокоить редкие приступы загрудинных болей. На ЭКГ от 10.05.13 г.: на фоне синусового ритма с ЧСС 75 уд./мин — выраженная депрессия сегмента ST в отведениях V2-6 (рис. 1). От предложенной госпитализации отказался.
Последние 2 нед. участились приступы загрудинных болей давящего характера, они стали возникать при минимальной физической нагрузке и в покое, сублингвальный прием нитроглицерина оказывал кратковременное действие, появилось чувство нехватки воздуха. Обратился в поликлинику, откуда был доставлен в ЦКБ с диагнозом «ИБС, прогрессирующая стенокардия».
При поступлении: кожные покровы бледные. Отеков нет. ЧД — 18 в 1 мин. Дыхание жесткое. Пульс — 72, АД — 140/70 мм рт. ст. на обеих руках. Систолический шум в точке Боткина и на верхушке, проводящийся в левую подмышечную область.
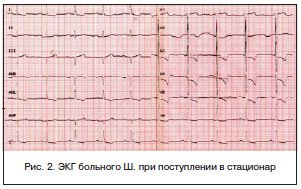
ЭКГ при поступлении (рис. 2): синусовый ритм с ЧСС 59 уд./мин, замедление атриовентрикулярной проводимости (PQ — 0,24 с). Замедление проводимости по левому предсердию и желудочку. Гипертрофия левого желудочка. Нарушение реполяризации в V2-5.
ЭхоКГ: гипертрофия миокарда ЛЖ (ММЛЖ — 240 г). Утолщение межжелудочковой перегородки (МЖП), более выраженное в базальной части (1,6–1,8 см), без признаков обструкции выходного отдела ЛЖ. Толщина ЗСЛЖ — 1,5 см. Сократительная способность миокарда ЛЖ удовлетворительная (ФВ по Тейхольцу — 63%), КСР — 3,6 см, КДР — 5,5 см, ЛП — 5,1 см. Зон нарушенной кинетики не выявлено. Изменение диастолической функции ЛЖ по первому типу.
В экстренном порядке выполнена коронароангиография (КАГ) (рис. 3): ствол ЛКА не изменен. ПМЖВ стенозирована на границе передней и средней третей на 50%, на протяжении дистальной трети — последовательные стенозы 30–60%. 1ДВ — анатомически некрупная, стенозирована в устье на 80%, окклюзирована в средней трети, дистальная часть слабо контрастируется по интерартериальным коллатералям. ВТК стенозирована в устье до 50%. ОВ анатомически крупная, проходима на всем протяжении, ранее имплантированные стенты — без стенотических изменений. ПКА субокклюзирована в передней трети, окклюзирована в средней трети, дистальная часть слабо контрастируется по меж- и интраартериальным анастомозам. Сбалансированный тип коронарного кровоснабжения.
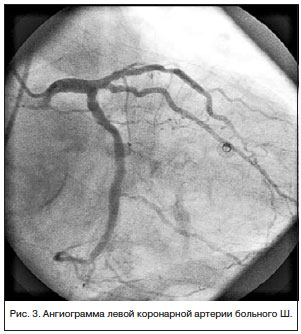
Учитывая отсутствие динамики стенозов-КА по сравнению с КАГ от января 2013 г., чрескожное коронарное вмешательство не проводилось.
В анализе крови: гемоглобин — 61 г/л, эритроциты — 2,30×10*12, ЦП — 0,8, гематокрит — 18,5, лейкоциты — 7,7×10*9.
Кардиоспецифические ферменты (КФК МВ, тропонин Т) находились в пределах референсных значений.
В анализе мочи: удельный вес — 1020, белок — 0,15, лейкоциты — 0–5 в поле зрения, эритроциты — 100–150 в поле зрения.
Дополнительный целенаправленный расспрос позволил выяснить, что на протяжении последних 4 мес. неоднократно были эпизоды выделения темно-красной мочи, иногда длившиеся по несколько дней (макрогематурия?).
Убедительных данных, говорящих об остром очаговом поражении миокарда, на момент госпитализации не получено. Учитывая наличие анемии тяжелой степени, произведена трансфузия отмытых эритроцитов (1150 мл за 2 сут) с положительным эффектом: уровень гемоглобина повысился до 100 г/л, число эритроцитов — до 3,59×10*12, гематокрит — до 29,4.
На ЭКГ через 1 сут после последней гемотранфузии отмечается нормализация конечной части желудочковых комплексов в грудных отведениях (в V4 — зубец Т слабоотрицательный).
Самочувствие пациента значительно улучшилось: в течение последующих 3 сут при расширении двигательного режима до уровня физических нагрузок, соответствующих 3 функциональному классу, боли в грудной клетке не возникали, выраженность одышки существенно уменьшилась, объем нагрузок ограничивался главным образом мышечной утомляемостью. Эпизоды макрогематурии не повторялись. В удовлетворительном состоянии больной переведен для дообследования в урологическое отделение.
Клинический случай 2
Больной К., 50 лет, госпитализирован в стационар в декабре 2014 г. с клиникой прогрессирования стенокардии напряжения, одышки, возникающих при минимальной физической нагрузке, в покое, с нарастанием общей слабости в течение последнего месяца.
В анамнезе: АГ с максимально известными значениями АД 200/100 мм рт. ст. давностью более 15 лет; регулярно принимает антигипертензивные препараты, однако контроль АД нерегулярный. В 2002 г. перенес ОИМ, в этом же году выполнено аортокоронарное шунтирование (АКШ) ПМЖА, ПКА, ОА. В 2009 г. развилась клиника прогрессирующей стенокардии, в связи с чем выполнено стентирование шунта к ОВ ЛКА. В мае 2014 г. — повторный ОИМ задней стенки левого желудочка, проводился системный тромболизис, чрескожное коронарное вмешательство с реканализацией и стентированием АКШ к ОА. После выписки и до настоящей госпитализации — состояние стабильное.
Сопутствующие заболевания: сахарный диабет 2-го типа, мочекаменная болезнь, хронический геморрой, железодефицитная анемия легкой степени регистрируется с 2009 г. (препараты железа не принимал).
При поступлении: кожные покровы бледные, сухие. ЧД — 18 уд./мин. Дыхание жесткое, небольшое количество свистящих хрипов на выдохе. Тоны сердца глухие. ЧСС -76 уд./мин. АД — 150/90 мм рт. ст. на обеих руках.
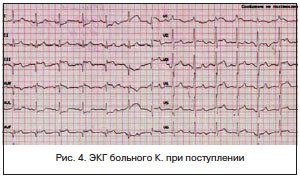
ЭКГ зарегистрирована на фоне болевого приступа (рис. 4): ритм синусовый, ЧСС — 88 уд./мин, смещение сегмента ST вверх от изолинии в отведениях III, aVF, V1. В отведениях I и aVL смещение сегмента ST книзу от изолинии. Зубец Q длительностью 0,04 с во II, III, aVF отведениях.
ЭхоКГ: гипертрофия миокарда ЛЖ (ММЛЖ — 213 г, МЖП — 1,5 см, ЗСЛЖ — 1,2 см). Дилатация левого предсердия (5,3×6,1 см). Нарушение диастолической функции левого желудочка по первому типу. Гипокинез диафрагмального, заднебазального и заднебоковых сегментов. ФВ — 54% по Тейхольцу.
В общем анализе крови: гемоглобин — 70 г/л, эритроциты — 4,29×10*12, гематокрит -23,5, ЦП — 0,48, гипохромия, анизоцитоз, пойкилоцитоз (овалоциты, мишеневидные эритроциты), лейкоциты — 5,9×10*9. Сывороточное железо — 1,9.
Кардиоспецифические ферменты (КФК МВ, тропонин Т) находились в пределах референсных значений.
Таким образом, убедительных данных, свидетельствующих об остром очаговом поражении миокарда, на момент госпитализации не получено. Высказано предположение, что причиной прогрессирования стенокардии являлась тяжелая железодефицитная анемия, вероятнее всего, постгеморрагическая. Проведена трансфузия эритроцитной взвеси 630 мл за первые сутки, начато парентеральное введение препаратов железа.
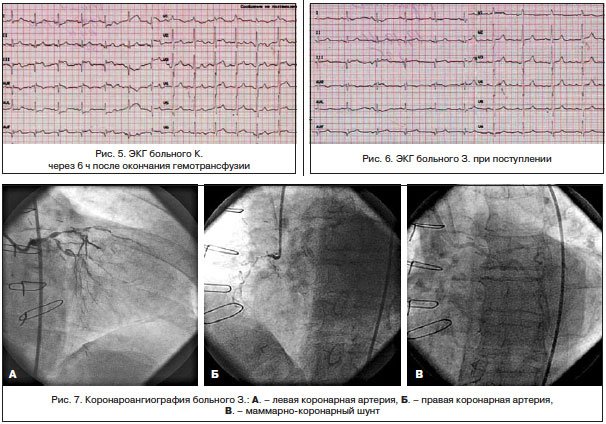
Трансфузионную терапию перенес хорошо. Ангинозные боли не рецидивировали. На ЭКГ, зарегистрированной после гемотрансфузии (рис. 5): ЧСС — 62 уд./мин. Сегмент ST вернулся к изолинии.
В анализе крови спустя 1 сут: уровень гемоглобина возрос до 105 г/л, число эритроцитов — до 5,71×10*12, гематокрит — 38,3, ЦП — 0,55, гипохромия, анизоцитоз сохраняются. Лейкоциты — 8×10*9.
В течение 3 сут пациент находился в ОРИТ, антиангинальной терапии не требовалось, т. к. приступы стенокардии не рецидивировали.
Проводился поиск возможного источника кровопотери, онкопоиск: при колоноскопии выявлен хронический комбинированный геморрой 3 ст. Другой патологии, которая могла бы объяснить наличие анемии, не найдено.
Проводилось постепенное расширение двигательного режима. Физические нагрузки, соответствующие уровню 3 функционального класса, приступов стенокардии и ЭКГ-признаков ишемии миокарда не вызывают.
Через 12 дней в стабильном состоянии пациент выписан для дальнейшего лечения в амбулаторных условиях. Хирургом рекомендовано выполнение в плановом порядке дезартеризации геморроидальных узлов под ультразвуковым контролем.
Клинический случай 3
Больной З., 82 года, госпитализирован в стационар с жалобами на дискомфорт за грудиной, нехватку воздуха, возникающие без четкой связи с физической нагрузкой, длительностью до 4–5 мин, накануне был затяжной приступ длительностью более 1 ч, выраженную слабость, потливость. Настоящее ухудшение состояния отмечает в течение последних 3 дней на фоне появившейся гипотонии.
В течение 2 нед. до госпитализации принимал по поводу дорсалгии нестероидные противовоспалительные препараты (НПВП) (кеторолак). 4 дня назад отметил появление учащенного жидкого стула темной окраски, необычно низкое АД — 80/40 мм рт. ст.
В 1995 г. перенес ОИМ нижней стенки ЛЖ. В этом же году выполнено маммарно-коронарное шунтирование ПМЖА, АКШ ЗБВ ОА и ПКА. В 2003 г. — линейное аортобедренное шунтирование синтетическим протезом слева. Ранний послеоперационный период осложнился развитием повторного ОИМ нижней стенки ЛЖ.
С 2009 г. — пароксизмы мерцательной тахиаритмии.
Постоянно принимает бисопролол — 2,5 мг/сут, периндоприл — 5 мг/сут, аторвастатин — 20 мг/сут, варфарин — 5 мг/сут. Контроль МНО не проводился более года.
При поступлении: кожные покровы и видимые слизистые бледные. Число дыханий — 20 в 1 мин. Дыхание ослабленное, жесткое. Тоны сердца глухие, ритмичные. ЧСС — 76 уд./мин. АД — 110/70 мм рт. ст.
Лабораторные данные: гемоглобин — 91 г/л, эритроциты — 3,93×10*12, гематокрит — 33,0, ЦП — 0,84, лейкоциты — 10,2–10,6×10*9, тромбоциты — 223×10*9, анизоцитоз, анизохромия.
Кардиоспецифические ферменты: КФК — 268 при поступлении, через 10 ч — 319, КФК МВ — 30 при поступлении, через 10 ч — 42, тропонин Т при поступлении — 177, через 10 ч — 538.
Сывороточное железо — 13 мкмоль, белки транспорта железа в границах нормы. Коагулограмма: АЧТВ — нет коагуляции, МНО — нет коагуляции, фибриноген — 3,3 г/л, Д-димер — 1147.
ЭКГ (рис. 6) при поступлении: синусовый ритм, АВ-блокада I ст., рубцовые изменения нижней стенки ЛЖ, смещение сегмента ST во II, III и avF отведениях, высокий R — в V1-2. Архив ЭКГ не предоставлен.
ЭхоКГ: склероз и кальциноз стенок аорты, кольца и створок АК. ММЛЖ — 204 г, толщина МЖП — 1,0 см, ЗСЛЖ — 1,0 см. Дилатация левых отделов сердца (ЛП — 4,5×5,5 см, левый желудочек: КСО — 92, КДО — 171). Относительная недостаточность МК II степени. Гипокинез среднего заднего и заднебокового сегментов ЛЖ. Снижение глобальной сократительной способности миокарда ЛЖ (ФВ по Тейхольцу — 47%). Диастолическая дисфункция левого желудочка первого типа.
С учетом жалоб, анамнеза, лабораторно-инструментальных данных у больного диагностирован повторный ОИМ диафрагмальной и заднебазальной локализации.
Не исключалось состоявшееся желудочно-кишечное кровотечение на фоне приема НПВП и орального антикоагулянта, в связи с чем экстренно выполнена ЭГДС: эндоскопические признаки хронического эзофагита, язва нижней трети пищевода Forrest II C. Острая язва желудка Forrest II B (без признаков продолжающегося кровотечения). Язва привратника Forrest I B (с признаками продолжающегося кровотечения). После эндоскопического инъекционного гемостаза кровотечение остановлено.
Причиной ОИМ, вероятно, явилась гипотония и анемия на фоне желудочно-кишечного кровотечения. Начата консервативная гемостатическая, противоязвенная терапия. От проведения КАГ с возможным чрескожным коронарным вмешательством решено воздержаться до стабилизации состояния.
На фоне лечения цифры АД стабилизировались на уровне 120/85 мм рт. ст., уровень гемоглобина повысился до 110 г/л, возросло число эритроцитов — до 5,71×10*12, гематокрит — 38,3, ЦП — 0,55, лейкоциты — 8×10*9, гипохромия, анизоцитоз сохраняются.
Уровень активности КФК снизился до 113 ед, МВ КФК — до 12,7, тропонина Т — до 225.
ЭГДС через 2 сут: язва нижней трети пищевода Forrest III, острая язва желудка Forrest III, язва привратника Forrest II С (отсутствие признаков кровотечения, появление в области дна фибрина).
На 3-й день пребывания в стационаре возобновились кратковременные приступы сжимающих болей за грудиной (2 приступа: во время приема пищи и при попытке сесть в кровати).
По экстренным показаниям выполнена коронароангиография (рис. 7): ствол ЛКА стенозирован на протяжении передней и средней трети до 70%, субокклюзирован в дистальной трети с переходом на устья ОВ и ПМЖВ; ПМЖВ субокклюзирована в устье, стенозирована в передней трети на 80%, окклюзирована в средней трети, дистальная часть контрастируется по функционирующему маммарно-коронарному шунту. ОВ субокклюзирована в устье, стенозирована в передней трети на 80%; ПКА субокклюзирована на протяжении передней и средней трети, окклюзирована на границе средней и дистальной третей, дистальная часть контрастируется по межартериальным анастомозам.
Правый тип коронарного кровоснабжения.
Маммарно-коронарный шунт из правой маммарной артерии в дистальной трети ПМЖВ проходим. Шунты к ОА и ПКА не визуализируются.
Попытка реканализации стенозированных артерий — без успеха в связи с выраженным кальцинозом.
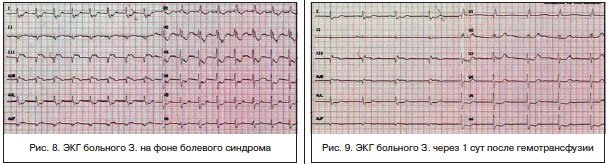
В течение последующих суток — состояние с отрицательной динамикой: в виде учащения кратковременных приступов стенокардии, сопровождающихся выраженными ЭКГ-признаками ишемии миокарда (рис. 8). Отмечено снижение гемоглобина со 110 до 87 г/л, гематокрита — до 26,0.
Кардиоспецифические ферменты в пределах нормальных значений. ЭхоКГ: размер левых отделов сердца прежний, новых участков нарушения движений стенок ЛЖ не выявлено.
Гастроскопия: активное кровотечение из острого дефекта слизистой кардиоэзофагеального перехода (Forrest I). Эндоскопическая остановка кровотечения.
После переливания 600 мл эритроцитной взвеси состояние с положительной динамикой: ангинозные боли и ЭКГ-признаки ишемии миокарда не рецидивируют (рис. 9), восстановление уровня гемоглобина (110 г/л), эритроцитов (3,85×10*12), гематокрита -33,7.
При контрольной ЭГДС через 10 дней положительная динамика — уменьшение в размерах язвенных дефектов без признаков кровотечения.
На фоне терапии ингибиторами протонной помпы, β-блокаторами, клопидогрелом 75 мг/сут показатели красной крови стабильны, двигательный режим расширен и по уровню нагрузок соответствует 3 ФК.
ХМЭКГ: ритм синусовый, ЧСС (за сут/днем/ночью): 78/77/78 уд/мин, максимальная ЧСС — 99 уд/мин, минимальная — 64 уд/мин. Отмечается появление депрессии сегмента ST при увеличении ЧСС свыше 90 уд/мин.
Приведенные случаи демонстрируют возможность проявления коронарной недостаточности на фоне снижения кислород-транспортной способности крови как у пациентов с тяжелым, так и умеренным поражением коронарного русла. Устранение анемии во всех трех случаях способствовало повышению коронарного резерва и стабилизации состояния.


