Биохимические аспекты развития атеросклероза
Атеросклероз
– это хроническое, прогрессирующее
заболевание, характеризующееся появлением
атерогенных бляшек на внутренней
поверхности сосудистой стенки.
Атеросклероз
– одна из важнейших медицинских проблем
современного общества. Во многих странах
данное заболевание, его прямые последствия
и осложнения являются одной из ведущих
причин смертности населения. Чтобы
подчеркнуть эпидемиологическое значение
атеросклероза, следует указать основные
нозологические единицы, которые являются
его прямыми последствиями: ишемическая
болезнь сердца, инфаркт миокарда,
инсульт, ишемические заболевания
конечностей.
Главными
факторами риска атеросклероза, по данным
многолетних эпидемиологических
популяционных исследований являются:
дислипопротеинемии
(первичные и вторичные)гипертензия
сахарный
диабеткурение
принадлежность
к мужскому полу.
К
другим, «мягким» факторам риска относят
– ожирение, гиподинамию, хронический
стресс, гиперурикемию.
Одна
из основных причин развития атеросклероза
– нарушение баланса между поступлением
ХС с пищей, его синтезом и выведением
из организма. У пациентов, страдающих
атеросклерозом, повышены концентрации
ЛПНП и ЛПОНП. Существует обратная
зависимость между концентрацией ЛПВП
и вероятностью развития атеросклероза.
Это согласуется с представлениями о
роли ЛПНП как переносчиков ХС в ткани,
а ЛПВП – из тканей.
Базовой
метаболической «предпосылкой» развития
атеросклероза является гиперхолестеролемия,
которая может возникать в силу
вышеперечисленных причин. Важную роль
в механизмах развития атеросклероза
играет модификация ЛП. Изменение
нормальной структуры белков и липидов
в составе ЛП делает их чужеродными для
собственного организма и поэтому более
доступными для захвата фагоцитами.
Модифицированные
липопротеины
– образуются в организме из нормально
синтезированных и секретированных в
кровь ЛП. Причиной их модификации могут
быть: выброс клетками свободных радикалов
и продуктов перекисного окисления
липидов, повышенная концентрация в
крови и межклеточной жидкости некоторых
метаболитов (например – глюкозы), а
также ферментов различного спектра
действия. Модификация ЛП может происходить
по нескольким механизмам, что приводит
к образованию различных продуктов:
гликозилированные
ЛП;перекисно-модифицированные
ЛП;аутоиммунные
комплексы ЛП-антитело;продукты
ограниченного протеолиза ЛП;комплексы
ЛП с гликозаминогликанами;агрегированные
ЛП.
Гликозилирование
– весьма распространенный вид
посттрансляционной модификации белков,
в ходе которой происходит неферментативное
ковалентное присоединение моносахаридов
к ε-аминогруппе белка. Гликозилирование
ЛП имеет место в норме, но особенно
активно оно протекает у лиц с гипергликемией.
Конечные продукты превращений
гликозилированных ЛП сами по себе
способствуют развитию атеросклероза:
повышают проницаемость эндотелия,
способствуют адгезии на нем клеток
крови, активируют хемотаксис макрофагов
в артериальную стенку, пролиферацию
гладкомышечных клеток. Гликозилирование
ЛП следует рассматривать как их
атерогенную модификацию, поэтому у
больных сахарным диабетом рано развивается
атеросклероз и около 80% диабетиков
погибают от его осложнений.
Из
всех классов ЛП перекисное окисление
липидов (ПОЛ) затрагивает в первую
очередь ЛПНП. ПОЛ в частицах ЛП – сложный
и многоступенчатый процесс. Постоянно
возникающие в организме свободные
радикалы генерируют образование
гидроперекисей ненасыщенных жирных
кислот, входящих в состав различных
липидов. Особенно чувствительны к
окислению глицерофосфолипиды. В
результате их окисления образуются
более полярные молекулы с укороченными
ацильными радикалами. Перекисно-модифицированные
ЛП слабо распознаются соответствующими
рецепторами, обогащены продуктами ПОЛ,
содержат меньше ненасыщенных жирных
кислот и антиоксидантов, обладают
цитотоксичностью. Такая модификация
делает ЛП (в первую очередь ЛПНП) более
высокоатерогенными.
В
крови больных с атеросклеротическими
признаками часто обнаруживают иммунные
комплексы, содержащие ЛП в качестве
антигена: ЛПНП-JgG
или ЛПОНП-JgG.
Одной из причин образования антител к
ЛП может являться их модификация и, как
следствие этого, приобретение ими
аутоантигенных свойств. Этому также
способствуют такие особенности структуры
и свойств ЛП, как вариабельность состава
и конформации белковых компонентов,
возможность комплексообразования с
другими соединениями, частичная
деградация в крови и тканях под действием
ферментов, процессов ПОЛ и большого
числа других причин, которые возникают
в норме и при патологии.
Развитие
атеросклероза проходит несколько
стадий. Цепь событий выглядит здесь
следующим образом: повреждение эндотелия
→ адгезия тромбоцитов → секреция
тромбоцитарного фактора роста →
пролиферация гладкомышечных клеток →
начало образования бляшки → фиброз и
кальцификация зоны повреждения →
сформированная атеросклеротическая
бляшка. Процесс начинается с повреждения
эндотелия сосудов, причем оно может
иметь различные механизмы. Важнейший
механизм – повреждение эндотелия
модифицированными ЛП, например в
результате активации ПОЛ. В ходе ПОЛ в
ЛПНП изменяется не только структура
липидных компонентов, но и апопротеинов.
Модифицированные ЛПНП захватываются
макрофагами. Этот процесс не регулируется
количеством поглощенного ХС, как в
случае его поступления в клетки через
специфические рецепторы, поэтому
макрофаги перегружаются ХС и превращаются
в «пенистые клетки» которые проникают
в субэндотелиальное пространство. Это
приводит к образованию липидных пятен
или полосок в стенке кровеносных сосудов.
На этой стадии эндотелий сосудов может
сохранять свою структуру. В норме клетки
эндотелия секретируют простагландин
J2,
который ингибирует агрегацию тромбоцитов.
При увеличении количества «пенистых
клеток», происходит повреждение эндотелия
и активация тромбоцитов. Последние
секретируют тромбоксан А2,
который стимулирует агрегацию тромбоцитов,
что может привести к образованию тромба
в области атеросклеротической бляшки.
Кроме того, тромбоциты начинают
продуцировать тромбоцитарный фактор
роста, стимулирующий пролиферацию
гладкомышечных клеток. Они мигрируют
из медиального во внутренний слой
артериальной стенки, способствуя, таким
образом, росту бляшки. Далее происходит
прорастание бляшки фиброзной тканью
(коллагеном, эластином), клетки под
фиброзной оболочкой некротизируются,
а ХС откладывается в межклеточном
пространстве. На данном этапе в центре
бляшки могут образовываться холестероловые
кристаллы. На последних стадиях развития
бляшка пропитывается солями кальция и
становится очень плотной. В области
бляшки часто образуются тромбы,
перекрывающие просвет сосуда, что
сопровождается острым нарушением
кровообращения в соответствующем
участке ткани и развитием инфаркта.
Чаще всего эти процессы развиваются в
артериях миокарда, поэтому наиболее
распространенное заболевание,
сопутствующее атеросклерозу – инфаркт
миокарда.
Достаточно
часто атеросклероз протекает на фоне
других атерогенных нарушений и такое
сочетание получило название метаболический
Х-синдром. При метаболическом Х-синдроме
у пациентов отмечается: ожирение,
гипертензия, сахарный диабет, гиперурикемия,
гиперлипопротеинемия и атеросклероз.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Одним из самых ярких и клинически значимых нарушений обмена липопротеинов является атеросклероз.
Атеросклероз
Атеросклероз – это отложение холестерина и его эфиров в соединительной ткани стенок артерий, в которых выражена механическая нагрузка на стенку (по убыванию воздействия): абдоминальная аорта, коронарная артерия, подколенная артерия, бедренная артерия, тибиальная артерия, грудная аорта, дуга грудной аорты, сонные артерии.
Стадии атеросклероза
Морфологически выделяют четыре стадии атеросклероза. Первая и вторая стадии распространены широко и при правильном питании являются обратимыми, 3 и 4 стадии уже имеют клиническое значение и необратимы.
1 стадия – повреждение эндотелия
Это «долипидная» стадия, обнаруживается даже у годовалых детей. Изменения этой стадии неспецифичны и ее могут вызывать: дислипопротеинемия, гипертензия, повышение вязкости крови, курение, вирусные и бактериальные инфекции, свинец, кадмий и т.п.
На этой стадии в эндотелии создаются зоны повышенной проницаемости и клейкости. Внешне это проявляется в разрыхлении и истончении (вплоть до исчезновения) защитного гликокаликса на поверхности эндотелиоцитов, расширении межэндотелиальных щелей. Это приводит к усилению выхода моноцитов и липопротеинов (ЛПНП и ЛПОНП) в интиму.
2 стадия – стадия начальных изменений
Отмечается у большинства детей и молодых людей.
Поврежденный эндотелий и активированные тромбоциты вырабатывают медиаторы воспаления, факторы роста, эндогенные окислители. В результате через поврежденный эндотелий в интиму сосудов еще более активно проникают моноциты и способствуют развитию воспаления. При этом ЛПНП, попавшие под интиму, начинают изменяться (модифицироваться), т.е. подвергаются окислению, гликозилированию, ацетилированию.
Моноциты, преобразуясь в макрофаги, активно поглощают измененные липопротеины при участии «мусорных» рецепторов (scavenger [‘skævɪnʤə] receptors). Таким образом, поглощение модифицированных ЛПНП макрофагами идет без участия апоВ-100-рецепторов, а, значит, нерегулируемо.
При поглощении модифицированных липопротеинов макрофаги активируются, выделяют цитокины и разнообразные факторы роста, которые стимулируют деление гладкомышечных клеток, синтез межклеточного вещества, и играют роль в развитии атеросклеротической бляшки.
Модификация липопротеинов в зоне воспаления является непосредственной биохимической причиной атеросклероза.
Окисление ЛПНП нарастает при недостаточной активности антиоксидантных систем – гиповитаминозах Е и С, нехватке металлов (железо, селен, медь, цинк), входящих в состав антиоксидантных ферментов каталазы, пероксидазы, супероксиддисмутазы.
Гликозилирование белков ЛПНП ускоряется при сахарном диабете или при других хронических гипергликемиях. Такие модифицированные липопротеины теряют способность связываться с апоВ-100-рецептором и проникать в клетки-мишени и, в результате, накапливаются в крови и в интиме сосудов.
Под действием факторов роста гладкомышечные клетки медии мигрируют в интиму и начинают пролиферировать, превращаясь в макрофагоподобные клетки. Они также накапливают модифицированные ЛПНП.
Накопление липидов в макрофагах быстро исчерпывает невысокие возможности клеток по утилизации свободного и этерифицированного ХС. Они переполняются стероидами и превращаются в пенистые клетки. Внешне на эндотелии появляются липидные пятна и полоски.
Процесс развития атеросклероза (в динамике слева-направо)
3 стадия – стадия поздних изменений
Продолжают развертываться и приобретают масштабность события, начавшиеся на второй стадии.
Внешне проявляется как выступание поверхности в просвет сосуда. Стадия дополнительно характеризуется следующими особенностями:
- увеличение количества коллагена, эластина и гликозаминогликанов, т.е. накопление межклеточного вещества,
- пролиферация и гибель пенистых клеток (апоптоз),
- накопление в межклеточном пространстве свободного ХС и этерифицированного ХС,
- инкапсулирование холестерола и формирование фиброзной бляшки.
4 стадия – стадия осложнений
На этой стадии происходят:
- кальцификация бляшки и ее изъязвление, приводящее к эмболии сосудов,
- тромбоз из-за адгезии и активации тромбоцитов,
- разрыв сосуда.
Основы лечения
В лечении атеросклероза обязательно должны быть две составляющие: диета и медикаменты. Целью лечения является снижение концентрации общего ХС плазмы, ХС ЛПНП и ЛПОНП, повышение концентрации ЛПВП.
Диета
1. Обеспечение организма витаминами: аскорбиновой кислотой, пантотеновой (коэнзим А) и никотиновой (НАДФ) кислотами, что способствует превращению холестерола печени в желчные кислоты (синтез желчных кислот). Для снижения окислительной модификации ЛПНП необходим витамин Е.
2. Снижение калорийности пищи за счет углеводов и жиров. Жиры пищи должны включать равные доли насыщенных, мононенасыщенных и полиненасыщенных жирных кислот. Доля жидких жиров, содержащих полиненасыщенные жирные кислоты (ПНЖК), должна быть около 30% от всех жиров, но не меньше 15 г/сут. Роль ПНЖК в лечении гиперхолестеролемии и атеросклероза сводится к:
- ограничению всасывания ХС в тонком кишечнике,
- активации синтеза фосфатидилхолина, что снижает вязкость желчи и облегчает ее отток в кишечник,
- усилению желчеотделения,
- снижению синтеза ЛПНП в печени и секреции их в кровь,
- увеличению синтеза ЛПВП и концентрации их в крови, что способствует удалению холестерина из тканей в печень.
3. Обеспечение организма чистой водой до физиологических норм (1,0-1.5 л/сут), что препятствует сгущению желчи.
4. Потребление высоких количеств овощей, содержащих целлюлозу (капуста, морковь, свекла) для усиления перистальтики кишечника, стимуляции желчеотделения и снижения всасывания ХС.
5. Умеренная физическая нагрузка – способствует синтезу ЛПВП и, значит, оттоку холестерина от тканей в печень.
Медикаменты
1. Препараты ω6- и ω3-жирных кислот (Линетол, Эссенциале, Омеганол и т.п.) повышают концентрацию ЛПВП в плазме, ускоряют отток ЛПНП в печень, стимулируют желчеотделение.
2. Подавление всасывания ХС в желудочно-кишечном тракте – анионообменные смолы (Холестирамин, Холестид, Questran).
3. Высокие дозы никотиновой кислоты подавляют мобилизацию жирных кислот из депо и снижают синтез ЛПОНП в печени, а, следовательно, и образование из них ЛПНП в крови.
4. Фибраты (клофибрат и т.п.) увеличивают активность липопротеинлипазы, ускоряют катаболизм ЛПОНП и хиломикронов, что повышает переход холестерола из них в ЛПВП и его эвакуацию в печень.
5. Статины (ловастатин, флувастатин) ингибируют ГМГ-SКоА-редуктазу, что снижает в 2 раза синтез ХС в печени и ускоряют его отток из ЛПВП в гепатоциты.
Предложены и совсем радикальные способы:
6. Подавление функции энтероцитов с помощью антибиотика неомицина, что снижает всасывание жиров.
7. Хирургическое удаление подвздошной кишки и прекращение реабсорбции желчных кислот.
Глубокое знание проблемы атерогенеза позволяет своевременно определите риски образования бляшек в сосудах. Биохимические механизмы развития атеросклероза являются предметом изучения современной медицинской науки. Для того чтобы в них разобраться, необходимо знать причины, предпосылки и факторы риска развития атеросклеротической дисфункции. Когда доктору удается определить их, установить признаки клинической симптоматики, он может с легкостью разобраться в механизмах, происходящих в организме больного.
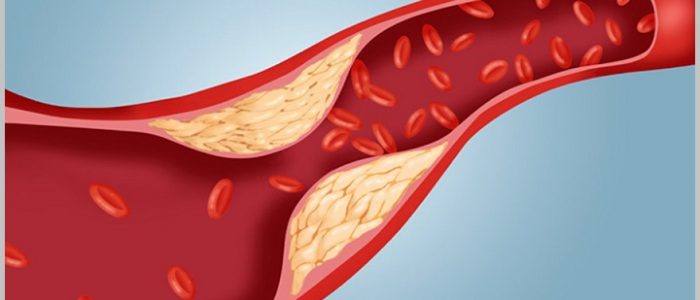
Обладая знаниями о формировании патологии на молекулярном уровне, можно разработать биохимические основы терапии. Такое лечение будет влиять на первое звено патогенетического процесса, что предотвратит осложнения.
Причины заболевания
Биохимия атеросклероза прослеживается уже в его причинных факторах:
- Генетическая предрасположенность. Гены, встроенные в хромосомы, кодируют последовательность аминокислот в белках. Последние становятся компонентами клеток, которые имеют те или иные функции и свойства. Таким образом генетика играет первичную роль в становлении метаболических нарушений, к которым и относится атеросклероз.
- Половые особенности. Статистика утверждает, что атеросклеротические бляшки встречаются чаще в сосудистом русле у женщин. Это обусловлено влиянием женских половых гормонов на эластичность и целостность эндотелия артерий и вен.
- Возрастные особенности. В пожилом возрасте возникают не только генные поломки, но и всевозможные метаболические дисфункции. В кровеносном русле аккумулируются токсические продукты обмена, которые запускают атерогенез.
Вернуться к оглавлению
Факторы риска и предпосылки
 Негативные факторы, в виде стрессовых состояний и вредных привычек, являются предпосылками к развитию заболевания.
Негативные факторы, в виде стрессовых состояний и вредных привычек, являются предпосылками к развитию заболевания.
Для атерогенеза характерны:
- Постоянное нахождение человека в нервном напряжении. Стрессовые факторы влияют на концентрацию в крови адреналина и норадреналина. Эти гормонально активные вещества в свою очередь воздействуют на стенки сосудов.
- Погрешности в диете. Питание большим количеством жирной, соленой пищи, а также продуктами, которые содержат моносахариды, приводит к образованию атеросклеротических бляшек в интиме сосудов.
- Метаболический синдром. Он включает ожирение, дисфункции щитовидной железы, сахарный диабет, гиперурикемию и другие компоненты.
- Климактерический период. Гормональный сбой у мужчин и женщин в период пременопаузы напрямую воздействует на содержание в крови холестерина, триглицеридов, липидов низкой и очень низкой плотности.
- Вредные привычки. Курение и злоупотребление алкогольными напитками также сказывается на нормальном течении биохимических процессов.
- Гиподинамия. Малоподвижный образ жизни ведет человека к образованию в его сосудистом русле холестериновых пробок.
Вернуться к оглавлению
Первые признаки
При образовании в организме атеросклеротических пятен, бляшек и других элементов у пациента не возникает практически никакой клинической симптоматики. Изредка у него могут появляться специфические ксантомы и ксантелазмы — желтые или белесые точки, полоски, пятнышки на коже периорбитального участка, шеи или сгибательных поверхностей верхних и нижних конечностей. Изредка пациенты жалуются на шум в ушах и мелькание мушек перед глазами. Эти симптомы свидетельствуют о начальных стадиях ишемии тканей. Позже к ним присоединяются боли, похолодание конечностей, нарушение мнестических функций и другие признаки.
Вернуться к оглавлению
Что происходит в организме?
 Протекание недуга вызывает закупорку капилляров, что приводит к чувству ползания по коже мурашек.
Протекание недуга вызывает закупорку капилляров, что приводит к чувству ползания по коже мурашек.
На последующих стадиях развиваются сосудистые стенозы. Они возникают в местах окклюзии просвета атеросклеротическими бляшками, разросшимися в интиме сосудистой стенки. Этот патологический процесс сопровождается следующей клинической симптоматикой:
- Болезненные ощущения в голове или в области сердца. Они возникают, когда ишемия тканей нарастает и сосуды рефлекторно спазмируются, пытаясь вытолкнуть к нервным клеткам или кардиомиоцитам как можно большее количество насыщенной кислородом крови.
- Появление ложных ощущений. Их еще называют парестезиями. Больному чудится, будто по коже у него ползают мурашки. Такой симптом возникает на фоне закупорки капилляров.
- Головокружение. Оно появляется, если атеросклеротический процесс успел затронуть сосудистое русло вестибулярного аппарата.
- Потемнение в глазах. Когда холестериновые бляшки закупоривают просвет артерий, питающих сетчатку, у пациента возникают расстройства зрения.
- Сухость кожи. Нарушение трофики кожных покровов сказывается на их качестве. Эластичность и упругость кожи теряются, она начинает шелушиться.
- Цианоз носогубного треугольника и кончиков пальцев на руках и ногах. Синюшность появляется, как результат недостаточного поступления оксигенированной крови в дистальные участки тела.
Вернуться к оглавлению
Биохимические основы терапии
Если научиться прослеживать патогенез атеросклеротического поражения сосудистого русла от самых его истоков, можно изобрести лекарственные средства, которые будут предотвращать тяжелые формы холестериновых бляшек. Медиками, учеными и фармацевтами разработаны прогрессивные лекарства — статины. К ним относятся «Розувастатин», «Аторвастатин», «Симвастатин», «Флувастатин» и другие фармакологические препараты. Эти медикаменты позволяют снизить концентрацию в крови пациента триглицеридов, липопротеидов низкой и очень низкой плотности, а также самого холестерола.