Анемия вследствие недостаточности глюкозо 6 фосфатдегидрогеназы
Самой распространенной ферментопатией является дефицит глюкозо-6-фосфатдегидрогеназы — выявлен приблизительно у 300 млн человек; на втором месте дефицит активности пируваткиназы, обнаруженный у нескольких тысяч пациентов в популяции; остальные типы ферментных дефектов эритроцитов встречаются редко.
Распространенность
Дефицит глюкозо-6-фосфатдегидрогеназы неравномерно распределен среди населения разных стран: чаще всего встречается у жителей европейских государств, расположенных на побережье Средиземного моря (Италия, Греция), у евреев-сефардов, а также в Африке и Латинской Америке. Недостаток глюкозо-6-фосфатдегидрогеназы широко регистрируется в бывших малярийных районах Средней Азии и Закавказья, особенно в Азербайджане. Известно, что больные тропической малярией, имеющие дефицит глюкозо-6-фосфатдегидрогеназы, реже погибали, поскольку эритроциты с недостаточностью фермента содержали меньше малярийных плазмодиев, чем нормальные эритроциты. Среди русского населения дефицит активности глюкозо-6-фосфатдегидрогеназы встречается приблизительно у 2 % людей.
Хотя недостаточность данного фермента встречается повсеместно, степень выраженности дефицита варьирует у разных этнических групп. Установлены следующие варианты недостаточности фермента в эритроцитах: А+ , А» , В+, В» и вариант Canton.
- Вариант глюкозо-6-фосфатдегидрогеназы В+ — нормальный (100 % активность Г-б-ФД), наиболее распространен у европейцев.
- Вариант глюкозо-6-фосфатдегидрогеназы В» — средиземноморский; активность эритроцитов, содержащих этот фермент, крайне низкая, часто менее 1 % от нормы.
- Вариант глюкозо-6-фосфатдегидрогеназы А+- активность ферментов в эритроцитах почти нормальная (90 % активности варианта В+)
- Вариант глюкозо-6-фосфатдегидрогеназыД А» — африканский, активность фермента в эритроцитах составляет 10-15 % от нормы.
- Вариант глюкозо-6-фосфатдегидрогеназы Canton — у жителей Юго-восточной Азии; активность фермента в эритроцитах снижена значительно.
Интересно отметить, что «патологический» фермент варианта А» по электофоретической подвижности и некоторым кинетическим свойствам очень близок с нормальными вариантами глюкозо-6-фосфатдегидрогеназы В+ и А+. Различия между ними заключаются в стабильности. Оказалось, что в юных эритроцитах активность фермента варианта А почти не отличается от таковой варианта В. Однако в зрелых эритроцитах картина резко меняется. Это связано с тем, что период полужизни в эритроцитах фермента варианта А приблизительно в 5 раз (13 дней) меньше, чем ферменты варианта В (62 дня). То есть недостаточная активность глюкозо-6-фосфатдегидрогеназы варианта А» является результатом значительно более быстрой, чем в норме, денатурации фермента в эритроцитах.
Частота разных типов недостаточности глюкозо-6-фосфатдегидрогеназы колеблется в различных странах. Поэтому частота лиц, «отвечающих» гемолизом на действие провоцирующих факторов, варьирует от 0 до 15 %, а в некоторых местностях достигает 30 %.
Недостаточность глюкозо-6-фосфатдегидрогеназы наследуется рецессивно, сцеплена с Х-хромосомой. Женщины могут быть как гомозиготными (активность фермента в эритроцитах отсутствует), так и гетерозиготными (активность фермента составляет 50 %) носителями дефекта. У мужчин активность фермента обычно ниже 10 /о, что обусловливает выраженные клинические проявления болезни.
Патогенез глюкозо-6-фосфатдегидрогеназы
Глюкозо-6-фосфатдегидрогеназа — первый фермент пентозофосфатного гликолиза. Основная функция фермента заключается в восстановлении НАДФ до НАДФН, необходимого для перехода окисленного глутатиона (GSSG) в восстановленную форму. Восстановленный глутатион (GSH) требуется для связывания активных форм кислорода (перекисей). Пентозофосфатный гликолиз обеспечивает клетку энергией.
Недостаточность активности фермента снижает энергетические запасы клетки и приводит к развитию гемолиза, тяжесть которого зависит от количества и варианта глюкозо-6-фосфатдегидрогеназы. В зависимости от тяжести дефицита выделяют 3 класса вариантов Г-6-ФД. Дефицит глюкозо-6-фосфатдегидрогеназы сцеплен с Х-хромосомой, наследуется рецессивно. Больные мужского пола всегда гемизиготны, женского — гомозиготны.
Наиболее важная функция пентозного цикла состоит в обеспечении достаточного образования восстановленного никотинамидадениндинуклеотидфосфата (НАДФ) для превращения окисленной формы глутамина в восстановленную. Этот процесс необходим для физиологической дезактивации соединений окислителей, таких как перекись водорода, накапливающихся в эритроците. При снижении уровня восстановленного глутатиона или активности глюкозо-6-фосфатдегидрогеназы, необходимого для поддержания его в восстановленной форме, под влиянием перекиси водорода происходит окислительное денатурирование гемоглобина и белков мембраны. Денатурированный и преципитированный гемоглобин находится в эритроците в виде включений — телец Гейнца-Эрлиха. Эритроцит с включениями быстро удаляется из циркулирующей крови либо путем внутрисосудистого гемолиза, либо тельца Гейнца с частью мембраны и гемоглобина фагоцитируются клетками ретикулоэндотелиальной системы и эритроцит приобретает вид «надкусанного» (дегмацит).
Симптомы глюкозо-6-фосфатдегидрогеназы
Заболевание может обнаруживаться у ребенка любого возраста. Выявляют пять клинических форм проявления недостаточности глюкозо-6-фосфатдегидрогеназы в эритроцитах.
- Гемолитическая болезнь новорожденных, не связанная с серологическим конфликтом (групповой или Rh-несовместимостью).
Ассоциируется с вариантами глюкозо-6-фосфатдегидрогеназы В (средиземноморский) и Canton.
Наиболее часто встречается у новорожденных итальянцев, греков, евреев, китайцев, таджиков, узбеков. Возможными провоцирующими факторами заболевания являются прием матерью и ребенком витамина К; использование при обработке пупочной ранки антисептиков или красителей; использование пеленок, обработанных нафталином.
У новорожденных с дефицитом глюкозо-6-фосфатдегидрогеназы в эритроцитах наблюдается гипербилирубинемия с признаками гемолитической анемии, но доказательства серологического конфликта между матерью и ребенком обычно отсутствуют. Выраженность гииербилирубинемии может быть различной, возможно развитие билирубиновой энцефалопатии.
- Хроническая несфероцитарная гемолитическая анемия
Встречается преимущественно у жителей Северной Европы .
Наблюдается у детей более старшего возраста PI взрослых; усиление гемолиза отмечается под влиянием интеркуррентных инфекций и после приема лекарств. Клинически отмечается постоянная умеренная бледность кожи, легкая иктеричность, незначительная спленомегалия.
- Острый внутрисосудистый гемолиз.
Возникает у внешне здоровых детей после приема лекарств, реже в связи с вакцинацией, вирусной инфекцией, диабетическим ацидозом.
В настоящее время установлено 59 потенциальных гемолитиков при дефиците глюкозо-6-фосфатдегидрогеназы. К группе лекарственных средств, обязательно вызывающих гемолиз, относятся: противомалярийные препараты, сульфаниламидные препараты, нитрофураны.
Острый внутрисосудистый гемолиз развивается, как правило, через 48-96 ч после приема больным лекарственного препарата, обладающего окислительными свойствами.
Лекарственные препараты, вызывающие гемолиз у лиц с недостаточностью активности глюкозо-6-фосфатдегидрогеназы в эритроцитах
| Препараты, вызывающие клинически выраженный гемолиз | Препараты, в некоторых случаях обладающие гемолитическим действием, но не вызывающие клинически выраженного гемолиза в «нормальных» условиях (например, при отсутствии инфекции) |
Анальгетики и антипиретики | |
| Ацетанилид | Фенацетин, ацетилсалициловая кислота (большие дозы), антипирин, аминопирин, парааминосалициловая кислота |
Противомалярийные препараты | |
| Пентахин, памахин, примахин, хиноцид | Хинакрин (атабрин), хинин, хлорохин (делагил), пириметамин (дараприм), плазмохин |
Сульфаниламидные препараты | |
| Сульфаниламид, сульфапиридин, сульфацетамид, салазо-сульфапиридин, сульфаметоксипиридазин (сульфапиридазин), сульфацил-натрий, сульфаметоксазол (бактрим) | Сульфадиазин (сульфазин), сульфатиазол, сульфамеразин, сульфазоксазол |
Нитрофураны | |
| Фурациллин, фуразолидон, фурадонин, фурагин, фуразолин, нитрофурантоин | |
Сульфоны | |
| Диаминодифенилсульфон, тиазольфон (промизол) | Сульфоксон |
Антибиотики | |
| Левомицетин (хлорамфеникол), новобиоцина натриевая соль,амфотерицин В | |
Туберкулостатические препараты | |
| Натрия параамоносалицилат (ПАСК-натрий), гидразид изоникотиновой кислоты, его производные и аналоги (изониазид, римифон, фтивазид, тубазид) | |
Другие лекарственные препараты | |
| Нафтолы (нафталин), фенилгидразин, толуидиновый синий, тринитротолуол, неосальварсан, налидоксовая кислота (невиграмон) | Аскорбиновая кислота, метиленовый синий, димеркапрол, витамин К, колхицин, нитриты |
Растительные продукты | |
Конские бобы (Vicia fava), вербена гибридная, горошек полевой, папоротник мужской, голубика, черника | |
Выраженность гемолиза варьирует в зависимости от степени недостаточности фермента и дозы принятого препарата.
Клинически во время острого гемолитического криза общее состояние ребенка тяжелое, отмечаются сильная головная боль, фебрильная лихорадка. Кожные покровы и склеры бледно-иктеричные. Печень чаще всего увеличенная и болезненная; селезенка не увеличена. Наблюдаются повторная рвота с примесью желчи, интенсивно окрашенный стул. Типичный симптом острого внутрисосудистого гемолиза — появление мочи цвета черного пива или крепкого раствора перманганата калия. При очень интенсивном гемолизе возможно развитие острой почечной недостаточности и ДВС-синдрома, которые могут привести к летальному исходу. После отмены препаратов, вызывающих криз, гемолиз постепенно прекращается.
- Фавизм.
Связан с употреблением в пищу конских бобов (Vicia fava) или вдыханием цветочной пыльцы некоторых бобовых. Фавизм может возникать при первом контакте с бобами или наблюдаться у лиц, которые ранее употребляли эти бобы, но проявлений болезни не имели. Среди больных преобладают мальчики. Фавизмом чаще заболевают дети в возрасте от 1 до 5 лет, у детей раннего возраста процесс протекает особенно тяжело. Рецидивы заболевания возможны в любом возрасте. Промежуток времени между употреблением конских бобов и развитием гемолитического криза составляет от нескольких часов до нескольких дней. Развитию криза могут предшествовать продромальные признаки: слабость, озноб, головная боль, сонливость, боли в пояснице, животе, тошнота, рвота. Острый гемолитический криз характеризуется бледностью, желтухой, гемоглобинурией, сохраняющейся до нескольких дней.
- Бессимптомная форма.
Лабораторные данные
В гемограмме больных с дефицитом глюкозо-6-фосфатдегидрогеназы выявляют нормохромную гиперрегенераторную анемию различной тяжести. Ретикулоцитоз может быть значительным, в некоторых случаях достигая 600-800 %, появляются нормоциты. Отмечается анизопойкилоцитоз, базофильная пунктация эритроцитов, полихромазия, иногда могут быть видны осколки эритроцитов (шизоциты). В самом начале гемолитического криза, а также в периоде компенсации гемолиза после специальной окраски мазка крови, в эритроцитах можно обнаружить тельца Гейнца-Эрлиха. В период криза, кроме того, отмечается лейкоцитоз со сдвигом лейкоцитарной формулы влево.
Биохимически наблюдается повышение концентрации билирубина за счет непрямого, резкое увеличение уровня свободного гемоглобина плазмы, гипогаптоглобинемия.
В костномозговом пунктате выявляется резкая гиперплазия эритроидного ростка, количество эритроидных клеток может достигать 50-75 % от общего числа миелокариоцитов, обнаруживаются явления эритрофагоцитоза.
Для верификации недостаточности глюкозо-6-фосфатдегидрогеназы в эритроцитах используют методы прямого определения активности фермента в эритроците. Исследование проводят в периоде компенсации гемолиза.
Для подтверждения наследственной природы заболевания активность глюкозо-6-фосфатдегидрогеназы необходимо определить и у родственников больного.
Дифференциальный диагноз
Проводится с вирусным гепатитом, другими ферментопатиями, аутоиммунной гемолитической анемией.
Лечение глюкозо-6-фосфатдегидрогеназы
Необходимо исключить приём лекарственных препаратов, провоцирующих гемолиз. Рекомендуют приём фолиевой кислоты.
При снижении концентрации гемоглобина менее 60 г/л проводят заместительную терапию эритроцитарной массой (требования к качеству и расчёт объёма эритроцитарной массы представлены ниже).
Спленэктомию применяют только при развитии вторичного гиперспленизма, так как операция не приводит к прекращению гемолиза.
 [1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 14 октября 2013;
проверки требуют 7 правок.
Глюкозо-6-фосфат дегидрогеназа (Г6ФД; G6PD) — цитозольный фермент, входящий в пентозофосфатный путь, метаболический путь, обеспечивающий образование клеточного НАДФ-H из НАДФ+. НАДФ-H необходим для поддержания уровня восстановленного глутатиона в клетке, синтеза жирных кислот и изопреноидов. У человека наследственное нарушение активности Г6ФД, или недостаточность глюкозо-6-фосфатдегидрогеназы, приводит к гемолитической несфероцитарной анемии.
Реакция[править | править код]
Основная катализируемая реакция:
D-глюкозо-6-фосфат + NADP+ ↔ D-глюконо-1,5-лактон-6-фосфат + NADPH
Глюкозо-6-фосфатдегидрогеназа — первый фермент пентозофосфатного гликолиза. Основная функция фермента заключается в восстановлении НАДФ до НАДФН, необходимого для перехода окисленного глутатиона (GSSG) в восстановленную форму. Восстановленный глутатион (GSH) требуется для связывания активных форм кислорода (перекисей). Пентозофосфатный гликолиз обеспечивает клетку энергией.
Недостаточность активности фермента снижает энергетические запасы клетки и приводит к развитию гемолиза, тяжесть которого зависит от количества и варианта глюкозо-6-фосфатдегидрогеназы. В зависимости от тяжести дефицита выделяют 3 класса вариантов Г-6-ФД. Дефицит глюкозо-6-фосфатдегидрогеназы сцеплен с Х-хромосомой, наследуется рецессивно. Больные мужского пола всегда гетерозиготны, женского — гомозиготны.
Наиболее важная функция пентозного цикла состоит в обеспечении достаточного образования восстановленного никотинамидадениндинуклеотидфосфата (НАДФ) для превращения окисленной формы глутатиона в восстановленную. Этот процесс необходим для физиологической дезактивации соединений окислителей, таких как перекись водорода, накапливающихся в эритроците. При снижении уровня восстановленного глутатиона или активности глюкозо-6-фосфатдегидрогеназы, необходимого для поддержания его в восстановленной форме, под влиянием перекиси водорода происходит окислительное денатурирование гемоглобина и белков мембраны. Денатурированный и преципитированный гемоглобин находится в эритроците в виде включений — телец Гейнца-Эрлиха. Эритроцит с включениями быстро удаляется из циркулирующей крови либо путём внутрисосудистого гемолиза, либо тельца Гейнца с частью мембраны и гемоглобина фагоцитируются клетками ретикулоэндотелиальной системы и эритроцит приобретает вид «надкусанного» (дегмацит).
Структура[править | править код]
Фермент состоит из 515 аминокислот (молекулярная масса 59,3 кДа). Находится в димерной или тетрамерной форме.
Изоформы[править | править код]
Существует 2 изоформы фермента: короткая и длинная. Короткая считается канонической как наиболее распространённая. Длинная версия отличается вставкой на месте аргинина-257: R → RGPGRQGGSGSESCSLSLGSLVWGPHALEPGEQGGELRRALASSVPR, что приводит к удлинению молекулы с 515 аминокислот до 561 и увеличению молекулярной массы до 63,8 кДа.
Потенциально опасные субстанции[править | править код]
Существует много субстанций, потенциально опасных для людей с дефицитом фермента G6PD, различные варианты ответа организма на введение этих субстанций затрудняет предсказание конкретного ответа у конкретного человека. Среди противомалярийных препаратов, которые могут вызвать острый гемолиз у людей с дефицитом фермента G6PD: primaquine, pamaquine и chloroquine. Имеются данные о том, что другие противомалярийные препараты также могут усугубить недостаточность G6PD, но в значительно более высоких дозах. Сульфаниламиды (sulfanilamide, sulfamethoxazole и mafenide), thiazolesulfone, метиленовый синий и нафталин также не должны использоваться у людей с недостаточностью G6PD, также как и некоторые анальгетики: аспирин, phenazopyridine и acetanilide, а также некоторые не-сульфонные антибиотики (nalidixic acid, nitrofurantoin и фуразолидон). Есть данные о том, что она вызывает гемолитический криз у новорожденных с недостаточностью G6PD.
Ссылки[править | править код]
- Глюкозо-6-фосфатдегидрогеназа (Г6ФД; G6PD).
- Гемолитическая несфероцитарная анемия (недостаточность глюкозо-6-фосфат дегидрогеназы: генетика.
Источник
Относящиеся к этой группе расстройства, среди которых многие обусловливают развитие острых или хронических гемолитических синдромов разной тяжести, составляют относительно новый раздел патологии крови.
Попытки определения начались уже более 20 лет назад при исследовании обмена углеводов и регулирующих его в эритроцитах ферментов. Результатом многочисленных исследований оказалось выделение ряда нозологических форм, характеризующихся некоторыми общими особенностями.
Речь идет о передающихся по наследству гемолитических анемиях, при которых не наблюдается наличие аномальных гемоглобинов, сфероцитов или иммуных факторов, нередко сопровождающихся спленомегалией; однако не всегда удаление селезенки дает положительные результаты.
Энзимопатии всегда определяются отсутствием или сокращением концентрации отдельных ферментов, участвующих в гликолизе эритроцитов. Вот почему они были отнесены в группу, получившую общее название эритроцитных энзимопатий (эритроэнзимопатий, энзимопатических гемолитических анемий, врожденных несфероцитных гемолитических анемий).
В зависимости от пораженного фермента упомянутые синдромы обнаруживаются часто или редко. По данным ВОЗ недостатком глюкозо-6-фосфатдегидрогеназы (G-6-PD) в эритроцитах охвачено примерно 300 млн. населения земного шара, в то время как дефицит иных эритроцитных ферментов, в том числе триозо-фосфат-изомеразы (TPI) — лишь в единичных случаях.
Метаболизм эритроцитов — последствия энзимопатий, недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД)
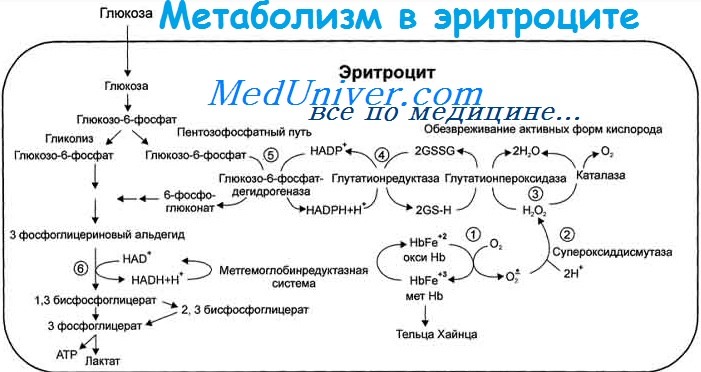
Недостаток глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах
Недостаток глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах — это передающаяся по наследству аномалия, которая проявляется разностепенным сокращением активности Г-6-фД, развитием гемолитических явлений, в основном за счет медикаментов или контакта с химическими веществами окислительного действия, равно как и в других условиях чрезмерной нагрузки функциональных механизмов эритроцитов.
Недостаток глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах был выявлен в результате проведенных в 1950—1960 гг. исследований гемолитической анемии, которая развивалась у отдельных «предрасположенных» лиц при введении им такого противолихорадочного препарата, как примахин.
Способом мечения эритроцитов радиоактивным хромом (Cr51), введенным в гематологическое исследование к тому времени, удалось доказать, что предрасположенность к гемолитическому эффекту примахина следует отнести за счет внутриэритроцитного фактора. К тому же было отмечено, что, у этих больных, гемолитические явления имели самоограничивающий характер и тенденция эритроцитов к гемолизу проявлялась лишь при первом контакте с медикаментом, в дальнейшем приобретая устойчивость к его действию.
В других исследованиях, применявших радиоактивное железо (Fe59) было установлено, что чувствительность эритроцитов к воздействию примахина зависит от их возраста, при этом самые молодые подвергаются наименьшему разрушению.
Результаты этих исследований привлекли внимание на роль ферментов в процессе внутриэритроцитного метаболизма глюкозы, с учетом того факта, что интенсивность гликолиза ослабевает с возрастом эритроцитов.
При этом было также установлено, что у лиц, предрасположенных к воздействию противолихорадочных медикаментов, концентрация восстановленного глютатиона (GSH) в эритроцитах меньше, и что они оказывались неспособными сопротивляться окислительному действию отдельных медикаментов (в том числе и противолихорадочных).
В итоге подробного исследования метаболических путей, в которые вовлекается и восстановленный глютатион удалось определить, что отсутствие Г-6-ФД в эритроцитах или наличие неэффективного изофермента составляет причину развития гемолиза у «предрасположенных» реагировать на примахин.
На протяжении последних 10—15 лет эта энзимопатия подвергалась многочисленным исследованиям, результаты которых естественно привели к прогрессивному изменению концепции о заболевании. Так, сделан вывод о том, что, по существу, недостаток Г-6-ФД в эритроцитах представляет собой ряд разнородных аномалий фермента, а различная степень тяжести клинических проявлений зависит от вида мутации в структурном гене, кодирующем синтез Г-6-ФД.
Определение способа передачи недостатка — посредством половой хромосомы X, на которой находится ген на Г-6-ФД — способствовало проведению сложных генетических исследований с помощью этого нового «маркера» и открыло новые перспективы в области антропологии.
В связи с развитием методологии исследования ферментов до настоящего времени удалось выделить более 100 разновидностей Г-6-ФД.
Вопреки уже точно определенным рамкам заболевания в отношении недостатка Г-6-ФД еще существует ряд недостаточно выясненных аспектов, в частности связанных с механизмом расплавления крови в условиях этого расстройства. Несомненно решение оставшихся проблем внесет новые изменения в концепцию об этой энзимопатии эритроцитов.
Этиология недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД)
Недостаток глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) определяет одна из многочисленных аномалий поражающих ген который управляет процессом синтеза соответствующего фермента путем кодирования, включенных в молекулу Г-6-ФД аминированных кислот. Происходящие при этом сдвиги в гене способствуют:
а) синтезу малого количества нормальных молекул;
б) синтезу молекул с небольшим сродством к соответствующему субстрату;
в) синтезу молекул ферментов меньшей стойкости, чем нормальные;
г) синтезу молекул, в которых наблюдаются совмещенные альтерацион-ные изменения.
Одним из более общих ферментов это так называемый вид В. Он выявляется чаще всего среди всех изученных до сих пор групп населений. Другой относительно часто выявляемый фермент это вид А, который отличается от вида В замещением лишь одной аминокислоты.
Дефицит чаще наблюдаемый у кавказскоподобного населения обусловлен ферментом М (средиземноморским), в то время как у цветного населения — ферментом А.
Каждый вид фермента характеризуется по определенной группе критериев: эритроцитная активность (выражается в единицах активности ферментов микромолями субстрата, преобразованного за минуту ферментом эритроцитов, которые по количеству соответствуют 1 г гемоглобина); постоянная Michaelis (наименьшая концентрация субстрата, при которой фермент действует без какой-либо утраты эффективности); электрофоретическая подвижность; оптимальный рН; тепловая устойчивость; способность использовать иные субстраты; сродство к специфическому субстрату.
Разновидность М характеризуется весьма слабой активностью, в то время как у варианта А она составляет 5—15% нормы. Иные виды изоферментов Г-6-ФД располагают другой активностью, при этом некоторые из них, по меньшей мере в пробирке больше, чем в нормальной клетке.
Генетические факторы недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД)
Ген Г-6-ФД расположен на хромосоме X, по соседству с генами, характеризующими ряд аномалий, таких как, альбинизм радужной оболочки, мышечную дистрофию Duchenne, ихтиоз ладони и ступни — расстройства, с которыми недостаток Г-6-ФД сочетается лишь в очень редких случаях.
Следовательно, передача дефицита осуществляется «в связи с полом» — от матери к сыну, что значительно упростило генетические исследования при этом заболевании.
Поскольку одна хромосома X женщин неактивна в генетическом плане (факт, доказанный тем, что, вопреки наличию двух хромосомов X белки, характеризуемые генами этих хромосом, в одинаковом количестве с отмечаемыми у мужчин) у гетерозиготных в отношении Г-6-ФД популяция эритроцитов состоит из одной нормальной и другой дефицитной частей.
Пропорция нормальных и патологических эритроцитов значительно колеблется, а в связи с этим и клиническое проявление обусловливаемых недостатком Г-6-ФД нарушений. Вариабильность интенсивности нарушений у женщины с недостатком Г-6-ФД в эритроцитах затрудняет выявление всех случаев гетерозиготизма в отношении этой энзимопатии.
Средовые факторы недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД)
Высокий показатель частоты недостатка Г-6-ФД в отдельных областях земного шара (средиземноморский бассейн, Западная Африка, Юго-Восточная Азия), равно как и относительно общее, для этих областей, его сочетание с талассемией и сиклемией, побудило мысль о том что этот дефицит, как и при сиклемии, может ассоциироваться с преимуществом в частности в отношении варианта, вызванного паразитом тропической малярии (Plasmodium falciparum).
Об этом видимо свидетельствуют статистические данные, касающиеся малярии и недостатка Г-6-ФД в эритроцитах в отдельных областях, равно как и ряд экспериментальных исследований развития протозоя в эритроцитах с недостатком Г-6-ФД.
— Также рекомендуем «Клиника недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах»
— Вернуться в раздел «гематология»
Оглавление темы «Талассемии»:
- Талассемические синдромы — история изучения, классификация
- бета-Талассемия (анемия Кули) — причины, классификация
- Клиника бета-талассемии — признаки
- Лабораторная диагностика бета-талассемии — анализы
- Механизмы развития бета-талассемии — патофизиология
- Течение бета-талассемии (анемии Кули) — осложнения
- Лечение бета-талассемии — анемии Кули
- а-Талассемия — причины, диагностика, классификация
- Легкие талассемические и талассемическоподобные синдромы: дельта- и гамма-талассемии, синдром Lepore
- Анемии вследствие энзимопатий: недостаток глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах
Источник