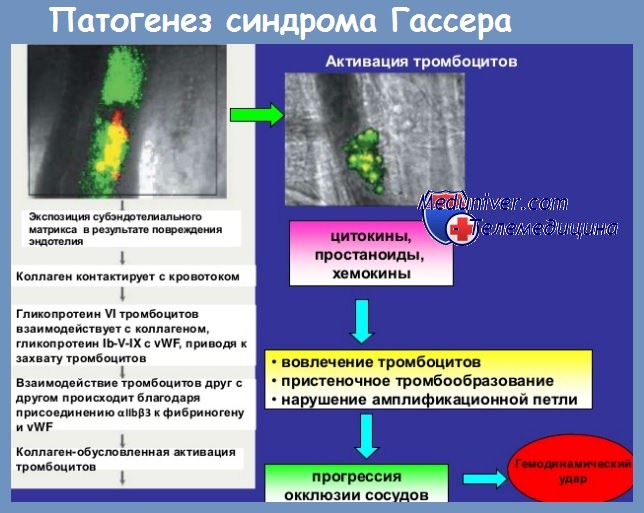
Анемия тромбоцитопения острая почечная недостаточность

КАТЕГОРИИ:

Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Геморрагический синдром при тромбоцитопениях и тромбоцитопатиях.
Он провоцируется вирусными и бактериальными инфекциями, лекарственными препаратами (салицилаты, сульфаниламиды, антибиотики и др.) физическими и психическими перегрузками, профилактическими прививками.
Клиника: Кровоизлияния в кожу характеризуются полиморфностью, полихромностью, асимметричностью, чаще спонтанным возникновением ночью. Кровотечения носовые, десневые, маточные, почечные, кровоизлияния в головной мозг, сетчатку глаза.
Диагностика: тромбоцитопения, нарушение агрегации тромбоцитов, снижение ретракции кровяного сгустка, изменение морфологии тромбоцитов.
Неотложная помощь:
1. Принять меры для остановки местного кровотечения и госпитализировать в гематологическое отделение.
2. Ввести 5 % раствор Е-АКК 0,1-0,2 г/кг/сут в/в струйно медленно или капельно.
3. Ввести дицинон 12,5 % в дозе 10-15 мг/кг/сут или 0,025 % раствор адроксона (5-10 мг/кг) в/в или в/м.
4. При носовом кровотечении тампонада носовых ходов (5 % Е АКК 50 мл + 2 мл 0,025 % адроксон + ампула тромбина).
5. При маточном кровотечении: прегнин 0,01 2 раза в сутки/сутки под язык или 0,05 % раствор фолликулина 1,0 1 раз в день в/м или 1 % раствор прогестерона по 1,0 мл 1 раз в день в/м.
Острая почечная недостаточность – неспецифический синдром, развивающийся в результате транзиторной или необратимой утраты гомеостатических функций почек, обусловленной в большинстве случаев гипоксией почечной ткани с последующим преимущественным повреждением канальцев и отеком интерстициальной ткани.
Основным клиническим проявлением ОПН является олигурия – диурез менее 1/3 от нормального или менее 300 мл/м2 поверхности тела за сутки, т.е. 10-12 мл/кг в сутки или менее 0,5 мл/кг в час. Для детей в возрасте от 7 дней до 3 месяцев олигурией является уменьшение диуреза менее 1 мл/кг в час.
Наиболее частые причины развития ОПН:
1. Нарушения реологических свойств крови, блокада микроциркуляции (гемолитико-уремический синдром (ГУС), шок), которые приводят к ишемии почечной ткани.
2. Гиповолемия различного генеза.
Органические изменения почечной ткани возникают при артериальной гипотензии <60 мм рт.ст. в течение 2ч. и более.
3. Гипоксия (респираторного генеза), на фоне которой органические нарушения в почках возникают при гипоксемии (РО2<50 мм рт.ст.) или гиперкапнии (РСО2>90 мм рт.ст.) в течение 8-12 ч.
4. Поступление (или эндогенное образование) нефротических ядов и лекарственных средств–ртути, пестицидов, витамина Д, лейкотоксинов и др.
Особенностью течения синдрома ОПН является его цикличность с возможностью полного восстановления функций почек. Этиологические особенности проявляются только в самой начальной стадии .
Стадии ОПН:
1. Начальная (преданурическая – функциональная почечная недостаточность) клинически определяется заболеваниями которые привели к ОПН, поражение почек проявляется через 1-2 дня снижением диуреза. Повышения в крови азотистых шлаков, калия не наблюдается.
2. Олигоанурическая стадия, наряду с резким снижением диуреза (менее 25 % нормы при низкой относительной плотности мочи – 1,005-1,008), характеризуется прогрессирующим ухудшением состояния больного, появлением бледности с иктеричным оттенком, реже гемморагий, головной боли, слабости, тошноты, рвоты, тахикардии, шумной одышки – следствие метаболического ацидоза и токсемии, судорог, отека легких. Нарастает анемия, возможна тромбоцитопения. Клинические проявления азотемии – беспокойство, кожный зуд, тошнота, рвота, анорексия, расстройство сна, стоматиты, колиты, гастриты. Бывают выражены признаки гиперкалиемии (мышечная слабость, аритмии, остановка сердца), задержка жидкости в организме (отеки, гипертензия, увеличение сердца, ритм галопа, отек легких и др.). При отсутствии лечения наступает кома и смерть.
3. Стадия восстановления диуреза наступает при восстановлении проходимости канальцев. Характеризуется увеличением диуреза, улучшением состояния больного. Функции реабсорбции и секреции не восстановлены, через 1-2 дня развиваются гипо- и изостенурия, снижение уровня электролитов (K, Na, Mg, Ca). Полиурия до 10 литров в сутки. Еще долго сохраняются анемия, астенический синдром. На этот период приходится 37 % всех летальных исходов ОПН (80 % из них – от вторичной инфекции). У всех больных имеется инфекция мочевых путей. Продолжительность полиурической стадии от нескольких дней до нескольких месяцев.
4. Стадия выздоровления продолжается до 2 лет. Хроническая инфекция мочевыводящих путей, как правило, наблюдается долго.
Диагноз. ОПН подтверждается следующими лабораторными исследованиями: в крови обычно анемия, ускоренная СОЭ, азотемия – остаточный азот более 30 ммоль/л, азот мочевины более 7,0 ммоль/л, креатинина более 0,1 ммоль/л, гиперкалиемия более 6 ммоль/л, гипокальциемия менее 2 ммоль/л, гиперфосфатемия более 1,8 ммоль/л, гипермагниемия более 2 ммоль/л, гипохлоремия менее 95 ммоль/л, декомпенсированный метаболический ацидоз (ВЕ > 10 ммоль/л).
Лечение. Зависит от периода ОПН.
В преданурическом периоде в основе лечения – воздействие на этиологический фактор, восстановление ОЦК, снятие периферического вазоспазма, устранение гипоксии. В течение 30 мин. внутривенно капельно вводят раствор 0,9 % хлорида натрия и 10 % раствор глюкозы с инсулином в дозе 20 мл/кг. При условии, что на подобную водную нагрузку достаточный ответ получен не был, можно внутривенно ввести 20 % раствор маннитола, из расчета 0,2-0,4 г/кг массы тела (сухого вещества). При гиповолемии фуросемид опасен, но в то же время он стимулирует диурез при сердечной недостаточности (2 мг/кг внутривенно). При отсутствии эффекта через 2 часа фуросемид вводят внутривенно в двойной дозе (суточная доза может достигать 5-10 мг/кг). Необходимо отметить, что лазикс, являясь салуретиком, в то же время улучшает микроциркуляцию в паренхиме почек. В дальнейшем продолжают инфузию, избегая растворов, содержащих К+.
Если была диагностирована III стадия ДВС-синдрома возможно переливание свежезамороженной плазмы в объеме 10 мл/кг. Гепаринотерапию проводят внутривенно капельно в дозе 15 ЕД/кг/час. Если время свертывания крови по Ли-Уайту через 6 часов не удлинняется до 20 мин., то дозу увеличивают до 30-40 ЕД/кг/час, если же оно свыше 20 мин., то дозу уменьшают до 5-10 ЕД/кг/час. Отмену гепарина проводят постепенно, уменьшая дозу в течение 1-2 суток во избежание рикошетного синдрома и гиперкоагуляции.
При тромбозах крупных сосудов почек назначают тромболитики – урокиназу в дозе 200 ЕД/кг/час в течение суток при небольших тромбах, а у новорожденных в дозе 400 ЕД/кг/час в течение 24-78 ч.
Олигоанурический период.
Показания к экстренному диализу: анурия свыше суток, уровни в сыворотке крови: мочевины – более 24 ммоль/л, калия – более 6,5-7 ммоль/л, фосфора – более 2,6 ммоль/л, рН крови – менее 7,2 и дефицит оснований более 10 ммоль/л, а так же суточный прирост в плазме крови мочевины – более 5 ммоль/л, калия – более 0,75 ммоль/л, креатинина – более 0,18 ммоль/л, гипонатриемия (менее 120 ммоль/л), отек легких или мозга. Как показание к диализу достаточно двух признаков.
Диета. Необходимо ограничение белка,Na, K, P. Количество белка в сутки – 0,6 г/кг, углеводов – 18-20 г/кг. Молоко ограничивают из-за высокого содержания фосфора. Возможно использование диеты Джиордано-Джиованетти. Суточный калораж 300 ккал/м2.
Объем вводимой жидкости. При гипонатриемии суточное количество жидкости равно300-400 мл/м2 (у новорожденных вдвое больше) + вчерашний диурез и патологические потери (со стулом, рвотами) – планируемые потери массы тела за сутки. Используются глюкозо-солевые растворы и (1/5 от этого – коллоидные).
Для коррекции метаболического ацидоза используют 2 % раствор гидрокарбаната натрия внутрь (0,12 г/кг сухого вещества), 4 % гидрокарбаната натрия капельно внутривенно – ВЕ (ммоль/л) х m (кг) х 0,3 (в сутки).
При азотемии обязателен туалет слизистых ротовой полости,
высокие сифонные клизмы с 1 % р-ром NaCl, внутрь энтеросорбент.
При гиперкалиемии показано внутривенное введение глюконата кальция 10 % р-р 2 мл/кг, 20 % р-р глюкозы с инсулином, осмотические слабительные (сорбитол, ксилит).
Учитывая высокую частоту наслоения инфекций показано назначение антибиотиков.
Диуретики в олигоанурическую стадию применяют в минимальной дозировке для того, чтобы выяснить ответную реакцию почек и не более 1 раза в сутки.
Кровозаменители и белковые препараты при анурии противопоказаны.
Главным в лечение и полиурической стадии ОПН являются поддержание баланса воды и электролитов (для чего нужен тщательный мониторинг ВЭБ) и постепенное увеличение пероральной белковой нагрузки.
В период выздоровления показана фитотерапия, при интеркуррентных заболеваниях желательно ограничиться минимальной фармакотерапией.
Диспансерное наблюдение осуществляется в течение 2 лет.
Дата добавления: 2014-11-25; Просмотров: 712; Нарушение авторских прав?; 
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Рекомендуемые страницы:
Источник
Тромбоцитопения при гемолитическом уремическом синдроме (синдром Гассера) — клиника, диагностикаСиндром Гассера появляется в основном в раннем детстве и по своему клиническому острому характеру подобен тромботической тромбоцитопенической пурпуре и при этом детерминируется также ДВС. Описанный Гассером в 1955 г., он повидимому становится более частым, так как до недавнего прошлого насчитывалось 500 случаев (Brain). С точки зрения этиопатогенеза синдром Гассера кажется острым заболеванием, имеющим характер ДВС по поводу иммунных комплексов или другого механизма, который создает синдром, подобный явлению Санарелли-Шварцманна. Повидимому коагуляция происходит по поводу первоначальных микроангиопатических поражений по поводу иммунных комплексов после вирусной инфекции или из-за других микроорганизмов (Mettler, Glascow и Balduzzi). В клиническом плане, после инфекции, обычно дыхательных путей, появляются серьезные симптомы тромботической тромбоцитопенической пурпуры с сильной лихорадкой, анемией, пурпурой, поражениями в центральной нервной системе и добавочно явления острой почечной недостаточности. В своей характерной форме, болезнь поражает детей в возрасте между 6 и 12 месяцами, но и старше, однако встречается довольно редко в возрасте старше 6 лет.
Лабораторные тесты показывают альтерации, как и при тромботической тромбоцитопенической пурпуре, от которой данная болезнь отличается с трудом, за исключением высокой поражаемости у детей, иногда в очень опасной форме благодаря почечной недостаточности, в особенности когда болезнь сопровождается и артериальной гипертензией, что бывает в 50% случаев. В одном случае, находившимся под нашим наблюдением, — речь идет о девочке 12 лет — после вирусной инфекции появился тяжелый сложный синдром с тромбоцитопенической пурпурой и геморрагиями, гемолитической анемией с понижением Hb до 3 г, нервными поражениями с локализацией верхне-правой моноплегии; в последующие дни, артериальная гипертензия и тяжелая почечная недостаточность с уремией. После короткой ремиссии, при которой церебральные и почечные симптомы смягтились, у девочки возникли острые приступы тяжелого гемолиза и тромбоцитопения с пурпурой. Кортикотерапия в дозах 100 мг/день и гепаринотерапия оказали слабое воздействие на эволюцию болезни: тромбоциты поднялись лишь до 30 000. Спленектомиюя, произведенная под кортикотерапией дала блестящую ремиссию и окончательное излечение без рецидив в течение 6-летнего надзора. В качестве лечения рекомендуется в первую очередь срочное лечение почечной недостаточности, прибегая даже к искусственной почке, затем массивная кортикотерапия и гепаринотерапия. Смертность, доходившая ранее до 30—35%, понизилась до 5%, однако у половины случаев появляется позже эволюция к хроническому громерулонефриту, даже спустя несколько лет, как это продемонстрировали Gianantonio и сотр. на 78 больных, находившихся под наблюдением долгое время. — Читать далее «Тромбоцитопеническая пурпура по поводу изоиммунизации — клиника, диагностика» Оглавление темы «Тромбоцитопеническая пурпура»:
|
Источник
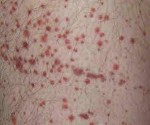
Гемолитико-уремический синдром — острое патологическое состояние, характеризующееся одновременным развитием микроангиопатической гемолитической анемии, тромбоцитопении и азотемии. Гемолитико-уремический синдром может проявляться кровавой диареей, абдоминальными болями, бледностью и иктеричностью кожи и склер, пастозностью лица, петехиями на коже, анурией, поражением ЦНС, печени, поджелудочной железы и сердца. Диагноз гемолитико-уремического синдрома основан на характерных клинических признаках, результатах общего и биохимического анализа крови и мочи, коагулограммы, бакпосева кала. Лечение гемолитико-уремического синдрома включает патогенетическую, симптоматическую и заместительную терапию.
Общие сведения
Гемолитико-уремический синдром (болезнь Гассера) – тяжелое полиэтиологическое расстройство, проявляющееся сочетанием неиммунной гемолитической анемии, тромбоцитопении и острой почечной недостаточности. Гемолитико-уремический синдром наблюдается преимущественно у детей грудного и младшего возраста (с 6 мес. до 4 лет), но также встречается у детей старшего возраста и редко у взрослых. Ежегодно в расчете на 100 тыс. детского населения регистрируются 2-3 случая гемолитико-уремического синдрома у детей до 5 лет и 1 случай у детей до 18 лет. Поскольку гемолитико-уремический синдром — одна из частых причин острой почечной недостаточности у детей, то от своевременности его диагностики и лечения зависит исход заболевания.
Гемолитико-уремический синдром
Классификация гемолитико-уремического синдрома
В зависимости от этиологии и клинических особенностей разделяют гемолитико-уремический синдром диареяассоциированный — Д+ (типичный) и не ассоциированный с диареей — Д- (спорадический или атипичный). Д+ гемолитико-уремический синдром чаще встречается у детей раннего и младшего возраста, является эндемическим (распространен в Поволжье, Московском регионе); недиарейный – более свойственен детям старшего возраста и взрослым.
По тяжести течения выделяют легкую и тяжелую формы гемолитико-уремического синдрома. Легкая форма гемолитико-уремического синдрома подразделяется на тип А (анемия, тромбоцитопения и азотемия) и тип Б (триада симптомов в сочетании с судорожным синдромом или артериальной гипертензией); тяжелая – на тип А (триада симптомов в сочетании с анурией длительностью более суток) и тип Б (триада симптомов в сочетании с анурией, артериальной гипертензией и судорожным синдромом).
Причины гемолитико-уремического синдрома
У детей частыми причинами гемолитико-уремического синдрома являются острая кишечная инфекция (90%) и инфекции верхних дыхательных путей (10 %).
Основное значение в развитии Д+ гемолитико-уремического синдрома имеет энтерогеморрагическая Е. coli, продуцирующая специфический шига-подобный веротоксин, способный избирательно повреждать эндотелиальные клетки сосудов почек и головного мозга. Наибольшее сродство веротоксина с эндотелием капилляров почек наблюдается у детей первых 3 лет жизни. Веротоксин вызывает эндотелиальный апоптоз и лейкоцитозависимое воспаление, а также запускает цепь патологических реакций, приводящих к гемолизу эритроцитов, агрегации и деструкции тромбоцитов, локальной активации процесса коагуляции и внутрисосудистого отложения фибрина, развитию ДВС-синдрома. Такими же свойствами обладает шигатоксин S. dysenteriae I типа. Развивающиеся микроциркуляторные нарушения (микроангиопатическая гемолитическая анемия, тромбоцитопения и микротромбозы) приводят к ишемическим изменениям в органах мишенях. При гемолитико-уремическом синдроме на фоне ОКИ наиболее часто поражаются капилляры клубочков почек, что может приводить к снижению скорости гломерулярной фильтрации, ишемии или некрозу клубочков, вторичной дисфункции или некрозу почечных канальцев, при массивном поражении – к ОПН.
Заражение энтерогеморрагической Е. coli может произойти при контакте с животными (кошками, крупным рогатым скотом) или инфицированным человеком; употреблении недостаточно термически обработанных мясных изделий, непастеризованных молочных продуктов, фруктовых соков, загрязненной воды. Для гемолитико-уремического синдрома характерна сезонность: на фоне ОКИ — преимущественно теплое время года (июнь-сентябрь), на фоне вирусных инфекций — зимне-весенний период.
Д- гемолитико-уремический синдром может быть постинфекционным, лекарственным, поствакцинальным, наследственным, связанным с системными заболеваниями соединительной ткани, идиопатическим. В 40% случаев развитие Д- гемолитико-уремического синдрома обусловлено респираторной инфекцией, возбудителем которой является S. pneumoniae, разрушающий мембраны эритроцитов, тромбоцитов и эндотелиоцитов с помощью фермента нейраминидазы. Вирусы ветряной оспы, ВИЧ, гриппа, Эпштейна-Барра, Коксаки также могут быть причиной гемолитико-уремического синдрома.
Установлена связь между развитием гемолитико-уремического синдрома у взрослых и употреблением некоторых медикаментов (циклоспорина А, митомицина С, эстроген — содержащих контрацептивов, противоопухолевых препаратов), трансплантацией костного мозга, злокачественными новообразованиями, системной красной волчанкой и антифосфолипидным синдромом, беременностью. Выявлены семейные случаи гемолитико-уремического синдрома с аутосомным типом наследования обусловленные дефектом системы комплемента, нарушением обмена простациклина, недостаточностью антитромботических факторов и др.
В основе гемолитико-уремического синдрома может лежать активация тромбоцитов иммунными комплексами (например, комплексом антиген – антитело после прививок живыми вакцинами против полиомиелита, против ветряной оспы, против кори, АКДС).
Симптомы гемолитико-уремического синдрома
В клинической картине гемолитико-уремического синдрома различают продромальный период, разгар заболевания и восстановительный период. Продолжительность продромального периода составляет от 2 до 7 суток. Для него характерно появление признаков поражения ЖКТ или дыхательных путей.
Гемолитико-уремический синдром на фоне ОКИ, вызванной энтеропатогенной Е. coli, имеет ярко выраженную симптоматику. Развиваются симптомы гастроэнтерита или колита (часто кровавая диарея), тошнота, рвота, абдоминальные боли, лихорадка. Постепенно общее состояния ребенка ухудшается, повышенная возбудимость сменяется вялостью.
В период разгара гемолитико-уремического синдрома превалируют проявления гемолитической анемии, тромбоцитопении и ОПН: бледность и иктеричность кожного покрова, склер и слизистых оболочек; пастозность век, голеней; кожный геморрагический синдром в виде петехий или экхимозов, иногда — носовые кровотечения, в тяжелых случаях — снижение диуреза (олигурия или анурия). Тяжесть и продолжительность дизурии зависит от степени и глубины повреждения почек.
Гемолитико-уремический синдром может проявляться полиорганной патологией: поражением ЦНС, печени, поджелудочной железы, сердца, артериальной гипертензией. В 50% случаев гемолитико-уремического синдрома наблюдаются неврологические нарушения: подергивания мышц, гиперрефлексия, децеребрационная ригидность, гемипарезы, судороги, ступор, кома (особенно выраженные у детей первых лет жизни). Выявляются гепатоспленомегалия, кардиомиопатия, тахикардия, аритмия.
В самых тяжелых случаях возможно легочное кровотечение, развитие отека легких, синдрома «ригидного легкого», сердечно-легочной недостаточности, отека головного мозга. Поражение ЖКТ может проявляться эзофагитом, энтероколитом, гепатитом, панкреатитом, а также некрозом, перфорацией, инвагинацией кишечника.
Продолжительность гемолитико-уремического синдрома обычно составляет 1-2 недели, затем наступает стабилизация и в 70% случаев — постепенное восстановление нарушенных функций: улучшение выделения мочи, повышение уровня тромбоцитов, нормализация уровня гемоглобина. При тяжелом течении наступает либо летальный исход вследствие экстраренальных поражений, либо формирование ХПН.
Диагностика гемолитико-уремического синдрома
Диагноз гемолитико-уремического синдрома основан на выявлении характерных клинических признаков, осложняющих течение ОКИ или ОРВИ: гемолитической анемии, тромбоцитопении, ДВС-синдрома, азотемии.
При гемолитико-уремическом синдроме в крови обнаруживаются анемия, анизоцитоз и полихроматофилия эритроцитов (наличие фрагментированных форм), присутствие свободного гемоглобина, снижение количества тромбоцитов, лейкоцитоз, умеренная непрямая гипербилирубинемия, возрастание уровня мочевины и креатинина, гипонатриемия, гиперкалиемия, ацидоз (в олигоанурической стадии ОПН), гипоальбуминемия.
Моча приобретает коричневато-ржавый цвет, в ней могут появиться фибриновые комки, отмечается гематурия, протеинурия, гемоглобинурия. У детей с ОКИ выполняют бактериологическое исследование кала на выявление штаммов энтеропатогенной Е. coli. При тяжелых неврологических нарушениях возможно проведение КТ головного мозга и люмбальной пункции для исключения кровотечения и менингита.
Дифференциальная диагностика гемолитико-уремического синдрома проводится с неотложными хирургическими состояниями (аппендицитом, кишечной непроходимостью, окклюзией мезентериальных сосудов, перфорацией кишечника, дивертикулом подвздошной кишки), ишемическим колитом, септицемией с ДВС-синдромом, вирусным или бактериальным гастроэнтеритом, тяжелой степенью дегидратации при кишечных токсикозах, тромботической тромбоцитопенией.
Лечение гемолитико-уремического синдрома
Лечение гемолитико-уремического синдрома определяется периодом развития заболевания и тяжестью поражения почечной ткани. Чем раньше ребенок с гемолитико-уремическим синдромом поступает в стационар, тем выше вероятность его успешного и полного излечения. Патогенетическая терапия включает нормализацию агрегатного состояния крови с использованием антиагрегантов, гепаринотерапии; улучшение микроциркуляции (трентал, эуфиллин); коррекцию антиоксидантного статуса (витамины А и Е).
При бактериальной этиологии гемолитико-уремического синдрома назначаются антибиотики широкого спектра действия; при инфекции, вызванной энтеропатогенной Е. coli, прием антибиотиков и препаратов, замедляющих моторику кишечника, не рекомендуется. При олигоанурии показана коррекция водно-электролитных расстройств, подавление реакций метаболического распада и инфекционного процесса. Для коррекции тяжелой анемии используется инфузия эритроцитарной массы.
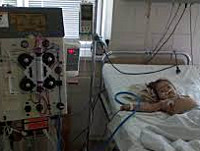
В половине случаев типичного гемолитико-уремического синдрома необходимо раннее проведение заместительной терапии: обменного плазмафереза, перитонеального диализа или гемодиализа. Гемодиализ проводится ежедневно в течение всего олигоуремического периода. В случае развития терминальной стадии ХПН показана трансплантация почки.
Прогноз гемолитико-уремического синдрома
Гемолитико-уремический синдром имеет серьезный прогноз, летальность у маленьких детей во время острой фазы заболевания составляет 3-5%, у 12% развивается терминальная ХПН, у 25% происходит снижение клубочковой фильтрации. Плохой прогноз имеют атипичные наследственные, аутоиммунные и связанные с беременностью формы гемолитико-уремического синдрома.
Классическая форма гемолитико-уремического синдрома у детей раннего возраста с преимущественным поражением почечных клубочков протекает более благоприятно. В случае Д+ гемолитико-уремического синдрома наблюдается лучший исход по сравнению с недиарейным синдромом, сопровождающимся частыми рецидивами и высокой летальностью.
Источник