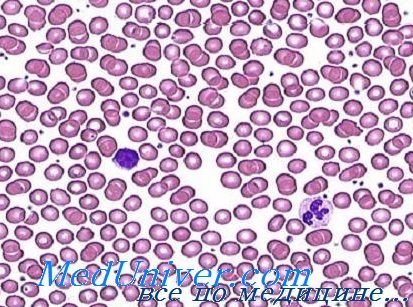
Анемия при раке поджелудочной железы

Анемия представляет собой патологическое состояние, для которого характерно снижение эритроцитов и/или концентрации гемоглобина в единице объема крови. Анемия не является самостоятельным заболеванием, это симптом, который характерен для самых разнообразных заболеваний, в том числе и для злокачественных опухолей.
Согласно статистике, данное состояние выявляется у каждого третьего онкологического пациента, а при прохождении химиотерапии — более чем в 90% случаев. Опасность анемии в онкологии заключается в том, что вместе с уменьшением уровня гемоглобина и эритроцитов, уменьшается и кислородная емкость крови. Этот фактор неблагоприятно сказывается на течении ракового процесса, снижает эффективность лечения и ухудшает дальнейший прогноз.
Основные причины развития анемии у онкологических пациентов
Снижение уровня эритроцитов и гемоглобина может развиваться вследствие снижения их образования, ускоренного разрушения или в результате потери. Каждой из этих причин способствуют собственные факторы, которые рассмотрим подробнее:
- Недостаточная выработка форменных элементов крови и гемоглобина может развиваться при поражении костного мозга, недостатке железа в организме или некоторых витаминов (фолиевая кислота, витамин В12). Данные состояния могут быть напрямую связаны с напрямую с онкологическим заболеванием. Например, потеря железа может развиваться в результате постоянной рвоты, отсутствия аппетита и нарушения его всасывания в кишечнике, который поражен опухолевым процессом. Некоторые виды препаратов, которые назначают при злокачественных опухолях, подавляют рост не только раковых клеток, но и клеток крови, которые активно делятся. Также анемия может развиваться при непосредственном поражении костного мозга опухолевым процессом.
- Ускоренное разрушение эритроцитов отмечается при воздействии различных лекарственных препаратов и при аномальной активности иммунной системы. Разрушение эритроцитов непосредственно в сосудах называется внутрисосудистым гемолизом. Этот процесс протекает в норме после завершения жизненного цикла эритроцитов, который составляет 120 дней. Однако при воздействии различных факторов (прием антибиотиков, цитостатиков, присоединение вторичной инфекции и др.), этот срок значительно уменьшается, что и приводит к развитию анемии.
- Кровопотеря у онкологических пациентов может быть как острой, так и хронической. Первый вариант встречается при проведении хирургического лечения рака, а также при развитии внутренних кровотечений, которые являются частым осложнением основного заболевания. Развитие анемии при хронической кровопотере отмечается в тех случаях, когда имеется скрытый источник незначительного кровотечения. Например, при колоректальном раке кровь может выделяться с калом незаметно для пациента.
Установление точной причины анемии играет решающее значение при выборе метода лечения. Кроме того, врач учитывает степень тяжести, тип анемии, общее состояние пациента и другие параметры. Получить эту информацию можно на диагностическом этапе.
Запись
на консультацию
круглосуточно
Как выявить анемию
Обследование традиционно начинается с опроса пациента и сбора анамнеза. Врач должен помнить, что не всегда анемия развивается вследствие основного заболевания. Возможны наследственные или любые другие причины, которые не связаны с опухолевым процессом. Также необходимо установить вид предшествующего противоопухолевого лечения, продолжительность и количество курсов, наименование препаратов, которые применялись. На следующем этапе врач проводит общий осмотр. Анемия может проявляться бледностью кожных покровов, слабостью, потерей аппетита, головокружением и другими симптомами. Очень часто эти проявления отмечаются при различных видах рака, который протекает без анемии, поэтому поставить диагноз исходя только из жалоб пациента невозможно.
Объективную информацию можно получить только при помощи лабораторных исследований. Анемия диагностируется по следующим анализам:
- Количество ретикулоцитов.
- Уровень железа сыворотки крови.
- Уровень белка трансферрина и ферритина.
- Уровень витамина В12 и фолиевой кислоты.
Отдельное внимание уделяется общему анализу крови. В нем определяется уровень гемоглобина, количество эритроцитов и гематокрит (отношение форменных элементов к жидкой составляющей крови). Также определяют средний объем эритроцита, среднее содержание гемоглобина в эритроците и среднее содержание гемоглобина во всей эритроцитарной массе.
При необходимости в программу комплексного обследования при анемии могут включаться и другие лабораторные анализы или специальные методы.
Как классифицируется анемия
В зависимости от значения цветового показателя, степени тяжести и механизма развития, анемия разделяется на несколько категорий. Цветовой показатель крови отражает степень насыщения эритроцитов гемоглобином. Его значение в норме колеблется от 0,85 до 1,05 единиц. Снижение показателя отмечается при гипохромной анемии, а повышение — при гиперхромной. Если цветовой показатель в норме, но уровень гемоглобина все равно низкий, то говорят о нормохромной анемии.
По степени тяжести, анемия разделяется на три группы, в зависимости от концентрации гемоглобина:
- При легкой степени анемии уровень гемоглобина не опускается ниже отметки в 90 г/л.
- При средней степени анемии показатель колеблется в пределах 90-70 г/л.
- Тяжелая анемия характеризуется падением гемоглобина ниже 70 г/л.
Классификация анемии по механизму развития наиболее обширна. Среди распространенных форм отмечаются:
- Железодефицитная анемия. Развивается в результате нарушения всасывания, усиленной потери или недостаточного поступления железа в организм.
- Гемолитическая анемия. Характеризуется разрушением эритроцитов в сосудистом русле или за его пределами. Наиболее частые причины — недостаточность специфических ферментов, аутоиммунные заболевания, воздействие лекарственных препаратов.
- Постгеморрагическая анемия. Данное состояние характерно для острой или хронической кровопотери
- Апластическая анемия. Характеризуется снижением уровня клеток-предшественников эритроцитов в костном мозге. Обычно отмечается снижение и других форменных элементов — тромбоцитов и лейкоцитов.
- В12-дефицитная анемия. При недостатке витамина В12 нарушается процесс образования эритроцитов, снижается их продолжительность жизни. Дефицит витамина может быть связан как с нарушением его всасывания в кишечнике, так и с недостаточным поступлением в организм.
В большинстве случаев определить точный вид анемии можно после нескольких лабораторных тестов, но иногда приходится применять более сложные методы диагностики, например, генетическое исследование. Понимание механизма развития анемии и получение максимально полной информации об изменениях в показателях крови являются важным компонентом эффективной терапии данного симптома.
Методы лечения анемии
Устранить анемию у онкологических пациентов можно тремя способами: переливание эритроцитарной массы, введение эритропоэтина, назначение препаратов, содержащих железо. В отдельных случаях может применяться комбинация этих методов.
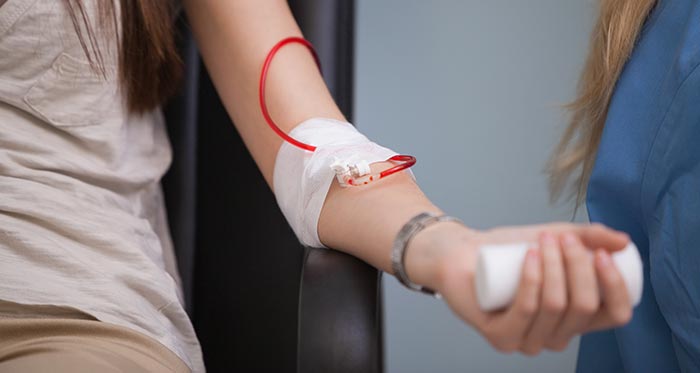
Переливание эритроцитарной массы при анемии
Переливание эритроцитарной массы является самым действенным методом, при помощи которого можно быстро восполнить дефицит эритроцитов, восстановить уровень гемоглобина и гематокрита. Однако без устранения причины анемии, этот способ даст лишь временный эффект. Поэтому переливание эритроцитарной массы не является альтернативой другим методикам и применяется только при наличии показаний. Одним из них является снижение уровня гемоглобина ниже 90 г/л. Переливание проводят при развитии у пациента характерных признаков анемии, среди которых отмечаются:
- Головокружение.
- Потеря сознания.
- Тахикардия.
- Быстрая утомляемость.
- Боль в груди.
- Одышка.
Данный метод лечения анемии также может применяться у пациентов, которые прошли курс химиотерапии или лучевой терапии и у которых отмечается быстрое снижение уровня гемоглобина или эритроцитов.
Применение стимуляторов эритропоэза
Стимуляторы эритропоэза при анемии увеличивают концентрацию гемоглобина и эритроцитов за счет усиления их образования в костном мозге. При сочетании с гемотрансфузиями, данный метод показывает очень хорошие результаты, но при этом имеет и ряд недостатков, которые касаются осложнений. В частности, применение стимуляторов эритропоэза для лечения анемии повышает риск развития тромботических осложнений, который и так является высоким у онкологических пациентов. По данным, полученным в ходе нескольких научных исследований, этот риск увеличивается в 1.4-1.7 раз.
В последнее время обсуждается вопрос о влиянии стимуляторов эритропоэза на выживаемость онкологических пациентов. В частности, специалисты установили, что применение препаратов данной группы при лечении анемии у пациентов с распространенным опухолевым процессом головы и шеи, шейки матки, молочной железы и других диагнозах снижает продолжительность жизни на 10-17%. В связи с этим специалисты предлагают придерживаться следующих правил:
- Если уровень гемоглобина составляет менее 100 г/л и пациент при этом проходит лечение химиопрепаратами, то стимуляторы эритропоэза могут назначаться с целью коррекции анемии и профилактики дальнейшего снижения показателей.
- Если уровень гемоглобина падает до 100 г/л и ниже, но химиотерапия при этом не проводится, то применять стимуляторы эритропоэза не рекомендуется ввиду повышенного риска развития осложнений и снижения продолжительности жизни.
- Во всех остальных случаях применять стимуляторы эритропоэза для лечения анемии у онкологических пациентов следует с осторожностью.
Также на протяжении всего времени лечения важно контролировать динамику лабораторных показателей и при увеличении уровня гемоглобина постепенно снижать дозировку стимуляторов эритропоэза.
Препараты железа при лечении анемии
Препараты железа применяются с целью лечения железодефицитных анемий, которые выявляются у 30-60% онкологический больных. При этом снижение уровня железа может быть связано как с самим опухолевым процессом или проводимым лечением, так и с другими факторами. Например, при назначении стимуляторов эритропоэза, существующего запаса железа в организме становится недостаточно для того, чтобы покрыть потребность, которая возникает в результате активного синтеза гемоглобина в костном мозге.

Для лечения анемии могут применяться как внутривенные, так и пероральные препараты. Второй вариант более удобен для пациента, так как таблетки проще принимать, но при этом данная форма действует медленнее и чаще приводит к осложнениям со стороны ЖКТ. Внутривенное введение позволяет добиться быстрого эффекта, что актуально при проведении химиотерапии.
Таким образом, для лечения анемии современная онкология может предложить различные методы, которые воздействуют на механизмы развития данного симптома. Точный план терапии подбирается индивидуально для каждого пациента, с учетом лабораторных показателей крови, особенностей лечения основного заболевания и других параметров.
Лечение анемии народными способами
Некоторые пациенты по разным причинам отказываются от приема описанных выше препаратов и обращаются к народной медицине. Безусловно, некоторые растения или продукты могут оказывать стимулирующее действие на систему кроветворения. Однако, учитывая основной диагноз и тяжесть анемии, этого действия крайне недостаточно для восстановления уровня гемоглобина и кислородной функции крови. В результате снижается эффективность противоопухолевого лечения, ухудшается прогноз и существенно повышается риск неблагоприятного исхода. Устранить выраженную анемию в домашних условиях при помощи народных методов невозможно. Этим должны заниматься врачи соответствующего профиля, в распоряжении которых имеются современные лекарственные препараты.
Запись
на консультацию
круглосуточно
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 8 октября 2019;
проверки требуют 2 правки.
Рак поджелудочной железы — злокачественное новообразование, исходящее из эпителия железистой ткани или протоков поджелудочной железы.
Этиология[править | править код]
Заболеваемость раком поджелудочной железы ежегодно увеличивается. Эта болезнь занимает шестое место по распространённости среди онкологических заболеваний среди взрослого населения. Поражает преимущественно людей пожилого возраста, одинаково часто мужчин и женщин[2]. В США в данное время рак поджелудочной железы находится на четвертом месте среди причин смерти от рака. Согласно предварительной оценке Американского Онкологического Общества, в 2015 году эта опухоль будет выявлена у 48 960 человек, и 40 560 пациентов погибнут. Риск возникновения рака у каждого жителя США в течение жизни составляет 1,5%.[3]
Факторами риска рака поджелудочной железы являются:
- употребление спиртных напитков
- курение
- обилие жирной и острой пищи
- сахарный диабет
- цирроз печени
К предраковым заболеваниям относятся:
- Аденома поджелудочной железы
- Хронический панкреатит
- Киста поджелудочной железы
Обычно опухоль поражает головку железы (50-60 % случаев), тело (10 %), хвост (5-8 % случаев). Также наблюдается полное поражение поджелудочной железы — 20-35 % случаев. Опухоль представляет собой плотный бугристый узел без чётких границ, на разрезе — белый или светло-жёлтый.
Недавно обнаружен ген, влияющий на форму нормальных клеток поджелудочной железы, который может принимать участие в развитии рака. По результатам исследования, опубликованного в журнале Nature Communications, целевой ген — это ген протеинкиназы P1 (PKD1). Воздействуя на него, можно будет затормозить рост опухоли. PKD1 — контролирует как рост, так и метастазирование опухоли. На данный момент исследователи заняты созданием ингибитора PKD1, для того чтобы можно было провести его дальнейшие испытания.[3][4]
В ходе исследования, проведенного в медицинском центре Лангон при Университете Нью-Йорка, было выявлено, что вероятность развития рака поджелудочной железы на 59% выше у тех пациентов, у которых в ротовой полости присутствует микроорганизм Porphyromonas gingivalis. Также риск заболевания в два раза выше, если у пациента будет обнаружен Aggregatibacter actinomycetemcomitans. На данный момент разрабатывается скрининговый тест, который позволит определять вероятность развития рака поджелудочной железы[5].
Гистологические формы[править | править код]
Всего насчитывают 5 гистологических форм рака поджелудочной железы:
- Аденокарцинома
- Плоскоклеточный рак
- Цистаденокарцинома
- Ацинарно-клеточный рак
- Недифференцированный рак
Наиболее распространена аденокарцинома, наблюдающаяся в 80 % случаев рака поджелудочной железы[2].
Метастазирование[править | править код]
Лимфогенное метастазирование рака поджелудочной железы имеет 4 стадии. На первой стадии поражаются панкреатодуоденальные лимфатические узлы (около головки поджелудочной железы), на второй — ретропилорические и гепатодуоденальные, затем чревные и верхнебрыжеечные лимфатические узлы и на четвёртой стадии — забрюшинные (парааортальные) лимфатические узлы.
Гематогенное метастазирование приводит к развитию отдалённых метастазов в печени, лёгких, почках, костях.
Кроме того, наблюдается имплантационный перенос опухолевых клеток по брюшине.
Клиническая классификация[править | править код]
Клиническая TNM-классификация применяется только к карциномам экзокринной части поджелудочной железы и нейроэндокринным опухолям поджелудочной железы, включая карциноиды.
T — первичная опухоль
- Tx — первичная опухоль не может быть оценена
- T0 — отсутствие данных о первичной опухоли
- Tis — карцинома in situ
- T1 — опухоль не более 2 см в наибольшем измерении в пределах поджелудочной железы
- T2 — опухоль более 2 см в наибольшем измерении в пределах поджелудочной железы
- T3 — опухоль распространяется за пределы поджелудочной железы, но не поражает чревный ствол или верхнюю брыжеечную артерию
- T4 — опухоль прорастает в чревный ствол или верхнюю брыжеечную артерию
Примечания:
Tis также включает панкреатическую интраэпителиальную неоплазию III.
N — регионарные лимфатические узлы
- Nx — регионарные лимфатические узлы не могут быть оценены
- N0 — нет метастазов в регионарных лимфатических узлах
- N1 — есть метастазы в регионарных лимфатических узлах
Примечания:
Регионарными лимфатическими узлами являются околопанкреатические узлы, которые можно подразделить следующим образом:
| группа узлов | локализация |
|---|---|
| Верхние | сверху над головкой и телом |
| Нижние | снизу под головкой и телом |
| Передние | передние поджелудочно-двенадцатиперстные, пилорические (только для опухолей головки) и проксимальные брыжеечные |
| Задние | задние поджелудочно-двенадцатиперстные, лимфатические узлы общего жёлчного протока и проксимальные брыжеечные |
| Селезёночные | узлы ворот селезёнки и хвоста поджелудочной железы (только для опухолей тела и хвоста) |
| Чревные | только для опухолей головки |
M — отдалённые метастазы
- M0 — нет отдалённых метастазов;
- M1 — есть отдалённые метастазы.
Стадии[править | править код]
| стадия | критерий T | критерий N | критерий M |
|---|---|---|---|
| Стадия 0 | Tis | N0 | М0 |
| Стадия IA | T1 | N0 | М0 |
| Стадия IB | T2 | N0 | М0 |
| Стадия IIA | T3 | N0 | М0 |
| Стадия IIB | T1, T2, T3 | N1 | М0 |
| Стадия III | T4 | Любая N | М0 |
| Стадия IV | Любая T | Любая N | М1 |
Симптомы[править | править код]
Симптомы рака поджелудочной железы часто не специфичны и не выражены, в связи с чем опухоль во многих случаях обнаруживается на поздних стадиях процесса. Среди симптомов наиболее часто присутствует механическая желтуха при прорастании или компрессии желчных протоков.
Если опухоль поражает головку железы, то она проявляется синдромом Курвуазье: при пальпации правого верхнего квадранта живота обнаруживается желчный пузырь, увеличенный вследствие давления желчи. Рак тела и хвоста поджелудочной железы сопровождается ноющей болью в эпигастрии, которая иррадиирует в поясницу и зависит от положения тела. Прорастание опухолью желудка и поперечно-ободочной кишки вызывает нарушения их проходимости. В дальнейшем нарушается функция железы и других органов пищеварительного тракта. Возможны кровотечения из поражённых органов.
Рак поджелудочной железы также сопровождается общими симптомами, характерными для злокачественных опухолей: раковая интоксикация, снижение аппетита и массы тела, общая слабость, повышение температуры организма и др.
Диагностика[править | править код]
Традиционными диагностическими методами исследования являются ультразвуковое исследование и компьютерная томография с болюсным контрастным усилением. Эти методы позволяют визуализировать не только распространённость первичной опухолевой массы, но и оценить наличие метастазов, сопутствующей патологии. Помимо этого, по показаниям применяются такие рентгенологические методы, как исследование желудка и двенадцатиперстной кишки с сульфатом бария (для оценки наличия дефектов наполнения из-за сдавления опухолью), эндоскопическая ретроградная холангиопанкреатография (для оценки распространённости поражения жёлчных и панкреатических протоков, морфологической верификации). С диагностической целью может применяться диагностическая лапароскопия, лапаротомия с биопсией или тонкоигольная биопсия под контролем УЗИ.
Кроме методов, позволяющих определить анатомические особенности образования поджелудочной железы, существуют методы, позволяющие индивидуально определить прогноз течения заболевания. Одним из таких методов является определение в крови матриксных металлопротеиназ.[6][7][8][9]
Эндоскопический ультразвук[править | править код]
Значительным прогрессом в диагностике рака поджелудочной железы на ранней стадии является эндосонография (эндоскопический ультразвук)[10].
В отличие от обычного УЗИ, для эндосонографии используется гибкий эндоскоп с видеокамерой и ультразвуковым датчиком, который можно ввести в кишку непосредственно к исследуемому образованию. Эндосонография решает проблему четкости изображения, которая возникает при исследовании глубоких органов чрескожным методом. При раке поджелудочной железы эндоскопический ультразвук позволяет установить диагноз в 90—95% случаев[уточнить] на самой ранней стадии[11].
Тестер Джека Андраки[править | править код]
В начале 2012 года 15-летний первокурсник Джек Андрака (англ. Jack Andraka) из North County High School, расположенной в пригороде Балтимора городе Glen Burnie, штат Мэриленд, США, изобрёл тестер рака [12], который позволяет диагностировать рак поджелудочной железы, легких и яичек на ранних стадиях путём анализа крови либо мочи. Указанный тестер создан на основе бумаги для проведения диабетических тестов.
По заявлению автора, основанному на некорректных оценках[13], метод более чем в сто раз быстрее, в десятки-тысячи раз дешевле (бумажный тестер при массовом изготовлении стоит не дороже 3-х центов), и в сотни раз более чувствителен, чем существовавшие до этого методы тестирования. Точность результатов по предварительным заявлениям может составлять 90 % или более. На разработку и исследования юного изобретателя подвигла смерть от рака поджелудочной железы близкого друга семьи мальчика.
За свою инновационную разработку Джек Андрака в мае 2012 года получил грант в сумме $75 000 на Всемирном конкурсе научных и инженерных достижений школьников, который ежегодно проходит в США (Intel ISEF 2012). Грант профинансирован компанией Intel. В январе 2014 года в журнале Forbes была опубликована статья, в которой способ тестирования Джека Андрака ставится под сомнение.[13]
Лечение[править | править код]
- Хирургическое вмешательство (по показаниям, при отсутствии метастазов — в 10—15 % случаев)
- Радиотерапия (в комплексе с хирургическим вмешательством)
- Химиотерапия
- Гормональная терапия
- Симптоматическая терапия (обезболивание и др.)
- Виротерапия
- Необратимая электропорация (Нанонож)
Из хирургических методов наиболее распространена при раке поджелудочной железы панкреатодуоденальная резекция (операция Уиппла), которая включает удаление головки поджелудочной железы с опухолью, участка двенадцатиперстной кишки, части желудка и жёлчного пузыря с регионарными лимфоузлами. Противопоказанием к операции считается распространение опухоли на крупные рядом лежащие сосуды и наличие отдаленных метастазов[14].
Послеоперационное лечение, называемое адъювантной терапией, проводится пациентам, у которых нет выявленных признаков остаточной болезни, но есть вероятность того, что в организме остались микроскопические опухолевые частицы, способные в отсутствие лечения привести к рецидиву опухоли и смерти[15].
Прогноз[править | править код]
Условно неблагоприятный. Современные хирургические методики позволяют снизить периоперационную смертность до 5%. Однако медиана выживаемости после операции составляет 15–19 месяцев, а пятилетняя выживаемость – менее 20%[16]. Если полное удаление опухоли невозможно, практически всегда следует рецидив; у оперированных больных с рецидивом продолжительность жизни в 3—4 раза дольше, чем неоперированных.[17] Современное состояние медицины не позволяет эффективно излечивать рак поджелудочной железы и в основном концентрируется на симптоматической терапии. В некоторых случаях положительный эффект даёт терапия интерфероном. Средняя 5-летняя выживаемость после радикального хирургического лечения составляет 8-45 %, что делает его одним из самых опасных заболеваний.
Другие опухоли поджелудочной железы[править | править код]
- Карциноидные опухоли
- Нейроэндокринные опухоли и опухоли из островковых клеток — инсулома
Известные люди, умершие от рака поджелудочной железы[править | править код]
См: Умершие от рака поджелудочной железы
Примечания[править | править код]
- ↑ 1 2 3 4 Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ 1 2 Ганцев Ш. Х. Онкология: Учебник для студентов медицинских вузов. — М.: ООО «Медицинское информационное агентство», 2006. — 488 с. — 5 000 экз. — ISBN 5-89481-418-9.
- ↑ 1 2 ГЕН, ОТВЕТСТВЕННЫЙ ЗА РАК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ. Дата обращения 23 марта 2015.
- ↑ Gene identified that lays foundation for pancreatic cancer. Medical News Today (23 February 2015). Дата обращения 23 марта 2015.
- ↑ «Signs Of Pancreatic Cancer Include These Bacteria Living In The Mouth», Medical Daily (19.04.2016). Дата обращения 20 апреля 2015.
- ↑ Isabelle M., Sloane B.F. Cysteine proteases and tumor progression // Perspectives in Drug Discovery and Design. 1995. V. 2. № 3. P. 16—19.
- ↑ Коровин М. С., Новицкий В. В., Васильева О. С. Роль лизосомальных цистеиновых протеиназ в опухолевой прогрессии //Бюл. сибирской медицины. – 2009. – Т. 8. – №. 2. – С. 85-90.
- ↑ Joyce J.A., Baruch A., Chehade K. et al. Cathepsin cysteine proteases are effectors of invasive growth and angiogenesis during multistage tumorigenesis (англ.) // Cancer Cell.. — 2004. — Iss. 5. 5.. — No. 453. — P. 443.
- ↑ Lah T.T., Durán Alonso M.B., van Noorden C.J. Antiprotease therapy in cancer: hot or not? (англ.) // Expert Opin. Biol. Ther.. — 2006. — Vol. 6.3. — P. 257-279.
- ↑ Старков Ю. Г. и др. Эндосонография в диагностике заболеваний органов гепатобилиарной зоны // Хирургия. — 2009. — Т. 6. — С. 10-16.
- ↑ Эндосонография. Европейская Клиника.. Дата обращения 7 сентября 2015.{{подст:не АИ}}
- ↑ A Novel Paper Sensor for the Detection of Pancreatic Cancer (англ.) (недоступная ссылка). Intel ISEF 2012 Finalist Profile. Student science. Дата обращения 16 июля 2015. Архивировано 10 июня 2015 года.
- ↑ 1 2 Мэтью Херпер. Джек Андрака: юный гений биотехнологий или медиазвезда?, forbes (16.01.2014).
- ↑ Методы лечения различных типов рака 4-й стадии — euroonco.ru
- ↑ A. К. Локхарт, М. Л. Ротенберг и др. Адъювантная терапия рака. Пер. с англ. Н. Д. Фирсова (2017)
- ↑ Базин И.С. Основные принципы ведения больных раком поджелудочной железы // Эффективная фармакотерапия. — 2014. — № 47. — С. 10-17. — ISSN 2307-3586.
- ↑ Рак поджелудочной железы: лечение
Литература[править | править код]
- Ганцев Ш. Х. Онкология: Учебник для студентов медицинских вузов. — М.: ООО «Медицинское информационное агентство», 2006. — 488 с. — 5 000 экз. — ISBN 5-89481-418-9.
- TNM: Классификация злокачественных опухолей. / Под ред. Л.Х. Собинина и др.; пер. с англ. и науч. ред. А.И. Щёголева, Е.А. Дубовой, К.А. Павлова. — М.: Логосфера, 2011. — 276 с. — Перевод изд. TNM Classification of Malignant Tumours, 7th ed. — ISBN 978-5-98657-025-9.
- Кубышкин В. А. Рак поджелудочной железы. // Consilium medicum. Том 5, № 8 (2003).
- Местно-распространенный рак. Пер. с англ. Н. Д. Фирсова (2017).