Анемия после родов клинические рекомендации лечение
Комментарии
Опубликовано в:
«Arch Gynecol Obstet» »» 25 июня 2010 г
Кристиан Брейман, Кристоф Хонеккер, Вольфганг Хольцгрев, Даниэл Сурбек
Аннотация
Введение. В период беременности и после родов часто развивается железодефицитная анемия, которая может привести к тяжелым осложнениям для матери и плода. Новые схемы лечения включают внутривенное введение железа в определенных клинических ситуациях. Целью данного исследования было определение оптимальных диагностических и терапевтических подходов для лечения железодефицитной анемии в период беременности и после родов.
Методы. Проводили обзор результатов по диагностике и лечению железодефицитной анемии, представленных в опубликованных работах и рекомендациях по лечению. В качестве выводов представлены рекомендации по лечению, составленные экспертным советом. Результаты. В период беременности в качестве терапии выбора применяют препараты железа, предназначенные для приема внутрь. При недостаточной эффективности, возникновении нежелательных побочных эффектов или очень низком уровне гемоглобина предпочтительным альтернативным методом является внутривенное введение карбоксимальтозы железа, хотя данные о безопасности данного метода лечения ограничены. В послеродовый период при уровне гемоглобина ниже 95 г/л идеальным методом лечения является внутривенное введение карбоксимальтозы железа, приводящее к более быстрому восстановлению уровня гемоглобина. Выводы.
Ключевые слова: анемия, беременность, послеродовый период, недостаточность железа
Рекомендации экспертной группы, Комитет по обеспечению качества Швейцарского общества по проблемам акушерства и гинекологии.
C. Breymann, C. Honegger, W. Holzgreve, D. Surbek (&)
University Women’s Hospital,
Inselspital Effingerstr. 102, 3010 Bern, Швейцария
Введение
Анемия представляет собой одну из распространенных проблем в области акушерства. Хорошо известно, что в зависимости от своей тяжести анемия выступает важным фактором риска смерти для матери и плода. При железодефицитной анемии в период беременности повышается риск преждевременных родов, внутриутробной задержки развития плода, нарушения развития плаценты и снижения запасов железа в организме новорожденного. Риски для матери включают: истощение резервов крови при родах, что ведет к повышению риска переливания аллогенной крови при значительной кровопотере, сердечно-сосудистый стресс, появление симптомов анемии (усталость, снижение переносимости физических и психологических нагрузок, головная боль, головокружение в положении стоя, упадок сил, продолжительная госпитализация, пониженная лактация, истощение запасов железа в организме матери после родов). В этой связи эффективное лечение диагностированной анемии оказывает положительное влияние на здоровье матери и плода. Одним из основных рассматриваемых вопросов является снижение объемов, или, в идеале, отсутствие необходимости в переливании аллогенной крови, возникающей вследствие недостаточно эффективного лечения анемии до родов. Затем рассматривается проблема лечения, но не профилактики, железодефицитной анемии.
Анемия в период беременности
Диагностика
Нижним пределом для уровня гемоглобина у беременных женщин считается <110 г/л в первом и последнем триместрах и <105 г/л во втором триместре (CDC, 1998). Таким образом, на всех этапах беременности уровень гемоглобина <105 г/л указывает на наличие анемии, требуя уточнения диагноза и проведения лечения, поскольку при анемии возрастает риск задержки внутриутробного развития и преждевременных родов. При постановке диагноза первыми тестами должны быть определение количества эритроцитов и уровня ферритина в сыворотке крови. Как правило, определения уровня ферритина в сыворотке крови достаточно для диагностики железодефицитной анемии: значения ниже 15 мкг/л четко указывают на наличие железодефицитной анемии. При нормальном и/или повышенном уровне ферритина следует рассмотреть иные причины (например, гемоглобинопатии, такие как ß-талассемия, серповидно-клеточная анемия, инфекционная анемия, геморрагическая анемия, недостаточность витамина B12 или фолиевой кислоты, и т.д.). Хорошим диагностическим подходом представляется определение уровня ферритина в сыворотке крови в дополнение к определению уровня гемоглобина в начале беременности. При уровне ферритина ниже 30 мкг/л вероятность истощения запасов железа составляет 90%, даже при отсутствии признаков анемии. В этих случаях в период беременности показана заместительная терапия препаратами железа. Следует учитывать, что при воспалительном ответе определяемый уровень ферритина в сыворотке крови может быть «ложно нормальным» или «ложно повышенным», так как ферритин и белок острой фазы реагируют одинаково. По этой причине рекомендуют определять уровень С-реактивного белка параллельно с определением уровня ферритина. Электрофоретический или хроматографический (методом ВЭЖХ – высокоэффективной жидкостной хроматографии) анализ гемоглобина для выявления ß-талассемии или иной гемоглобинопатии, являющихся причиной анемии, рекомендуют проводить в следующих случаях: (1) наличие данных заболеваний в семейной истории беременной женщины или ее партнера, (2) анемия, не связанная с недостаточностью железа (при нормальном уровне ферритина), (3) при среднем объеме эритроцитов ниже 70 фл и среднем содержании гемоглобина в эритроцитах ниже 27 пг (следует помнить, что при α-талассемии результаты электрофоретического анализа гемоглобина могут быть нормальными) и (4) в зависимости от этнической принадлежности (следует помнить, что количество эритроцитов при серповидно-клеточной анемии находится в пределах нормальных значений). В случае подтверждения гемоглобинопатии (обычно гетерозиготной) следует выполнить диагностическое обследование партнера и, при наличии риска для плода, предложить использовать пренатальную инвазивную диагностику.
Лечение
Выбор лечения зависит от причины, вызвавшей анемию – обычно причиной служит недостаточность железа. Основным лечением при железодефицитной анемии легкой степени тяжести (при уровне гемоглобина 90-105 г/л) является прием железа внутрь (соли двухвалентного железа или комплекс трехвалентного железа с полимальтозой) в дозах по 160-200 мг/сутки (желательно на голодный желудок (соли двухвалентного железа), в несколько приемов). Такое же лечение применяют при истощении запасов железа на начальных этапах беременности (уровень ферритина ниже 30 мкг/л) на фоне отсутствия анемии, поскольку в период беременности потребность в железе возрастает.
В ряде случаев предпочтителен переход на внутривенное введение препаратов железа: при отсутствии ответа на прием железа внутрь (повышение уровня гемоглобина менее чем на 10 г/л через 14 дней лечения), несоблюдении назначенного лечения, непереносимости пероральных препаратов железа (побочные эффекты со стороны желудочно-кишечного тракта), при тяжелой, запущенной или прогрессирующей анемии (уровень гемоглобина ниже 90 г/л), стремлении быстро достичь эффекта (на поздних сроках беременности, при лечении свидетелей Иеговы и в ряде других случаев). В нескольких работах показано, что внутривенное введение препаратов железа более эффективно при сравнении с приемом железа внутрь при тех же показаниях. Помимо этого, внутривенная терапия позволяет избежать возникновения побочных эффектов со стороны желудочно-кишечного тракта, наблюдающихся при приеме препаратов железа внутрь.
Сахарат железа (III) (Венофер®)
Мировая практика доказала безопасность и высокую переносимость комплекса железа (III) с сахаратом. Данный препарат одобрен для применения в период беременности, начиная со второго триместра; частота возникновения побочных эффектов при применении Венофера ниже 0,5%. Венофер® следует вводить только в учреждениях, располагающих оборудованием для сердечно-легочной реанимации. Максимальная разовая парентеральная доза сахарата железа (III) составляет 200 мг, предпочтительно развести препарат в 100 мл 0,9%-го раствора NaCl для введения в форме инфузии. Продолжительность инфузии составляет приблизительно 30 мин с использованием внутривенного доступа (следует помнить, что высокая скорость инфузии связана с риском гипотензивной реакции). В зависимости от исходных значений уровня гемоглобина внутривенное введение повторяют 1-3 раза в неделю, до повышения уровня гемоглобина >105 г/л. Затем пациента можно перевести на прием пероральных препаратов железа для поддерживающей терапии. Нет оснований ожидать возможной передозировки железом.
Комплекс железа с карбоксимальтозой (Феринжект®)
Карбоксимальтоза железа (Феринжект®) представляет новый недекстрановый комплекс железа, преимуществом которого является возможность введения высоких доз (до 1000 мг за одно введение) в короткий промежуток времени (на одну инфузию требуется 15-30 мин). Благодаря этому отсутствует необходимость в дорогостоящих повторных инфузиях небольших доз железа, при этом Феринжект® характеризуется хорошей переносимости, по-видимому, сопоставимой с таковой для сахарата железа (III). Как и в случае сахарата железа (III), данный препарат одобрен для применения в период беременности, начиная со второго триместра. На сегодняшний день (как и в случае сахарата железа (III)) не проводилось масштабных рандомизированных исследований для оценки безопасности применения данного препарата для плода. По этой причине перед назначением любых препаратов железа внутривенно необходимо тщательно оценить соотношение пользы и рисков, даже во втором и третьем триместрах беременности. В модели плацентарного кровотока показано, что карбоксимальтоза железа не проникает через плацентарный барьер к плоду (Malek, 2009). Карбоксимальтозу железа вводят в виде быстрой инфузии в течение 15-30 мин или в виде болюса в течение 1-2 мин (НЕ подкожно или внутримышечно!). В виде быстрой инфузии карбоксимальтозу железа можно вводить в разовых дозах до 1000 мг железа или, соответственно, 15 мг железа в расчете на 1 кг веса тела (до уровня желаемой общей дозы); максимальная доза для внутривенного болюсного введения составляет 200 мг. При необходимости введения более высоких доз (>1000 мг) следует вводить препарат частями с интервалом в 7 дней.
Согласно недавно опубликованному обновлению Кокрановской базы данных (Reveiz, Gyte and Cuervo, 2007, CD 003094), четкие рекомендации по выбору лечения железо-дефицитной анемии в период беременности отсутствуют. При парентеральном введении железа повышение уровня гемоглобина происходит быстрее, чем при приеме внутрь. В то же время отсутствуют данные по безопасности парентерального введения железа в отношении развития тромбозов и тяжелых аллергических реакций. Помимо этого, данных, полученных в 17 исследованиях, недостаточно для оценки пользы лечения для матери и плода. В то же время в данный обновленный обзор не включены результаты недавних исследований эффективности и безопасности сахарата железа в период беременности.
Не проводилось масштабных исследований для оценки безопасности обоих препаратов (карбоксимальтозы железа и сахарата железа (III)) для плода.
Послеродовая анемия
Диагностика
Клинически значимой послеродовой анемией считают уровень гемоглобина ниже <100 г/л. Обычно такие значения являются следствием геморрагической анемии и в некоторых случаях присутствовавшей до родов железодефицитной анемии. Решение о контроле уровня гемоглобина после родов следует принимать с учетом потери крови и клинического состояния роженицы (симптомы анемии). Помимо этого, значение имеет уровень гемоглобина до родов. Нижнее значение уровня гемоглобина после родов достигается приблизительно через 48 ч после первичного распределения плазмы крови. Дополнительное определение уровня ферритина в послеродовый период бесполезно, так как в течение первых 6 недель после родов значения могут быть «ложно нормальными» или «ложно повышенными» (см. выше: ферритин = белок острой фазы). Запасы железа у роженицы можно оценивать до родов или через 6 недель после родов. Не имеет смысла определять уровень ферритина в тех случаях, когда анемия присутствовала до родов, и сохраняется после них, так как можно уверенно констатировать истощение запасов железа. В случаях гемохроматоза (частота гетерозигот 1:10) опасность может представлять парентеральное введение железа без предварительного определения уровня ферритина.
Лечение
Лечение зависит от тяжести анемии и состояния здоровья в послеродовый период. Как правило, при анемии легкой степени тяжести с уровнем гемоглобина 95-120 г/л рекомендуют прием препаратов железа внутрь в дозах около 80-200 мг (соли железа (II) или комплекс железа (III) с полимальтозой). В случае плохой переносимости (со стороны желудочно-кишечного тракта) перорального лечения, хорошей альтернативой служит внутривенное введение железа. При анемии средней степени тяжести (гемоглобин <95 г/л) и тяжелой анемии (гемоглобин <85 г/л) парентеральное введение железа выступает важной альтернативой пероральному методу лечения. В нескольких работах продемонстрировано преимущество парентерального введения сахарата железа (III) при сравнении с приемом железа внутрь. В одной работе показано даже, что при использовании сахарата железа (III) для парентерального ведения в исследуемой группе снижалась необходимость в переливании аллогенной крови. Максимальные однократные дозы сахарата железа (III) для парентерального введения составляют 200 мг, при этом желательно разводить препарат в 100 мл 0,9% NaCl для инфузии. Раствор вводят приблизительно в течение 30 мин с использованием внутривенного доступа (следует помнить, что высокая скорость инфузии связана с риском гипотензивной реакции). В зависимости от исходных значений уровня гемоглобина внутривенное введение повторяют 2-3 раза в неделю, до повышения уровня гемоглобина >100 г/л. Затем пациента можно перевести на прием пероральных препаратов железа для поддерживающей терапии. Нет оснований ожидать возможной передозировки железом. Через 14 дней ожидаемое повышение уровня гемоглобина составляет 30 г/л. В конце периода наблюдения у родильниц, получавших сахарат железа (III) парентерально, повышение уровня ферритина, и, по-видимому, запасов железа, выражено сильнее, чем у женщин, получавших препараты железа внутрь. Данные характеристики парентерального введения особенно привлекательны в тех случаях, когда в течение короткого времени друг за другом следует несколько беременностей.
В нескольких рандомизированных многоцентровых исследованиях было проведено сравнение нового препарата, карбоксимальтозы железа (Феринжект®), и заместительной терапии с приемом железа внутрь при лечении послеродовой анемии. Исследования показали очень высокую безопасность применения, сопоставимую с таковой для сахарата железа (III), а также высокую эффективность карбоксимальтозы железа. В трех из четырех исследований внутривенное введение карбоксимальтозы железа для лечения послеродовой анемии показало более высокую эффективность при сравнении с пероральным введением железа. В четвертом исследовании при лечении в течение 12 недель внутривенное введение карбоксимальтозы железа и пероральный прием железа обладали равной эффективностью. Профиль безопасности получил очень высокую оценку, сопоставимую с таковой для сахарата железа. Дозировки аналогичны описанным выше. Практическая польза, удобство для пациентов и снижение затрат, обусловленное необходимостью однократного введения, указывают на преимущество карбоксимальтозы железа перед сахаратом железа (III).
При тяжелой анемии (уровень гемоглобина <80 г/л) оправдано введение рекомбинантного эритропоэтина (рЭПО) в дополнение к парентеральному введению карбоксимальтозы железа. Согласно Кокрановской базе данных, введение рЭПО улучшает ход лечения анемии, но только в сочетании с парентеральным введением железа, что обеспечивает эффективный эритропоэз. Эритропоэтин следует назначать только в случаях тяжелой анемии при наличии дополнительных факторов (выраженные клинические симптомы, отказ от переливания донорской крови и др.). Примерная дозировка: 150 МЕ/кг веса тела один раз в сутки подкожно, суммарно четыре дозы эпоэтина альфа (Эпрекс®) на фоне парентерального лечения с применением карбоксимальтозы железа. Следует учитывать также тот факт, что применение рЭПО выходит за рамки зарегистрированных показаний и связано с дополнительным увеличением стоимости лечения.
Критические значения уровня гемоглобина, при которых оправдано переливание аллогенной крови, составляют приблизительно 60 г/л, однако такая необходимость зависит от клинических симптомов. Решение о назначении переливания аллогенной крови всегда следует принимать на индивидуальной основе с учетом всех пожеланий пациента. Четкого порогового значения не существует (например, гемоглобин 60 г/л = переливание крови), однако следует учитывать на возможность возникновения неявных осложнений, например, указания на скрытую ишемию миокарда.
Цитируемая литература: доступна по запросу
Заявление о конфликте интересов: конфликт интересов отсутствует.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Введение
Анемия – патологическое состояние, характеризующееся уменьшением концентрации гемоглобина и, в подавляющем большинстве случаев, числа эритроцитов в единице объема крови. Частота анемии у беременных колеблется от 15 до 30% и, по данным Минздрава России, за последние 10 лет увеличилась в 6,3 раза, причем наиболее распространенной является железодефицитная анемия (ЖДА), на ее долю приходится около 90% от всех анемий [1]. Синдром ЖДА характеризуется ослаблением эритропоэза из-за дефицита железа вследствие несоответствия между поступлением и расходом (потреблением, потерей) железа, снижением наполнения гемоглобина железом с последующим уменьшением содержания гемоглобина в эритроците [2].
В соответствии с МКБ 10-го пересмотра учитывают следующие формы анемий, связанных с дефицитом железа:
D50 – железодефицитная анемия (асидеротическая, сидеропеническая, гипохромная);
D50.0 – железодефицитная анемия, связанная с хронической кровопотерей (хроническая постгеморрагическая анемия);
D50.1 – сидеропеническая дисфагия (синдромы Келли – Паттерсона и Пламмера – Винсона);
D50.8 – другие железодефицитные анемии;
D50.9 – железодефицитная анемия неуточненная.
ЖДА – нарушение, при котором снижается содержание железа в сыворотке крови, в костном мозге и депо, что приводит к нарушению образования гемоглобина, эритроцитов, возникновению анемий и трофических расстройств в тканях.
ЖДА занимают одно из ведущих мест в структуре экстрагенитальной заболеваемости беременных, т. к. во время беременности потребность в железе резко увеличивается вследствие высокой потребности в нем плаценты и плода, и возникает дисбаланс поступления и потребности необходимого микроэлемента. Согласно современным данным, дефицит железа в конце гестационного процесса развивается у всех без исключения беременных [2].
В организме человека содержится около 4 г железа: основная часть его (75%) входит в состав гемоглобина, меньшая часть входит в состав миоглобина (3,5%) и тканевых ферментов (0,5%), а также депонируется в печени и селезенке в виде ферритина и гемосидерина. Часть ферритина присутствует в плазме, а его концентрация служит индикатором запасов железа в организме [3].
Во время беременности потребность в железе неуклонно увеличивается (I триместр – на 1 мг/сут, II триместр – на 2 мг/сут, III триместр – на 3–5 мг/сут). Для выработки дополнительного железа используется 300–540 мг этого элемента. У большинства женщин к 28–30-недельному сроку физиологически протекающей беременности развивается анемия, связанная с неравномерным увеличением объема циркулирующей плазмы крови и объема эритроцитов. В результате показатель гематокрита снижается с 0,4 до 0,32, количество эритроцитов уменьшается с 4 до 3,5×1012/л, концентрация гемоглобина также снижается со 140 до 110 г/л (от I до III триместра). Подобные изменения картины красной крови, как правило, не отражаются на состоянии и самочувствии беременной. Истинная анемия беременных сопровождается типичной клинической картиной и оказывает влияние на течение беременности и родов. По сравнению с анемией, развившейся до беременности, анемия беременных протекает тяжелее, поскольку представляет собой осложнение, подобное гестозу. При наличии у женщины анемии, возникшей до наступления беременности, организм, как правило, успевает адаптироваться [3]. Суммарная потеря железа к окончанию беременности составляет примерно 1000–1200 мг. Процесс всасывания железа на протяжении беременности усиливается и составляет в I триместре 0,6–0,8 мг/сут, во II триместре – 2,8–3,0 мг/сут, в III триместре – до 3,5–4,0 мг/сут [4, 5]. Однако это не компенсирует повышенный расход элемента во время беременности. Более того, уровень депонированного железа у 100% беременных к концу гестационного периода снижается. Для восстановления запасов железа, потраченного в период беременности, родов и лактации, требуется не менее 2–3-х лет [6].
Биологическая значимость железа определяется его участием в тканевом дыхании. При дефиците железа у беременных возникает прогрессирующая гемическая гипоксия с последующим развитием вторичных метаболических расстройств. Поскольку при беременности потребление кислорода увеличивается на 15–33%, это усугубляет развитие гипоксии [4, 7].
ЖДА характеризуется нарушениями белкового обмена с возникновением дефицита белков в организме, что приводит к развитию отеков у беременной. При ЖДА развиваются дистрофические процессы в матке и плаценте, которые ведут к нарушению функции и формированию плацентарной недостаточности, у 10–15% отмечаются гипотония и слабость родовой деятельности. При этом развивающийся плод не получает в достаточном количестве полагающиеся ему питательные вещества и кислород, вследствие чего возникает задержка роста плода. Основными осложнениями беременности при ЖДА являются: угроза прерывания беременности (20–42%); гестоз (40%); артериальная гипотония (40%); преждевременная отслойка плаценты (25–35%); задержка роста плода (25%); преждевременные роды (11–42%). Роды часто осложняются кровотечениями. В послеродовом периоде могут возникать различные воспалительные осложнения (12%) [3, 5]. Даже при скрытом дефиците железа у 59% женщин отмечено неблагоприятное течение беременности в виде угрозы ее прерывания и гестоза [2, 5].
Одним из основных критериев ЖДА служит уровень гемоглобина, экспертами ВОЗ принята классификация анемии у беременных по концентрации гемоглобина (Hb) в крови:
• анемия легкой степени тяжести – концентрация Hb в крови от 90 до 110 г/л;
• умеренно выраженная анемия – концентрация Hb в крови от 89 до 70 г/л;
• тяжелая анемия – концентрация Hb в крови < 70 г/л.
Также к диагностическим критериям ЖДА относятся: цветовой показатель – < 0,85, микро- и анизоцитоз; средний диаметр эритроцитов – < 6,5 мкм; общая железосвязывающая способность сыворотки – > 64,4 мкмоль/л; сывороточное железо – < 12,6 мкмоль/л и уровень сывороточного ферритина (в норме 32–35 мкг/л), который служит индикатором дефицита железа в организме (≤ 12 мкг/л).
Для лечения ЖДА необходимы сбалансированная диета и назначение железосодержащих препаратов.
Cогласно Национальным рекомендациям «Клинические рекомендации (протоколы лечения) – железодефицитная анемия» (2015 г.), терапия железодефицитных состояний требует комплексного подхода, который включает коррекцию питания, применение лекарственных средств, строго соответствующих определенному патогенетическому варианту анемии, использование преимущественно препаратов орального применения, адекватно высокие суточные дозы одного препарата с хорошей переносимостью. Возможно назначение трансфузии эритроцитов по жизненным показаниям. Оценивают эффект лечения по клинико-лабораторным признакам, в т. ч. по ретикулоцитарному кризу [8].
В первую половину беременности рекомендуется суточный рацион, состоящий из 110 г белков, 80 г жиров и 350–400 г углеводов. Общая энергетическая ценность суточного рациона должна составлять 2600–2800 ккал. Во вторую половину беременности количество белков должно быть увеличено до 125 г, жиров – до 70–90 г, углеводов – до 400–420 г, калорийность питания составляет в этом случае 2900–3050 ккал. Таким образом, в физиологических условиях коррекция рациона может обеспечивать потребности организма в железе и предупреждать развитие железодефицитных состояний.
Однако, учитывая тот факт, что из пищи всасывается 2,5 мг железа в сутки, а из лекарственных препаратов – в 15–20 раз больше, необходима дотация железа лекарственными препаратами.
Рекомендуется назначение препаратов, содержащих Fe2+, FeSO4, из-за их лучшей абсорбции. Суточная доза для профилактики анемии и лечения легкой формы заболевания – 50–60 мг Fe2+, а для лечения выраженной анемии – 100–120 мг Fe2+. Железа сульфат назначают внутрь по 320 мг (соответствует 100 мг Fe2+) 2 р./сут строго за 1 ч до или через 2 ч после еды, т. к. на абсорбцию влияют различные ингредиенты пищи.
Наиболее предпочтительным является прием препаратов железа внутрь, а не в виде инъекций, т. к. в последнем случае чаще могут возникать различные побочные эффекты: запор, вздутие живота, понос, изжога, боли в желудке, тошнота, темный стул.
Причинами неэффективной терапии препаратами железа могут быть:
1) отсутствие ЖДА;
2) недостаточная доза лекарства;
3) недостаточная длительность лечения;
4) нарушение всасывания в кишечнике;
5) одновременный прием препаратов, уменьшающих всасывание железа;
6) имеющаяся незначительная кровопотеря (геморрой и пр.).
Из лекарственной формы всасывается не более 10–12% содержащегося в ней железа. При тяжелой степени дефицита железа показатель всасываемости железа может возрастать до 3-х раз. Повышению биодоступности железа способствуют присутствие аскорбиновой и янтарной кислот, фруктозы, цистеина и других акселераторов, а также использование в ряде препаратов специальных матриц, замедляющих высвобождение железа в кишечнике [3, 4].
Расчет суточного количества препарата (СКП) для пероральных препаратов железа выполняют по следующей формуле:
СКП = НСД/СЖП
где НСД – необходимая суточная доза двухвалентного или трехвалентного (не элементарного) железа (у взрослых – 200 мг/сут, у детей – 30–100 мг/сут);
СЖП – содержание двухвалентного или трехвалентного (не элементарного) железа в единице препарата (таблетке, капсуле, капле раствора, миллилитре сиропа или раствора) [5].
Расчет ориентировочной курсовой дозы препарата железа, назначаемого парентерально, может быть произведен по формуле с учетом массы тела больного и уровня гемоглобина, отражающего степень дефицита железа:
А=М(Hb1–Hb2) × 0,24+D,
где A – количество железа в мг;
M – масса тела в кг;
Hb1 – нормативная величина гемоглобина для массы тела < 35 кг – 130 г/л, > 35 кг – 150 г/л;
Hb2 – уровень гемоглобина у пациента в г/л;
D – расчетная величина депо железа для массы тела < 35 кг – 15 мг/кг, для массы тела > 35 кг – 500 мг.
Оптимальная суточная доза для препаратов железа при лечении ЖДА должна соответствовать необходимой суточной дозе и рассчитываться по приведенным формулам. Применение меньших доз препаратов не дает адекватного клинического эффекта. При латентном дефиците железа или для насыщения депо после окончания курса терапии применяются половинные относительно лечебных дозы препаратов [9].
Из железосодержащих препаратов особого внимания заслуживают многокомпонентные оральные препараты. Предпочтение данных препаратов обусловлено отсутствием или низкой частотой побочных эффектов, а главное, быстрым увеличением уровня гемоглобина и нормализацией показателей ферростатуса. Положительный эффект объясняется дополнительными компонентами в составе этих препаратов. Оптимальный препарат должен состоять из сульфата железа в достаточном количестве, аскорбиновой кислоты, превышающей в 2–5 раз количество железа в препарате, больших доз фолиевой кислоты и цианокобаламина. Эти компоненты принимают активное участие в процессах метаболизма железа в организме, обеспечивая лучшую абсорбцию этого микроэлемента из ЖКТ.
На сегодняшний день представлен большой выбор ферропрепаратов, различающихся по составу. Препаратом, наиболее удовлетворяющим всем основным требованиям, является Сорбифер.
Форма выпуска препарата в оболочке предотвращает образование желтой каймы на зубах при длительном приеме. Препарат содержит 320 мг сульфата железа (что соответствует100 мг двухвалентного железа) и 60 мг аскорбиновой кислоты (для улучшения всасывания и усвоения микроэлемента). Мы использовали схему приема препарата – 1 таблетка 2 р./сут. Основными достоинствами препарата являются наименьшая частота побочных эффектов, быстрое купирование объективных и субъективных клинических признаков ЖДА, хорошая переносимость [9, 10]. Эти качества наиболее важны при выборе метода лечения ЖДА у беременных. Дополнительные компоненты препарата обеспечивают лучшую абсорбцию железа и профилактику поливитаминной недостаточности у женщин во время беременности. Результаты исследований доказывают, что Сорбифер оказывает положительное влияние на общее состояние беременной.
Основные схемы лечения препаратом Сорбифер с приемом внутрь после еды: при анемии легкой формы – по 1 таблетке 2 р./сут в течение 3–4-х нед.; при среднетяжелом течении – по 1 таблетке 3 р./сут в течение 8–12 нед., при тяжелой форме – по 2 таблетки 3 р./сут в течение 16 нед. и более. Оценка первых результатов лечения (по уровню гемоглобина) проводится уже через 2 нед. от начала терапии [10].
Таким образом, в настоящее время комбинированный препарат Сорбифер можно считать препаратом выбора при лечении беременных с ЖДА.
Цель исследования: оценка эффективности применения препарата Сорбифер в коррекции ЖДА во время беременности.
Материал и методы
Для реализации поставленной цели были проведены клинико-лабораторное обследование и лечение 33 беременных во II триместре гестации (13–20 нед.) с ЖДА в сочетании с угрозой прерывания различного генеза.
Возраст беременных варьировал от 16 до 39 лет (средний возраст – 27,5±5,6 года).
Результаты анализа свидетельствуют, что характерными для обследованных пациенток явились следующие особенности: высокая частота инфекционных заболеваний, наличие сопутствующей экстрагенитальной патологии, особенно со стороны желудочно-кишечного тракта, хронические очаги инфекции, осложненное течение предыдущих беременностей. ЖДА при предыдущей беременности имела место у 14 (42%) женщин. В обследованной группе первобеременных было 5 (15,1%), первородящих – 9 (27,2%). Из 28 (84%) повторно беременных лишь у 11 (33%) женщин предыдущие беременности закончились срочными родами; у 5 (15,1%) пациенток в анамнезе были самопроизвольные выкидыши и у 3-х женщин (9%) – неразвивающаяся беременность.
Все пациентки предъявляли жалобы на общую слабость, утомляемость, нарушение сна и тянущие боли в низу живота.
Для подтверждения диагноза ЖДА проводилось исследование показателей периферической крови: уровня гемоглобина (Hb), эритроцитов, цветового показателя. Для оценки запасов железа использовано также определение уровня сывороточного железа (Fe) и ферритина (SF). О тяжести течения ЖДА судили по уровню гемоглобина. У 20 беременных имела место легкая степень анемии (снижение уровня гемоглобина от 90 до 110 г/л) и у 13 – средняя степень (снижение уровня гемоглобина от 70 до 89 г/л).
Все беременные, помимо терапии, направленной на пролонгирование беременности (спазмолитики, антиоксиданты, гормоны по показаниям), для лечения анемии получали препарат Сорбифер, который назначали внутрь после еды 3 р./сут в течение 3–4-х нед. при ЖДА легкой степени и в течение 8–10 нед. при ЖДА средней степени тяжести.
До назначения Сорбифера лечение другими железосодержащими препаратами не проводилось. У каждой беременной до и после приема препарата Сорбифер определяли гематологические и феррокинетические параметры.
Результаты и обсуждение
Результаты изучения показателей до и после лечения препаратом представлены в таблице 1.
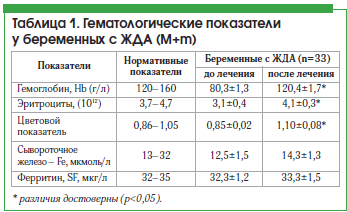
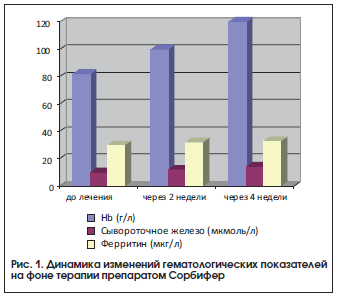
Как видно из приведенных данных, у пациенток после лечения препаратом Сорбифер наблюдались достоверное (р<0,05) увеличение содержания гемоглобина, цветового показателя и уровня эритроцитов, а также увеличение уровня сывороточного железа, хотя разница показателей до и после лечения была недостоверной, что, возможно, связано с наличием легкой степени тяжести ЖДА у большинства пациенток (рис. 1). Нами не выявлено снижение уровня ферритина. Однако, согласно имеющимся данным, содержание сывороточного железа не всегда отражает показатели запасов железа, т. к. оно зависит от скорости высвобождения ферритина из тканей и плазмы [6].
За время наблюдения состояние беременных значительно улучшилось: купировались признаки угрозы прерывания беременности, исчезли жалобы на слабость, утомляемость, нарушение сна. Необходимо также отметить, что за время лечения препаратом Сорбифер побочных эффектов, таких как аллергические реакции, желудочно-кишечные расстройства и др., не наблюдалось.
Таким образом, включение препарата Сорбифер в лечение беременных с ЖДА способствует нормализации показателей периферической крови, улучшению состояния пациенток, а также пролонгированию беременности, что является одним из факторов профилактики невынашивания беременности.


