Анемия гемолитическая наследственная сфероцитарная анемия
Гемолитическая анемия (лат. anaemia haemolytica от др.-греч. αἷμα «кровь» + λύσις «разрушение, растворение» + анемия) — групповое название редких заболеваний, общим признаком которых является усиленное разрушение эритроцитов, обусловливающее, с одной стороны, анемию и повышенное образование продуктов распада эритроцитов, с другой стороны — реактивно усиленный эритропоэз.
Клинические проявления[править | править код]
Увеличение продуктов распада эритроцитов клинически проявляется желтухой лимонного оттенка, повышением содержания в крови непрямого (неконъюгированного) билирубина (гипербилирубинемия) и сывороточного железа, плейохромией желчи и кала, уробилинурией.
При внутрисосудистом гемолизе добавочно возникают гипергемоглобинемия, гемоглобинурия, гемосидеринурия.
Об усилении эритропоэза свидетельствуют ретикулоцитоз и полихроматофилия в периферической крови, эритронормобластоз костного мозга.
Классификация гемолитической анемии[править | править код]
Наиболее часто встречающиеся формы гемолитической анемии:
- Наследственные (врождённые) формы гемолитической анемии:
- Мембранопатии эритроцитов (нарушение строения эритроцитов):
- микросфероцитарная,
- овалоцитарная,
- акантоцитарная.
- Энзимопенические (ферментопенические) — анемии, связанные с нехваткой какого-либо фермента.
- связанные с дефицитом ферментов пентозо-фосфатного ряда,
- связанные с дефицитом ферментов гликолиза,
- связанные с дефицитом ферментов, участвующих в образовании, окислении и восстановлении глутатиона,
- связанные с дефицитом ферментов, участвующих в использовании АТФ,
- связанные с дефицитом ферментов, участвующих в синтезе порфиринов.
- Гемоглобинопатии:
- гемоглобинопатии качественные (Серповидно-клеточная анемия)
- талассемия (нарушение синтеза одной из полипептидных цепей гемоглобина).
- Мембранопатии эритроцитов (нарушение строения эритроцитов):
- Приобретённые формы гемолитической анемии:
- Иммуногемолитические анемии:
- аутоимунные,
- изоимунные.
- Приобретённые мембранопатии:
- пароксизмальная ночная гемоглобинурия,
- шпороклеточная анемия.
- Связанные с механическим повреждением эритроцитов:
- маршевая гемоглобинурия,
- болезнь Мошкович (микроангиопатическая гемолитическая анемия),
- возникающая при протезировании клапанов сердца
- Токсические.
- гемолитические анемии при приеме лекарственных средств и гемолитических ядов.
- Иммуногемолитические анемии:
- Другие гемолитические анемии
- гемолитическая желтуха новорождённых, при которой материнские антитела разрушают эритроциты плода или ребёнка,
- идиопатическая (примерно 50 % случаев гемолитических анемий),
- вторичная (например при лимфоме, причём анемия может быть первым проявлением лимфомы)
Лечение[править | править код]
Так как любая анемия это синдром какого-либо заболевания, необходимо адекватное лечение вызвавшего анемию заболевания. Установить причину анемии.
При гемолитической анемии:
- спленэктомия
- глюкокортикостероиды при аутоиммунных гемолитических анемиях в средних дозах
- иммунодепрессанты
- трансфузия эритроцитов при гемолитических кризах, нужны отмытые эритроциты, индивидуально подобранные
- при повышении уровня железа необходимо его удалить — десферал
Если антитела при гемолитической анемии активны только при низкой температуре — они называются холодовыми, если они активны при температуре тела — тепловыми.
Классификация по МКБ-10
Источники информации[править | править код]
- Классификация гемолитической анемии приведена по: Ю.И. Лорие, 1967; Л.И. Идельсон, 1975.
- БМЭ. 1977. т.5
- Дж. Мёрта. Справочник врача общей практики. 1230 с, 540 илл. Пер. с англ. Мак-Гроу — Хилл Либри Италия.
Наследственная сфероцитарная гемолитическая анемия (болезнь Минковского — Шоффара; врожденная микросфероцитарная гемолитическая анемия, врожденный сфероцитоз)
Наследственная сфероцитарная гемолитическая анемия впервые наиболее обстоятельно описана в 1900 г. Minkowsky и в 1907 г. Chauffard. В основе заболевания лежит генетический дефект эритроцитов, приводящий к изменению их формы — к сфероцитозу и к снижению минимальной осмотической резистентности к гипотоническим растворам поваренной соли.
Патогенез болезни до сих пор остается недостаточно ясным. До конца неизвестна истинная причина и характер внутриклеточного дефекта эритроцитов (Aussannaire с соавт., 1960). Предположение о врожденном нарушении метаболизма эритроцитов в результате ферментных дефектов высказывают Dacie (1954), Prankerd с соавт. (1955, 1960). Имеются работы, указывающие на недостаток энзима энолазы в эритроцитах больных (Motulsky с соавт., 1958). Нарушение нуклеотидного состава красных кровяных телец отмечали Corsini с соавт. (1967), Mircevova с соавт. (1967).
Изменение обмена дезоксинуклеазы у детей со сфероцитарной гемолитической анемией наблюдал Willy (1967). Исследования Shojania с соавт. (1964) свидетельствуют о снижении уровня фолиевой кислоты у больных с данным заболеванием. Работы Jacob (1967, 1968) указывают на увеличение проницаемости оболочки сфероцитов для ионов натрия. Повышенная проницаемость натрия через оболочку эритроцитов сопровождается потерей их осмотической устойчивости в результате снижения концентрации ионов калия и выхода липидов.
Имеется предположение, что сфероцитоз эритроцитов при данном заболевании является результатом нарушения в них транспорта катионов, связанный с изменением контрактильных свойств мутантного белка, содержащегося в мембране эритроцитов и обладающего АТФазной активностью.
Применяя метод кислотных эритрограмм, М. Д. Бриллиант и А. И. Воробьев (1962) выявили нарушение проницаемости мембраны эритроцитов и изменение их липидного состава у взрослых больных со сфероцитарной гемолитической анемией. Подобное наблюдали и Cooper, Sande (19ЬУ). Сферуляцию эритроцитов А. И. Осипов (1965) связывает с «поломом» в системе АТФ — АТФазы, поскольку АТФ способствует сохранению формы эритроцитов и поддерживает в них баланс Na и К (Schrier, 1967). Лабораторные исследования Mochler (1967) определяют in vitro снижение гемолиза сфероцитов при добавлении к ним АТФ, глюкозы, глютатиона.
На повышение АТФазной активности при сфероцитарной гемолитической анемии указывают В. Г. Соловьев, Н. П. Ша балов (1970). Данный факт они связывают с наследственным дефектом обмена липидов в мембране эритроцитов. Повышение активности глюкозо6фосфатдегидрогеназы и транскеталазы наблюдал Ю. Р. Ковалев (1970). Наибольшую активность глюкозо6фосфатдегидрогеназы Б. Я. Резник и Ю. А. Сорока отмечают во время криза. Высокую активность гексокиназы у больных со сфероцитарной гемолитической анемией наблюдал Ю. А. Сорока (1973).
Внутриклеточные молекулярные изменения, происходящие при наследственной сфероцитарной гемолитической анемии, способствуют сферуляции эритроцитов, что сопровождается уменьшением их диаметра, увеличением толщины и объема. Цикл жизни сфероцитов укорачивается. Длительность их жизни, определяемая методом Эшби (1919) и с помощью радиоактивных изотопов, сокращается иногда до 18 дней (Я. Д. Сахибов, 1967) при норме 90 — 120 дней.
Наблюдения Э. Г. Метровелли (1966) и Ф. Б. Репиной (1968) выявили укорочение длительности жизни эритроцитов иногда до 1 — 1,5 дня у детей, больных наследственной сфероцитарной гемолитической анемией.
Длительное время дискутировался вопрос о роли селезенки при данном заболевании. Minkowsky (1900), Eppinger, Charnas с соавт. (1913), Heilmeyer (1950) и др. основное значение придавали селезенке в развитии гемолитического процесса, считая, что селезенка способствует сферуляции и разрушению эритроцитов. Свое предположение они основывали на том, что удаление селезенки приводит к выздоровлению больных. Однако последующие наблюдения опровергли эту точку зрения. Перекрестное переливание эритроцитов от больных сфероцитарной гемолитической анемией здоровым указали на сокращение цикла жизни сфероцитов в их крови и нормальную длительность жизни эритроцитов донора в крови больных сфероцитарной гемолитической анемией. Эти опыты указывают на непричастность в данных ситуациях селезенки (Mollison с соавт., 1949; Dacie, 1954).
Исследования Г. А. Алексеева (1970) осмотической резистентности эритроцитов крови селезеночной вены (во время спленэкто мии) показали их более высокую осмотическую резистентность в сравнении с эритроцитами периферической крови, что указывает на отсеивающую роль селезеночного фильтра. В селезенке происходит гемолиз подготовленных к распаду эритроцитов, чему способствует медленное кровообращение в ней, и узкие устья венозных синусов, где происходит трав матизация неполноценных эритроцитов. Все сказанное свидетельствует о том, что основная причина гемолиза эритроцитов при наследственной сфероцитарной гемолитической анемии заключается в самих эритроцитах, в их генетической неполноценности. Роль селезенки в гемолитическом процессе является вторичной. Однако в последние годы появились высказывания о том, что селезенка не является простым «кладбищем» эритроцитов при этом заболевании. Ее роль в патологическом процессе сложнее (Д. Ф. Окунев, 1926; Ю. И. Лорие, 1964).
Остается нерешенным вопрос о месте сферуляции эритроцитов в костном мозге или в периферической крови. Измерение диаметра ретикулоцитов и клеток костного мозга показало их нормальные размеры, что свидетельствует о процессе сферуляции эритроцитов уже по выходе из костного мозга.
При наличии интенсивного гемолиза эритроцитов селезенка гиперплазирует и вторично усиливает проявление основного заболевания, т. е. ведет к возникновению явлений вторичного гиперспленизма. На усиление функции ретикулогистиоцитарной системы при гемолитической анемии указывает Я. Г. Ужанский (1968). Секвестрацию эритроцитов в селезенке при гемолитической анемии наблюдал с помощью радиоизотопов Veeger с соавт. (1961).
Повышенное разрушение эритроцитов в клетках ретикулогистиоцитарной системы селезенки приводит у больных сфероцитарной гемолитической анемией к повышенному освобождению свободного билирубина и накоплению его в крови. Этот пигмент, прокрашивая кожу, слизистые оболочки и внутренние органы, ведет к появлению желтухи. Одновременно со свободным билирубином освобождается железо, в результате чего его количество увеличивается в сыворотке крови, что способствует развитию вторичного гемосидероза органов (В. Я. Орлова, 1962).
Целесообразная реакция организма, стремящегося к компенсации возникших в нем нарушений, выражается у больных в активации деятельности кроветворной системы. Гиперлазирует костный мозг, в крови появляются молодые недостаточно зрелые элементы эритропоэза — ретикулоциты, нормобласты.
«Гемолитические анемии у детей»,
М.Я.Студеникин, А.И.Евдокимова
Сущность лекарственного гемолиза эритроцитов при дефиците Г6ФД заключается в следующем. При встрече эритроцитов с гемолизирующим веществом окислительного действия в норме происходит компенсаторное усиление активности Г6ФД для поддержания редукции глютатиона на необходимом уровне. При наследственном дефиците Г6ФД резервные возможности эритроцитов снижаются и поэтому при встрече их с гемолизирующими агентами резко нарушается процесс восстановления глютатиона, что приводит…
В настоящее время привлекают внимание заболевания, связанные с наследственной недостаточностью ферментов — энзимопатии. Открыто много внутри-эритроцитарных ферментов, недостаток которых может способствовать появлению гемолитической анемии. Ферментопатии можно разделить на две группы. К первой группе относятся дефициты пируваткиназы, глюкозофосфатизомеразы, триозофосфатизомеразы, гексокиназы, фосфофруктокиназы, АТФазы и др. При дефиците ферментов этой группы у больных нарушается течение внутриклеточных гликолитических процессов…
Артур Г., 10 лет. Поступил в клинику 4.1 1971 г. Отец армянин, мать — азербайджанка. У родителей умеренная гипохромная анемия. Мальчик родился весом 3550 г. С раннего возраста страдает экссудативным диатезом. В возрасте 4 лет впервые выявлена анемия. При поступлении в клинику состояние средней тяжести, бледный, склеры субиктеричные, изменения в скелете — «башенный» череп, прогнатизм,…
При гемоглобинозах Н и Zurich чаще всего после дачи лекарственных препаратов развивается гемолитический криз и иногда очень тяжелый. При этом моча может приобретать темный цвет за счет выделения дипирроллов мезабилифусциновой группы. По органам удается выявить спленомегалию. Диагностика гемоглобинопатий группы нестабильных гемоглобинов проводится с помощью лабораторных методов исследования. Они включают достаточно большой арсенал методик, способствующих не…
У большинства гемоглобинов этой группы в каком-то положении р-цепей имеется замена одних аминокислотных остатков на другие. Это приводит к изменению электрофоретической подвижности (преимущественно они мигрируют между гемоглобинами A и А2), нарушению соединения гема с глобином (НЬН Hammersmith, Koln), увеличению образования метгемоглобина (in vivo и in vitro), легкой денатурации белка под влиянием некоторых химических веществ (сульфопрепаратов,…

Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для данной группы заболеваний типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
Общие сведения
Гемолитическая анемия (ГА) — малокровие, обусловленное нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Данная группа анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных когортах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. Патология характеризуется укорочением жизненного цикла эритроцитов и их распадом (гемолизом) раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).
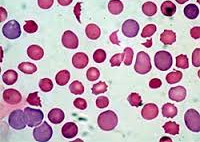
Гемолитическая анемия
Причины
Этиопатогенетическую основу наследственных гемолитических синдромов составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфофункциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды, среди которых:
- Аутоиммунные процессы. Образование антител, агглютинирующих эритроциты, возможно при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии). Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода.
- Токсическое действие на эритроциты. В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Вызывать разрушение клеток крови может прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков).
- Механическое повреждение эритроцитов. Гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.

Гемолитическая анемия
Патогенез
Центральным звеном патогенеза ГА является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. При аутоиммунном механизме анемии происходит образование антиэритроцитарных АТ (тепловых, холодовых), которые вызывают ферментативный лизис мембраны эритроцитов. Токсические вещества, являясь сильнейшими окислителями, разрушают эритроцит за счет развития метаболических, функциональных и морфологических изменений оболочки и стромы красных кровяных телец. Механические факторы оказывают прямое воздействие на клеточную мембрану. Под влиянием этих механизмов из эритроцитов выходят ионы калия и фосфора, а внутрь поступают ионы натрия. Клетка разбухает, при критическом увеличении ее объема наступает гемолиз. Распад эритроцитов сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
Классификация
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные. Наследственные ГА включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии — анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные ГА подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные) – обусловлены воздействием антител
- токсические – анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- механические — анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Симптомы
Наследственные мембранопатии, ферментопении и гемоглобинопатии
Наиболее распространенной формой данной группы анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке. Манифестация микросфероцитарной ГА возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом — обтурационная желтуха. При микросфероцитозе во всех случаях увеличена селезенка, а у половины пациентов – еще и печень. Кроме наследственной микросфероцитарной анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Энзимопенические анемии связаны с недостатком определенных ферментов эритроцитов (чаще — Г-6-ФД, глутатион-зависимых ферментов, пируваткиназы и др). Гемолитическая анемия может впервые заявлять о себе после перенесенного интеркуррентного заболевания или приема медикаментов (салицилатов, сульфаниламидов, нитрофуранов). Обычно заболевание имеет ровное течение; типична «бледная желтуха», умеренная гепатоспленомегалия, сердечные шумы. В тяжелых случаях развивается ярко выраженная картина гемолитического криза (слабость, рвота, одышка, сердцебиение, коллаптоидное состояние). В связи с внутрисосудистым гемолизом эритроцитов и выделением гемосидерина с мочой последняя приобретает темный (иногда черный) цвет. Особенностям клинического течения гемоглобинопатий — талассемии и серповидно-клеточной анемии посвящены самостоятельные обзоры.
Приобретенные гемолитические анемии
Среди различных приобретенных вариантов чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер. Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка. При некоторых формах аутоиммунных анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия. Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Осложнения
Каждый вид ГА имеет свои специфические осложнения: например, ЖКБ – при микросфероцитозе, печеночная недостаточность – при токсических формах и т.д. К числу общих осложнений относятся гемолитические кризы, которые могут провоцироваться инфекциями, стрессами, родами у женщин. При остром массивном гемолизе возможно развитие гемолитической комы, характеризующейся коллапсом, спутанным сознанием, олигурией, усилением желтухи. Угрозу жизни больного несут ДВС-синдром, инфаркт селезенки или спонтанный разрыв органа. Неотложной медицинской помощи требуют острая сердечно-сосудистая и почечная недостаточность.
Диагностика
Определение формы ГА на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки. Лабораторный диагностический комплекс включает:
- Исследование крови. Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. При аутоиммунных анемиях большое диагностическое значение имеет положительная проба Кумбса.
- Анализы мочи и кала. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина.
- Миелограмму. Для цитологического подтверждения выполняется стернальная пункция. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, порфирии, гемобластозы. Пациента консультируют гастроэнтеролог, клинический фармаколог, инфекционист и другие специалисты.

Аутоиммунная гемолитическая анемия
Лечение
Различные формы ГА имеют свои особенности и подходы к лечению. При всех вариантах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной анемии выполняется спленэктомия. Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов.
Прогноз и профилактика
Течение и исход зависят от вида анемии, тяжести протекания кризов, полноты патогенетической терапии. При многих приобретенных вариантах устранение причин и полноценное лечение приводит к полному выздоровлению. Излечения врожденных анемий добиться нельзя, однако возможно достижение длительной ремиссии. При развитии почечной недостаточности и других фатальных осложнений прогноз неблагоприятен. Предупредить развитие ГА позволяет профилактика острых инфекционных заболеваний, интоксикаций, отравлений. Запрещается бесконтрольное самостоятельное использование лекарственных препаратов. Необходимо тщательная подготовка пациентов к гемотрансфузиям, вакцинации с проведением всего комплекса необходимых обследований.


