Анемия федеральные клинические рекомендации
В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
В настоящей публикации на основании данных литературы и анализа собственных наблюдений представлены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий, а также принципы их лечения у детей. Установлено, что основной формой дефицитных анемий (ДА) в педиатрической популяции является анемия, обусловленная недостаточным содержанием в организме железа. При этом особо подчеркивается, что железодефицитная анемия (ЖДА) не только наиболее распространенная ДА, но и самое частое гематологическое заболевание у детей [1–3]. С учетом того, что другие типы анемий (в т. ч. развивающиеся при дефиците таких витаминов, как фолиевая кислота и В12) хуже известны врачам-педиатрам, их верификация, как правило, запаздывает, т. к. они ошибочно принимаются за ЖДА. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма и ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения дифференциальной диагностики и лечения анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Дифференциальная диагностика ДА у детей
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).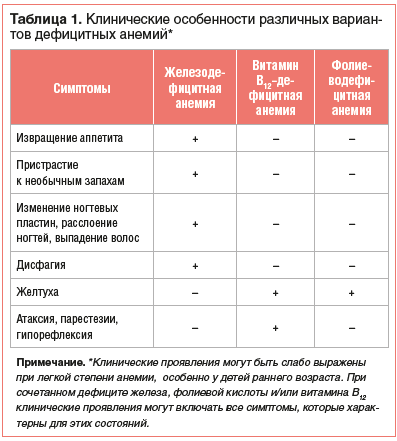
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).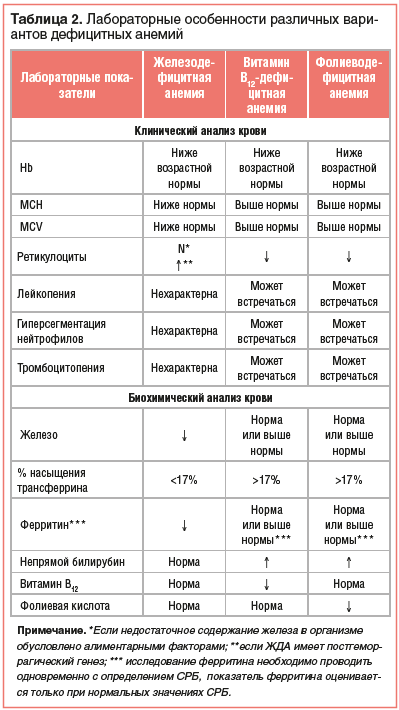
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Лечение ДА у детей
Корректная трактовка клинико-анамнестических данных и результатов лабораторного обследования позволяет верифицировать причину ДА и своевременно назначить адекватную терапию. Принципиально важным при этом является положение о том, что компенсировать дефицитные состояния невозможно только за счет нормализации рациона питания. Основная роль в купировании дефицита железа, фолиевой кислоты и витамина В12 принадлежит заместительной фармакотерапии [1–7]. При этом для лечения ЖДА используются солевые препараты железа или препараты на основе железа гидроксид полимальтозата. Суточная доза препаратов зависит от массы тела и возраста ребенка, расчет при этом проводится по элементарному железу. Так, для солевых препаратов железа, назначаемых внутрь, используются следующие дозы (расчет по элементарному железу!): для детей до 3 лет — 3 мг/кг/сут, для детей старше 3 лет — 45–60 мг/сут, для подростков —
до 120 мг/сут. При использовании пероральных форм железа гидроксид полимальтозата рекомендованные дозы составляют 5 мг/кг/сут (расчет по элементарному железу!). Продолжительность терапии препаратами железа зависит от степени тяжести ЖДА. При легкой ЖДА курс лечения составляет 3 мес., при среднетяжелой форме — 4,5 мес., при тяжелой — до 6 мес. [3].
В случае диагностики фолиеводефицитной анемии заместительная терапия проводится препаратами фолиевой кислоты. Рекомендовано использовать следующие суточные дозы фолиевой кислоты: для детей до 1 года — 0,25–0,5 мг/сут, для детей старше 1 года — 1,0 мг/сут. При синдроме мальабсорбции доза может быть повышена до 5–15 мг фолиевой кислоты в сутки. Терапия проводится в указанных дозах ежедневно на протяжении 4–6 нед. Через 7 дней от начала лечения необходимо выполнить клинический анализ крови с обязательным подсчетом ретикулоцитов (рис. 1). Повышение уровня ретикулоцитов на фоне приема фолиевой кислоты указывает на правильно установленный диагноз и является обоснованием для продолжения терапии. Купирование анемии достигается через 4–6 нед. от начала лечения [6].
Для лечения витамин В12-дефицитной анемии используют препараты цианокобаламина для парентерального введения. При этом рекомендовано придерживаться следующего режима дозирования: для детей до 1 года — 5 мкг/кг/сут, для детей старше 1 года — 100 мкг/сут, для подростков — 200 мкг/сут. Препарат вводится внутримышечно 1 р./сут ежедневно. На 7–10-й день терапии проводят клинический анализ. Выявление ретикулоцитоза позволяет сделать вывод об эффективности проводимого лечения. Терапию следует продолжить в том же режиме дозирования еще в течение 3–4 нед. В дальнейшем, при достижении нормализации уровня гемоглобина, переходят на поддерживающее лечение: цианокобаламин вводят в терапевтической дозе 1 раз в 7 дней в течение 2 мес., а затем 1 раз в 14 дней в течение 6 мес. (рис. 2). Учитывая, что дефицит витамина В12, как правило, редко обусловлен алиментарными факторами, одновременно проводят поиск причин данного патологического состояния (болезнь Крона, целиакия, инвазия широким лентецом, наследственные нарушения всасывания и/или транспортировки витамина В12 и др.) [7]. В тех случаях, когда имеют место полидефицитные состояния с развитием анемического синдрома, оправданно комбинированное заместительное лечение. Чаще всего у детей встречается сочетанный дефицит железа и фолиевой кислоты, что требует одновременного назначения препаратов железа и фолиевой кислоты.
Заключение
Таким образом, выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. Своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка. Авторы выражают надежду, что информация, представленная в настоящей публикации, будет полезна практикующим врачам-педиатрам.
Син.: анемия воспаления
Код по МКБ-1 D63.8
Анемия хронических болезней (АХБ) является второй по распространенности после
ЖДА и наблюдается у пациентов с острой или хронической активацией иммунной
системы вследствие различных как инфекционных, так и неинфекционных заболеваний
(см. рисунок).

Рисунок 1. Наиболее частые причины анемий в клинической практике.
Наиболее частые состояния, которые могут приводить к развитию АХБ, представлены в таблице (см. таблицу).
В настоящее время считается, что образование гепцидина – ключевой механизм развития АХБ. Являясь гормоном, секретируемым гепатоцитами в условиях воспаления, гепцидин блокирует всасывания железа в кишечнике и реутилизацию железа из депо (депонирование железа в клетках моноцитарно-макрофагальной системы), тем самым снижая концентрацию железа в плазме крови, что способствует развитию железодефицитного эритропоэза. Другим важным фактором развития АХБ является неадекватно низкая продукция ЭПО вследствие избыточной продукции провоспалительных цитокинов. Таким образом, ведущую роль в развитии АХБ играет
комплекс факторов, основными из которых являются нарушение гомеостаза железа
вследствие повышенной продукции гепцидина и нарушение эритропоэза в виде
неадекватно низкой продукции ЭПО степени анемии, что является патогенетическим
обоснованием терапевтического применения при них эритропоэзстимулирующих
препаратов (ЭСП).
АХБ развивается не только при хронических, но и острых воспалительных заболеваниях. Снижение уровня Hb можно обнаружить уже менее, чем через 2 недели
от начала заболевания. Обычно это умеренная, микроцитарная анемия с уровнем Hb
90-130 г/л и гематокритом 30-40%. Лишь у 20% пациентов гематокрит может снижаться меньше 25%. При хроническом течении анемии, она становится более
гипохромной с более выраженным воспалительным компонентом в ее этиологии. При
острой инфекции, когда анемия развивается быстро, она часто нормохромная.
| Заболевания, ассоциируемые с анемией хронических болезней | Предположительная распространенность анемии при данном заболевании (%) |
|---|---|
Инфекции (острые и хронические)
| 18 – 95 |
Рак
| 30 – 77 |
Аутоиммунные реакции
| 8 – 71 |
Хроническая реакция трансплантат против | 8 – 70 |
Хронические заболевания почек | 23 – 50 |
1.1. Особенности диагностики анемии хронических болезней
Принципиальное различие между ЖДА и АХБ заключается в том, что ЖДА имеет
отношение к абсолютному дефициту железа, тогда как патофизиология АХБ является
мультифакторной. С высокой долей вероятности об АХБ следует думать, если анемия
развилась на фоне тяжелых заболеваний. АХБ необходимо также исключить в случаях,
когда перо-ральная ферротерапия в течение 4 нед не привела к повышению НЬ >10 г/л.
С этой целью проводится определение биохимических показателей обмена железа с расчетом коэффициента НТЖ и концентрации сывороточного ферритина СФ (см. клинические рекомендации по ЖДА, дифференциальная диагностика). Следует
учитывать, что уровень СФ повышается в условиях воспаления (острые и хронические
инфекции, болезни печени, аутоиммунные и онкологические заболевания), что может
маскировать наличие дефицита железа (ДЖ). Поэтому при повышенном уровне СРБ
(>10 мкг/л) ДЖ констатируется при СФ <50 мкг/л.
Для выявления ДЖ в случаях часто встречающегося сочетания ЖДА и АХБ, при
котором ФС, как правило, нормальный или повышен, в клинической практике
рекомендуется использование коэффициента НТЖ. У пациентов с АХБ в сочетании с
ДЖ НТЖ меньше возрастного уровня, представленного в таблице см. таблицу.
Насыщение трансферрина железом, % | – 1–2 года — < 9% – 3–5 лет — < 13% – 6–15 лет — < 14% – старше 15 лет- <16% |
* не имеют самостоятельного значения для диагностики ДЖ
Нормальный уровень сывороточного трансферринового рецептора 1 (сТФР) и высокая концентрация гепцидина, характерные для АХБ, вероятно, имеют высокую
диагностическую ценность. Однако их применение в клинической практике ограничивается отсутствием доступных коммерческих тест-систем и стандартизации в
педиатрической практике.
1.2. Лечение АХБ
Адекватное лечение основного заболевания – наиболее эффективный способ лечения
АХБ. Однако лечение АХБ необходимо при всех хронических заболеваниях трудно
поддающихся терапии (системные заболевания соединительной ткани, хронические
воспалительные заболевания кишечника, ВИЧ-инфекция и др.), поскольку анемия
значительно ухудшает прогноз и исходы этих заболеваний и является независимым
фактором риска повышенной летальности. Поскольку гепцидин блокирует всасывания
железа в кишечнике, лечение АХБ пероральными препаратами железа не эффективно.
Частичный эффект от пероральной ферротерапии может наблюдаться у пациентов с АХБ, развившейся на фоне ДЖ. Внутривенная ферротерапия с патогенетической точки
зрения более целесообразна при АХБ, однако если она используется в виде
монотерапии (только в случаях доказанного при АХБ ДЖ по низкому уровню НТЖ или
ФС) следует ожидать высокого уровня резистентности (около 50%) к терапии. Это
связано с неадекватно низкой продукцией ЭПО степени тяжести анемии, характерной
для АХБ. Поэтому наиболее эффективной схемой лечения АХБ является
комбинированное использование ЭСП и внутривенных препаратов железа.
Использование пероральных препаратов железа вместо внутривенной ферротерапии
допустимо, но может снижать ответ на рчЭПО терапию.
В настоящее время самый большой опыт применения рч ЭПО у детей и подростков
имеется у пациентов с хронической почечной недостаточностью (см. соответствующие
клинические рекомендации). В литературе доступны немногочисленные публикации о
эффективности рч ЭПО в сочетании с препаратами железа при АХБ у детей.
С практической точки зрения уровень сывороточного ЭПО (с-ЭПО), определяемый у
пациента с анемией, не может просто сравниваться с нормальным значением ЭПО.
Продукция ЭПО почками увеличивается обратно пропорционально степени гипоксии
(снижения концентрации Hb). Поэтому уровень с-ЭПО следует оценивать
относительно степени тяжести анемии. В каждой лаборатории рекомендуется на
основании анализа данных обследования популяции пациентов с анемией (чаще с
ЖДА) рассчитать уравнение регрессии Hb-ЭПО, которое будет моделью адекватности
продукции ЭПО степени тяжести анемии.
Для врача-клинициста важно все анемии разделить на две большие группы: I – анемии
с адекватной продукцией ЭПО и II – анемии с неадекватно низкой продукцией ЭПО
степени тяжести анемии.
Оценку адекватности продукции ЭПО проводят на основании определения отношения
логарифма, определяемого (О) уровня ЭПО (в исследуемой сыворотке) к логарифму предполагаемого (П) уровня ЭПО (в контрольной сыворотке пациента с ЖДА с тем же уровнем Hb) – коэффициент О/П (log ЭПО). Продукцию ЭПО считают неадекватно низкой степени анемии при О/П (log ЭПО) < 0,8.
При анемии с адекватной продукцией ЭПО выявляется высокая степень обратной зависимости уровня Hb от концентрации сывороточного ЭПО. То есть, чем ниже уровень Hb, тем выше концентрация ЭПО в сыворотке крови. Моделью адекватной продукции ЭПО степени анемии является ЖДА (верхняя прямая см.рисунок). При анемиях с неадекватно низкой продукцией ЭПО обратная зависимость уровня Hb от концентрации ЭПО низкая (нижняя прямая см.рисунок). Уровень эндогенного ЭПО при этом виде анемии, если и повышается, то незначительно, и не соответствует
степени снижения уровня Hb (неадекватно низкая степени анемии продукция ЭПО). В группу ЭДА относятся: анемия при хронической почечной недостаточности, АХБ,
ранняя анемия недоношенных, анемия при злокачественных новообразованиях, анемия при хронической сердечной недостаточности, анемия беременных.

Рисунок 2. Зависимость между уровнем Hb и концентрацией сывороточного эритропоэтина (ЭПО) (Log шкала) при анемии с адекватной (верхняя прямая) и неадекватно низкой (нижняя прямая) продукцией ЭПО.
В клинической практике уровень с-ЭПО <100 МЕ/л при НЬ <100 г/л может служить
индикатором неадекватно низкой продукции ЭПО степени тяжести анемии и
предиктором эффективного ответа на рчЭПО-терапию.
Уменьшение продукции ЭПО при ЭДА приводит к гипопролифера-тивному эритропоэзу. Получен ряд убедительных данных, что неадекватно низкая продукция ЭПО является следствием воздействия провоспалительных цитокинов (IJ.-1.TNF-аи INF-y). Повышенные плазменные концентрации этих цитокинов описаны у пациентов с различными ЭДА. Выявление неадекватно низкой продукции ЭПО у пациента с анемией.
1.3. Протокол применения рекомбинантного человеческого эритропоэтина для лечения АХБ у детей и подростков
Показания к применению:
Hb < 100 г/л
Противопоказания к применению:
гематокрит свыше 0,6;
лейкоцитоз свыше 40×109/л;
тромбоцитоз свыше 700×109/л;
индивидуальная непереносимость препарата
Сроки лечения:
продолжительность терапии до 12 недель.
Режимы дозирования:
150-300 МЕ/кг 3 раза в неделю подкожно или 600 МЕ/кг 1 раз в неделю внутривенно.
Терапевтический режим:
стартовая доза рч ЭПО — 150 МЕ/кг
на фоне лечения рчЭПО необходимо дополнительно назначать внутрь
или внутривенно препараты железа в суточной дозе не более 5 мг/кг для
профилактики функционального дефицита железа.
Лабораторный контроль:
общий анализ крови с подсчетом количества эритроцитов, гемоглобина,
гематокрита, ретикулоцитов, тромбоцитов перед началом терапии и на фоне
лечения каждые 7-10 дней.
Требования к результатам лечения:
целевой уровень Hb – 110 г/л
Коррекция дозы рч ЭПО:
При отсутствии полного терапевтического ответа через 2 недели применения рч-
ЭПО в дозе 150 МЕ/кг, определяемого как повышение уровня гемоглобина на ≥ 10 г/л
от исходного при отсутствии трансфузий эритроцитарной массы, разовая доза препарата увеличивается на 50 МЕ/кг. Последующее увеличение дозы рч-ЭПО
предусматривается каждые 2 недели на 50 МЕ/кг при условии недостаточной скорости
прироста уровня гемоглобина (< 5 г/л в неделю), максимально 300 МЕ/кг. Если доза в
300 МЕ/кг не дает эффекта, дальнейшее повышение дозы нецелесообразно.
Максимальная продолжительность введения рч-ЭПО – 12 недель. Если уровень Hb
повышается чрезмерно быстро (более чем на 20 г/л в неделю) или если его концентрация превышает 120 г/л, следует прекратить введение препарата.
Применение ЭСП при АХБ у детей патогенетически обосновано, однако имеет недостаточную доказательную базу. Необходимы многоцентровые рандомизированные
исследования для того, чтобы высказаться за или против применения ЭСП при АХБ в педиатрической практике. До этих пор применение ЭСП возможно в рамках исследовательских протоколов, а также в некоторых исключительных случаях, например, по религиозным убеждениям, как альтернатива гемотрансфузиям.
Диспансерное наблюдение
Учитывая симптоматический характер анемического синдрома, продолжительность наблюдения определяется клиникой основного заболевания.