Анемия фанкони у детей клиника
Анемия Фанкони – это генетическое заболевание, которое передается по аутосомно-рецессивному типу и характеризуется нарушением кроветворения, формированием злокачественных новообразований, пороками развития, ломкостью хромосом. Проявляется частыми кровотечениями, кровоподтеками на коже, вялостью, бледностью, склонностью к инфекциям. Диагностика проводится лабораторными методами, назначаются цитогенетическое, молекулярно-генетическое и клиническое исследования крови, миелограмма. Основные способы лечения – пересадка костного мозга, медикаментозное поддержание кроветворения, переливание крови.
Общие сведения
Синонимичные названия анемии Фанкони – врожденная панмиелопатия Фанкони, наследственная панмиелопатия. Заболевание названо по фамилии швейцарского педиатра Гвидо Фанкони, который в 1927 году описал врожденную апластическую патологию на основе симптомов у трех братьев. Анемия Фанкони является редкой генетической болезнью, наследуется согласно аутосомно-рецессивному принципу. Эпидемиологические показатели низкие – 1 больной ребенок на 350 тысяч новорожденных. Распространенность одинакова среди представителей женского и мужского пола, выше в сообществах с разрешенными близкородственными браками, например, у некоторых южноафриканских народов.
Анемия Фанкони
Причины
Заболевание является наследственным, развивается при передаче дефектного гена от родителей к ребенку. Выявлено 15 генов, мутации которых проявляются анемией Фанкони. Из них 14 расположены в аутосомах и являются рецессивными, 1 тип гена находится в X-хромосоме (сцепленной с полом). Все эти гены отвечают за производство определенного фермента, участвующего в репарации ДНК.
Аутосомно-рецессивное наследование подразумевает, что и отец, и мать должны быть носителями патологической генетической информации. При этом сами они, как правило, здоровы. Вероятность рождения больного ребенка в такой паре составляет 25%. Генетическая панмиелопатия диагностируется у детей и взрослых, получивших от каждого из родителей один и тот же измененный ген. В крайне редких случаях анемия провоцируется передачей дефектной Х-сцепленной хромосомы. Женщины могут быть носительницами мутации, заболевание проявляется только у мальчиков. Риск развития патологии у сына при наличии у матери мутированного гена – 50%.
Патогенез
В норме в клетках организма существуют специальные ферментные системы, которые исправляют разрывы молекул ДНК, поврежденных в процессе биосинтеза или воздействия химических, физических реагентов. При анемии Фанкони обнаруживается генетический дефект в кластере белков, ответственных за репарацию ДНК, что приводит к повышенной ломкости хромосом. В итоге у пациентов развиваются нарушения функций костного мозга – неоплазии и апластическая анемия. Онкологические заболевания чаще всего представлены острым миелоидным лейкозом – злокачественной опухолью миелоидного ростка крови, провоцирующей накопление измененных белых клеток, подавляющих рост эритроцитов, тромбоцитов и нормальных лейкоцитов. При апластической анемии в результате дисплазии костного мозга резко угнетается рост и созревание всех трех видов клеток крови.
Симптомы анемии Фанкони
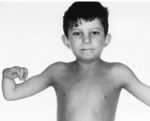
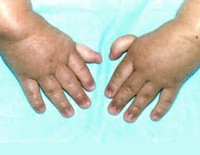
Более чем у половины пациентов наблюдаются врожденные аномалии развития внутренних органов и скелета. Костные деформации проявляются специфическим внешним видом: больные низкорослые, с уменьшенным размером головы, отсутствием или заметным укорочением большого пальца на руках, недоразвитием лучевой кости, врожденным вывихом бедра и/или наличием шейного ребра, косолапостью, недоразвитым подбородком («птичьим лицом»). Характерна гиперпигментация кожи в виде светлых и коричневатых пятен.
Неврологические расстройства представлены косоглазием, недоразвитием одного или двух глаз, опущением верхнего века, глазным дрожанием, глухотой, умственной отсталостью. Больные зачастую имеют незрелые половые органы, у них отсутствует одно или оба яичка. К распространенным аномалиям строения органов относятся пороки мочевыделительной системы: удвоение мочеточников или лоханки, подковообразные почки, почечные кисты, смещенное наружное отверстие уретры (гипоспадия). Врожденные пороки сердца включают атрезию трехстворчатого клапана, дефект межпредсердной перегородки, митральный стеноз, дефект межжелудочковой перегородки. Пациенты страдают от почечной и сердечной недостаточности.
Ключевые симптомы связаны с постепенным нарастанием нарушений в работе костного мозга. Чаще они дебютируют в детском возрасте (в 5-10 лет). Из-за снижения количества тромбоцитов развивается повышенная кровоточивость: при ранениях кровь долго не сворачивается, легко возникают носовые кровотечения, выделения при менструациях обильны, на теле обнаруживается много «беспричинных» кровоподтеков. Уменьшение числа эритроцитов проявляется анемией с характерной слабостью, быстрой утомляемостью, головокружениями, обмороками, бледностью кожи, учащенным сердцебиением и одышкой. Недостаток лейкоцитов способствует ухудшению сопротивляемости инфекциям. Впоследствии формируется лейкоз, миелодиспластический синдром, онкологические болезни.
Осложнения
Наиболее распространенным осложнением считаются частые инфекционные заболевания. У пациентов развивается ОРВИ, ангина, ринит, бронхит, грипп, тиф, герпес. Рецидивирующий характер болезней и их тяжелое течение приводят к деструкции органов, сопровождаются риском сепсиса. Другим осложнением наследственной анемии являются злокачественные новообразования – лейкемия, эпителиальные опухоли органов шеи и головы, половых органов. Рак у таких больных тяжело поддается лечению из-за повышенной ломкости и сниженной репарации ДНК. Это явление ограничивает применение лучевой терапии, цитотоксических препаратов. Нарушение свертываемости становится причиной больших кровопотерь.
Диагностика
Обследование больных проводят онкологи, гематологи, педиатры, врачи-генетики. Диагностика начинается с анализа анамнестических данных и жалоб. Врач выясняет, имеется ли данное наследственное заболевание у близких родственников, уточняет время появления первых признаков болезни, ранние обращения к врачам. При осмотре оценивает общее состояние пациента, выявляет наличие аномалий развития, гиперпигментированных пятен, кровотечений, кровоподтеков. В большинстве случаев не составляет труда обнаружить типичные деформации костей, недоразвитие глаз. Для подтверждения диагноза и различения анемии Фанкони с приобретенной анапластической анемией проводится ряд лабораторных исследований:
- Клинический анализ крови. Характерны изменения клеточного состава крови. На ранних этапах нарушения кроветворения диагностируется тромбоцитопения и лейкопения, на более поздних – панцитопения (резкое снижение объема эритроцитов, лейкоцитов и тромбоцитов). Возможен умеренный гемолиз без гипербилирубинемии, но с ретикулоцитозом. Значение СОЭ увеличено до 60-80 мм/ч.
- Цитогенетическое исследование клеток. Выполняется проба с диэпоксибутаном, митомицином C, указывающая на частоту и спектр хромосомных аберраций. В пользу генетической анемии рассматриваются показатели ДЭБ-теста более 45%, пограничный уровень – 11-45% (процент клеток с хромосомными разрывами).
- Молекулярно-генетический анализ клеток. Исследуются гены, мутации в которых могут привести к развитию заболевания. В 60-70% случаев мутации обнаруживаются в паре генов FANCA, в 14% – в аллели FANCC, в 10% – в генах FANCG. Частота мутаций в других парах – 0,2-3%.
- Миелограмма. По данным исследования определяется увеличение количества плазматических клеток и макрофагов, фагоцитирующих жиры. Содержание недифференцированных клеток – в пределах нормы. Снижена концентрация клеток миелоцитарного ростка, увеличен показатель лимфоцитов.
Лечение анемии Фанкони
Основная терапия направлена на восстановление процесса кроветворения. Методы лечения подбираются индивидуально, зависят от тяжести заболевания, возраста пациента, наличия и выраженности врожденных аномалий. Дополнительно проводится лечение инфекций и онкопатологий, осуществляются реабилитационные мероприятия. Для устранения анемии используются следующие методы:
- ТКМ. Трансплантация костного мозга является наиболее эффективной в долгосрочной перспективе, но имеет противопоказания, нередко сопровождается развитием осложнений. Оптимальный возраст для проведения операции – до десяти лет. Донорами могут выступать здоровые сестра и братья, подходящие по критериям совместимости. Предварительная интенсивная терапия (кондиционирование) связана с риском токсического воздействия на органы. После трансплантации сохраняется высокая вероятность острого или хронического иммунного конфликта между клетками донора и реципиента.
- Медикаментозная стимуляция кроветворения. При невозможности проведения трансплантации пациентам показано консервативное лечение, временно улучшающее их состояние. Выработка кровяных клеток стимулируется андрогенами (мужскими половыми гормонами) и гематопоэтическими факторами роста – эритропоэтином, фактором стволовых клеток, интерлейкинами-1-12. Параллельно применяются иммунодепрессанты. Медикаментозная терапия способна на протяжении многих лет поддерживать высокое качество жизни больных, но ее эффективность постепенно снижается.
- Переливание компонентов крови. При выраженных побочных эффектах или противопоказаниях к этиотропной терапии (трансплантации, стимуляции кроветворения) назначаются процедуры гемотрансфузии. Переливаются отмытые эритроциты – донорские красные кровяные тельца, освобожденные от поверхностных белков. При кровотечениях и снижении уровня тромбоцитов пациентам вводится тромбоцитарная масса.
Прогноз и профилактика
Продолжительность жизни больных определяется степенью нарушения функции костного мозга. Иногда пациенты доживают до 40 лет без лечения, но нередко умирают в детстве от тяжелой анемии или онкологических заболеваний. Прогноз наиболее благоприятен при своевременном проведении аллогенной трансплантации костного мозга, после которой есть шанс полного восстановления нормального кроветворения и увеличения срока жизни. Поскольку заболевание генетическое, предотвратить его развитие невозможно. Профилактика сводится к медико-генетической консультации супружеских пар из групп риска, планирующих беременность, а также к проведению пренатальной диагностики патологии, в ходе которой из пуповинной вены плода производится забор крови и выполняется ДЭБ-тест. При его положительном результате рассматривается вопрос о прерывании беременности.
Анемия Фанкони является одной из разновидностей врожденных анемий. На данный момент заболевание полностью не изучено, однако собранные данные позволяют говорить о причинах, проявлении и лечении этой болезни.
История заболевания
Впервые это заболевание было описано в 1937 году швейцарским врачом-педиатром Гвидо Фанкони, который выявил его у трех детей в одной семье. Действительно, заболевание имеет очень много «семейных» случаев. Заболевание это достаточно редкое, в настоящее время в литературе описано более ста случаев заболевания.
Клиника
Анемия Фанкони (врожденная панмиелопатия) – наследственное заболевание, приобретается благодаря аутосомно-рецессивному наследованию, проявляется у гомозигот. Эта болезнь поражает преимущество детей мужского пола. Сопутствующими заболеваниями, причиной которых является анемия Фанкони, может быть предрасположенность к злокачественным новообразованиям (аденома, гепатома, рак пищевода), пороки развития, повышенная чувствительность к химическим мутагенам. У детей, больных анемией Фанкони, существуют дефекты в репарации ДНК, поэтому их хромосомы легко повреждаются даже при малодозном облучении ультрафиолетом.
Заболевание во многом связана с дефектом стволовых клеток, поскольку сыворотка больных, а также их лимфоциты, не оказывают влияния на эффективность колониеобразования во время культивирования донорского костного мозга.
Симптомы
Симптомы анемии Фанкони очень часто не проявляются у малышей до пяти лет, однако при тяжелых случаях болезнь можно диагностировать уже на первом году жизни ребенка. Внешне малыш вялый, на окружающий мир реагирует довольно слабо, у него слабый ответ на внешние раздражители. Кожа больных анемией детей бледная, слизистые оболочки тоже значительно светлее. Заболевание проявляется постепенно, первыми симптомами могут быть кровоподтеки или кровотечения. Помимо этого, больные дети очень подвержены инфекционным заболеваниям по причине ослабленного иммунитета. Селезенка и печень обычно не гипертрофированы, однако лимфоузлы могут увеличиваться, что обычно говорит о наличии инфекции в организме. Лабораторное исследование крови показывает низкое содержание гемоглобина, снижение числа эритроцитов и ретикулоцитов, а вот показатели по лейкоцитам и тромбоцитам в норме. На основании клиники и данных лабораторных исследований врачи могут говорить о наличии у ребенка этого опасного заболевания.
Кроме описанных выше патологических изменений есть еще и другие аномалии, сопровождающиеся при этой болезни. Чаще всего это избыточная пигментация кожи, такие ребятишки отстают в росте. Довольно частым признаком является микроцефалия. Болезнь может вызывать различные патологии развития опорно-двигательного аппарата. Скелет детей, больных анемией Фанкони, может содержать недоразвитые кости – лучевую кость, шейное ребро, кости стоп (велика возможность появления косолапости). Из-за неправильного развития тазовых костей такие младенцы могут родиться с врожденным вывихом бедра.
Если болезнь спровоцировала неврологические проблемы, то среди них чаще всего можно встретить птоз век (опущение), нистагм (дрожание глаз), косоглазие, умственную отсталость, недоразвитость глазных яблок.
В том случае, если анемия Фанкони спровоцировала отклонения в половом развитии, то чаще всего это проявляется в гипоспадии, недоразвитости половых органов, отсутствии одного или двух яичек.
Тяжелые последствие болезни могут выявиться в недоразвитии почек, изменении формы органа (пока принимает форму подковы), наличие в почках множества кист.
Кроме этого, болезнь может спровоцировать развитие пороков сердца.
Лечение
При анемии Фанкони показано стационарное лечение в гематологическом отделении. Стратегия лечения во многом определяется тяжестью течения болезни.
При невозможности помочь больному ребенку консервативными методами показано оперативное вмешательство (спленэктомия), после чего рекомендуется курс анаболических стероидов. Если эти меры не помогают, то необходимо использовать антилимфоцитарный глобулин.
В настоящее время применяется лечение иммунодепрессантами – метотрексатом и циклофосфаном. Однако применение этих препаратов опасно тем, что могут возникнуть кровотечения и появиться воспалительные очаги. Чаще всего эти побочные явления возникают при применении метотрексата, а циклофосфан более щадящий.
Если болезнь перешла в тяжелую стадию, то здесь необходима пересадка костного мозга. Лучше всего, если будет донором однояйцовый близнец. Тогда пересадку можно проводить без иммунодепрессии. Если таких доноров нет, то костный мозг можно брать у сестер или братьев больного ребенка. Перед пересадкой ребенку вводят большую дозу циклофосфана, чтобы не было отторжения.
Трансплантация может сопровождаться тяжелыми осложнениями, когда пересаженный орган (в данном случае костный мозг) будут бороться против реципиента. Это может проявиться в поражении печени и желудочно-кишечного тракта. Донора для пересадки при анемии Фанкони подобрать трудно, поскольку в последнее время семьи не имеют двух и более детей.
Прогноз
При позднем обнаружении анемии Фанкони длительность жизни пациентов не превышает двух-пяти лет. Чаще всего дети умирают от кровоизлияния в мозг или в желудок. Если больному ребенку будет сделана трансплантация костного мозга, то с более, чем пятидесяти процентной вероятностью состояние здоровья ребенка улучшится. Удаление селезенки при незапущенной болезни тоже достаточно эффективно, особенно если было впоследствии проведено лечение анаболическими гормонами. У таких деток может полностью восстановиться функция кроветворения. О хороших прогнозах после лечения болезни можно говорить, если результаты лабораторного анализа крови говорят о нормальной концентрации в крови ее компонентов.
- Автор: Юлия
- Распечатать
Меня зовут Юлия. Свою жизнь я решила связать с медициной, а именно с педиатрией. Моя любовь к деткам безгранична. Могу сказать, что мне в жизни повезло.
Оцените статью:
(1 голос, среднее: 5 из 5)
Суть болезни
Анемия Фанкони (АФ) – генетическое заболевание, проявляющееся в виде целого комплекса симптомов. Наиболее серьезными и опасными среди них являются развивающиеся в ходе этой болезни гематологические нарушения и опухоли.
У большинства больных анемией Фанкони в течение жизни постепенно развивается аплазия кроветворения, которая приводит к панцитопении, то есть к дефициту всех видов клеток крови. Однако, хотя АФ считается в основном заболеванием кроветворной системы, фактически при ней поражены многие органы и системы органов, причем уже при рождении часто выявляются пороки развития.
У больных АФ резко повышена вероятность возникновения в раннем возрасте гематологических и онкологических заболеваний, включая острый миелоидный лейкоз, миелодиспластические синдромы, а также опухоли пищевода, печени, желудка, верхних дыхательных путей, женских половых органов.
Иногда анемию Фанкони называют «врожденной апластической анемией», хотя проявления АФ и «обычной» (приобретенной) апластической анемии не во всем совпадают.
Частота встречаемости, факторы риска
Анемия Фанкони – редкое заболевание. Частота рождения детей с АФ в среднем составляет приблизительно 1 случай на 350 тысяч новорожденных. АФ возникает с одинаковой частотой у мужчин и у женщин и встречается среди всех национальностей.
Анемия Фанкони – врожденное заболевание, которое наследуется по аутосомно-рецессивному типу. Это значит, что если и отец, и мать являются носителями дефектного гена (при этом они могут быть полностью клинически здоровыми), то при каждом деторождении есть 25% риск появления ребенка с этим заболеванием. Поэтому частота возникновения АФ повышена в сообществах людей, где приняты близкородственные браки.
Признаки и симптомы
Дети с анемией Фанкони часто обладают характерными внешними признаками. Среди возможных особенностей известны пороки развития скелета (например, больших пальцев рук, костей запястья, бедер, позвоночника, ребер), низкий рост, «птичье лицо» (недоразвитый подбородок), пятна на коже – светлые или типа «кофе с молоком». Нередки врожденные аномалии глаз, ушей, сердца, почек, мочеполовой системы. Встречается задержка физического развития. Интеллект у больных АФ, как правило, нормален.
Наиболее серьезные проблемы при АФ связаны с постепенно развивающимися нарушениями работы костного мозга. Обычно они становятся заметными с возраста 5-10 лет и затем углубляются с течением времени, хотя иногда болезнь протекает практически бессимптомно в течение многих лет.
Снижение числа тромбоцитов ведет к повышенной кровоточивости (возникают носовые кровотечения, синяки «без причины»), анемия из-за снижения числа эритроцитов – к слабости и утомляемости, а снижение числа лейкоцитов (нейтрофилов) – к плохой сопротивляемости инфекциям. Наконец, как уже говорилось, у многих больных впоследствии развивается лейкоз или миелодиспластический синдром, а также другие онкологические заболевания.
При отсутствии пороков развития и медленном нарастании симптомов болезнь порой впервые диагностируется только тогда, когда уже возникло одно из ее серьезных осложнений в виде лейкоза, миелодиспластического синдрома или другого онкологического заболевания. В этом случае прогноз ухудшается.
Диагностика
Заподозрить АФ у ребенка можно по некоторым внешним признакам, перечисленным выше, в сочетании с изменениями в клиническом анализе крови. Может наблюдаться как недостаток всех клеток крови, так и снижение числа только тромбоцитов или лейкоцитов. Для уточнения диагноза полезны исследования клеточного состава костного мозга (миелограмма). Могут использоваться и другие обследования – например, рентгенография для обнаружения и изучения врожденных дефектов костей.
Окончательный диагноз АФ можно установить после цитогенетического исследования клеток крови больного – проба с диэпоксибутаном, митомицином С или аналогичные тесты. Это связано с тем, что хромосомы клеток при АФ характеризуются определенными особенностями – повышенной нестабильностью («ломкость хромосом»). Возможен также молекулярно-генетический анализ для обнаружения конкретных генетических дефектов, однако его проведение возможно только в специальных лабораториях.
Во всех случаях снижения показателей крови (цитопении) необходимо четко отличать АФ от приобретенной апластической анемии (АА), поскольку подходы к лечению больных АА и АФ, включая тактику трансплантации костного мозга, различаются.
Семьям, где уже были случаи рождения детей с АФ, при всех последующих беременностях рекомендуется пренатальная диагностика с помощью кордоцентеза (исследования крови из пуповинной вены плода – проба с диэпоксибутаном), чтобы узнать о наличии болезни у будущего ребенка еще до его рождения. Также обследование на АФ целесообразно при рождении ребенка с аномалиями скелета, особенно кистей рук.
Лечение
Аллогенная трансплантация костного мозга — единственный шанс достичь нормализации кроветворения у больных АФ. При этом очень желательно произвести трансплантацию, пока пациент еще в молодом возрасте, оптимально — до 10 лет. Если у больного есть здоровые братья и сестры, являющиеся совместимыми потенциальными донорами для него, то предпочтительна трансплантация от них, а не от неродственного донора.
Пациенты с АФ особенно чувствительны к химиотерапии (а также лучевой терапии) и нуждаются в применении специальных протоколов кондиционирования. У них чаще обычного встречаются такие осложнения трансплантации, как токсическое воздействие терапии кондиционирования на различные внутренние органы и реакция «трансплантат против хозяина» — острая и хроническая.
Больные, для которых по тем или иным причинам невозможна трансплантация, могут получать терапию, которая временно улучшит их состояние. Так, выработку клеток крови можно стимулировать андрогенами (мужскими гормонами), а также в ряде случаев факторами роста (эритропоэтин, Г-КСФ). Примерно половина больных положительно отвечает на лечение андрогенами. Порой такая терапия помогает в течение многих лет, но со временем становится менее эффективной и связана с рядом побочных эффектов. С заместительной целью применяются также переливания компонентов крови.
Прогноз
Продолжительность жизни больных анемией Фанкони зависит от того, насколько сильно нарушена функция костного мозга. Некоторые больные живут по 30–40 лет без лечения, но многие погибают еще в детском возрасте или от самой болезни, или от развившихся в связи с ней онкологических заболеваний. Поэтому так важно вовремя провести аллогенную трансплантацию костного мозга – это единственный шанс на восстановление нормального кроветворения и на увеличение продолжительности жизни.
Трансплантация в детском возрасте от здорового совместимого родственного донора (брата или сестры) приводит к успеху у большинства больных АФ, хотя и после такой трансплантации они должны регулярно проходить осмотр для раннего выявления возможных злокачественных опухолей различных органов – вероятность их возникновения остается повышенной даже после трансплантации.
При трансплантации от неродственного донора результаты хуже, чем при использовании родственного донора, хотя и они постепенно улучшаются.