Анемии у детей пособие
В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
В настоящей публикации на основании данных литературы и анализа собственных наблюдений представлены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий, а также принципы их лечения у детей. Установлено, что основной формой дефицитных анемий (ДА) в педиатрической популяции является анемия, обусловленная недостаточным содержанием в организме железа. При этом особо подчеркивается, что железодефицитная анемия (ЖДА) не только наиболее распространенная ДА, но и самое частое гематологическое заболевание у детей [1–3]. С учетом того, что другие типы анемий (в т. ч. развивающиеся при дефиците таких витаминов, как фолиевая кислота и В12) хуже известны врачам-педиатрам, их верификация, как правило, запаздывает, т. к. они ошибочно принимаются за ЖДА. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма и ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения дифференциальной диагностики и лечения анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Дифференциальная диагностика ДА у детей
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).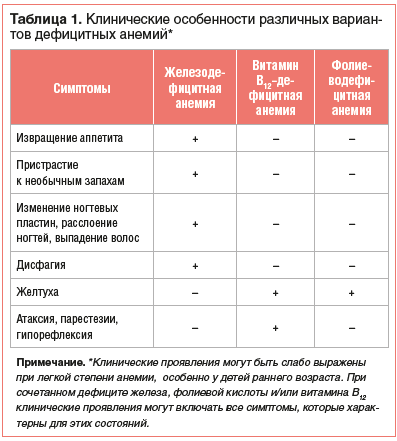
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).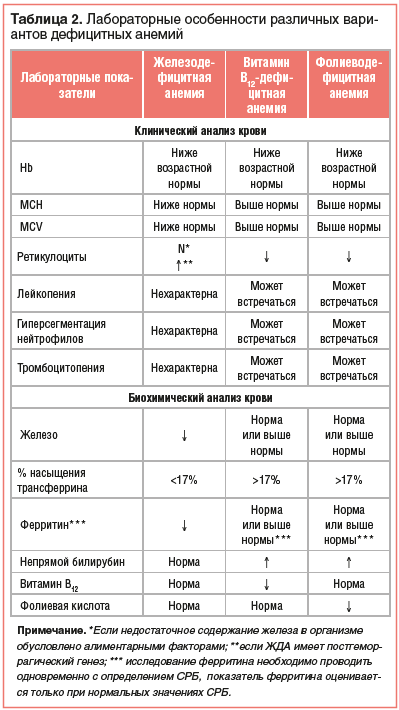
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Лечение ДА у детей
Корректная трактовка клинико-анамнестических данных и результатов лабораторного обследования позволяет верифицировать причину ДА и своевременно назначить адекватную терапию. Принципиально важным при этом является положение о том, что компенсировать дефицитные состояния невозможно только за счет нормализации рациона питания. Основная роль в купировании дефицита железа, фолиевой кислоты и витамина В12 принадлежит заместительной фармакотерапии [1–7]. При этом для лечения ЖДА используются солевые препараты железа или препараты на основе железа гидроксид полимальтозата. Суточная доза препаратов зависит от массы тела и возраста ребенка, расчет при этом проводится по элементарному железу. Так, для солевых препаратов железа, назначаемых внутрь, используются следующие дозы (расчет по элементарному железу!): для детей до 3 лет — 3 мг/кг/сут, для детей старше 3 лет — 45–60 мг/сут, для подростков —
до 120 мг/сут. При использовании пероральных форм железа гидроксид полимальтозата рекомендованные дозы составляют 5 мг/кг/сут (расчет по элементарному железу!). Продолжительность терапии препаратами железа зависит от степени тяжести ЖДА. При легкой ЖДА курс лечения составляет 3 мес., при среднетяжелой форме — 4,5 мес., при тяжелой — до 6 мес. [3].
В случае диагностики фолиеводефицитной анемии заместительная терапия проводится препаратами фолиевой кислоты. Рекомендовано использовать следующие суточные дозы фолиевой кислоты: для детей до 1 года — 0,25–0,5 мг/сут, для детей старше 1 года — 1,0 мг/сут. При синдроме мальабсорбции доза может быть повышена до 5–15 мг фолиевой кислоты в сутки. Терапия проводится в указанных дозах ежедневно на протяжении 4–6 нед. Через 7 дней от начала лечения необходимо выполнить клинический анализ крови с обязательным подсчетом ретикулоцитов (рис. 1). Повышение уровня ретикулоцитов на фоне приема фолиевой кислоты указывает на правильно установленный диагноз и является обоснованием для продолжения терапии. Купирование анемии достигается через 4–6 нед. от начала лечения [6].
Для лечения витамин В12-дефицитной анемии используют препараты цианокобаламина для парентерального введения. При этом рекомендовано придерживаться следующего режима дозирования: для детей до 1 года — 5 мкг/кг/сут, для детей старше 1 года — 100 мкг/сут, для подростков — 200 мкг/сут. Препарат вводится внутримышечно 1 р./сут ежедневно. На 7–10-й день терапии проводят клинический анализ. Выявление ретикулоцитоза позволяет сделать вывод об эффективности проводимого лечения. Терапию следует продолжить в том же режиме дозирования еще в течение 3–4 нед. В дальнейшем, при достижении нормализации уровня гемоглобина, переходят на поддерживающее лечение: цианокобаламин вводят в терапевтической дозе 1 раз в 7 дней в течение 2 мес., а затем 1 раз в 14 дней в течение 6 мес. (рис. 2). Учитывая, что дефицит витамина В12, как правило, редко обусловлен алиментарными факторами, одновременно проводят поиск причин данного патологического состояния (болезнь Крона, целиакия, инвазия широким лентецом, наследственные нарушения всасывания и/или транспортировки витамина В12 и др.) [7]. В тех случаях, когда имеют место полидефицитные состояния с развитием анемического синдрома, оправданно комбинированное заместительное лечение. Чаще всего у детей встречается сочетанный дефицит железа и фолиевой кислоты, что требует одновременного назначения препаратов железа и фолиевой кислоты.
Заключение
Таким образом, выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. Своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка. Авторы выражают надежду, что информация, представленная в настоящей публикации, будет полезна практикующим врачам-педиатрам.
МиНИСТЕРСВО
ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ
РФ
Кафедра
педиатрии
Учебно-методическое
пособие
для
студентов педиатрических факультетов,
интернов, ординаторов и врачей педиатров.
ЖЕЛЕЗОДЕФИЦИТНЫЕ
АНЕМИИ У ДЕТЕЙ.
Железодефицитные
анемии (ЖДА) – исключительно часто
встречающееся заболевание, характерной
чертой которого является снижение
содержания гемоглобина в эритроцитах
вследствие дефицита железа в организме,
что проявляется гипохромией и тенденцией
к микроцитозу.
По
данным Всемирной Организации
Здравоохранения до 20 % населения Земли
страдают ЖДА, но наиболее актуальна эта
проблема в акушерстве и педиатрии. У
беременных женщин и детей раннего
возраста до 70-75% всех анемических
состояний связано с дефицитом железа
в организме. Это не случайно, так как
именно во время беременности и в раннем
детстве наиболее часто возникают
ситуации, приводящие к дефициту данного
микроэлемента, обусловленные высокими
темпами роста и соответственно большими
потребностями организма плода и ребенка.
К развитию ЖДА в раннем детском возрасте,
кроме того, могут приводить хронические
микрокровопотери из желудочно-кишечного
тракта (например, при вскармливании
смесями, изготовленными на коровьем
молоке), воспалительных и иных заболеваний
ЖКТ, обуславливающие снижение абсорбции
железа.
Однако
не все перечисленные выше факторы,
вызывающие ЖДА равнозначны. Отмечены
существенные региональные различия в
причинах ЖДА, определяемые географическими,
социальными и социально-бытовыми
условиями. Именно знание ведущих причин
развития анемии позволяет формировать
необходимый для каждого конкретного
региона комплекс профилактических
мероприятий. Например, в г. Москве по
данным Д.Н. Дегтярева в течение последнего
десятилетия наблюдается значительный
рост частоты ЖДА среди детей и беременных
женщин. Причем, среди беременных женщин
частота ЖДА возросла более чем в 1,5 раза
выше, чем среди детей. Наблюдения,
проведенные в нашей клинике, показали,
что среди московских детей первых 18
месяцев жизни, у которых железодефицитное
состояние было диагностировано в
1999-2000 гг., практически не удается выявить
обычно называемых причин, таких как
грубое нарушение диететики. Наоборот,
большая часть детей с ЖДА вскармливалась
вполне адекватно. Можно было отметить
лишь более позднее введение овощного
и мясного прикормов у некоторой части
из них. Среди детей с ЖДА оказался
незначительным процент недоношенных
и маловесных (всего около 7%) и детей с
высокими темпами развития (не более
20%). В то же время у матерей детей с ЖДА
выявилась достоверно высокая частота
анемии во время беременности, токсикоза
первой половины беременности, гестозов,
2/3 из них курили.
Таким
образом, возрастание частоты ЖДА среди
московских детей 1998-2000 г.г. рождения, в
первую очередь, связано с состоянием
здоровья их матерей, неблагоприятным
течением беременности, развитием анемии
беременных и высокой частотой вредных
привычек среди матерей. В то же время,
так называемые, «детские» причинные
факторы (неправильное вскармливание,
повышенные темпы развития и т. д.), хотя
и имеют место, но не доминируют.
Полученные
данные позволяют сформулировать основные
направления профилактики заболевания
и сконцентрировать на них усилия врачей
и организаторов здравоохранения. Так,
для г. Москвы – это, прежде всего,
улучшение качества здоровья беременных,
профилактика и лечение ЖДА в этот период.
Однако
до настоящего времени не сложилось
единого мнения о наиболее оптимальных
сроках и длительности проведения
профилактической ферротерапии у
беременных женщин.
Изучение
гемограмм и ферритинового статуса
пуповинной крови развивающихся плодов
22–36 недельного гестационного возраста
(забор крови проводился методом
кордоцентеза) [Исследования
выполнены совместно с сотрудниками
кафедры акушерства и гинекологии
педиатрического факультета РГМУ (зав.
– академик РАМН, профессор Г.М.
Савельева).],
показали, что наиболее интенсивное
возрастание уровня гемоглобина и числа
эритроцитов и, соответственно, наиболее
интенсивное потребление железа происходит
у плода в период с 30 по 36 недели гестации.
Можно предположить, что наиболее
оптимальным сроком профилактической
ферротерапии должен быть период
беременности, предшествующий 30 недели.
Для
детей первых месяцев жизни «естественной»
профилактикой ЖДА является сохранение
и поддержка грудного вскармливания, по
крайней мере, в первые 4-5 месяцев жизни,
когда наблюдается наиболее активное
потребление депонированного в
антенатальном периоде жизни железа.
К
группе риска по развитию ЖДА относятся
дети с низкой массой тела при рождении
(как недоношенными, так и доношенными),
например, дети от многоплодной
беременности, с задержкой внутриутробного
развития или с высокими темпами
физического развития. При необходимости
искусственного или смешанного
вскармливания этой категории детей
следует использовать смеси, обогащенные
железом (т.е. содержащие 8-12 мг железа на
1 л смеси). Обогащенные железом смеси
используются у доношенных детей группы
риска, начиная с 3-месячного возраста,
а у недоношенных, — начиная с 2-месячного
возраста.
Многочисленные
исследования, проведенные среди детей,
вскармливаемых смесями на основе
коровьего молока, показали, что при этом
наблюдается хроническая кровопотеря
(вследствие диапедезной кровоточивости)
со слизистой ЖКТ ребенка. Поэтому дети,
находящиеся на искусственном или
смешанном вскармливании, должны относится
к группе риска по развитию ЖДА.
Ряд
ведущих фирм-производителей продуктов
детского питания придерживаются
концепции ступенчатой профилактики
ЖДА у детей 1-го года жизни. Например, в
начальной смеси Сэмпер Бэби 1 предусмотрено
содержание железа 0,7 мг/100 мл, а «последующая»
формула Сэмпер Бэби 2 при содержании
железа 1,1 мг/100 мл способствует более
высокой обеспеченности в этом микроэлементе
детей второго полугодия. Железом
обогащены также все фруктовые соки
Сэмпер (5 мг/100 мл), что в сочетании с
повышенным содержанием витамина С
обеспечивает высокую степень усвоения
железа. Дополнительное обогащение
железом других постоянно используемых
продуктов прикорма (фруктовые пюре,
каши и вэллинги) также вносит существенный
вклад в профилактику ЖДА у детей.
Наряду
с этим всем детям группы риска (как на
искусственном, так и на естественном
вскармливании), начиная с 2 месячного
возраста с профилактической целью,
следует назначать препараты железа.
Продолжительность профилактического
курса ферропрепаратов велика и
продолжается до 12-18-месячного возраста
ребенка (табл.).
Таблица
1
Дозировки
элементарного железа, используемые при
профилактике и лечении железодефицитной
анемии у детей.
Цель | Расчет |
Профилактика масса 1000 1500 | 4 |
3 | |
2 | |
Лечение ЖДА ЖДА ЖДА | 3-4 5 6 |
У
детей раннего возраста снижение уровня
гемоглобина менее 110 г/л при наличии
гипохромии и анизоцитоза является
основанием для проведения ферротерапии.
Как правило, препараты железа назначают
внутрь (табл. 1). Общая длительность курса
терапии составляет от 3 до 6 месяцев, что
зависит от тяжести анемии. Однако в
полной дозе препарат назначается в
течение первых 6-8 недель, затем проводится
поддерживающая терапия, направленная
на формирование депо микроэлемента. В
период поддерживающей терапии доза
препарата составляет 1-2 мг железа/кг
массы тела в сутки.
Для
парентерального введения препаратов
железа необходимо иметь особые показания.
К ним относятся:
выраженные
побочные проявления (в основном,
гастроинтестинальные) при назначении
железосодержащих препаратов внутрь,нарушение
абсорбции препаратов железа в кишечнике
(например, при синдроме мальабсорбции),воспалительные
и язвенные поражения кишечника, состояние
после резекции кишечника.
Доза
для парентерального введения препаратов
железа рассчитывается по следующей
формуле:
2,5
мг Fe/кг
массы тела x дефицит Hb
в г/дл.
При
этом общая суточная доза не должна
превышать:
25
мг для детей с массой тела до 5 кг,50
мг для детей с массой тела от 5 до 10 кг,100
мг для детей с массой тела от 10 до 20 кг.
Ограничение
максимальной суточной дозы вводимого
парентерально железа обусловлено крайне
тяжелыми проявлениями, возникающими
при перегрузке организма этим
микроэлементом. Обычно клиническая
картина отравления развивается при
передозировке солей железа и возникает
при введении внутрь или парентерально
60
и более мг железа/кг массы тела
ребенка. Но описаны редкие случаи
отравления при введении более низких
доз.
Клиническая
картина отравления солями железа имеет
определенную фазность развития.
Первая
фаза (ирритативная) развивается через
1,5-2 часа после приема препарата и
продолжается 6-12 часов. Для неё характерно
появление повторной рвоты, к которой
присоединяется диарея и наблюдается
падение АД. Диарея может сопровождаться
появлением в каловых массах примеси
крови.
Вторая
фаза – фаза «стихания симптомов» или
фаза «видимого благополучия»,
характеризуется уменьшением
гастроинтестинальных проявлений и
длится от 2 до 6 часов.
Этот
период мнимого благополучия сменяется
третьей фазой — фазой тяжелых обменных
нарушений, для которой характерно
прогрессирующее нарастание метаболического
ацидоза и гипогликемии. Наблюдается
повторное падение АД с развитием картины
шока, комы, судорожного синдрома.
Развитие
печеночной недостаточности знаменует
четвёртую фазу отравления солями железа
– фазу некроза печени. Появляется
желтуха, изменение размеров печени,
нарастают обменные расстройства. Фаза
некроза печени длится 2-4 дня и завершается
финальной фазой, для которой характерно
присоединений некроза слизистых ЖКТ и
прогрессирование некротического
поражения печени, возможно развитие
почечного некроза и развитие ОПН.
Отравление
солями железа исключительно тяжелое
состояние с высокой летальностью.
Остановить патологический процесс
способна лишь своевременная помощь (в
1 и 2 фазе процесса), которая подразумевает,
прежде всего, тщательное промывание
желудка, введение адсорбентов, назначение
десферала и «ловушек» свободных радикалов
(мексидол, гипоксен, рутин и т.д.),
проведение симптоматической терапии.
Помимо
отравления солями железа (передозировка),
использование солевых ферропрепаратов
в обычных терапевтических дозах внутрь
также может вызывать побочные проявления.
Первое место среди них занимают
гастроинтестинальные расстройства.
Они обычно проявляются снижением
аппетита, появлением тошноты, рвоты,
диареи. При использовании капель и
сиропов у детей может появиться окраска
зубов и, реже, десен.
Парентеральное
введение препаратов железа даже в
терапевтических дозах может вызывать
кардиологические побочные эффекты:
тахикардию, редко, развитие фибрилляции.
Необходимость
длительного приема препаратов железа
продиктована не только сроками
нормализации показателей гемоглобина,
но и восстановления/восполнения запасов
данного микроэлемента в депонирующих
органах. Это определяет особые требования,
предъявляемые к препаратам железа:
высокая
биодоступность,хорошая
переносимость,хорошие
органолептические свойства,комплайентность,
безопасность.
Причем,
значимость каждого из перечисленных
выше требований практически равнозначна.
Современные
препараты железа, используемые для
лечения и профилактики ЖДА, принято
делить на препараты, содержащие
двухвалентное закисное железо, и
препараты трехвалентного железа (табл.
2).
Таблица
2.
Препараты
железа, используемые для лечения и
профилактики ЖДА у детей.
Препараты | Препараты |
Сульфат
| Гидроксид-полимальтозный
|
Глюконат
| |
Фумарат
|
Современные
препараты двухвалентного железа (соли
двухвалентного железа) обладают бóльшей
биодоступностью, чем старые трехвалентные
и двухвалентные препараты (препараты
первого поколения), которые характеризовались
низкой биодоступностью, плохой
переносимостью и в связи с этим в
настоящее время практически не применяются
(сироп алоэ с железом, гематоген, лактат
железа и т.д.). Но при своем восстановлении
в трехвалентное железо в слизистой
оболочке ЖКТ двухвалентные соли железа
образуют свободные радикалы, обладающие
повреждающим эффектом. Именно с этим
связаны побочные проявления ферротерапии
солями железа: гастроинтестинальные
расстройства (боль, тошнота, рвота,
диарея) и отравление при их передозировке,
которое также проявляется тяжелыми
гастроинтестинальными расстройствами
вплоть до некротического геморрагического
энтероколита и некроза печени.
Современные
препараты трехвалентного железа
(препараты нового поколения) практически
лишены этих нежелательных эффектов,
так как не требуют восстановления и,
соответственно, не вызывают образования
свободных радикалов. Они более безопасны,
намного лучше переносятся пациентами,
практически не сопровождаются
гастроинтестинальными расстройствами.
При этом биодоступность их достаточно
высока (не менее 68%), т.е. по биодоступности
они не только не уступают, а порой даже
превышают, препараты закисного железа.
Новое
поколение препаратов трехвалентного
железа основано на использовании
гидроксид-полимальтозного комплекса.
И представлены препаратами для
парентерального введения (Венофер) и
для перорального применения (Мальтофер,
Мальтофер Фол, Феррум Лек). Каждый из
них имеет свою сферу использования:
Венофер вводится внутривенно, Мальтофер
и Феррум Лек — перорально, Мальтофер-Фол,
обогащенный фолиевой кислотой,
предназначен, главным образом, для
беременных женщин и девочек-подростков
с ЖДА.
В
раннем детском возрасте, особенно
учитывая необходимость длительного, в
течение нескольких недель и месяцев,
введения препаратов, абсолютное
предпочтение отдаётся специальным
детским формам лекарственных препаратов
железа. Среди них препарат солей железа
Актиферрин, применяется в виде капель,
сиропа и капсул. Актиферрин содержит в
своем составе аминокислоту серин,
которая существенно усиливает всасывание
железа. Этим достигается высокая
эффективность при минимальных побочных
эффектах, которые, по данным М.К. Соболевой,
не превышают 4%.
Могут
быть также использованы такие препараты
как Тотема (раствор) и Ферронат (суспензия).
Необходимо помнить, что Тотема является
комплексным микроэлементным препаратом,
включающим глюконат железа, глюконат
марганца и глюконат меди, что может
ограничивать его применение у детей
раннего возраста.
Использование
капель Мальтофера
у детей первых месяцев жизни по данным
зарубежной литературы практически не
вызывает побочных проявлений. Однако
в наших наблюдениях побочные проявления
при использовании Мальтофера
отмечены в 2% случаев. Клиническая
эффективность препарата высока и
приближается к 95%. Восстановление уровня
гемоглобина при легкой и среднетяжелой
анемии достигается уже к 3-4 неделям
терапии.
Однако
критерием излечения ЖДА является не
столько повышение уровня гемоглобина,
сколько ликвидация дефицита железа в
организме. Поэтому основным критерием
излечения является восстановление
нормального уровня ферритина сыворотки.
По нашим данным при использовании
Мальтофера
при легкой и среднетяжелой степени ЖДА
сывороточный ферритин у большинства
больных восстанавливается до нормальных
значений к 8-10 неделям терапии,
соответственно. После этого целесообразно
проведение курса поддерживающей терапии
препаратом железа в дозе 1-2 мг/кг в сутки
в течение 4-6 недель. Такая терапия
способствует формированию депо
микроэлемента в организме ребенка,
восстановлению баланса эритропоэтических
и регулирующих факторов, а, следовательно,
формированию стойкого терапевтического
эффекта.

