Журналы по бронхиальной астме у детей
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Миненкова Т.А.
1
Веденьева М.О.
1
Симкина А.В.
1
1 Курский государственный медицинский университет
В статье рассматриваются возможные варианты результатов исследования функции внешнего дыхания у детей в возрасте от 5 до 14 лет на фоне проводимой терапии и до нее, оценка эффективности назначенных вариантов базисной терапии для исследуемой группы детей. Также в статье отражены результаты обследования детей различных возрастов, количество обследованных — 30 человек. Бронхиальная астма является одним из самых распространенных хронических заболеваний органов дыхания у детей и подростков, что отражается на их качестве жизни и развитии [8]. За последние годы в мире отмечается тенденция к росту заболеваемости бронхиальной астмой. Так, по данным российской официальной статистики (1997–2004), число детей, страдающих бронхиальной астмой, выросло в 1,5–2,0 раза [4]. Основной целью врача является выбор таких методов терапии астмы, в результате которых образуется стойкая ремиссия заболевания вне зависимости от его тяжести. Согласно GINA (2014), основными целями терапии является достижение хорошего контроля над симптомами и поддержание нормального уровня активности ребенка [7]. Полученные результаты демонстрируют тесную взаимосвязь данных исследования функции внешнего дыхания в зависимости от клинической картины течения бронхиальной астмы у детей и проводимой терапии.
бронхиальная астма
функция внешнего дыхания
диагностика
лечение
бронхообструктивный синдром.
1. Балаболкин И. И. Современные подходы к терапии острой бронхиальной астмы у детей // Аллергология и иммунология в педиатрии. — М.: ИНФОМЕДИС. — № 3. — 2010. — С. 12-19.
2. Бронхиальная астма у детей: диагностика, лечение и профилактика. Научно-практическая программа. М. – 2017.
3. Герасимова Н.Г., Горбатов В.А., Коваленко Е.Н. и др., Эффективность применения сингуляра при лечении бронхиальной астмы у детей // Вестник РУДН. — Москва, 2010. — № 4. — С. 185-186.
4. Миненкова Т.А., Мизерницкий Ю.Л., Цыпленкова С.Э., Сорокина Е.В., Ружицкая Е.А., Окунева Т.С., Котов В.С. Клинико-иммунологические особенности бронхиальной астмы, ассоциированной с различными типами грибковой сенсибилизации у детей. // Вопросы практической педиатрии. — № 4. – 2010. – С.12-15.
5. Ненашева Н. М. Обзор некоторых основных изменений GINA – 2014. // Практическая пульмонология. — № 3.– 2014. С. 5.
6. Федеральные клинические рекомендации по диагностике и лечению бронхиальной астмы, М. – 2013г. – С. 31.
7. Akiyama K. The role of fungal allergy in bronichial asthma // Nippon Ishinkin Gakkai Zasshi.- 2009.- V.41.- N 3.- P.149-155.
8. Leon E.E., Craig T.J. Antifungals in the treatment of allergic bronchopulmonary aspergillosis. // Ann. Allergy. Asthma Immunol. — 2009.- V.82.- N 6.- P.511-516. quiz. 516-519.
9. Papadopoulos N.G., Arakawa H., Carlsen K.-H. et al. // Allergy. – 2012. – Vol.67. – P.976–997.
10. Papadopoulos N.G. Asthma in childhood // Global atlas of asthma. – Zurich, 2013. – P.57–60.
Актуальность. Бронхиальная астма (БА) — хроническое воспалительное заболевание дыхательных путей, в котором принимают участие многие клетки и клеточные элементы. Хроническое воспаление обусловливает развитие бронхиальной гиперреактивности, которая приводит к повторяющимся эпизодам свистящих хрипов, одышки, чувства заложенности в груди и кашля в особенности по ночам или ранним утром. Эти эпизоды связаны с распространенной вариабельной обструкцией дыхательных путей в легких, которая часто бывает обратима спонтанно или под влиянием лечения [1,2].
Бронхиальная астма представляет собой серьезную медицинскую и социальную проблему. Во всем мире в последнее время отмечены тенденции к росту заболеваемости во всех возрастных группах, в том числе среди детей. Наиболее подвержены болезни дети, которые впоследствии «перерастают» проблему (около половины болеющих). В последние годы во всем мире наблюдается устойчивый рост заболеваемости, потому работает огромное количество программ, и всемирных, и национальных, по борьбе с астмой.
Приступы удушья наблюдаются с разной периодичностью, но даже в стадии ремиссии воспалительный процесс в дыхательных путях сохраняется. В основе нарушения проходимости потока воздуха, при бронхиальной астме лежат следующие компоненты:
- обструкция дыхательных путей из-за спазмов гладкой мускулатуры бронхов или вследствие отека их слизистой оболочки.
- закупорка бронхов секретом подслизистых желез дыхательных путей из-за их гиперфункции.
- замещение мышечной ткани бронхов на соединительную при длительном течении заболевания, из-за чего возникают склеротические изменения в стенке бронхов.
У больных астмой снижается трудоспособность и часто наступает инвалидность, потому что хронический воспалительный процесс формирует чувствительность к аллергенам, различным химическим раздражителям, дыму, пыли и т.д. из-за чего образуется отечность и бронхоспазм, так как в момент раздражения идет повышенная выработка бронхиальной слизи.
Проблема распространенности астмы в нашей стране требует дальнейшего изучения и уточнения [3].
Остаются открытыми вопросы подбора адекватной терапии при тяжелой форме БА, что обусловлено ограниченными количеством клинических исследований в детской популяции, часто неадекватным подходом при выборе препаратов, их доз, продолжительности лечения, распространенной стероидфобией и низкой приверженностью терапии среди пациентов.
Лечение бронхиальной астмы проводится поэтапно. Каждая из стадий развития требует внесения корректив в план терапевтических мероприятий. Для оценки астмы в динамике и степени контроля заболевания следует использовать пикфлоуметрию. Базисная (основная) терапия предполагает поддерживающее лечение, направленное на уменьшение воспалительной реакции. Рациональная терапия, начатая по возможности раньше, существенно замедляет процесс развития астмы.
Цель. Оценка вариантов базисной терапии у детей, страдающих бронхиальной астмой.
Материалы и методы исследования. Данная работа проведена в дизайне простого открытого клинического проспективного рандомизированного исследования. Было обследовано 30 детей в возрасте от 5 до 14 лет, которым проводилось лечение на базе 1 педиатрического отделения ОБУЗ «ОДКБ»; средний возраст в исследованной группе составил 7,53±0,45 лет; распределение по полу: мальчики составили 60%(18), а девочки – 40%(12).
Критерием включения пациентов в исследование явилось: наличие у них бронхиальной астмы; критерием исключения пациентов из исследования явилось наличие другой патологии. Средняя продолжительность заболевания у обследованных детей составила 1,5±1,3 лет.
В соответствии с поставленными задачами, объемом и характером проводимого лечения были определены следующие варианты базисной терапии: 33,3%(10) пациентам терапия проводилась кромонами, антилейкотриеновыми препаратами (тайлед, сингуляр); монотерапия ингаляционными глюкокортикостероидами (пульмикорт) – 33,3%(10) пациентов, терапия ингаляционными глюкокортикостероидами в средних или высоких дозах в комбинации с ингаляционным ß2-агонистом длительного действия (серетид, симбикорт) – 33,3%(10).
Степень тяжести астмы и уровень контроля болезни на момент сбора информации уточняли в соответствии с Федеральными клиническими рекомендациями по диагностике и лечению бронхиальной астмы от 2013г. и GINA-2014 [5,6].
Статистическая обработка данных проводилась с помощью программ BIOSTAT и EXCEL. Для определения достоверности различий использовали t-критерий Стьюдента. Достоверными считались различия при степени вероятности безошибочного прогноза (р) 95% (р < 0,05).
Результаты и их обсуждение. 50% (15) пациентов поступили в период обострения бронхиальной астмы с менее выраженной симптоматикой, а 13,3%(4) пациентов – в период обострения с приступом удушья, оставшиеся 36,7%(11) пациентов были госпитализированы на дообследование и аллергообследование.
При клиническом обследовании исследуемой группы пациентов было определено, что астму легкой степени тяжести имели 33,3%(10), средней степени – 46,7%(14), тяжелая астма наблюдалась в 20%(6) случаев.
В ходе обследования было выявлено несколько вариантов объективной картины: вариант 1 (перкуторно – ясный легочный звук и аускультативно – везикулярное дыхание) у 26,7%(8), вариант 2 (ясный легочный звук и жесткое дыхание) у 53,3%(16), вариант 3 (коробочный легочный звук, жесткое дыхание, сухие хрипы) у 20%(6) [10].
Данные спирометрии до назначения базисной терапии (рис.1) выглядели следующим образом: ОФВ1 ≥ 80% от должного зарегистрирован у 60%(18) пациентов, ОФВ1 80 – 60% от должного – у 26,7%(8) и менее 60% от должного – у 13,3%(4) [13].
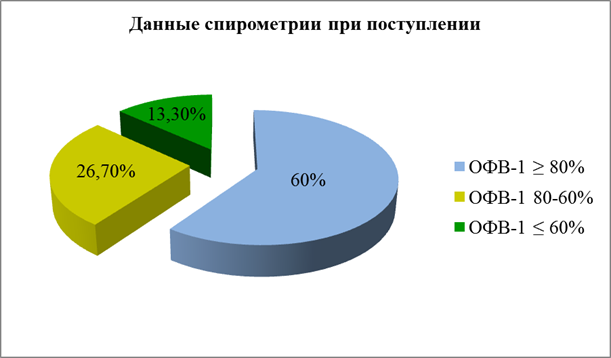
Рис. 1.
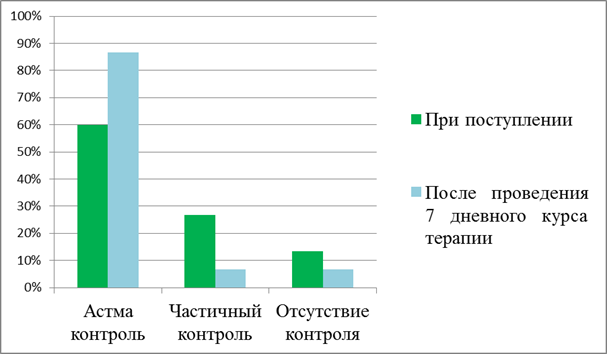
Было выявлено, что до начала базисной терапии астма контроль заболевания был достигнут у 60%(18) пациентов, частично контролировалась у 26,7%(8), вовсе не контролировалась у 13,3%(4). При повторном обследовании после проведенного 7 дневного курса базисной терапии астма хорошо поддавалась контролю у 86,6%(26) пациентов, частично контролировалась у 6,7%(2), вовсе не контролировалась у 6,7%(2) [11,12].
При повторной спирометрии после проведенного 7 дневного курса базисной терапии (рис.2) были получены следующие показатели функции внешнего дыхания: ОФВ1 ≥ 80% от должного зарегистрирован у 70%(21) пациентов, ОФВ1 80 – 60% от должного – у 23,3%(7) и менее 60% от должного – у 6,7%(2) [9].
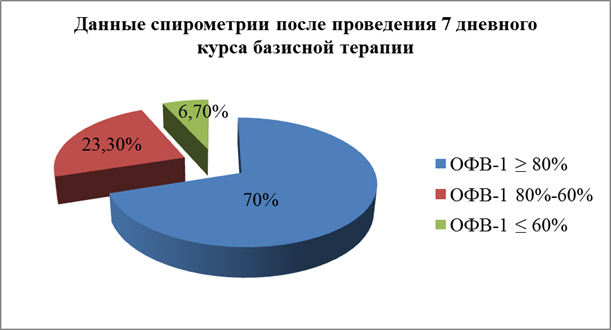
Рис. 2.
Сравнение результатов оценки функции внешнего дыхания, по данным спирометрии, до и после проведения 7 дневного курса базисной терапии показало, что количество лиц, имевших ОФВ-1≤60%, достоверно уменьшилось (p<0,05) [17]. Также наблюдалось уменьшение числа детей, имевших ОФВ-1 80-60% (p>0,05). Соответственно увеличивается количество пациентов с ОФВ-1≥80%. Таким образом, назначенные варианты базисной терапии бронхиальной астмы способствовали улучшению функции внешнего дыхания у исследуемой группы пациентов (рис.3.) [14].
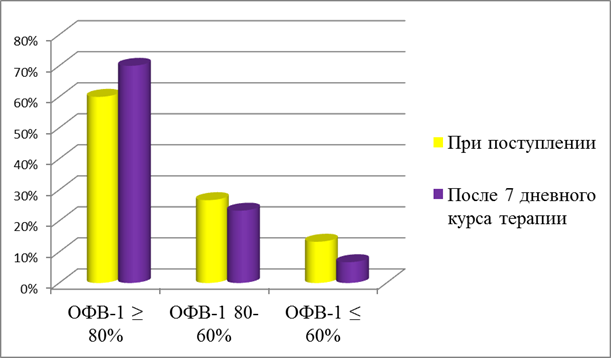
Рис.3.
При сравнении данных по астма контролю до и после проведения 7 дневного курса базисной терапии было выявлено, что количество пациентов в исследованной группе, у которых астма хорошо контролировалась выросло с 60% до 86,6% (p>0,05); также наблюдалось достоверное уменьшение числа детей с частично контролируемой и вовсе не контролируемой бронхиальной астмой (p<0,05). Таким образом, назначенные варианты базисной терапии, являются эффективными в осуществлении контроля бронхиальной астмы [15,16].
Вывод. Назначенные варианты базисной терапии бронхиальной астмы способствовали улучшению показателей функции внешнего дыхания, т.к. по результатам повторной спирометрии количество пациентов с ОФВ-1≤60% достоверно уменьшилось с 13,3 до 6,7% (p<0,05), также снизилось количество детей, имевших ОФВ-1 80-60% (p>0,05). Проведенная базисная терапия является эффективной для осуществления контроля бронхиальной астмы у исследуемой группы детей, т. к. после повторного обследования наблюдалось достоверное уменьшение числа детей с частично контролируемой (с 26,7 до 6,7%) и вовсе не контролируемой (с 13,3 до 6,7%) астмой (p<0,05) [15]. С целью оптимизации терапии пациентов с частично контролируемой и неконтролируемой астмой на стандартной базисной терапии необходимо внедрение дополнительных препаратов, относящихся к данной ступени, в том числе ИКС, отличающихся большей клинической эффективностью и безопасностью[18].
Библиографическая ссылка
Миненкова Т.А., Веденьева М.О., Симкина А.В. КЛИНИЧЕСКИЕ ОСОБЕННОСТИ БРОНХИАЛЬНОЙ АСТМЫ У ДЕТЕЙ // Международный студенческий научный вестник. – 2018. – № 6.;
URL: https://eduherald.ru/ru/article/view?id=19352 (дата обращения: 14.02.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Бронхиальная астма (БА) — хроническое заболевание, которое при отсутствии адекватного лечения неуклонно прогрессирует: нарастает тяжесть клинических и функциональных проявлений, что приводит к ранней инвалидизации ребенка и может явиться причиной развития угрожающих жизни состояний.
Воспалительная природа заболевания, обусловленная воздействием специфических и неспецифических факторов, проявляется морфологическими и функциональными изменениями во всех структурах бронхов. При этом наблюдаются повреждение и десквамация эпителиальных клеток, дезорганизация и склерозирование субэпителиальной части базальной мембраны, а также гипертрофия гладких мышц, инфильтрация стенки бронха эозинофилами, тучными клетками и Т-лимфоцитами. Длительный воспалительный процесс способен привести к необратимым морфологическим изменениям в виде резкого утолщения базальной мембраны с нарушениями микроциркуляции и развитием склероза стенки бронхов. Наличие характерных воспалительных изменений в бронхах определило важность применения медикаментозных противовоспалительных препаратов у больных БА. Основной целью назначения противовоспалительных препаратов при БА является достижение стойкой ремиссии заболевания посредством воздействия на воспалительный процесс в дыхательных путях.
К средствам базисной противовоспалительной терапии относятся мембраностабилизирующие препараты (кетотифен, кромоны), ингаляционные кортикостероиды и аллергенспецифическая иммунотерапия. В качестве средств базисной противорецидивной терапии рассматриваются также антилейкотриеновые препараты, β2-агонисты пролонгированного действия, а также теофиллины длительного действия.
Мембраностабилизирующие препараты. Из этой группы препаратов наиболее широко используются кромогликат натрия (интал) и недокромил натрия (тайлед), а также кетотифен (задитен). Данные препараты применяются в терапии бронхиальной астмы у детей на протяжении 30–40 лет. За это время накоплен огромный опыт их использования, определены показания и противопоказания к их назначению. В детской практике перечисленные препараты по-прежнему сохраняют свою актуальность.
Терапевтический эффект интала связан со способностью предупреждать развитие ранней фазы аллергического ответа посредством блокирования высвобождения медиаторов аллергии из тучных клеток и базофилов. Интал уменьшает проницаемость слизистых оболочек дыхательных путей и снижает бронхиальную гиперреактивность. Препарат назначается детям с легкой и средней персистирующей степенью тяжести БА. Используется в виде дозированных аэрозолей (разовая доза 1 и 5 мг) или порошка в капсулах (по 20 мг в капсуле) для ингаляций. У детей раннего возраста возможно введение препарата посредством небулайзера. С этой целью применяется раствор для ингаляций (ампулы по 2 мл). Длительность курсового лечения составляет от 3 до 6 мес, больному назначают по 1–2 ингаляции от 2 до 4 раз в сут. Вопрос о дальнейшем приеме данного препарата решается лечащим врачом индивидуально, с учетом эффективности лекарственного средства и его влияния на течение заболевания.
Механизм действия недокромила натрия (тайлед) и кромогликата натрия сходен, однако тайлед, в отличие от последнего препарата, угнетает дегрануляцию тучных клеток не только в соединительной ткани, но и в слизистых оболочках дыхательных путей. Недокромил натрия обладает более выраженным противовоспалительным действием по сравнению с кромогликатом натрия. Препарат применяется у детей с легким и среднетяжелым течением БА в качестве базисной (противорецидивной) терапии. Он выпускается в виде дозированного аэрозоля и назначается по 2 вдоха 4 раза в сут в течение двух нед, а затем — по 2 вдоха 2 раза в день, курс лечения составляет от 3 до 6 мес.
Применение интала и тайледа способствует сокращению приступов бронхиальной астмы и достижению более легкого течения болезни, исчезновению ночных симптомов и приступов удушья при физическом напряжении.
К препаратам, способным подавлять высвобождение медиаторов аллергии, относится кетотифен (задитен, астафен, кетастма, кетоф, позитан) — средство, обладающее противовоспалительным и антигистаминным действием. Кетотифен применяется в основном у детей раннего возраста в виде таблеток или сиропа в разовой дозе 0,25 мг на 1 кг массы тела 2 раза в сут или по 1/3–1/2 табл. 2 раза в день. Длительность курса лечения составляет 3, 6, 9, 12 мес, в зависимости от течения болезни.
Необходимо отметить, что эффективность мембраностабилизирующих препаратов высока у детей с легким и среднетяжелым течением БА. На фоне регулярной терапии кромонами при легком и среднетяжелом течении БА отмечается уменьшение числа экстренных обращений в поликлинику и скорую медицинскую помощь, а также снижение частоты и длительности госпитализаций.
В качестве средств базисной терапии БА у детей используются антилейкотриеновые препараты, среди которых успешно применялись монтелукаст (сингуляр) и зафирлукаст (аколат). Данные препараты выпускаются в таблетках: сингуляр по 5 мг (1 табл.), применяется 1 раз вечером; аколат по 20 мг 2 раза в день, утром и вечером за 1 ч до еды или через 2 ч после еды.
В работе Н. А. Мокиной (2005) было показано, что у детей с легкой персистирующей и среднетяжелой бронхиальной астмой, не получающих ингаляционные глюкокортикостероиды (ИГКС), наиболее оптимальным способом повышения эффективности кромонов является присоединение к ним формотерола (оксис турбухалера, фородила). Данное сочетание препаратов позволяет хорошо контролировать течение БА у детей, приводит к улучшению клинико-функциональных показателей и улучшает качество жизни. В случае недостаточной эффективности данной терапии необходимо рассматривать вопрос о назначении ИГКС.
Глюкокортикостероидные препараты (ГКС), как ингаляционные, так и системные, обладают выраженной противовоспалительной активностью. Они подавляют острое и хроническое воспаление, снижают выживаемость воспалительных клеток и тканей (например, увеличивают апоптоз эозинофилов) и усиливают транскрипцию генов, отвечающих за выработку противовоспалительных белков (липокортина-1), ингибирующего фосфолипазу А2, синтез лейкотриенов, простагландинов, способствуют уменьшению выработки противовоспалительных цитокинов.
Современные принципы терапии бронхиальной астмы предусматривают широкое применение ингаляционных ГКС, особенно при тяжелых формах заболевания. Эти препараты обладают выраженным местным противовоспалительным действием и способствуют уменьшению отека слизистых оболочек дыхательных путей и гиперреактивности бронхов. Они не оказывают бронхолитического эффекта, но тем не менее улучшают показатели функции внешнего дыхания. При назначении адекватных доз ингаляционных кортикостероидов практически не наблюдается системных эффектов. При БА эти препараты используются в виде различных устройств для ингаляций (табл.).
| Таблица. Ингаляционные глюкокортикостероидные препараты, использующиеся при бронхиальной астме | ||
| Действующее вещество | Торговое название | Форма выпуска |
| Беклометазон | Альдецин, Бекотид, Бекломет, Беклазон, Беклазон Легкое Дыхание, Беклоджет, Бекодиск и др. | Дозированный аэрозоль с разовыми дозами 50, 100 и 250 мкг активного вещества; в дисках в разовой дозе 50 и 100 мкг |
| Будесонид | Будесонид, Бенакорт, Пульмикорт Турбухалер, Пульмикорт суспензия | Дозированный аэрозоль 50 и 100, 200 мкг в 1 дозе; порошок для ингаляций в турбухалере/циклохалере по 100, 200/200 мкг в 1 дозе; Суспензия для ингаляций в дозе 0,25, 0,5 мг |
| Флутиказон | Фликсотид | Дозированный аэрозоль 25, 50, 125, 250 мкг в 1 дозе |
Применение ингаляционных ГКС позволило существенно повысить эффективность терапии тяжелых форм БА за счет местного противовоспалительного действия этих лекарственных средств, а также уменьшить выраженность и частоту побочных эффектов, связанных с их системным действием.
Проблема назначения ИГКС у детей постоянно находится в центре внимания специалистов. До сих пор не решен вопрос о длительности курсового лечения ИГКС у детей. Дискутируется вопрос об адекватности высоких и низких доз этих препаратов. Не решена проблема обоснованности или необоснованности «стероидофобии», которая до сих пор наблюдается среди родителей детей и врачей. Назначая пациенту высокоэффективную, но постоянную медикаментозную терапию, особенно ИГКС, педиатры часто задумываются о том, как уберечь ребенка с бронхиальной астмой от возможных побочных эффектов, особенно при длительном лечении. Кроме того, многие современные средства базисной терапии, позволяющие контролировать течение болезни, к сожалению, доступны далеко не всем. Так, стоимость месячного курса ИГКС колеблется от 650 до 900 руб. Не решен до конца вопрос о льготном обеспечении этими препаратами детей, страдающих данным заболеванием.
В ряде случаев ИГКС оказываются недостаточно эффективными, поскольку выраженная бронхиальная обструкция существенно снижает поступление этих лекарственных средств в средние и нижние дыхательные пути. В связи с этим перспективным становится применение у детей с БА комбинированных препаратов, содержащих вещества с различным механизмом действия. Одним из преимуществ комбинированной терапии является высокая эффективность лекарственных средств при использовании более низких доз ИГКС, простота выполнения процедур и достаточно высокая дисциплина со стороны родителей и самих пациентов.
Среди комбинированных препаратов особое значение приобретают средства для ингаляционного введения, содержащие в своем составе ИГКС и β2-агонисты пролонгированного действия. Эти средства применяются в клинической практике всего несколько лет, однако уже успели занять центральное место в фармакотерапии бронхиальной астмы. Комбинация ИГКС и β2-агонистов пролонгированного действия оказывает влияние на различные аспекты острого и хронического воспаления, а также обладает бронхолитическим эффектом. Препараты взаимодействуют на клеточном и молекулярном уровне, оказывая синергичное действие. При этом ИГКС усиливают транскрипцию β2-адренергических рецепторов в легких человека и повышают их синтез в слизистой оболочке дыхательных путей. Имеется ряд доказательств, что β2-агонисты пролонгированного действия стимулируют неактивный глюкокортикоидный рецептор, в результате чего он становится более чувствительным к стероидозависимой активации. Последнее обстоятельство позволяет использовать более низкие дозы ИГКС без потери клинического эффекта.
Считается, что при назначении комбинированных средств в виде одной ингаляции, препараты приобретают большую эффективность и обеспечивают лучшую приверженность больных к лечению. Кроме того, такой способ лечения обходится дешевле, чем применение двух препаратов по отдельности.
Одним из комбинированных препаратов, представленных на российском рынке, является симбикорт (будесонид + формотерол), одна доза которого содержит 80 мкг будесонида и 4,5 мг формотерола (I) либо 160 мкг будесонида и 4,5 мг формотерола (II). Симбикорт I рекомендован детям с 6 лет и старше, а симбикорт II — детям с 12 лет. Препарат назначают 2 раза в день (по 1 вдоху х 2 раза), однако можно увеличивать количество ингаляций до 4 в сутки (по 2 вдоха х 2 раза) либо уменьшать до 1 раза в сут. Разовая доза может колебаться, составляя 1–2 вдоха; возможен однократный прием.
Международные исследования показали, что гибкое дозирование поддерживающей терапии будесонидом/формотеролом приводило к значимому сокращению числа тяжелых обострений, несмотря на уменьшение объема терапии на 40% по сравнению с приемом фиксированных доз будесонида/формотерола. Уменьшение суммарной лекарственной нагрузки представляется особенно важным для пациентов со среднетяжелой и тяжелой БА, использующих более высокие дозы препаратов. Кроме того, применение будесонида/формотерола в режиме гибкого дозирования уменьшает затраты на лечение.
Изучение преимуществ гибкого дозирования на фоне поддерживающей терапии будесонидом/формотеролом и использования фиксированных доз этого препарата было проведено в ходе 7-месячного рандомизированного, двойного, слепого с открытой фазой и в параллельных группах исследования (SUND). Оно было проведено в 93 центрах 6 стран (Дания, Финляндия, Германия, Норвегия, Швеция, Нидерланды). В исследование были включены 1044 амбулаторных больных в возрасте 12 лет и старше с тяжелым течением БА.
Все пациенты были разделены на три группы: симбикорт 160/4,5 мг фиксированные дозы (ФД), симбикорт 160/4,5 мг гибкое дозирование поддерживающей дозы (ГДПД) и серетид мультидиск 50/25 мкг (ФД).
В ходе наблюдения было установлено, что в группе больных, получающих симбикорт в режиме гибкого дозирования поддерживающей дозы, на 40% уменьшалось количество тяжелых обострений болезни, устанавливался более эффективный контроль над течением заболевания, по сравнению с группами больных, получавших симбикорт ФД и серетид ФД. С помощью меньших доз симбикорта в режиме гибкого дозирования удавалось свести к минимуму использование β2-агонистов короткого действия. Наши собственные наблюдения согласуются с результатами зарубежных и российских исследований, согласно которым применение симбикорта значительно улучшает показатели функции внешнего дыхания, уменьшает выраженность клинических симптомов, положительно влияет на самочувствие больных.
Необходимо также помнить, что в случаях, когда при использовании комбинированных препаратов не удается стабилизировать состояние больного, следует искать иную причину обострений болезни.
Национальные и международные согласительные документы определяют также тактику и стратегию, которых следует придерживаться по отношению к детям-инвалидам по бронхиальной астме. Предлагается целый комплекс терапевтических мероприятий, позволяющих вывести их из рамок физических, эмоциональных и социальных ограничений, предупредить прогрессирование заболевания и улучшить его прогноз.
Большое значение на современном этапе реформирования здравоохранения для детей с БА приобретает санаторно-курортное лечение, так как с помощью естественных и лечебных факторов, правильно подобранной базисной терапии, диетотерапии, использования элиминационных режимов, ЛФК, массажа, физиотерапии, обучения в «Астма-школе» можно добиться существенных успехов в плане достижения стойкой ремиссии болезни.
В последние годы возрос интерес к немедикаментозным методам терапии. Данные методы терапии должны хорошо сочетаться с базисной терапией и быть патогенетически обоснованы. Рациональное использование немедикаментозных методов терапии позволяет уменьшить объем и длительность применения лекарственных препаратов и психологически хорошо переносится детьми.
В современной концепции развития здравоохранения приоритетным является Государственная программа поэтапного выполнения комплекса мероприятий по раннему выявлению и лечению БА, профилактики осложнений и развития инвалидности.
Важным аспектом проблемы остается вопрос медицинского наблюдения за детьми, страдающими бронхиальной астмой. В настоящее время лечением БА у детей занимаются врачи различных специальностей: педиатр, пульмонолог, аллерголог. В связи с этим нередко возникают трудности в достижении согласованности и плодотворного сотрудничества между медицинскими работниками, с одной стороны, и родителями ребенка — с другой. Все это мешает установлению адекватного контроля за течением болезни. Ситуацию усугубляют кратковременность контактов с врачом, невозможность получить консультацию специалиста из-за перегруженности последних. Ведущие специалисты России пришли к единому мнению, что дети с БА должны наблюдаться у участковых педиатров. Для выработки плана обследования и коррекции терапии этим пациентам необходимы консультации специалистов (аллергологов и пульмонологов). Соблюдение преемственности в работе педиатра, аллерголога и пульмонолога окажет существенную помощь в профилактике серьезных осложнений и благоприятных исходов болезни.
Актуальным является вопрос разработки полноценной программы терапии и реабилитации при БА у детей с учетом возможности полноценной ее реализации. Это ключевая проблема лечения детей с БА, поскольку результаты данной терапии напрямую влияют на здоровье завтрашней трудоспособной молодежи.
Литература
- Бронхиальная астма у детей: диагностика, лечение и профилактика // Научно-практическая программа. — М., 2004. — 48 с.
- Геппе Н. А., Ревякина В. А. и др. Многоцентровое открытое рандомизированное клинико-экономическое исследование различных режимов фармакотерапии при лечении среднетяжелой и тяжелой бронхиальной астмы у детей // Аллергология. — 2004. — № 3. — С. 3–11.
- Геппе Н. А., Ревякина В. А., Мизерницкий Ю. Л. и др. Клиническая эффективность и безопасность симбикорта при лечении бронхиальной астмы у детей 6–12 лет // Пульмонология детского возраста: проблемы и решения. — 2004. — Вып 4. — С. 170–180.
- Глобальная стратегия лечения и профилактики бронхиальной астмы /Под редакцией А. Г. Чучалина. — М.: Издательство «Атмосфера», 2002. — 160 с., ил.
- Глобальная стратегия лечения и профилактики бронхиальной астмы (Совместный доклад Национального института «Сердце, Легкие, Кровь» (США) и Всемирной Организации Здравоохранения) // М.: Издательства «Атмосфера», 2002.— 160 с.
- Дрожжев М. Е., Лев Н. С., Костюченко М. В. и др. Современные показатели распространенности бронхиальной астмы среди детей // Пульмонология. — 2002. — № 1. — С. 42–46.
- Княжеская Н. П., Потапова М. О. Возможности гибкого дозирования Симбикорта у пациентов со среднетяжелой и тяжелой бронхиальной астмой по данным исследования SUND// Атмосфера. — 2004. — № 3. — С. 21–24.
- Кондюрина Е. Г., Елкина Т. Н., Лиханов А. В., Карцева Т. В. Динамика распространенности бронхиальной астмы у детей в г. Новосибирске // Пульмонология. — 2003. — № 6. — С. 51–56.
- Мокина Н. А. Ретроспективный анализ и оптимизация терапии бронхиальной астмы у детей: Автореф. … док. мед. наук. — 2005. — 36 с.
- Огородова Л. М., Петровский Ф. И., Прохорова Т. П. Контроль над бронхиальной астмой: можем ли мы достичь большего? //Атмосфера — 2004. — № 3. — С. 1-4.
- Anderson H. R., Poloniecki J. D., Strachan D. P. et al. Immunization and symptoms of atopic disease in children: results from the International Study of Asthma and Allergies in Childhood// Am Public Health. — 2001.— № 91. — P. 1126–1129.
- Barners P. J. Pathophysiology of asthma//in «Asthma» edit by Chung F., Fabrri L.M. — 2003 — ERS Monography — Vol.8 .— P. 84–114.
- Carlsson A. K., Axelsson I. E., Borul S. Serolodgical screening for celiac disease in healthy 2,5-year-old children in Sweden//Pediatrics. — 2001; 107 — P. 42–5.
- Holgate S. T., Arshad S. H. The year in allergy 2003// Oxford. — 2003.— 320 p.
- Kay A. B. Allergy and allergic disease. First of two parts// N Engl J Med 2001.— 344, P. 30–37.
- Lack G. Pediatric allergic rhinitis and comorbid disorders// J. Allergy Clin Immunol. — 2001. — № 108. — P. 9–15.
- Martinez F.D. Global Strategy for Asthma Managment and Prevention. Revised 2002//National Institutes of health. — 2002. Development of wheezihg Disoders and asthma in Preschool Children// Pediatrics — 2002.- Vol. 109. — N.102 (February). — P. 362–367.
- Mutius E. The rising trends in asthma and allergic disease //Clin. Exp. Allergy. — 2001. — Vol. 28 (Suppl.). — N. 5. — P. 45–49.
- Pocket G. For Asthma Management and Prevention in Children. Revised 2002 // Natio nal Institutes of health. — 2002. — P. 4.
- Wahn U. Der allergische March // Allergologic 2002.— № 25.— Р. 60–73.
- Wright A. L. Epidemiology of asthma and recurrent wheeze in childhood//Clin Rev Allergy and Immunol. — 2002. — № 22. — P. 33–44.
В. А. Ревякина, доктор медицинских наук, профессор
НЦЗД РАМН, Москва
Источник