Воспаление жировой ткани и атеросклероз
Ученые Методистской больницы (The Methodist Hospital), работающие под руководством Виллы Хсуе (Willa Hsueh), утверждают, что, по крайней мере, частью проблемы являются сами жировые клетки –
адипоциты. В экспериментах на клетках страдающих ожирением людей и содержащихся на высококалорийной диете мышей они установили, что чрезмерное поступление из кровотока питательных веществ,
трансформирующихся в жиры и откладывающихся в адипоцитах, усиливает синтез гормона лептина, избыток которого стимулирует продукцию иммунными клетками CD4+ T-лимфоцитами
гамма-интерферона. Это сигнальное соединение, в свою очередь, запускает в жировых клетках синтез белков комплекса гистосовместимости II класса.
Обычно эти белки экспрессируются клетками для того, чтобы привлечь внимание иммунной системы к проникшему в организм патогену (бактерии или вирусу). Получается, что причиной развития
воспалительного статуса жировой ткани, является ложный сигнал тревоги, посылаемый адипоцитами иммунной системе. В дальнейшем этот процесс все больше усугубляется и в него вовлекаются другие
клетки иммунной системы – макрофаги. Специалистам и ранее было известно об активном участии Т-лимфоцитов и макрофагов в воспалении жировой ткани, однако до сих пор никто не мог понять, что
выступает в роли пускового механизма этой воспалительной реакции.
Выяснение того, что причиной развития воспаления жировой ткани является продукция адипоцитами белков главного комплекса гистосовместимости II класса, указывает на принципиально новую мишень
медикаментозной терапии ожирения. Блокирование этой реакции адипоцитов на поступление избытка питательных веществ само по себе не излечит от ожирения, однако поможет облегчить наиболее
неблагоприятные проявления этого состояния во время проведения курса комплексной терапии.
Запуск воспалительной реакции сопровождается усилением синтеза липидов печенью (в основном холестерина и нейтральных жиров) с одновременным угнетением их депонирования в жировой ткани и окисления
жирных кислот в печени и мышцах. Предполагается, что в условиях ожирения структурные элементы жировой ткани находятся в состоянии нарастающей гипертрофии и постоянного
оксидативного стресса, вызванного, в частности, токсическим воздействием промежуточных продуктов метаболизма жирных кислот. Это приводит к активации внутриклеточных сигнальных
систем в адипоцитах и происходит существенная пролиферация клеток макрофагального типа в жировой ткани. Последние, в свою очередь, активируют и далее усиливают воспалительные процессы во всей
жировой ткани организма. В дальнейшем происходит генерализация воспаления с повышением синтеза таких провоспалительных цитокинов, как интерлейкин-1-бета (ИЛ-1В) и интерлейкин-6 (ИЛ-6), а также
С-реактивного белка (СРБ).
Таким образом, большие объемы жировой ткани становятся постоянным источником значительных количеств провоспалительных цитокинов, синтезируемых как самими
адипоцитами, так и мигрировавшими в жировую ткань макрофагами, что приводит к формированию и поддержанию в организме хронического вялотекущего воспалительного процесса. Особенность данного
воспаления заключается в том, что оно не вполне соответствует общепринятому патофизиологическому представлению об этом процессе. Для его описания были даже предложены специальные термины, такие
как мета-воспаление или пара-воспаление.
Его характерной чертой можно считать невысокую интенсивность, не дающую прямых клинических симптомов, но, в то же время, выраженную системность, т.е. воздействие на широкий спектр органов и
тканей, приводящее к изменению их метаболизма, нарушению их функции и параллельной активации в них реакций иммунной системы.
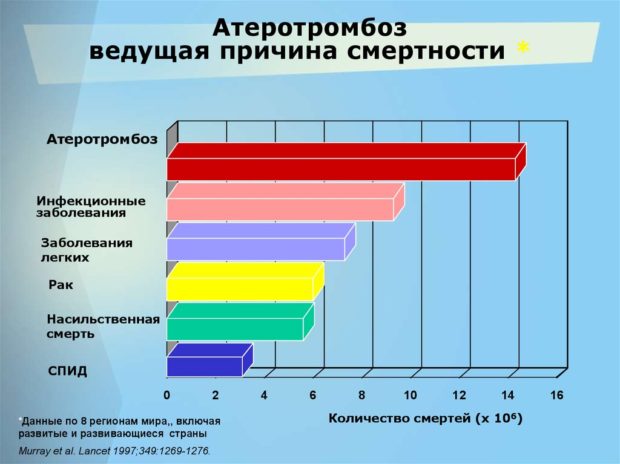
Примерами такого системного воздействия могут служить сосудистый атерогенез, инсулинорезистентность и сахарный диабет 2-го типа.
Понятно поэтому, что наличие хронического воспалительного процесса делает очень проблематичной успешную коррекцию избыточной массы тела. Возникающие в процессе воспаления нарушения липидного
обмена усугубляются еще и тем, что жировая ткань сама является весьма иммунологически активным органом. Поскольку она вырабатывает ряд факторов воспаления, больные ожирением обладают намного
большей склонностью к развитию хронических воспалительных заболеваний — дыхательной системы, опорно-двигательного аппарата, желудочно- кишечного тракта и др.
Доказано что, при ожирении, воспаление инициируется локальной гипоксией для увеличения количества кровеносных сосудов и улучшения кровоснабжения жировой ткани.
Все больше данных свидетельствует о том, что макрофагы и провоспалительные цитокины необходимы для реконструкции жировой и дифференциации адипоцитов. Таким образом, при ожирении формируется
порочный круг на уровне иммунной системы, который необходимо разорвать для успешного лечения ожирения.
При комплексном лечении ожирения и инсулинорезистентности надо учитывать, что жировая ткань накапливает в себе воспалительные агенты, токсины, которым жировая ткань служит “складом”
именно поэтому человек с лишним весом находится в состоянии хронического воспаления и интоксикации.
Подпишитесь на НОВОСТИ и получайте эксклюзивную информацию о самых последних исследованиях по противостоянию раку. Информация доступна только подписчикам.
Источник
Столкнувшись с «плохим холестерином», иммунные клетки макрофаги запускают воспалительную реакцию, после чего начинают накапливать избыток холестерина в самих себе.
Липопротеины низкой плотности становятся причиной атеросклеротических бляшек на сосудистых стенках, которые сужают просвет сосудов и нарушают кровоснабжение тканей. (Иллюстрация: Manu5 / Wikipedia)
‹
›
Атеросклеротические бляшки, возникающие на стенках сосудов, состоят не только из холестерина и других жиров – в них содержится довольно много иммунных клеток, нейтрофилов и макрофагов.
Как известно, одна из главных задач макрофагов – поглощение разнообразного клеточного мусора: мертвых клеток, обломков мембран, белковых агрегатов, избыток липидов. Однако, когда макрофаги пытаются избавить сосуды от избытка липидов, могут возникнуть проблемы.
У нас в крови плавает много липопротеинов, то есть комплексов липидов с белками-переносчиками; из этих липопротеинов всем хорошо знакомы ЛПВП (липопротеины высокой плотности) и ЛПНП (липопротеины низкой плотности). ЛПНП иногда называют «плохим» холестерином, так как чем их больше, тем выше риск атеросклероза. В норме ЛПНП просто перевозят липиды, которые нужны для разных текущих клеточных процессов. Угроза атеросклероза возникает, когда липопротеины низкой плотности получают некоторые химические модификации.
Макрофаги в стенках сосудов поглощают избыток липопротеинов, однако из-за модификаций они не могут их переварить. Из-за избытка липидов иммунные клетки становятся менее подвижными (в таком виде их называют пенистыми клетками), начинают выделять воспалительные сигналы и в итоге гибнут. В результате в атеросклеротическую бляшку, которая состоит из холестерина, соединительнотканных белков, кальция и пр., добавляются еще и больные переродившиеся макрофаги, не справляющиеся со своей работой, провоцирующие воспаление и накопление соединительной ткани.
О том, что воспалительная реакция и атеросклероз тесно связаны между собой, говорят уже сравнительно давно (о чем мы неоднократно упоминали), однако кое-что в их взаимосвязи остается неясным. В частности, до сих пор было непонятно, как именно всё-таки из макрофагов получаются пенистые клетки. Отчасти ответ на этот вопрос дают исследования сотрудников НИИ общей патологии и патофизиологии, НИИ физико-химической медицины Росздрава, компании «Биософт» и их коллег из других научных центров России, США, Германии и Японии.
Очевидно, что у пенистых клеток некоторые гены должны работать иначе, чем у макрофагов. В экспериментах иммунным клеткам скармливали модифицированные липопротеины, из-за которых в макрофагах накапливается холестерин. В ответ на такие атерогенные липопротеины в клетках менялась активность десяти генов – однако ни один из них не участвовал в метаболизме холестерина.
С другой стороны, семь из десяти генов имели прямое отношение к воспалению. Иными словами, «плохие» липопротеины сначала включают в иммунных клетках воспаление, а потом уже иммунные клетки начинают накапливать в себе липиды, и далее уже разворачиваются прочие атеросклеротические процессы. Подробно результаты исследований опубликованы в журналах Atherosclerosis и Current Pharmaceutical Design.
Полученные результаты лишний раз говорят о том, насколько важны воспалительные процессы в развитии атеросклероза – а это значит, что если мы хотим с ним эффективно бороться, мы должны думать не только о холестерине, не только об обмене веществ, но и об иммунитете.
Работа выполнена при поддержке Российского научного фонда (РНФ).
По материалам пресс-службы РНФ.
Источник
- Как развивается атеросклероз?
- Как образуются атеросклеротические бляшки?
- Причины воспаления
- Почему какие-то органы больше страдают от атеросклероза, а какие-то меньше?
Сахарный диабет, ожирение, повышенный уровень холестерина и артериального давления, все это — факторы риска развития атеросклероза кровеносных сосудов и повышенного риска сердечно-сосудистых событий. Что кроется за этими непонятными словами?

Как развивается атеросклероз?
Атеросклероз — это, простыми словами, процесс отложения в стенке сосудов «плохого» холестерина. Ключевым моментом здесь является именно предлог «В». «Плохой холестерин» откладывается внутри сосудистой стенки, а не налипает бляшками снаружи. При этом атеросклерозом поражаются именно артерии. В венах чаще образуются тромбы, они имеют другую природу, и пока мы о них говорить не будем, чтобы не создавать каши в голове.
Холестерин — это общее количество липидов в крови (продуктов расщепления жиров в кишечнике) разного качества. В состав холестерина входят:
- Липопротеиды низкой плотности (ЛПНП) — «плохой холестерин», наиболее атерогенная фракция. Это основной транспортировщик триглицеридов в крови. На стенках сосудов находится большое количество рецепторов к ЛПНП. Именно этому холестерину проще всех проникнуть в сосудистую стенку. Это нужно, чтобы обеспечить ткани и органы триглицеридами. Если его недостаточно, то клетки начинают разрушаться, из-за того, что уменьшается их обеспечение триглицеридами, которые помогают поддерживать структуру клеточной стенки. Такое бывает, например, при передозировке статинами (препаратами от холестерина).
- Триглицериды (ТГ) — источник энергии и строительный материал клетки. Они входят в состав клеточной стенки, обеспечивают ее стабильность и поддерживают энергетический обмен в организме. Их уровень повышается после приема жирной пищи, а в промежутках между едой они сжигаются, обеспечивая организм энергией. При злоупотреблении жирной пищей их уровень в крови повышается в 2-3 раза, что является риском острого панкреатита, делает кровь более густой и жирной («хилезной»). Повышение уровня триглицеридов в 5 и более раз часто связано с различными нарушениями белкового состава крови или наследственными патологиями.
- ЛПВП — «хороший холестерин». Он, грубо говоря, вытаскивает «плохой холестерин» из сосудистой стенки и отправляет в печень, где тот перерабатывается и выводится из организма.
Как образуются атеросклеротические бляшки?
Избыточное питание, недостаточное движение, ожирение и сахарный диабет провоцируют отложение жира в печени. Развивается так называемый жировой гепатоз. Ведь жир откладывается не только под кожей, но и во внутренних органах, в том числе, и в печени. Жировой гепатоз — это отправной момент развития атеросклероза, ведь именно печень вырабатывает ЛПНП и ЛПВП, а также выводит избыток холестерина с желчью.
В результате жирового гепатоза часть клеток печени перестают выполнять свою функцию. Это приводит к изменению соотношения плохого и хорошего холестерина в организме. В крови повышается уровень «плохого холестерина» (ЛПНП) и понижается уровень «хорошего холестерина» (ЛПВП). Такое изменение соотношений «плохого» и «хорошего» холестерина называется дислипидемия.

Когда уровень ЛПНП в крови выше нормы (для каждого эти нормы подбираются индивидуально в зависимости от возраста и сопутствующей патологии), то он начинает в избытке поступать в сосудистую стенку и откладываться внутри нее. Это происходит не где-то в одном месте, в каких-то определенных артериях или органах. Это происходит во всех сосудах одновременно.
В местах наибольшего повреждения сосудистой стенки откладываются атеросклеротические бляшки — это участки наибольшего отложения холестерина, сильно суживающие просвет сосуда.

По началу атеросклеротическая бляшка довольно рыхлая, а ткань, которая ее покрывает и отделяет ее содержимое от просвета сосуда, «покрышка», — довольно тонкая. Такая атеросклеротическая бляшка не сильно перекрывает просвет сосуда, однако, может легко повреждаться под воздействием высокого артериального давления или сахара крови. От этого в покрышке могут появляться трещины или язвы, сквозь которые в просвет сосуда попадает содержимое бляшки. Это может стать источником эмболии (закупорки) более мелких сосудов и повреждения тканей, которые они кровоснабжают.
В области язв и повреждений покрышки могут образовываться тромбы, блокирующие просвет сосуда и также вызывающие ишемическое повреждение ткани. То есть смерть тканей, к которым не поступает кровь из-за того, что сосуд, по которому она поступала, блокирован тромбом или содержимым атеросклеротической бляшки.
Чаще всего повреждение бляшки является причиной инфарктов и инсультов у молодых пациентов (35-45 лет), когда атеросклеротические изменения сосудов уже начались, но еще не стабилизировались. Именно в этом возрасте, особенно у мужчин, начинает подскакивать давление. Стрессы и неправильный образ жизни уже подрывают здоровье, но Вы об этом еще не знаете.

Основной причиной локального отложения холестерина и развития атеросклеротических бляшек является повреждение сосудистой стенки. В настоящее время основной причиной такого повреждения рассматривается воспаление.
Причины воспаления
- Высокий сахар крови;
- Высокое артериальное давление;
- Хронические вирусные или бактериальные инфекции;
- Гипоксия, то есть недостаток кислорода, который бывает у курильщиков, людей, ведущих малоподвижный образ жизни или страдающих хроническими легочными заболеваниями или хроническим бронхитом;
- Высокий уровень холестерина сам по себе провоцирует воспаление;
- Злоупотребление алкогольными напитками.
Чем больше проходит времени с момента отложения холестерина в стенке сосуда, тем интенсивнее он захватывается окружающими клетками и начинается дальнейшее ремоделирование атеросклеротической бляшки, то есть изменение ее структуры.
В стенке артерий есть гладкомышечные клетки, которые позволяют им изменять свой диаметр, сокращаться или расслабляться. Это нужно для поддержания давления, например, при изменении положения тела в пространстве.
Под воздействием высокого уровня холестерина в крови и стенке сосудов, эти гладкомышечные клетки начинают делиться, разрастаться, захватывать излишки ЛПНП, изменяться и вырабатывать факторы, которые приводят к уплотнению атеросклеротической бляшки.

Чем старше атеросклеротическая бляшка, тем она становится плотнее, и тем труднее от нее избавиться.
В ней начинают откладываться соли кальция. Она становится жесткой, грубо говоря, обызвествляется.
Особенно показательно это видно на посмертных вскрытиях людей, умерших от сердечно-сосудистых заболеваний. Их артерии буквально хрустят под ножом, а аорта как будто покрыта маленькими жемчужинками.
Почему какие-то органы больше страдают от атеросклероза, а какие-то меньше?
Потому что в разных органах ширина артерий разная. Самая крупная артерия в нашем организме — это аорта, ее толщина 2-2,5 см. Самые мелкие артерии — это артерии глаз и почек, в этих органах толщина самых крупных артерий 0,1-0,2 мм. Теперь представьте, какие из них будут страдать первыми.
Атеросклероз — это системное заболевание организма. Но с ним можно справиться: отсрочить его появление или замедлить развитие. О том, как это сделать, читайте в моей следующей статье.
Вам также может понравиться статья:
- Полезные жирные продукты
- Как почистить сосуды от холестерина
- Сахарный диабет и повышенное артериальное давление
- Лимонад-убийца или чем опасны сладкие напитки
- Что съесть, чтобы снизить уровень холестерина?
Источник

Что такое панникулит?
— это воспалительная реакция, в основном подкожной жировой клетчатки, вызванная некрозом липоцитов. Может касаться жировой ткани в любом месте, а также протекатьс симптомами со стороны различных систем и органов. Причина неизвестна. Провоцирующие факторы: травмы (также связанные с умышленным калечением), химические вещества с внешним воздействием, биохимические нарушения в организме (например, повышение активности ферментов железы поджелудочной), инфекции. Может сопровождать другие системные заболевания ткани соединительной (СКВ), лимфопролиферативные синдромы, гистиоцитоз.
Клиническая картина и типовое течение панникулита
Наиболее частой является идиопатическая форма (болезнь Вебера-Крисчена); обычно развивается у женщин белой расы. Основной симптом: очень болезненные узловатые патологические образования в жировой подкожной клетчатке, расположенной преимущественно на конечностях, реже в области туловища. Обострению болезни часто предшествуют боли в суставах и мышцах и субфебрилитет. Патологические образования в подкожной жировой клетчатке сохраняются в течение нескольких недель, заживают с формированием «тарелкообразных» шрамов. Реже возникают свищи, из которых выделяется масляное асептическое содержание. Иногда сопутствующе проявляются артрит, серозит, нефрит, поражение печени и системы крови. Узлы в подкожной жировой клетчатке могут быть сопутствующими болезням поджелудочной железы (панкреатиту, псевдокисте, посттравматическим повреждениям, ишемии), а в некоторых случаях присоединяется артрит и тогда формируется триада заболеваний — панникулит (panniculitis), артрит (arthritis), панкреатит (pancreatitis).
Диагностика панникулита
Вспомогательные исследования панникулита при диагностике:
1. Лабораторные исследования: при обострениях болезни наблюдается значительное повышение СОЭ, лейкоцитоз с преимуществом нейтрофилов, анемия, иногда протеинурия и повышенное количество эритроцитов и лейкоцитов в осадке мочи, повышенная активность липазы в сыворотке (у больных с изменениями в поджелудочной железе).
2. Гистологическое исследование биоптата, взятого с места с воспалительными изменениями на ранней стадии заболевания, выявляет некроз липоцитов, наличие макрофагов, содержащих фагоцитированные липиды, тромботические изменения в сосудах, а на более поздней стадии фиброз.
3. РГ пораженных суставов: сужение щелей суставных и очаги остеолиза.
Диагностические критерии панникулита
Диагноз устанавливают на основе типичных изменений в гистологической картине. Существенным (кроме изменений в подкожной жировой клетчатке) является определение наличия других поражений, которые могли бы иметь связь с панникулитом (например, это может быть первое проявление заболевания поджелудочной железы); а также решение вопроса, является заболевание идиопатическим или составным иного патологического синдрома. Необходимо исключить умышленное повреждение кожи у лиц с психическими расстройствами.
Дифференциальная диагностика панникулита
Узловая эритема, инфекция подкожной жировой клетчатки.
Лечение панникулита
Идиопатическую форму лечат НПВП, а обострения с тяжелым течением — ГК или иммуносупрессантами (циклоспорин, циклофосфамид).
Установка точечных светильников своими руками
Источник